修回日期: 2012-01-10
接受日期: 2012-03-10
在线出版日期: 2012-03-18
目的: 探讨MTHFR基因多态性与胃癌发病风险的相关性.
方法: 收集进展期胃癌患者97例, 应用PCR对C677T、G1793A多态位点进行检测; 采用病例对照研究设计, 比较病例组和对照组多态位点基因频率和基因型频率.
结果: 677T等位基因频率在病例组和对照组中差异无显著性意义, 病例组CC基因型频率、CT基因型频率、TT基因型频率与对照组相应基因型频率差异无显著性意义; 1793A等位基因频率在病例组和对照组中差异无显著性意义, 病例组GG基因型频率、GA基因型频率与对照组相应基因型频率差异无显著性意义.
结论: MTHFR多态性可能参与了胃癌的发生、发展, 但他仅是导致胃癌发生的因素之一. 因此研究MTHFR多态性与胃癌发生之间的关系, 有必要对胃癌病因进行分类, MTHFR多态性可能参与了某一类胃癌的发生.
引文著录: 郭威, 陈萍, 郑立红, 李松. MTHFR基因多态性与胃癌的相关性. 世界华人消化杂志 2012; 20(8): 690-693
Revised: January 10, 2012
Accepted: March 10, 2012
Published online: March 18, 2012
AIM: To explore the association between two non-synonymous single nucleotide polymorphisms (C677T and G1793A) of the methylenetetrahydrofolate reductase (MTHFR) gene and risk of gastric cancer.
METHODS: Ninety patients with advanced gastric cancer and 114 normal controls were included in the study. DNA samples isolated from peripheral blood which were used to genotype C677T and G1793A polymorphisms by polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP).
RESULTS: No significant differences in allele frequencies and genotype frequencies were found between the patients and controls, suggesting that there might be no association between the two MTHFR gene polymorphisms and risk of gastric cancer.
CONCLUSION: It is necessary to classify gastric cancer according to causes of disease to investigate the association between MTHFR gene polymorphisms and risk of this disease since MTHFR gene polymorphisms may be associated with only some subtypes.
- Citation: Guo W, Chen P, Zheng LH, Li S. Association between methylenetetrahydrofolate reductase gene polymorphisms (C677T and G1793A) and risk of gastric cancer. Shijie Huaren Xiaohua Zazhi 2012; 20(8): 690-693
- URL: https://www.wjgnet.com/1009-3079/full/v20/i8/690.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i8.690
胃癌是最常见的消化系恶性肿瘤, 在我国的发病率也较高, 一般北方比南方高. 在胃癌的发生中, 遗传因素起到了非常重要的作用, 约10%-15%的胃癌患者有家族聚集现象, 这已被一些研究所证实[1]. 多数学者认为遗传因素使致癌物质对易感者更易致癌. 亚甲基四氢叶酸还原酶(MTHFR)活性的改变会导致5-甲基四氢叶酸生成障碍, 从而造成同型半胱氨酸复甲基化障碍, 引起高半胱氨酸血症、高半胱氨酸尿症和血浆低甲硫氨酸[2,3]; 同时可能也会影响DNA合成和甲基化, 进而影响许多疾病的遗传易感性. 现已发现MTHFR基因上有近30个SNP位点, 其中C677T和G1793A突变是较为常见的2种类型. 我们采用分子生物学方法对97例进展期胃癌与这2个基因多态性的关系进行了研究.
根据"知情同意"的原则, 收集齐齐哈尔医学院第一附属医院消化内科进展期胃癌患者97例, 所有患者均经胃镜活检病理支持. 所有患者均为汉族, 男62例、女35例, 年龄15-83岁, 平均年龄55.53岁±12.80岁; 114例健康对照来自齐齐哈尔医学院第一附属医院同期健康体检者, 根据年龄和性别与病例组进行频数配对. 所有样本之间无血缘关系. 取外周静脉血, 用ACD抗凝, -20 ℃保存, 提取基因组DNA.
1.2.1 MTHFR基因型分析: C677T多态位点: PCR反应体系(20 μL): 模板DNA 50 ng、4×dNTP 2.5 mmol、PCR引物各5 μmol、rTaq 0.5 U; PCR反应条件: 95 ℃预变性5 min, 94 ℃ 30 s, 64 ℃ 20 s, 72 ℃ 20 s, 共30个循环, 72 ℃延伸10 min; 电泳检测PCR扩增产物: 取PCR产物5 μL, 加1 μL加样缓冲液, 在1%琼脂糖凝胶上200 V恒压电泳20 min; HinfⅠ酶切: 酶切体系15 μL: 含PCR扩增产物7 μL, HinfⅠ酶2.5 U, 37 ℃水浴过夜; 琼脂糖凝胶电泳检测酶切产物: 取酶切产物8 μL, 加2 μL加样缓冲液, 在3%琼脂糖凝胶上200 V恒压电泳40 min.
1.2.2 MTHFR基因型分析: G1793A多态位点: PCR反应体系(20 μL): 模板DNA 50 ng、4×dNTP 2.5 mmol、PCR引物各5 μmol、rTaq 0.5 U; PCR反应条件: 95 ℃预变性5 min, 94 ℃ 30 s, 68 ℃ 20 s, 72 ℃ 20 s, 共30个循环, 72 ℃延伸10 min; 电泳检测PCR扩增产物: 取PCR产物5 μL, 加1 μL加样缓冲液, 在1%琼脂糖凝胶上200 V恒压电泳20 min; BsrBⅠ酶切: 酶切体系15 μL: 含PCR扩增产物7 μL, BsrBⅠ酶2.5 U, 37℃水浴过夜; 琼脂糖凝胶电泳检测酶切产物: 取酶切产物8 μL, 加2 μL加样缓冲液, 在2%琼脂糖凝胶上200 V恒压电泳40 min.
统计学处理 采用SPSS13.0软件进行分析, 计算MTHFR C677T和G1793A基因突变率、等位基因频率、基因型频率、基因多态性与疾病的相关性及相对危险度. 计算资料组间比较用χ2检验, 基因型及等位基因相对风险率以比数比(odds ratios, OR)及95%可信区间(CI)表示.
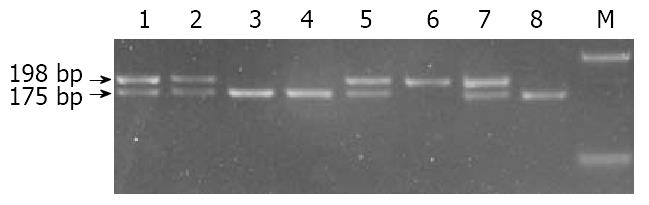
通过PCR-RFLP(HinfⅠ), 其CC野生型只有一条198 bp长度的片段, CT杂合型有198 bp、175 bp和23 bp 3条片段, TT纯合突变型有175 bp和23 bp 2条片段. 用3%的琼脂糖凝胶电泳检测, 23 bp的片段将跑出凝胶(图1). 经χ2检验, 677T等位基因频率在病例组和对照组中差异无显著性意义, 病例组CC基因型频率、CT基因型频率、TT基因型频率与对照组相应基因型频率差异无显著性意义(表1).
| 病例组n(%) | 对照组n(%) | OR(95%CI) | P值 | |
| CC | 22(22.68) | 32(28.07) | 1(参考值) | |
| CT | 48(49.48) | 57(50.00) | 1.225(0.630-2.382) | 0.550 |
| TT | 27(27.84) | 25(21.93) | 1.57(0.728-3.388) | 0.248 |
| 对照组相应基因型频率 | 0.5258 | 0.4693 | - | 0.248 |
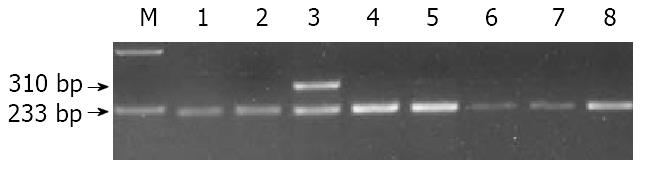
G1793A基因型 G1793A位点PCR扩增产生310 bp长度片段, 经BsrBⅠ酶切后产生233 bp和77 bp 2种长度片段. 由于MTHFR1793位点出现G→A的突变, 消除了1个BsrBⅠ酶切位点, 故野生型GG产生233 bp和77 bp 2种片段, 突变型AA只产生310 bp 1种片段, 杂合型GA产生310 bp、233 bp和77 bp 3种片段. 电泳结果(图2). 经χ2检验, 1793A等位基因频率在病例组和对照组中差异无显著性意义, 病例组GG基因型频率、GA基因型频率与对照组相应基因型频率差异无显著性意义(表2).
| 基因型 | 病例组n(%) | 对照组n(%) | OR(95%CI) | P值 |
| GG | 89(91.75) | 106(92.98) | 1(参考值) | - |
| GA | 8(8.25) | 8(7.02) | 0.840(0.303-2.328) | 0.737 |
| AA | 0(-) | 0(-) | - | - |
| 对照组相应基因型频率 | 0.0412 | 0.0351 | - | 0.728 |
在我们的研究中, MTHFR基因C677T突变和G1793A突变与胃癌的发生没有统计学意义的关联.
导致胃癌发生的病因是多方面的, 既有诸多的遗传因素, 又有环境因素, 包括幽门螺杆菌感染、胃病史、生活方式和习惯、精神心理因素等[4]. 有研究表明, C677T突变引起的MTHFR活性下降会引起血中同型半胱氨酸水平升高, 甲硫氨酸含量下降, 进而产生高半胱氨酸血症、高半胱氨酸尿症和低甲硫氨酸血症, 是心脑血管疾病、出生缺陷疾病, 尤其是神经管畸形的肯定危险因素[5,6]不是导致胃癌发生的主要危险因素.
DNA甲基化是生物体在DNA甲基转移酶(DNMT)的作用下, 以S-腺苷蛋氨酸(SAM)作为甲基供体, 将活化的甲基引入到DNA链中特定碱基上. DNA甲基化是基因的表观遗传修饰形式之一, DNA甲基化的高低与基因的表达程度往往呈负相关. 通常甲基化水平较低时, 基因表达水平高; 甲基化水平较高时, 基因表达水平低, 从而在维持细胞的正常功能方面发挥着重要作用[7]. 大量研究表明, 癌基因的低甲基化和抑癌基因的高甲基化参与了胃癌的发生、发展[8,9].
有研究认为MTHFR基因C677T多态性通过影响DNA的甲基化和核酸的稳定性, 参与了胃癌的发生. 在Homberger和Weisberg的研究中, 纯合突变型(TT)的酶活性仅为野生型(CC)的30%, 杂合突变型(TC)的酶活性仅为野生型(CC)的60%, 同时酶的热稳定性下降[10,11]酶活性的降低间接改变了SAM水平, 导致DNA低甲基化, 同时增加了染色体的不稳定性[12]. 一般来讲, 5%-10%的酶活性即可使该酶所催化的代谢反应正常进行, 并维持底物和产物在适当的水平. 当然也有一些酶需要具有较高活性才能使机体代谢途径正常进行. 在我们的研究中, 未得出MTHFR基因C677T和G1793A突变与胃癌的发生具有相关性的结论, 可能是由于MTHFR基因突变导致酶活性降低尚不足以影响机体的DNA甲基化过程.
5, 10-亚甲基四氢叶酸在MTHFR催化下转变为5-甲基四氢叶酸, 后者通过合成SAM参与了多种甲基化过程. 研究表明, 叶酸缺乏可导致DNA低甲基化和染色体损害[13,14]. 在我国北方地区, 冬天气候寒冷, 而且持续时间较长, 较易发生蔬菜和水果摄入不足, 导致叶酸缺乏. Ma等[15]研究发现, 叶酸摄入充足, 虽然MTHFR活性降低, 仍可保证DNA甲基化的正常进行; 而叶酸摄入不足, C677T变异基因型携带者可能既有DNA甲基化异常, 又有DNA合成、修复异常, 使细胞癌变风险增加. 故而叶酸摄入不足和MTHFR基因突变导致的酶活性降低可能存在协同作用. 在我们的研究中, 未得出MTHFR基因C677T和G1793A突变与胃癌的发生具有相关性的结论, 也可能是由于叶酸摄入不足, 不论MTHFR基因突变是否存在, 都可导致DNA低甲基化的发生.
胃癌的发生是多途径、多因素、多步骤的, MTHFR多态性可能参与了胃癌的发生、发展, 但他仅是导致胃癌发生的因素之一. 因此, 研究MTHFR多态性与胃癌发生之间的关系, 有必要对胃癌病因进行分类, MTHFR多态性可能参与了某一类胃癌的发生. 对于MTHFR基因多态性与胃癌发生、发展的关系, 仍有待于今后更多大样本的研究来证实.
近些年来, 随着对胃癌研究的不断深入, 遗传因素在胃癌发病中所起的作用日益引起人们的重视. 亚甲基四氢叶酸还原酶(MTHFR)基因突变可能也会影响DNA合成和甲基化, 进而影响许多疾病的遗传易感性.
邹小明, 教授, 哈尔滨医科大学附属第二医院普外二科
大量研究表明, 癌基因的低甲基化和抑癌基因的高甲基化参与了多种肿瘤的发生、发展, 探讨MTHFR基因多态性、DNA甲基化与各种肿瘤(包括胃癌)之间的关系已成为当前肿瘤病因学研究的一项重要课题.
有研究表明, C677T突变引起的MTHFR活性下降会引起血中同型半胱氨酸水平升高, 甲硫氨酸含量下降, 进而产生高半胱氨酸血症、高半胱氨酸尿症和低甲硫氨酸血症, 是心脑血管疾病、出生缺陷疾病, 尤其是神经管畸形的肯定危险因素不是导致胃癌发生的主要危险因素.
本文报道并探讨分析了MTHFR基因多态性与胃癌发病风险的相关性. 选题新颖, 实验方法先进, 结果可靠, 虽然是阴性结果, 但也有学术价值.
编辑: 曹丽鸥 电编: 鲁亚静
| 1. | Barber M, Fitzgerald RC, Caldas C. Familial gastric cancer - aetiology and pathogenesis. Best Pract Res Clin Gastroenterol. 2006;20:721-734. [PubMed] [DOI] |
| 2. | Kawamoto R, Kohara K, Tabara Y, Miki T, Doi T, Tokunaga H, Konishi I. An association of 5,10-methylenetetrahydrofolate reductase (MTHFR) gene polymorphism and common carotid atherosclerosis. J Hum Genet. 2001;46:506-510. [PubMed] [DOI] |
| 3. | Matthews RG, Vanoni MA, Hainfeld JF, Wall J. Methylenetetrahydrofolate reductase. Evidence for spatially distinct subunit domains obtained by scanning transmission electron microscopy and limited proteolysis. J Biol Chem. 1984;259:11647-11650. [PubMed] |
| 5. | Arsene D, Găină G, Bălescu C, Ardeleanu C. C677T and A1298C methylenetetrahydropholate reductase (MTHFR) polymorphisms as factors involved in ischemic stroke. Rom J Morphol Embryol. 2011;52:1203-1207. [PubMed] |
| 6. | Cho SE, Hong KS, Shin GJ, Chung WS. The methylenetetrahydrofolate reductase C677T gene mutation is associated with hyperhomocysteinemia, cardiovascular disease and plasma B-type natriuretic peptide levels in Korea. Clin Chem Lab Med. 2006;44:1070-1075. [PubMed] [DOI] |
| 8. | Hu SL, Kong XY, Cheng ZD, Sun YB, Shen G, Xu WP, Wu L, Xu XC, Jiang XD, Huang DB. Promoter methylation of p16, Runx3, DAPK and CHFR genes is frequent in gastric carcinoma. Tumori. 2010;96:726-733. [PubMed] |
| 9. | Yamamoto E, Suzuki H, Takamaru H, Yamamoto H, Toyota M, Shinomura Y. Role of DNA methylation in the development of diffuse-type gastric cancer. Digestion. 2011;83:241-249. [PubMed] [DOI] |
| 10. | Homberger A, Linnebank M, Winter C, Willenbring H, Marquardt T, Harms E, Koch HG. Genomic structure and transcript variants of the human methylenetetrahydrofolate reductase gene. Eur J Hum Genet. 2000;8:725-729. [PubMed] [DOI] |
| 11. | Weisberg I, Tran P, Christensen B, Sibani S, Rozen R. A second genetic polymorphism in methylenetetrahydrofolate reductase (MTHFR) associated with decreased enzyme activity. Mol Genet Metab. 1998;64:169-172. [PubMed] [DOI] |
| 12. | Narayanan S, McConnell J, Little J, Sharp L, Piyathilake CJ, Powers H, Basten G, Duthie SJ. Associations between two common variants C677T and A1298C in the methylenetetrahydrofolate reductase gene and measures of folate metabolism and DNA stability (strand breaks, misincorporated uracil, and DNA methylation status) in human lymphocytes in vivo. Cancer Epidemiol Biomarkers Prev. 2004;13:1436-1443. [PubMed] |
| 13. | Shookhoff JM, Gallicano GI. A new perspective on neural tube defects: folic acid and microRNA misexpression. Genesis. 2010;48:282-294. [PubMed] [DOI] |
| 14. | Watanabe Y, Maekawa M. Methylation of DNA in cancer. Adv Clin Chem. 2010;52:145-167. [PubMed] [DOI] |
| 15. | Ma J, Stampfer MJ, Giovannucci E, Artigas C, Hunter DJ, Fuchs C, Willett WC, Selhub J, Hennekens CH, Rozen R. Methylenetetrahydrofolate reductase polymorphism, dietary interactions, and risk of colorectal cancer. Cancer Res. 1997;57:1098-1102. [PubMed] |