修回日期: 2012-01-19
接受日期: 2012-03-10
在线出版日期: 2012-03-18
目的: 构建乙型肝炎病毒X基因(HBV X)重组慢病毒表达载体, 建立稳定表达HBV X蛋白(HBx)的HepG2细胞系.
方法: 应用PCR法从质粒pIERES2-EGFP-HBV中扩增X基因片段, 克隆至慢病毒载体pZac2.1, 应用PCR、酶切和测序鉴定正确后, 经病毒包装, 感染HepG2细胞, 经嘌呤霉素筛选稳定表达细胞株, RT-PCR、免疫组织化学、Western blot鉴定HBx的表达.
结果: 酶切鉴定和基因序列测定证实长度为489 bp的HBx基因成功克隆至慢病毒表达载体pZac2.1-HBx; 重组慢病毒经包装、纯化后获得滴度为1×108 TU/mL, 通过感染HepG2细胞株和嘌呤霉素筛选, 8-10 d形成生长形态良好的单克隆细胞株HepG2-HBx; RT-PCR鉴定显示细胞株HepG2-HBx在3 d, 14 d, 30 d和2 mo后均可见稳定表达的HBx mRNA; 利用免疫组织化学和蛋白免疫印迹法鉴定, 细胞株HepG2-HBx可稳定表达HBx蛋白.
结论: 成功构建了HBV X重组慢病毒载体, 获得稳定表达HBx的HepG2细胞系, 为进一步研究HBx的生物学功能及致病机制提供细胞模型.
引文著录: 余桂芳, 严跃红, 王瑞鑫, 李显波, 曾文铤, 朱科伦. 慢病毒介导HBV X基因稳定表达HepG2细胞系的建立. 世界华人消化杂志 2012; 20(8): 638-643
Revised: January 19, 2012
Accepted: March 10, 2012
Published online: March 18, 2012
AIM: To establish a HepG2 cell line stably transduced with a lentivirus expressing the HBV X (HBx) gene for studying the biological function of HBx and its role in hepatocarcinogenesis.
METHODS: The HBV X gene was amplified from plasmid pIERES2-EGFP-HBV by PCR. The purified HBx gene fragment was inserted into a lentivirus vector (pZac2.1), and the insertion was identified by PCR, restriction endonuclease analysis and DNA sequencing. HepG2 cells were then transfected with the packaged recombinant lentivirus, and resistant cell clones were selected with puromycin. The expression of HBx was examined using RT-PCR, immunohistochemistry, and Western blot.
RESULTS: Restriction enzyme digestion and DNA sequencing showed that the full-length HBx (489 bp) gene had been successfully subcloned into the lentiviral vector to result in the recombinant vector pZac2.1-HBx. The titre of purified recombinant lentivirus was 1×108 TU/mL. Monoclonal cell line HepG2-HBx was produced 8-10 d after transfection with the recombinant lentivirus and selected with puromycin. HBx mRNA could be detected on days 3, 14, 30 and at 2 mo after cell colony formation. Meanwhile, stable expression of HBx protein was verified by immunohistochemistry and Western blot.
CONCLUSION: A HepG2 cell line stably transduced with a lentivirus expressing the HBx gene has been successfully generated.
- Citation: Yu GF, Yan YH, Wang RX, Li XB, Zeng WT, Zhu KL. Establishment of a HepG2 cell line stably transduced with a lentivirus expressing the HBV X gene. Shijie Huaren Xiaohua Zazhi 2012; 20(8): 638-643
- URL: https://www.wjgnet.com/1009-3079/full/v20/i8/638.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i8.638
乙型肝炎病毒(hepatitis B virus, HBV)感染是一个世界性的健康问题, 也是原发性肝癌(hepatocellular carcinoma, HCC)发生的主要原因之一. HBV基因组有4个开放读码框架(open reading frame, ORF)-C、P、S和X区, 其中X基因是最小的读码框架, 保守性高, 编码含有154个氨基酸的X蛋白(HBx). 近年发现, HBx是一种多功能病毒调节蛋白, 具有广泛的基因转录调控作用, 并能与宿主细胞的多种蛋白质相互作用, 不但影响病毒复制, 还调节宿主细胞的信号转导、细胞增殖与分化、细胞凋亡等[1], 被认为与肝细胞癌的发生、发展关系非常密切[2,3]. 为进一步探索HBx蛋白的理化和生物学特性及其与HCC发生和转归的关系, 有必要建立稳定表达HBx的HCC细胞模型. 其中源于人类肝癌组织的细胞株HepG2应用最为普遍, 既往已有许多报道主要应用脂质体的转染方法[4,5]或电转导方法[6]对HepG2进行瞬时转染或稳定表达及其应用酵母表达系统进行HBx蛋白的功能研究[7], 本研究尝试利用慢病毒载体的方法建立稳定表达HBx蛋白的HepG2细胞株, 为研究肝癌的分子发生机制和基因治疗打下良好基础.
大肠杆菌DH5α、HEK293细胞、人肝母细胞瘤细胞系HepG2细胞均为本室保存. Taq DNA聚合酶、dNTP、限制性内切酶HindⅢ、EcoRⅠ、T4 DNA连接酶、DNA marker均购自TaKaRa公司; PCR产物纯化试剂盒、DNA片段纯化回收试剂盒及质粒抽提试剂盒购自QIAGEN公司; 慢病毒表达系统由东莞博捷生物科技公司提供; DMEM培养基、胎牛血清、胰蛋白酶购自Gibco公司; 嘌呤霉素购自Sigma公司; TRIzol、Alex568标记的山羊抗人IgG均购自Invitrogen公司; 逆转录试剂盒购自TOYOBO公司; 兔源抗HBx抗体购自武汉博士德生物科技公司; 二抗检测试剂盒购自上海基因公司.
1.2.1 HBV X基因的获取: 从中山大学第三附属医院彭晓谋教授惠赠的pIERES2-EGFP-HBV质粒扩增X基因. 扩增的上游引物为: 5'GATCACGCGTGCCACCATGGCTGCTAGGCTG3', 内含NheⅠ酶切位点; 下游引物为: 5'GTCGACTCTAGATTAGGCAGAGGTGAAAAAG3', 内含NotⅠ酶切位点.
1.2.2 重组质粒的构建和鉴定: 上述PCR产物X基因和质粒pZac2.1分别以限制性内切酶NheⅠ和NotⅠ37 ℃双酶切过夜, T4连接酶16 ℃连接4 h, 连接产物转化到感受态细胞大肠杆菌DH5α, 用含有氨苄青霉素的LB平板筛选, 挑取阳性克隆, 扩大培养, 提抽质粒, PCR、酶切鉴定, 将上述2种方法鉴定正确的质粒送深圳华大基因公司测序.
1.2.3 慢病毒载体重组: 上述pZac2.1-HBx经NheⅠ和NotⅠ酶切后亚克隆至慢病毒载体pCDH1-MCS1-EF1-Puro形成pCDH1-HBx, 亚克隆过程同上. 按常规接种HEK293细胞, 次日连接载体pCDH1-HBx与预先优化的辅助转染质粒混合物(ViraPower™, Invitrogen, 美国; 包含pLP1、pLP2和pLP/VSVG), 以及Lipofectamine 2000共同转染HEK293, 并应用opti-MEM进行培养. 48 h后, 应用0.45 μm Millex-HV PVDF膜过滤, 最后离心提纯病毒颗粒.
1.2.4 病毒滴度测定: 取提纯后的重组慢病毒进行滴度测定. 测定前对293T细胞进行传代, 并接种于96孔板, 每孔加入约1.0×104个细胞, 将病毒储存液按梯度稀释, 依次加到细胞孔中. 培养4 d后置于倒置显微镜中观察荧光表达, 并在最大稀释倍数孔中计算荧光表达的细胞数, 病毒滴度(TU/mL) = (荧光细胞个数×转染时细胞数/100×每孔加入病毒稀释液体积)×1/稀释浓度.
1.2.5 重组慢病毒转染HepG2: 按常规方法培养HepG2细胞, 用含100 mL/L胎牛血清的DMEM/F12完全培养基, 调整细胞密度为5×105/mL, 于转染前1 d胰蛋白酶消化HepG2, 重新接种于培养瓶中; 待细胞生长汇合度达70%-80%时弃原培养液, 加入含200 μL的重组慢病毒颗粒(MOI = 10). 感染4 h后更换培养液继续培养, 以不含目的基因的空载体为对照.
1.2.6 筛选稳定表达株: 感染48 h后加入终浓度为2 g/L的嘌呤霉素进行稳定表达株筛选. 挑取抗性细胞克隆于96孔培养板、24孔培养板、6孔培养板逐级扩大培养. 经过大约14 d建立稳定表达的HepG2细胞系.
1.2.7 RT-PCR法鉴定稳定表达HBx的HepG2-HBx细胞株: TRIzol法提取经筛选稳定表达的细胞总RNA, 反转录试剂盒合成、扩增cDNA, 琼脂糖电泳检测, 同时以转染空质粒为对照.
1.2.8 免疫组织化学鉴定HBx表达: 培养的HepG2-HBx细胞株(第10代)用多聚甲醛固定, 按照常规方法进行间接法免疫组织化学反应. 兔源抗HBx抗体(1:500)4 ℃孵育过夜, PBS漂洗; 按二抗反应试剂盒说明书进行二抗结合、底色反应.
1.2.9 Western blot鉴定HBx表达: 培养的HepG2-HBx细胞株至第10代, 使用细胞全蛋白抽提试剂盒抽提细胞总蛋白, 经过常规的定量, 变性聚丙烯酰胺凝胶电泳, 转印至PVDF膜, 底物化学发光法显影曝光.
统计学处理 反转录PCR凝胶电泳采用美国Biorad公司Quantity one 4.0图像分析软件进行扫描分析, 获得灰度值数据, 经过内参照β-actin条带灰度进行校正. 校正灰度值以mean±SD表示, 多组比较采用单因素ANOVA检验, 两两比较应用Bonferroni检验, 以P<0.05作为具有显著性差异.
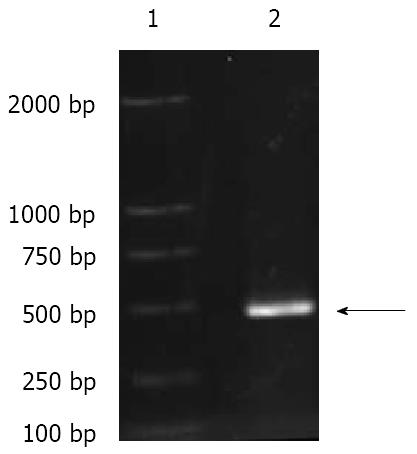
根据惠赠的pIERES2-EGFP-HBV质粒的HBV全长基因组扩增X基因, 设计PCR产物的长度为489 bp. 扩增产物经琼脂糖凝胶电泳图可见清晰的特异性扩增条带, 近似于500 bp marker条带, 与理论值预期值相符(图1).
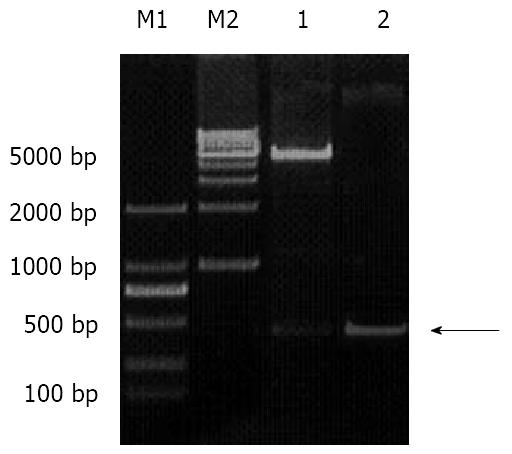
PCR扩增的X基因经纯化, 连接至慢病毒质粒载体pZac2.1, 连接产物转化感受态细胞后经抗生素筛选的单克隆扩大培养, 通过质粒抽提纯化进行PCR和双酶切鉴定. 在理论预期值489 bp处可见一特异性条带. 阳性克隆通过测序, Genebank数据库比对, 与目标序列完全一致, 无突变及缺失, 证实pZac2.1-HBx载体构建成功. 大量包装后最终得到的病毒滴度为1×108 TU/mL(图2).
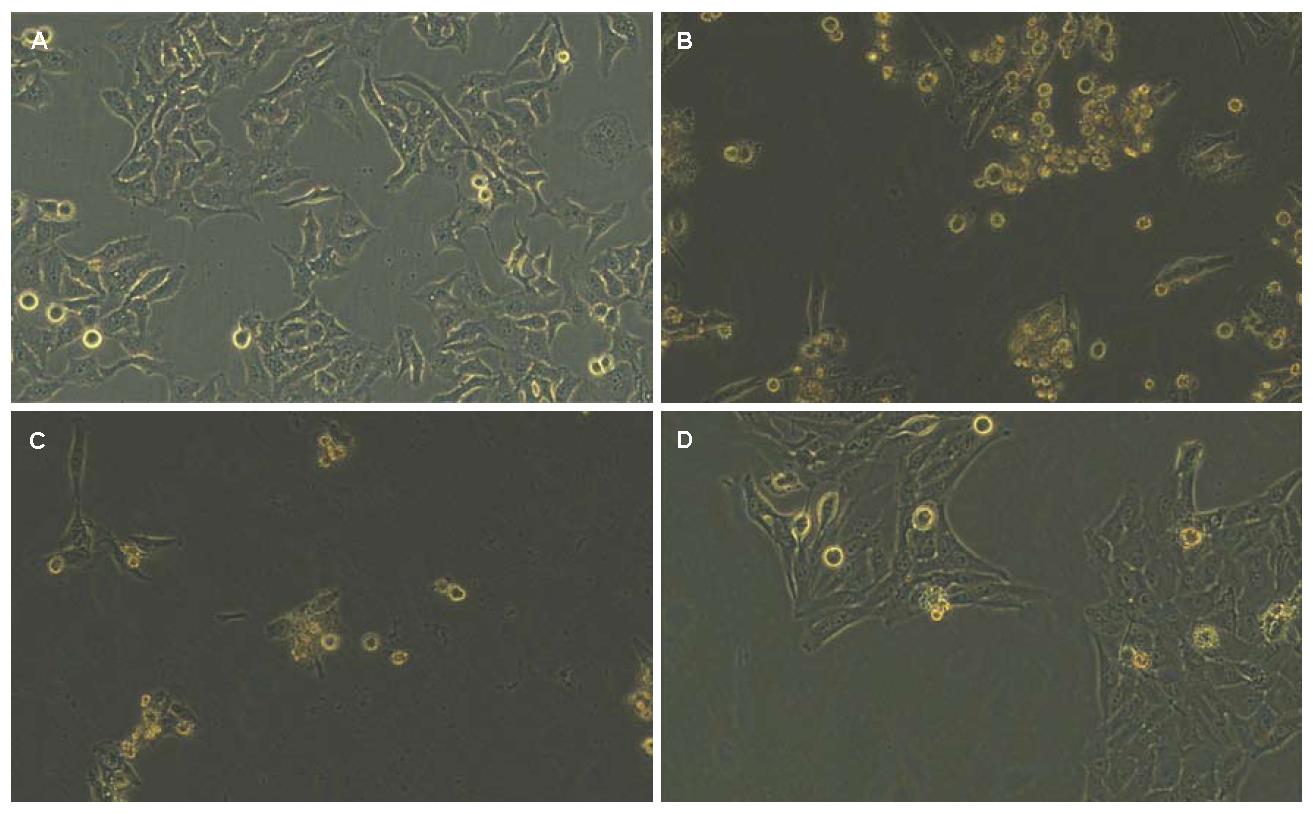
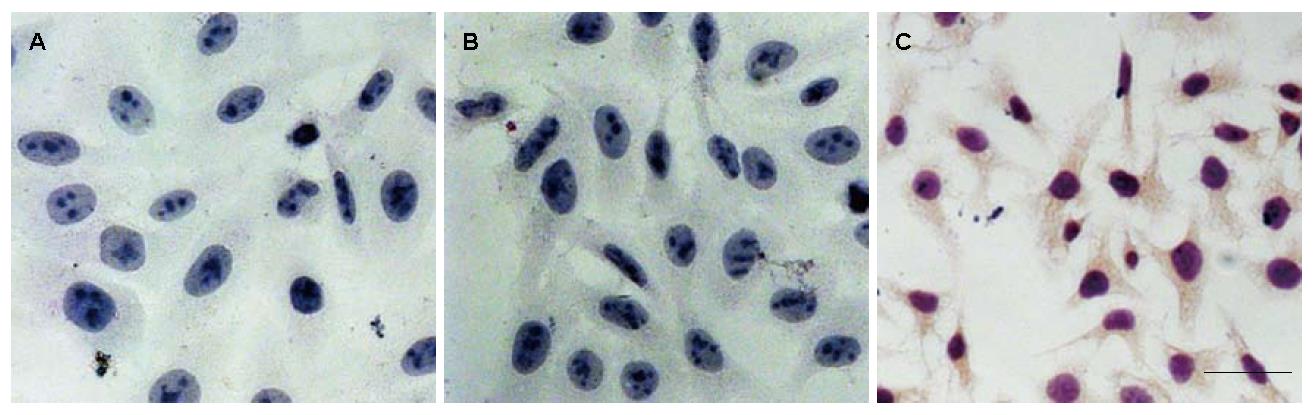
将重组慢病毒载体pZac2.1-HBx和负性参照pZac2.1分别感染HepG2细胞. 病毒感染后24 h内可见部分细胞死亡(图3A, B), 经过细胞的传代、嘌呤霉素筛选, 8-10 d逐渐形成生长形态良好的单克隆细胞株(图3C, D).
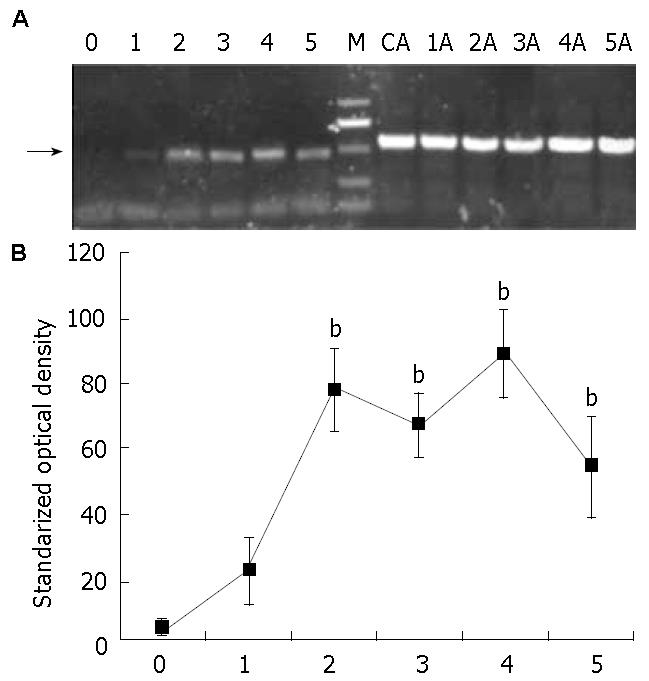
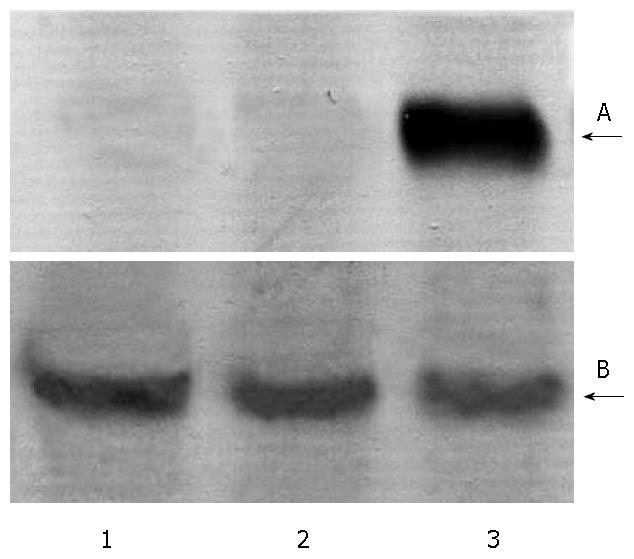
对单克隆细胞株进行扩大培养, 在不同感染后的时间点进行RT-PCR分析鉴定. 产物经琼脂糖凝胶电泳分析(图4), 重组慢病毒载体pZac2.1-HBx感染的细胞在感染后24 h可见较弱的目的基因表达, 3 d后呈现稳定的HBx mRNA高表达(P<0.01 vs 24 h, n = 5); 内参照(pZac2.1)则未见HBx mRNA表达. 在14 d、30 d和2 mo后均可见稳定的表达, 组内HBx mRNA表达量无显著差异(P>0.05).
经过免疫组织化学分析, 体外扩大培养稳定表达株HepG2-HBx几乎所有细胞均呈现HBx的阳性信号, 主要位于胞浆, 未见局部的高浓度聚集; 野生型HepG2以及负性对照均未见阳性信号(图5). 应用Western blot技术, 同样证实了稳定表达株HepG2-HBx的蛋白表达(图6).
HBV感染是肝细胞癌发生的一个主要危险因子[8]. 大部分HBV感染相关HCC可以检测到HBV DNA整合到肝细胞基因组中[9], 整合于染色体上的HBV DNA不是完整的, 通常发生于DNA链末端的直接重复序列(DR1和DR2)[10,11]. 由于HBV X基因紧邻DR序列, HBV的X基因片段在病毒DNA序列整合中最为常见[12]. HBV感染肝细胞后即形成共价闭合环状DNA, 作为转录模板在宿主RNA聚合酶Ⅱ的作用下产生不同转录子, 其中包括X基因转录本. X基因的ORF位于调控元件增强子Ⅰ(EnhⅠ)的下游, 与其他功能区有高度的重叠, 并可独立转录[13]. 这种功能重叠性和独立性提示了HBx功能的多样性和重要性. 现已揭示HBx不但与传染期病毒复制有关, 还可在宿主细胞发挥重要影响, 可诱导肝细胞染色体改变和微粒体形成, 影响基因组的稳定性, 促进细胞癌变; 参与肝细胞转化、细胞凋亡调控、DNA修复等[2,14]; 还可促进肿瘤血管增生, 加速肿瘤的侵袭与转移[13,15,16]. 在肝癌细胞中, HBx蛋白表达可导致β-链蛋白活性增加, 可激活Ras/Raf/MEK/ERK和PI3K/Akt通路, 从而影响细胞增殖、周期和凋亡, 间接参与了肝细胞的恶性转化与癌变[1,17,18]. 进一步的研究提示HBx对上述信号转导激酶的活化并不是通过与这些蛋白直接作用来完成的, 而是通过活化其编码基因的上游序列[2]. HBx不能直接结合双链DNA, 而是通过蛋白相互作用与转录因子和转录元件结合, 介导转录起始复合物的形成, 直接或间接作用于基因启动子或增强子[19,20], 因此被定义为反式激活因子[21]. HBx的转录调节作用在不同细胞系表现不一致, 与其相互作用的转录因子等也非常复杂. HBx在HCC形成、发展、转归的过程中所发挥的作用尚不清楚, HBx的具体功能及致病机制还需要进一步的揭示.
随着分子生物学的发展, 应用基因转导的技术在肝癌细胞特异表达HBx是研究HBx生物学功能与病理机制的重要手段. X基因序列具有较高的保守性, 不含有内含子, 经PCR克隆所得目的基因可以直接用于该蛋白的原核和真核表达. 由于HBx对肝癌细胞的影响往往是长期积累的效果, 因此, 建立一种稳定表达HBx的肝癌细胞株非常必要. 在既往研究报道中, 已有许多成功建立长期稳定表达HBx的肝癌细胞株, 最常见的是HepG2和Huh7细胞系[22-25]. 这些研究大都利用脂质体转染的方法进行稳定表达株的细胞筛选. 这种方法操作简单, 含有HBV X基因的重组载体可直接转染HepG2或Huh7细胞系进行瞬时表达, 再通过携带的抗性基因进行筛选稳定表达的细胞株. 这些载体(如pcDNA3)在目的基因上游使用强启动子, 抗性基因使用弱启动子, 以期筛选高表达的细胞株[26]. 然而, 这种筛选方法阳性率低, 难以获得长期稳定表达的细胞株. 在本研究中探索利用慢病毒载体的方法筛选稳定表达HBx的HepG2细胞. 与传统的脂质体转染方法不同, 慢病毒载体的操作相对复杂, 既要和辅助病毒共转染, 还要经过有效的病毒包装, 产生具有感染能力的病毒颗粒才能用于感染宿主细胞, 并将目的基因整合到宿主基因组中. 相比脂质体转染, 病毒感染可使宿主细胞中发生整合的频率相对较高, 有助于获得长期稳定表达的细胞株[27,28]. 在筛选过程中, 我们发现大部分克隆(>80%)RT-PCR鉴定成阳性(数据未显示), 在8-14 d便可筛选获得稳定表达株, 效率远高于脂质体筛选的方法. 筛选出的稳定表达株在3 d-2 mo均有较高的表达水平, 而在24 h仅有低水平表达. 与其他载体相比, 慢病毒载体的目的基因表达较为滞后. 有报道利用腺病毒表达系统筛选稳定表达HBx的HepG2细胞株[29,30], 腺病毒是双链DNA, 基因组游离于宿主基因组外, 也较难获得稳定表达的细胞株.
由此可见, 慢病毒载体在HepG2-HBx稳定表达株的筛选具有一定优势. 本研究构建HBx重组慢病毒表达载体, 实现HBx分子在肝癌细胞HepG2中的稳定性表达, 为后续研究HBx在细胞增殖、细胞周期、蛋白降解、基因稳定性、肿瘤细胞凋亡提供一个细胞模型. 此外, 构建的HBx慢病毒载体还可应用于其他非分裂细胞系的基因转导, 研究HBx在不同细胞中的作用. 慢病毒表达系统是目前基因治疗的主要手段[31], 本研究利用慢病毒载体在HepG2中稳定表达HBx的方法, 或许可成为日后研究肝癌基因治疗的提示和借鉴.
感谢中山大学第三附属医院感染科彭晓谋教授在实验过程中给予的指导!
乙型肝炎病毒X基因与原发性肝癌的发生、发展以及侵袭转移等关系密切, 构建HBx稳定表达HepG2为日后研究HBx的蛋白功能及其肿瘤发生的机制奠定基础.
周霞秋, 教授, 上海瑞金医院感染科
本文介绍慢病毒表达系统构建稳定表达HBx的HepG2细胞系的方法, 其效率和蛋白表达的动态变化值得研究者的借鉴.
本文主要以慢病毒表达系统在HepG2细胞系稳定表达HBV X基因, 这种表达系统方法有较多的优势, 可连接其他相关基因共表达. 该表达系统有可能为将来的基因治疗提供技术条件和研究基础.
本研究内容新颖, 方法先进, 设计科学, 研究过程合理, 结论可靠, 对今后的基础研究和临床应用有一定的指导意义.
编辑: 曹丽鸥 电编: 鲁亚静
| 1. | Arbuthnot P, Capovilla A, Kew M. Putative role of hepatitis B virus X protein in hepatocarcinogenesis: effects on apoptosis, DNA repair, mitogen-activated protein kinase and JAK/STAT pathways. J Gastroenterol Hepatol. 2000;15:357-368. [PubMed] [DOI] |
| 2. | Benhenda S, Cougot D, Buendia MA, Neuveut C. Hepatitis B virus X protein molecular functions and its role in virus life cycle and pathogenesis. Adv Cancer Res. 2009;103:75-109. [PubMed] [DOI] |
| 4. | Li WH, Miao XH, Qi ZT, Ni W, Zhu SY, Fang F. Proteomic analysis of differently expressed proteins in human hepatocellular carcinoma cell lines HepG2 with transfecting hepatitis B virus X gene. Chin Med J (Engl). 2009;122:15-23. [PubMed] |
| 8. | Ganem D. Virology. The X files--one step closer to closure. Science. 2001;294:2299-2300. [PubMed] [DOI] |
| 9. | Lee AT, Lee CG. Oncogenesis and transforming viruses: the hepatitis B virus and hepatocellularcarcinoma--the etiopathogenic link. Front Biosci. 2007;12:234-245. [PubMed] [DOI] |
| 10. | Nguyen DH, Ludgate L, Hu J. Hepatitis B virus-cell interactions and pathogenesis. J Cell Physiol. 2008;216:289-294. [PubMed] [DOI] |
| 11. | Park EH, Koh SS, Srisuttee R, Cho IR, Min HJ, Jhun BH, Lee YS, Jang KL, Kim CH, Johnston RN. Expression of HBX, an oncoprotein of hepatitis B virus, blocks reoviral oncolysis of hepatocellular carcinoma cells. Cancer Gene Ther. 2009;16:453-461. [PubMed] [DOI] |
| 12. | Zhang X, Zhang H, Ye L. Effects of hepatitis B virus X protein on the development of liver cancer. J Lab Clin Med. 2006;147:58-66. [PubMed] [DOI] |
| 13. | Tang H, Oishi N, Kaneko S, Murakami S. Molecular functions and biological roles of hepatitis B virus x protein. Cancer Sci. 2006;97:977-983. [PubMed] [DOI] |
| 14. | Ye L, Qi J, Li G, Tao D, Song S. The effect of HBx gene on the apoptosis of hepatic cells. J Huazhong Univ Sci Technolog Med Sci. 2007;27:167-169. [PubMed] [DOI] |
| 15. | Wang XW, Hussain SP, Huo TI, Wu CG, Forgues M, Hofseth LJ, Brechot C, Harris CC. Molecular pathogenesis of human hepatocellular carcinoma. Toxicology. 2002;181-182:43-47. [PubMed] [DOI] |
| 16. | Ou DP, Tao YM, Chang ZG, Tang FQ, Yang LY. Hepatocellular carcinoma cells containing hepatitis B virus X protein have enhanced invasive potential conditionally. Dig Liver Dis. 2006;38:262-267. [PubMed] [DOI] |
| 17. | Kekulé AS, Lauer U, Weiss L, Luber B, Hofschneider PH. Hepatitis B virus transactivator HBx uses a tumour promoter signalling pathway. Nature. 1993;361:742-745. [PubMed] [DOI] |
| 18. | Kim YC, Song KS, Yoon G, Nam MJ, Ryu WS. Activated ras oncogene collaborates with HBx gene of hepatitis B virus to transform cells by suppressing HBx-mediated apoptosis. Oncogene. 2001;20:16-23. [PubMed] [DOI] |
| 19. | Cougot D, Wu Y, Cairo S, Caramel J, Renard CA, Lévy L, Buendia MA, Neuveut C. The hepatitis B virus X protein functionally interacts with CREB-binding protein/p300 in the regulation of CREB-mediated transcription. J Biol Chem. 2007;282:4277-4287. [PubMed] [DOI] |
| 20. | Park SG, Chung C, Kang H, Kim JY, Jung G. Up-regulation of cyclin D1 by HBx is mediated by NF-kappaB2/BCL3 complex through kappaB site of cyclin D1 promoter. J Biol Chem. 2006;281:31770-31777. [PubMed] [DOI] |
| 21. | Wei Y, Neuveut C, Tiollais P, Buendia MA. Molecular biology of the hepatitis B virus and role of the X gene. Pathol Biol (Paris). 2010;58:267-272. [PubMed] [DOI] |
| 22. | 杨 林, 范 红梅, 陈 幼明, 谢 奇峰, 吴 盟, 陈 雪娟, 李 刚, 高 志良. GFP/HBV X融合蛋白重组载体的构建及稳定表达细胞系的建立. 热带医学杂志. 2007;7:112-115, 125. |
| 24. | He Y, Yang F, Wang F, Song SX, Li DA, Guo YJ, Sun SH. The upregulation of expressed proteins in HepG2 cells transfected by the recombinant plasmid-containing HBx gene. Scand J Immunol. 2007;65:249-256. [PubMed] [DOI] |
| 25. | Kanda T, Yokosuka O, Nagao K, Saisho H. State of hepatitis C viral replication enhances activation of NF-kB- and AP-1-signaling induced by hepatitis B virus X. Cancer Lett. 2006;234:143-148. [PubMed] [DOI] |
| 26. | Yang JQ, Pan GD, Chu GP, Liu Z, Liu Q, Xiao Y, Yuan L. Interferon-alpha restrains growth and invasive potential of hepatocellular carcinoma induced by hepatitis B virus X protein. World J Gastroenterol. 2008;14:5564-5569; discussion 5568. [PubMed] [DOI] |
| 27. | Logan AC, Lutzko C, Kohn DB. Advances in lentiviral vector design for gene-modification of hematopoietic stem cells. Curr Opin Biotechnol. 2002;13:429-436. [PubMed] [DOI] |
| 28. | Young LS, Searle PF, Onion D, Mautner V. Viral gene therapy strategies: from basic science to clinical application. J Pathol. 2006;208:299-318. [PubMed] [DOI] |
| 30. | Chen YB, Shi XJ, Lu G, Nie HF, Shen XQ, Yu CH, Gong JP. Recombinant adenovirus with human indoleamine-2,3-dioxygenase and hepatitis B virus preS was constructed and expressed in HepG2 cells. Chin Med J (Engl). 2011;124:3159-3163. [PubMed] |
| 31. | Lever AM, Kaye JF, McCann E, Chadwick D, Dorman N, Thomas J, Zhao J. Lentivirus vectors for gene therapy. Biochem Soc Trans. 1999;27:841-847. [PubMed] [DOI] |