修回日期: 2012-01-22
接受日期: 2012-02-24
在线出版日期: 2012-03-08
目的: 观察丙酮酸乙酯(EP)对实验性结肠炎大鼠结肠组织HMGB1表达及炎症因子的影响.
方法: SD大鼠随机分为空白对照组、模型组、EP治疗组, 每组12只; 模型组、治疗组大鼠用DSS溶液复制实验性结肠炎大鼠模型, 观察各组实验大鼠DAI评分、大体形态学及组织病理学评分(HPS)改变, 采用应用逆转录-聚合酶链反应(RT-PCR)和免疫印迹法(Western blot)检测结肠组织HMGB1表达; 酶联免疫吸附法检测细胞因子(TNF-a、IL-6)的含量.
结果: DAI和HPS在DSS模型组中高于空白对照组(7.20±2.28 vs 0.45±0.16, 13.60±0.72 vs 6.4±0.85, P<0.01), 在空白对照组结肠组织中HMGB1低表达, 但在模型组表达显著上调(P<0.01); 模型组血清TNF-a、IL-6水平高于空白对照组(190.40±24.55 vs 43.65±8.79, 238.75±26.58 vs 74.3±7.92, P<0.01); 与DSS模型组相比, EP可以缓解大鼠体质量的减轻, 减少腹泻及便血的发生, 并且能够显著下调结肠组织DAI、HPS、HMGB1 mRNA和蛋白的表达, 下调血清TNF-a、IL-6水平(P<0.05).
结论: HMGB1参与了实验性结肠炎大鼠的发病过程, 应用EP治疗可有效抑制实验性结肠炎大鼠结肠组织HMGB1的表达, 可以明显下调TNF-a、IL-6等促炎因子的水平, 有助于减轻实验性结肠炎大鼠炎症反应.
引文著录: 葛文松, 吴建新, 陈颖伟, 范建高, 胡颖. 丙酮酸乙酯对实验性结肠炎大鼠结肠组织HMGB1表达及细胞因子的影响. 世界华人消化杂志 2012; 20(7): 558-562
Revised: January 22, 2012
Accepted: February 24, 2012
Published online: March 8, 2012
AIM: To evaluate the effect of ethyl pyruvate (EP) on the expression of high mobility group box 1 protein (HMGB1) and cytokine levels in rats with experimental colitis.
METHODS: Thirty-six rats were randomly and equally divided into three groups: blank control group, model control group, and EP treatment group. Experimental colitis was induced in mice by giving dextran sodium sulfate (DSS). The impact of EP on disease activity index (DAI) and histopathological score (HPS) in experimental colitis was evaluated. The expression of HMGB1 mRNA and protein was measured by reverse transcription-polymerase chain reaction (RT-PCR) and Western blot, respectively. Serum levels of TNF-a and IL-6 were determined by ELISA.
RESULTS: DAI and HPS were higher in the model control group than in the blank control group (7.20 ± 2.28 vs 0.45 ± 0.16, 13.60 ± 0.72 vs 6.4 ± 0.85, both P < 0.01). The expression levels of HMGB1 mRNA and protein were significantly higher in the model control group than in the blank control group (both P < 0.01). The levels of TNF-a and IL-6 in serum were also significantly higher in the model control group than in the blank control group (190.40 ± 24.55 vs 43.65 ± 8.79, 238.75 ± 26.58 vs 74.3 ± 7.92, both P < 0.01). Compared to the model control group, EP inhibited the body weight loss and occurrence of diarrhea as well as rectal bleeding in rats. DAI, HPS, TNF-a, IL-6 as well as the expression levels of HMGB1 mRNA and protein in the EP treatment group were significantly lower than those in the model control group (all P < 0.05).
CONCLUSION: The expression of HMGB1 is up-regulated in experimental colitis, which is closely related with the development and progression of experimental colitis. EP exerts significant therapeutic effects on DSS-induced experimental colitis in rats possibly by down-regulating the expression of HMGB1 and ameliorating the levels of inflammatory factors.
- Citation: Ge WS, Wu JX, Chen YW, Fan JG, Hu Y. Effect of ethyl pyruvate on high mobility group box 1 protein expression and serum cytokine levels in rats with experimental colitis. Shijie Huaren Xiaohua Zazhi 2012; 20(7): 558-562
- URL: https://www.wjgnet.com/1009-3079/full/v20/i7/558.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i7.558
高迁移率族蛋白B1(high mobility group box-1 protein, HMGB1)是一类广泛存在于真核细胞内的非组核蛋白. 研究表明, HMGB1是启动和维持炎症瀑式反应的中心分子, 与实验性结肠炎等疾病的发病机制关系密切[1-3], 持续和规范的HMGB1抑制已成为一种治疗手段. 丙酮酸乙酯(ethyl pyruvate, EP)是一种稳定的丙酮酸衍生物, 体内外实验中已证明他是一种有效的抗炎因子[4]. 但实验性结肠炎时EP是否可以通过抑制HMGB1的表达, 进而减轻结肠炎目前尚不清楚. 本研究通过观察EP对实验性结肠炎大鼠干预后模型大鼠病理学/结肠组织HMGB1表达和血清炎症因子的影响, 探讨EP治疗实验性结肠炎的可能机制.
EP为Sigma公司产品, 以Ringer's液配制(1L含EP 28 mmol/L, 钠离子130 mmol/L、钾离子4 mmol/L、钙离子27 mmol/L、氯离子139 mmol/L, pH7.02); DSS为Sigma公司产品, 以蒸馏水配制成5%溶液; RNA提取试剂盒为美国Promega公司产品; 鼠抗人HMGB1单克隆抗体为美国Santa Cruz公司产品. TNF-a、IL-6检测试剂盒均购于R&D公司.
1.2.1 实验动物与模型制备: ♂SD大鼠36只, 体质量220-250 g, 由中国人民解放军第二军医大学实验动物中心提供, 实验前在本院动物喂养中心适应性饲养1 wk. 实验前、后分别禁食12 h, 自由饮水. 模型组及治疗组均按按照Cooper等[5,6]的经典方法, 让大鼠自由饮用5% DSS溶液连续7 d, 建立大鼠急性期UC动物模型. 造模后, 使动物保持平躺, 自由饮食.
1.2.2 实验分组: 将36只SD大鼠随机分为空白对照组、DSS模型对照组和EP治疗组. 空白对照组饮用蒸馏水7 d, DSS模型对照组和EP治疗组饮用5% DSS溶液7 d, 建立急性期UC模型; DSS模型对照组未给予任何治疗; EP治疗组从给DSS第3天开始给予EP(40 mg/kg, ip, qd), 共5 d; 第8天用颈椎脱臼法处死所有大鼠, 采集大鼠血清标本和结肠标本备检.
1.2.3 疾病活动指数评分: 观察各组大鼠的体质量变化、大便性状、便血情况, 参照Cooper等[1]的经典的评分系统方法, 根据体质量、大便性状和隐血或便血情况的进行疾病活动指数(disease activity index, DAI)评分.
1.2.4 结肠组织学评分(histopathological score, HPS): 各组分别剖腹取全结肠, 纵行切开后, 于距肛门6 cm处取结肠组织0.5 cm. 组织石蜡包埋, 连续切片, 片厚4 mm, 行HE染色和Cooper经典组织学损伤评分标准进行评分[5]. 剩余结肠组织置入-80 ℃冰箱保存待测.
1.2.5 RT-PCR测定结肠组织HMGB1 mRNA表达: 使用TRIzol试剂提取细胞总RNA并进行逆转录反应. PCR引物, HMGB1: 5'-ACCCGGATGCTTCTGTCAAC-3'(上游), 5'-AGAAGAAGGCCGAAGGAGGC-3'(下游), 扩增产物219 bp; 内参GAPDH: 5'-CAGTGCCAGCCTCGTCTCAT-3'(上游), 5'-AGGGGCCATCCACAGTCTTC-3'(下游), 扩增产物595 bp. PCR条件: 94 ℃ 5 min; 94 ℃ 30 s, 50 ℃ 30 s, 72 ℃ 1 min(循环30次). PCR产物经2%琼脂糖凝胶电泳检测.
1.2.6 Western blot测定结肠组织HMGB1蛋白表达: 用蛋白裂解液提取结肠组织蛋白并测定浓度, 行聚丙烯酰胺凝胶电泳, 然后将蛋白转印至硝酸纤维素膜, 在封闭液中与一抗(抗HMGB抗体)结合, 而后再与二抗(辣根过氧化物酶标记的山羊抗兔IgG, 上海钰森试剂公司)室温孵育3 h, ECL检测、曝光和显影.
1.2.7 血清TNF-a、IL-6的检测: ELISA法检测细胞因子TNF-a、IL-6含量, 参照试剂盒说明书操作并绘制标准曲线, 根据标准曲线方程计算大鼠鼠血清TNF-a、IL-6的浓度.
统计学处理 实验数据均以mean±SD表示. 全部资料利用SPSS13.0统计软件进行统计分析, 组间的比较采用单因素方差分析. P<0.05为有统计学意义.
DSS造模后, 大鼠出现黏液稀便, 且逐渐加重; 造模1 d后, 开始逐渐出现大便次数增多、软便或稀便、大便末端有黏液或脓点等表现; 第3天, 大鼠大便完全为稀便, 有部分出现肉眼血便, 体质量有所减轻; 1 wk左右可见脓血便、体质量明显减轻、毛发无光泽、饮食明显减少、懒动等. EP治疗后大鼠饮食、体质量逐渐增加、毛色逐渐恢复光泽, 便血或大便隐血逐渐减少至消失或隐血. DSS模型组与空白对照组相比, DAI评分明显增高, 差异有统计学意义(P<0.01); EP治疗组与DSS模型组对比, DAI明显下降, 差异有统计学意义(P<0.05); EP治疗组与空白对照组相比, 差异无统计学意义(表1).
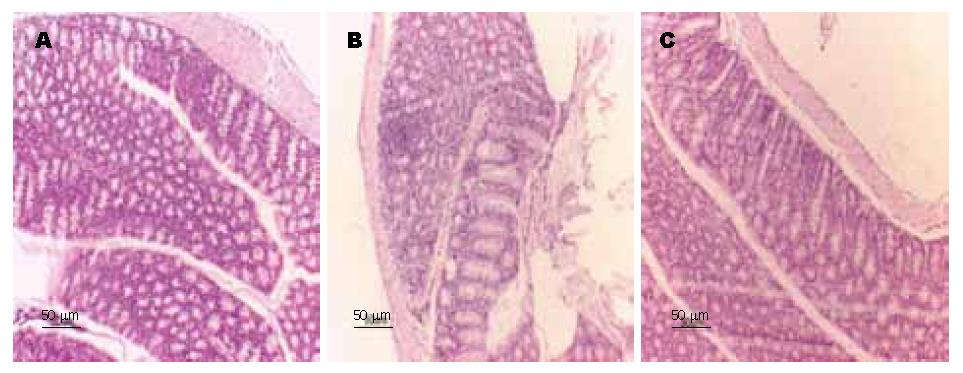
模型组大鼠结肠黏膜明显充血、水肿, 光镜下可见黏膜上皮坏死脱落、溃疡形成, 固有层内有大量中性粒细胞, 广泛黏膜糜烂、隐窝炎及脓肿形成, 腺管排列紊乱; EP治疗组肠黏膜上皮脱落缺损较轻, 溃疡区域减少, 黏膜周围上皮可见增生修复, 炎症细胞浸润减少(图1); 模型组HPS显著高于空白对照组(P<0.01), EP治疗组与DSS模型组对比, HPS明显下降, 差异有统计学意义(P<0.05); EP治疗组与空白对照组相比, HPS差异无统计学意义(表1).
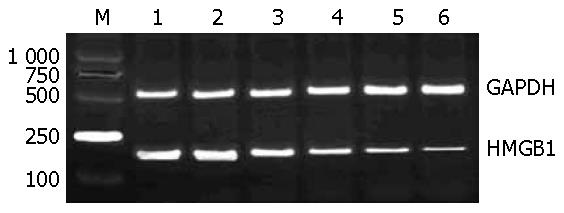
正常对照组大鼠结肠组织中HMGB1 mRNA低表达, 模型组HMGB1 mRNA表达显著升高; 给予EP处理后, HMGB1 mRNA表达显著降低(图2).
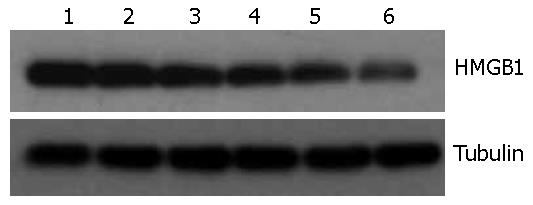
正常对照组大鼠结肠组织中HMGB1蛋白低表达. 与正常对照组相比, 模型组HMGB1蛋白表达显著升高; 给予EP处理后, HMGB1蛋白表达显著降低(图3).
我国炎症性肠病(inflammatory bowel disease, IBD)的发病率增长较快[7]. 这一以慢性、进行性胃肠道损毁为主要特征的自身免疫性疾病, 严重危害患者的生命质量. 近20年, 国内外对IBD胃肠黏膜免疫损伤机制、尤其是炎症因子调控网络的研究和认识在不断深化[8-12]. 免疫应答模式识别及其损伤相关模式(damage-associated molecular patterns, DAMP)理论的提出以及对DAMP分子中最主要成分HMGB1研究, 为我们从新的视角认识IBD炎症因子网络、寻找新的抗炎靶点打开了另一扇门户[13-15].
HMGB1作为一种重要的炎症介质和致炎细胞因子, 是启动和维持炎症瀑式反应的中心分子, 不仅自身分泌有级联放大效应, 而且还可以调节其他炎症因子的分泌, 与炎症性肠病等自身免疫性疾病的发病关系密切. HMGB1分子质量小, 因其在聚丙烯酰胺凝胶电泳中表现为快速迁移而得以命名. 他是主要由坏死细胞被动释放以及单核/巨噬细胞受脂多糖(LPS)等刺激后表达的信息分子, 处在核因子-kB(nuclear factor kB, NF-kB)上游. HMGB1主要功能为在细胞活化过程中通过影响DNA复制、转录和重组等, 调控修复信号, 使炎症反应趋向于良性或恶性发展. 他是近年研究发现的一种强大的致炎细胞因子, 并可与IL-l、IL-6和TNF-a等重要炎症因子相互诱生[16,17]. 因此, HMGB1成为治疗炎症性疾病的重要靶物质, 并为炎症性疾病开辟了一个新的研究领域[18,19].
HMGB1可能是调控胃肠黏膜的免疫损伤机制的重要的信息分子[20]. 在DSS、TNBS、IL-10-/-诱导的大鼠实验性结肠炎模型中, HMGB1表达显著升高, 抑制HMGB1释放后, 结肠炎病理损害的指标显著减轻, 局部或循环中的细胞炎症因子水平显著降低[21,22]. 我们在噁唑酮(OXZ)诱导大鼠实验性结肠炎模型上发现模型组大鼠结肠组织中HMGB1 mRNA及蛋白表达升高, 并与结肠黏膜损伤积分呈正相关; 模型组大鼠结肠组织TLR2和NF-kB蛋白表达亦明显升高; HMGB1蛋白与TLR2和NF-kB蛋白表达呈显著正相关. 这提示, 实验性结肠炎的形成、发展和维持, 可能与局部异常表达的HMGB1启动炎症级联反应有关[23].
EP作为稳定的丙酮酸酯化物, 不仅具有抗氧化作用, 还具有调节炎症因子的表达、维持机体的抗炎和促炎平衡及保护脏器的功能[24-26]. 他可通过抑制由NF-kB和p38 MAPK介导的信号转导, 并能通过浓度依赖的方式抑制巨噬细胞释放HMGB1而发挥抗炎作用[27-30]. 本研究应用HMGB1拮抗剂EP对DSS诱导的实验性结肠炎大鼠进行了干预治疗, 并观察EP对大鼠结肠组织HMGB1表达及血清细胞因子的影响. 结果显示, EP干预显著降低了实验性结肠炎大鼠结肠组织HMGB1 mRNA和蛋白水平; 结肠组织病理学检查亦显示EP干预组大鼠结肠组织学得到明显的改善; 血清炎症因子水平显著下调.
总之, 本研究说明EP具有一定的抗炎和减轻肠黏膜损伤的作用, 能有效防止大鼠实验性结肠炎的发生及发展, 其作用机制可能与其通过影响实验性结肠炎炎症反应过程中的关键炎症因子HMGB1而实现, 进而下调促炎细胞因子的产生和表达有关, 但其中的具体作用机制尚不十分清楚, 有待于进一步研究.
高迁移率族蛋白B1(HMGB1)是启动和维持炎症瀑式反应的中心分子, 与实验性结肠炎等疾病的发病机制关系密切; 丙酮酸乙酯(EP)是一种稳定的丙酮酸衍生物, 体内外实验已证明他是一种有效的抗炎因子.
张小晋, 主任医师, 北京积水潭医院消化内科
在DSS、TNBS、IL-10-/-诱导的大鼠实验性结肠炎模型中, HMGB1表达显著升高, 抑制HMGB1释放后, 结肠炎病理损害的指标显著减轻, 局部或循环中的细胞炎症因子水平显著降低.
本研究立意清晰, 实验设计合理, 结果明确, 对临床认识和治疗炎症性肠病有一定的参考意义.
编辑: 张姗姗 电编: 何基才
| 1. | Voll RE, Urbonaviciute V, Herrmann M, Kalden JR. High mobility group box 1 in the pathogenesis of inflammatory and autoimmune diseases. Isr Med Assoc J. 2008;10:26-28. [PubMed] |
| 2. | Jiang W, Pisetsky DS. Mechanisms of Disease: the role of high-mobility group protein 1 in the pathogenesis of inflammatory arthritis. Nat Clin Pract Rheumatol. 2007;3:52-58. [PubMed] [DOI] |
| 3. | Ostberg T, Kawane K, Nagata S, Yang H, Chavan S, Klevenvall L, Bianchi ME, Harris HE, Andersson U, Palmblad K. Protective targeting of high mobility group box chromosomal protein 1 in a spontaneous arthritis model. Arthritis Rheum. 2010;62:2963-2972. [PubMed] [DOI] |
| 4. | Fink MP. Ethyl pyruvate. Curr Opin Anaesthesiol. 2008;21:160-167. [PubMed] [DOI] |
| 5. | Cooper HS, Murthy SN, Shah RS, Sedergran DJ. Clinicopathologic study of dextran sulfate sodium experimental murine colitis. Lab Invest. 1993;69:238-249. [PubMed] |
| 6. | Dieleman LA, Palmen MJ, Akol H, Bloemena E, Peña AS, Meuwissen SG, Van Rees EP. Chronic experimental colitis induced by dextran sulphate sodium (DSS) is characterized by Th1 and Th2 cytokines. Clin Exp Immunol. 1998;114:385-391. [PubMed] [DOI] |
| 7. | Jiang XL, Cui HF. An analysis of 10218 ulcerative colitis cases in China. World J Gastroenterol. 2002;8:158-161. [PubMed] [DOI] |
| 8. | Xavier RJ, Podolsky DK. Unravelling the pathogenesis of inflammatory bowel disease. Nature. 2007;448:427-434. [PubMed] [DOI] |
| 9. | Rakoff-Nahoum S, Bousvaros A. Innate and adaptive immune connections in inflammatory bowel diseases. Curr Opin Gastroenterol. 2010;26:572-577. [PubMed] [DOI] |
| 11. | Sartor RB. Microbial influences in inflammatory bowel diseases. Gastroenterology. 2008;134:577-594. [PubMed] [DOI] |
| 12. | Lehmann FS. [Pathophysiology of inflammatory bowel disease]. Ther Umsch. 2003;60:127-132. [PubMed] [DOI] |
| 13. | Huang W, Tang Y, Li L. HMGB1, a potent proinflammatory cytokine in sepsis. Cytokine. 2010;51:119-126. [PubMed] [DOI] |
| 14. | van Zoelen MA, Yang H, Florquin S, Meijers JC, Akira S, Arnold B, Nawroth PP, Bierhaus A, Tracey KJ, van der Poll T. Role of toll-like receptors 2 and 4, and the receptor for advanced glycation end products in high-mobility group box 1-induced inflammation in vivo. Shock. 2009;31:280-284. [PubMed] |
| 15. | Toiyama Y, Araki T, Yoshiyama S, Hiro J, Miki C, Kusunoki M. The expression patterns of Toll-like receptors in the ileal pouch mucosa of postoperative ulcerative colitis patients. Surg Today. 2006;36:287-290. [PubMed] [DOI] |
| 16. | Scaffidi P, Misteli T, Bianchi ME. Release of chromatin protein HMGB1 by necrotic cells triggers inflammation. Nature. 2002;418:191-195. [PubMed] [DOI] |
| 17. | Andersson U, Wang H, Palmblad K, Aveberger AC, Bloom O, Erlandsson-Harris H, Janson A, Kokkola R, Zhang M, Yang H. High mobility group 1 protein (HMG-1) stimulates proinflammatory cytokine synthesis in human monocytes. J Exp Med. 2000;192:565-570. [PubMed] [DOI] |
| 18. | Mantell LL, Parrish WR, Ulloa L. Hmgb-1 as a therapeutic target for infectious and inflammatory disorders. Shock. 2006;25:4-11. [PubMed] [DOI] |
| 19. | Wang H, Ward MF, Sama AE. Novel HMGB1-inhibiting therapeutic agents for experimental sepsis. Shock. 2009;32:348-357. [PubMed] [DOI] |
| 20. | Sanderson IR, Walker WA. TLRs in the Gut I. The role of TLRs/Nods in intestinal development and homeostasis. Am J Physiol Gastrointest Liver Physiol. 2007;292:G6-G10. [PubMed] [DOI] |
| 21. | Maeda S, Hikiba Y, Shibata W, Ohmae T, Yanai A, Ogura K, Yamada S, Omata M. Essential roles of high-mobility group box 1 in the development of murine colitis and colitis-associated cancer. Biochem Biophys Res Commun. 2007;360:394-400. [PubMed] [DOI] |
| 22. | Davé SH, Tilstra JS, Matsuoka K, Li F, DeMarco RA, Beer-Stolz D, Sepulveda AR, Fink MP, Lotze MT, Plevy SE. Ethyl pyruvate decreases HMGB1 release and ameliorates murine colitis. J Leukoc Biol. 2009;86:633-643. [PubMed] [DOI] |
| 25. | Uchiyama T, Delude RL, Fink MP. Dose-dependent effects of ethyl pyruvate in mice subjected to mesenteric ischemia and reperfusion. Intensive Care Med. 2003;29:2050-2058. [PubMed] [DOI] |
| 27. | Miyaji T, Hu X, Yuen PS, Muramatsu Y, Iyer S, Hewitt SM, Star RA. Ethyl pyruvate decreases sepsis-induced acute renal failure and multiple organ damage in aged mice. Kidney Int. 2003;64:1620-1631. [PubMed] [DOI] |
| 28. | 杨 智勇, 王 春友, 陶 京, 熊 烔炘, 万 赤丹, 周 峰, 李 晓辉. 丙酮酸乙酯对重症急性胰腺炎大鼠血清高迁移率蛋白-1水平的影响及意义. 中华实验外科杂志. 2004;21:1306-1308. |
| 30. | Karabeyoğlu M, Unal B, Bozkurt B, Dolapçi I, Bilgihan A, Karabeyoğlu I, Cengiz O. The effect of ethyl pyruvate on oxidative stress in intestine and bacterial translocation after thermal injury. J Surg Res. 2008;144:59-63. [PubMed] [DOI] |