修回日期: 2012-01-29
接受日期: 2012-02-15
在线出版日期: 2012-03-08
目的: 探讨肿瘤坏死因子相关诱导配体受体(DR5)的单克隆抗体HCTB006联合5-FU对人胃癌细胞系7901、MKN28的作用以及机制.
方法: 用ATPlite法检测HBCT006单药组、5-FU单药组及两药物合用对胃癌细胞存活率的影响, 研究两者之间的关系; 采用流式细胞技术检测胃癌细胞系7901以及MKN28表面DR5的表达水平; Western blot检测上述3组用药后胃癌细胞内XIAP, caspase3的变化.
结果: 胃癌细胞系7901、MKN28对HCTB006不敏感; 5-FU对二者的增殖抑制作用具有时间以及浓度依赖效应; 联合用药组具有很好的协同抑制胃癌细胞系增殖的效果, 且具有浓度依赖效应, 与给药次序无关. 流式细胞技术检测胃癌细胞系7901, MKN28表面死亡受体DR5的表达依次为: 93.8%以及87.7%. 免疫迹印结果表明, 联合用药组可以引发胃癌细胞内凋亡抑制蛋白XIAP的降解, 激活最终凋亡执行蛋白caspase3, 引起细胞死亡.
结论: HTB006与5-FU联合应用具有协同杀伤胃癌细胞的作用. 胃癌细胞7901、MKN28对于HCTB006的敏感程度与细胞表面DR5的表达量不相关; 联合用药作用机制可能与细胞内抑制凋亡蛋白XIAP降解有关.
引文著录: 张择伟, 宁守斌, 沈恩允, 郭雷鸣, 赵亚娟, 王巧梅. HCTB006联合5-FU对胃癌细胞系MKN28、7901的作用及其机制. 世界华人消化杂志 2012; 20(7): 546-551
Revised: January 29, 2012
Accepted: February 15, 2012
Published online: March 8, 2012
AIM: To investigate the effect of combined anti-human death receptor 5 (DR5) monoclonal antibody HCTB006 and 5-fluorouracil (5-FU) on the growth of human gastric cancer cell lines SGC-7901 and MKN28 and to explore possible mechanisms involved.
METHODS: The ability of HCTB006 and 5-FU, alone or in combination, to inhibit the proliferation of SGC-7901 and MKN28 cells was measured by ATP-Lite assay. The expression of DR5 on the surface of gastric cancer cells was examined by flow cytometry. The level of X-linked inhibitor of apoptosis (XIAP) and caspase 3 in treated cells was detected by Western blot.
RESULTS: SGC-7901 and MKN28 cells were less sensitive to HCTB006. Concentration- and time-dependent cytotoxicity of 5-FU was exhibited in SGC-7901 and MKN28 cells. The combination of 5-FU and HTCB006 exhibited a synergistic effect on the proliferation of SGC 7901 and MKN28 cells. The positive rates of DR5 expression on the surface of SGC-7901 and MKN28 cells were 93.8% and 87.7%, respectively. Western blot analysis revealed that combined HCTB006 and 5-FU induced XIAP degradation and caspase 3 activation.
CONCLUSION: The combination of 5-FU and HTCB006 exhibited a synergistic effect on the growth of SGC-7901 and MKN28 cells possibly via a mechanism associated with XIAP degradation. The in vitro sensitivity of gastric cancer cells to HCTB006 has no direct association with DR5 expression.
- Citation: Zhang ZW, Ning SB, Shen EY, Guo LM, Zhao YJ, Wang QM. Effect of combined HCTB006 and 5-fluorouracil on the growth of human gastric cancer cell lines SGC-7901 and MKN28. Shijie Huaren Xiaohua Zazhi 2012; 20(7): 546-551
- URL: https://www.wjgnet.com/1009-3079/full/v20/i7/546.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i7.546
胃癌是世界范围内常见的恶性肿瘤之一, 全球每年新发病例数占新发癌症病例总数的17%[1]. 胃癌一经发现大多数处于晚期, 且治疗手段以化疗为主, 但目前胃癌化疗没有统一方案, 如何通过药物联合增加肿瘤细胞的凋亡是研究的关键. 而胃癌的靶向药物治疗提供了新的治疗思路, 其中针对肿瘤细胞表面死亡受体DR5的抗体药物是目前研究热点, 他能够选择性地诱导肿瘤细胞或转化细胞发生凋亡, 而对正常细胞无明显毒性[2]. 本实验室通过研究DR5单克隆抗体HCTB006联合5-FU作用于胃癌细胞系7901, MKN28, 观察其联合应用有无协同杀伤肿瘤细胞的作用, 并初步探讨其可能的作用机制.
胃癌细胞系MKN28, 7901购自美国模式菌种收藏所(ATCC); 将胃癌细胞系MKN28, 7901培养于含有100 mL/L的胎牛血清, 0.1%青霉素+链霉素的DMEM培养基中, 置于孵箱内, 37 ℃, 50 mL/L CO2, 饱和湿度下培养, 实验时取对数生长期的细胞. 抗人DR5单克隆抗体HCTB006由北京同为时代公司提供; caspase3购自sellsignaling公司; XIAP, 山羊抗鼠单克隆抗体以及ECL显影试剂盒均购自Santa Cruz公司; 胃癌细胞培养材料、胎牛血清购自GIBCO公司; ATPlite检测试剂盒购自购自美国PerkinElmer公司; 羊抗人IgG(H+L)RPE、羊抗人RPE购自Southern Biotech公司; 5-FU为上海旭东海普药业有限公司产品. 微孔板发光分析仪(BHP9504-2)为北京滨松光子技术有限公司产品; 流式细胞仪(CytomicsTM FC500)为美国Beckman Coulter公司生产; 垂直电仪以及电转装置为Thermo EC公司产品.
1.2.1 ATPlite法检测HCTB006与5-FU联合应用对胃癌细胞系MKN28, 7901的杀伤[3]: 取对数生长期胃癌细胞系MKN28, 7901, 胰酶消化后, 细胞计数, 3000个/孔铺于96孔板中培养过夜. 药物分为4组: HCTB006单药组, 5-FU单药组, HCTB006+5-FU联合用药组以及空白对照组. HCTB006U药物浓度梯度为: 500 ng/L, 250 ng/L, 125 ng/L, 62.5 ng/L, 31.25 ng/L, 15.625 ng/L; 5-FU药物浓度为: 500 mmol/L, 400 mmol/L, 300 mmol/L, 200 mmol/L, 100 mmol/L, 50 mmol/L, 联合用药为各单药浓度梯度的联合. 联合用药组给药次序为: 序贯给药, 5-FU预处理24 h之后加入HTB006组共同作用24 h; 同时给药组: 两药同时作用48 h. ATPlite检测细胞存活率. 每孔加入50 mL细胞裂解液, 震荡3 min; 吸取裂解上清50 mL于酶标板中; 在酶标板中加入25 mL的发光液, 震荡10 s后, 避光静置3 min. 将孵育好的酶标板放入发光仪, 读取发光值. 细胞存活率(survival rate) = (样品发光值平均值/对照组发光值的平均值)×100%. 实验重复3次, 取平均值.
1.2.2 流式细胞术检测胃癌细胞系MKN28, 7901死亡受体DR5的表达: 收集对数生长期的细胞, 用含2% FBS的预冷PBS洗液1 500 r/min, 4 min, 洗1次, 调整细胞密度为2×106个/mL, 分50 mL/孔加入96孔圆底板中. 设空白对照、底物对照、HCTB006组3组, 底物对照组加入小鼠IgG, HCTB006终浓度为10 mg/L. 冰上孵育1 h. 洗液洗2次, 再于每管中加入山羊抗小鼠IgG-RPE,冰上孵育15 min, PBS洗2次, 每管加入300 mL洗液重悬上流式细胞仪检测. 用流式专用软件WinMI-D 2.9软件分析结果, 求出各株细胞结合率(%). 实验重复3次, 取平均值.
1.2.3 Western blot检测胃癌细胞7901, MKN28细胞XIAP, caspase3的变化: 将胃癌细胞系7901, MKN28调整成1×106个/mL. 培养于6孔板中过夜培养. 第2天药物处理, 给药浓度: 5-FU组: 250 mmol/L; 500 mmol/L; HCTB006: 500 mg/L组: 联合给药组: HCTB006(con: 500 ng/L)+5-FU(250 mmol/L); HCTB006(500 ng/L)+5-FU(500 mmol/L); 体积为2 mL, 培养24 h. 收集胃癌细胞7901, MKN28, 3 000 r/min; 离心5 min, 吸取上清, BCA蛋白定量. 配制SDS-PAGE胶, 上层胶10%, 下层胶5%. 每个泳道上样的j蛋白量均为30 mg/L, 电泳至预染的Marker充分分离. 以30 V电压转膜1 h转至PVDF膜上. 5%的脱脂牛奶封闭过夜. caspase3, XIAP, b-actin按照说明稀释抗体, 室温孵育2 h, TBST洗膜3次, 10 min/次. 加入1:3 000稀释的山羊抗小鼠二抗, 室温孵育1 h, TBST洗去未结合的抗体, ECL显影, 曝光并拍照.
统计学处理 应用SPSS17.0统计软件, 计量资料采用meanSD表示, 采用One-way ANOVA进行组间比较, 差异显著应用SNK-q检验进行组间多重比较, P<0.05为差异具有统计学意义.
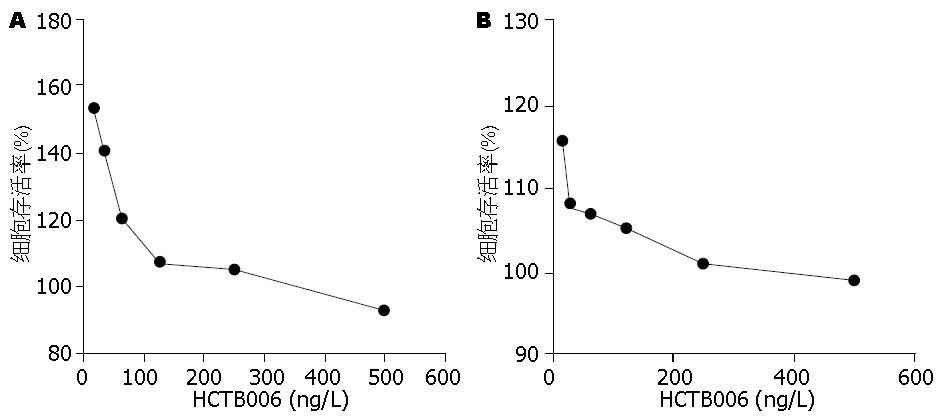
胃癌细胞系7901以及MKN28对HCTB006不敏感; HCTB006高浓度(500 ng/L)时对癌细胞系7901的抑制率仅为8%, 对MKN28的抑制率为6%, 低浓度的药物对2株胃癌细胞系存活率无明显影响(图1).
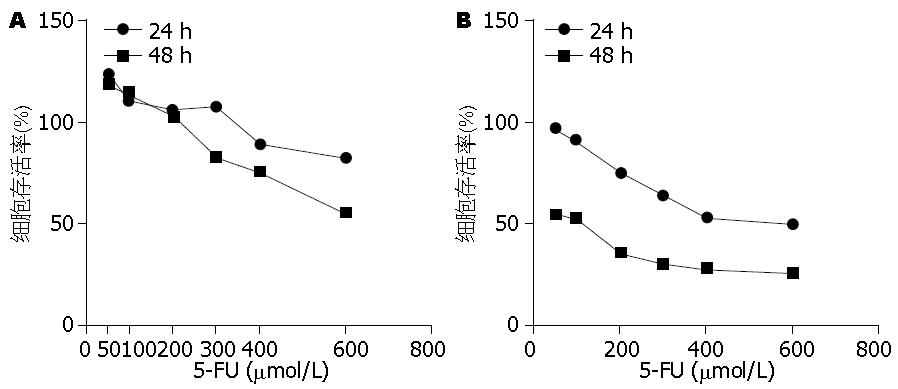
不同浓度的5-FU对胃癌细胞系7901, MKN28具有明显的抑制细胞增殖作用, 48 h细胞存活率低于24 h; 5-FU对胃癌细胞系7901, MKN28的增殖抑制作用具有时间以及浓度依赖效应, 差异具有统计学意义(P<0.05, 图2).
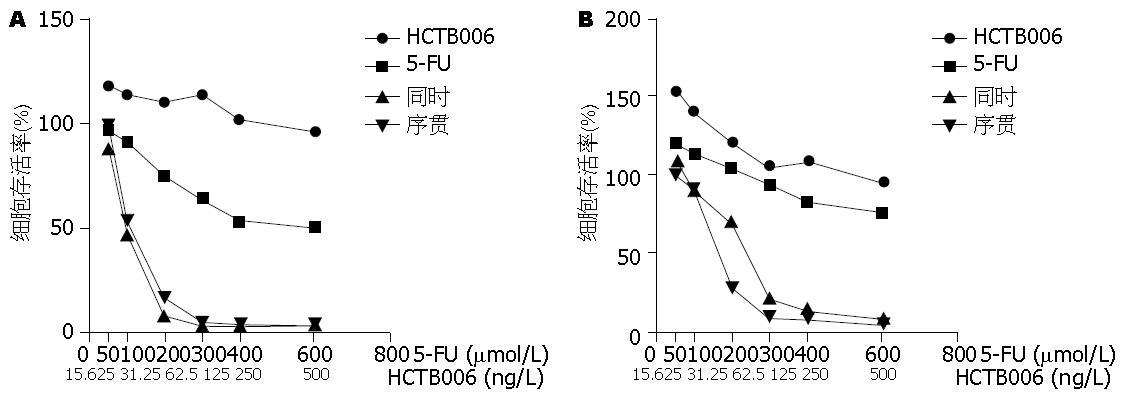
联合用药组具有很好的协同抑制胃癌细胞系7901以及MKN28增殖作用, 同时对细胞增殖的抑制作用具有浓度依赖效应, 但无统计学意义, 尚不能认为不同给药方式对细胞存活的影响有明显差别(表1).
| HCTB006+5-FU (ng/L+μmol/L) | MKN28 | 7901 | ||
| 同时 | 序贯 | 同时 | 序贯 | |
| 500+600 | 13.48±0.028 | 2.89±0.115 | 8.17±0.068 | 4.49±0.009 |
| 250+400 | 13.71±0.059 | 3.56±0.062 | 13.89±0.058 | 7.95±0.019 |
| 125+300 | 15.01±0.031 | 3.51±0.251 | 21.72±0.202 | 9.48±0.121 |
| 62.5+125 | 16.39±0.116 | 8.24±0.340 | 69.08±2.036 | 27.66±0.168 |
| 31.25+62.5 | 51.86±0.186 | 47.20±0.272 | 90.27±0.279 | 87.10±0.141 |
| 15.625+31.25 | 98.38±0.239 | 88.26±0.221 | 110.56±0.412 | 101.23±1.738 |
联合应用5-FU以及HCTB006对胃癌细胞有很好的协同抑制胃癌细胞系7901以及MKN28的作用, 与HCB006组比较, 联合用药组和5-FU组差异显著(P<0.05, 图3).
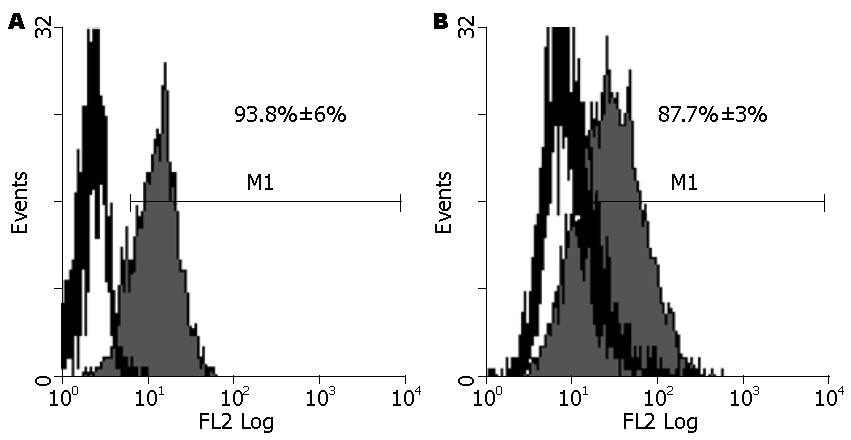
胃癌细胞系7901, MKN28死亡受体DR5表达量分别为: 93.8%及87.7%(图4).
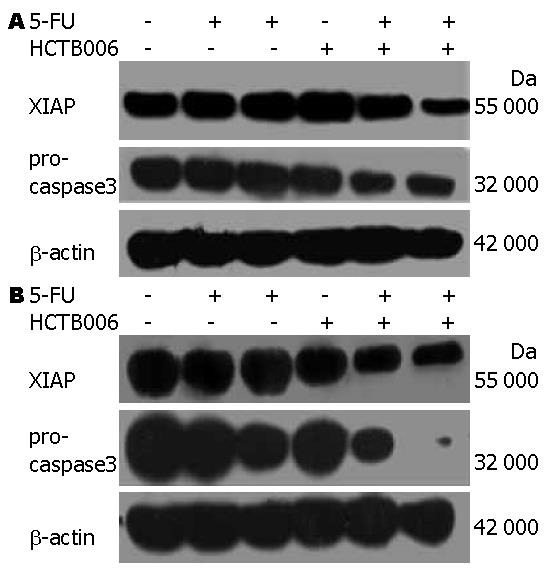
MKN28细胞内与凋亡相关蛋白XIAP, caspase3的表达变化见图5. 研究结果表明HCTB006以及5-FU联合应用引起胃癌细胞7901, MKN28胞内XIAP, caspase3的降解, 降解程度与药物浓度有关. 单独应用HCTB006, 5-FU未见XIAP, caspase3的降解.
肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor related apoptosis inducing ligand, TRAIL)能够通过细胞表面死亡受体DR4或者DR5介导肿瘤细胞凋亡[4,5]. DR4或者DR5可以通过胞内段完整的死亡结构域(death domain, DD)形成三聚体募集胞质的某些连接蛋白, 形成死亡起始信号复合物(death-inducing signaling complex, DISC)继而活化caspase系统并触发细胞凋亡[6]. 研究表明许多肿瘤, 如结肠癌、胃癌、胰腺癌、乳腺癌等均表达DR5或者DR4, 且DR5的表达量高于DR4, 而正常的细胞二者的表达量很低或者不表达, DR5是在TRAIL中诱导细胞凋亡过程中起主要作用的受体[7,8]. 目前许多体内外实验证实, 针对DR5的单克隆抗体能够起到很好地抑制肿瘤细胞生长的作用[9,10], 而且较TRAIL具有更好的特异性. 然而胃癌细胞对TRAIL不敏感甚至耐药[11], 目前为止DR5单抗作用于胃癌研究较少.
HCTB006是DR5的单克隆抗体, 本研究结果表明高浓度HCT006(500 ng/L)作用于胃癌细胞系7901以及MKN28, 24 h后细胞抑制率仅为8%以及6%, 表明胃癌细胞系7901以及MKN28对于抗体HCTB006不敏感, 与文献报道胃癌细胞对于TRAIL耐药结果一致. 据文献报道, 某些化疗药物与TRAIL联合作用于胃癌细胞可以起到协同杀伤肿瘤细胞的作用[12-14].
为此我们采用临床胃癌一线化疗药物5-FU联合HCTB006共同作用于肿瘤细胞, 观察其抑制肿瘤效果. 研究结果表明, 5-FU与HCTB006联合作用于胃癌细胞系可以起到很好地协同抑制肿瘤细胞增殖的作用, 减少化疗药物剂量. 通过与单药组比较, 联合用药组明显降低胃癌细胞7901以及MKN28的存活率, 差异具有统计学意义. 这与文献报道5-FU联合TRAIL作用协同作用胃癌细胞结果一致[15].
目前为止胃癌细胞对于DR5激动剂的耐药性机制尚未完全研究清楚, 与肿瘤细胞表面受体表达量以及凋亡通路中多种促凋亡因子以及抗凋亡因子相关. 为进一步研究5-FU以及HCTB006联合应用杀伤胃癌细胞的作用机制, 本研究从胃癌细胞表面DR5表达以及细胞内信号通路凋亡相关蛋白XIAP, caspase3两方面进行研究. 流式细胞技术结果表明: 胃癌细胞系7901以及MKN28死亡受体呈高表达, 但HTCB006对二者无明显抑制效果, 表明DR5的表达量高低与胃癌细胞系对于DR5抗体药物敏感性无明显相关, 这与目前研究结果一致[16]. 研究结果提示我们: 胃癌细胞对于抗体药物的耐受以及联合用药的作用有更深的机制需要进一步研究.
连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein, XIAP)是凋亡抑制蛋白家族中最有效的caspase抑制物, 近年来发现XIAP在肿瘤中高表达, 与肿瘤分化程度以及预后有关[17]. XIAP可以直接抑制caspase9, caspase3, caspase7, 而发挥作用, 而最主要的是抑制caspase3的活性从而抑制肿瘤细胞的凋亡[18]. 目前研究采用多种方法如基因敲除[19], siRNA干预XIAP的合成[20]等证实XIAP在凋亡通路中起重要的抗凋亡作用. 有研究报道, 人乳腺癌DMA-231细胞对TRAIL的抵抗与XIAP的表达和ERK激活有关[21], XIAP的降解可以增加肿瘤细胞对TRAIL的敏感性[22].
本研究采用Western blot技术研究HCTB006, 5-FU单独以及联合作用对于胃癌细胞系7901, MKN28死亡受体通路信号蛋白XIAP, caspase3的变化, 初步探讨其协同作用的机制. 结果表明, 单独应用5-FU不能引起XIAP的降解, 但是联合应用5-FU和HCB006能够明显引起XIAP的降解, 同时相应的凋亡执行蛋白caspase3也相应降解, 而且与联合用药浓度正相关. 这与最新的研究结果[23]一致, 通过化疗药物硼替咗咪以及多柔比星联合单克隆抗体TRA-8作用于耐乳腺癌细胞, 细胞内BCL-2, XIAP蛋白降解, 激活内源性凋亡通路.
本实验研究表明, HCTB006对胃癌细胞7901以及MKN28的细胞增殖抑制作用较低, 通过联合化疗药物5-FU可以极大增加对胃癌细胞的杀伤作用, HTCB006对胃癌细胞的杀伤作用与肿瘤细胞的表面DR5的表达量无明显相关; 联合用药能够引起细胞内抗凋亡蛋白XIAP的降解, 最终激活caspase3引起细胞凋亡, 但由于肿瘤细胞耐药机制复杂, 抑制凋亡蛋白只是研究的一个方面, 其中还有更多的机制需要进一步探讨. 由于联合用药可在保证药效的同时降低药物的剂量, 同时降低药物的不良反应, 对临床应用有一定的指导意义.
胃癌一经发现大多数处于晚期, 且治疗手段以化疗为主, 但目前胃癌化疗没有统一方案, 如何通过药物联合增加肿瘤细胞的凋亡是研究的关键.
张俊, 副研究员, 上海交通大学医学院附属瑞金医院普外科
研究表明胃癌细胞对于TRAIL耐药, 通过药物联合杀伤肿瘤细胞是研究的热点.
研究表明许多肿瘤, 如结肠癌、胃癌、胰腺癌、乳腺癌等均表达DR5或者DR4, 且DR5的表达量高于DR4, 而正常的细胞二者的表达量很低或者不表达, DR5是在TRAIL中诱导细胞凋亡过程中起主要作用的受体.
本研究发现, 死亡受体DR5单克隆抗体药物对正常细胞无作用, 只特异杀伤肿瘤细胞, 通过与化疗药物联合应用, 不仅可以降低化疗用药剂量, 而且具良好的靶向性, 能够特异性消灭肿瘤而对正常组织没有损伤.
本研究设计合理, 结果可靠, 具有较好的临床参考价值.
编辑: 曹丽鸥 电编: 何基才
| 1. | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun MJ. Cancer statistics, 2009. CA Cancer J Clin. 2009;59:225-249. [PubMed] [DOI] |
| 3. | Cree IA, Andreotti PE. Measurement of cytotoxicity by ATP-based luminescence assay in primary cell cultures and cell lines. Toxicol In Vitro. 1997;11:553-556. [PubMed] [DOI] |
| 4. | Schneider P, Thome M, Burns K, Bodmer JL, Hofmann K, Kataoka T, Holler N, Tschopp J. TRAIL receptors 1 (DR4) and 2 (DR5) signal FADD-dependent apoptosis and activate NF-kappaB. Immunity. 1997;7:831-836. [PubMed] [DOI] |
| 5. | Papenfuss K, Cordier SM, Walczak H. Death receptors as targets for anti-cancer therapy. J Cell Mol Med. 2008;12:2566-2585. [PubMed] [DOI] |
| 6. | Thomas LR, Henson A, Reed JC, Salsbury FR, Thorburn A. Direct binding of Fas-associated death domain (FADD) to the tumor necrosis factor-related apoptosis-inducing ligand receptor DR5 is regulated by the death effector domain of FADD. J Biol Chem. 2004;279:32780-32785. [PubMed] [DOI] |
| 7. | Tolcher AW, Mita M, Meropol NJ, von Mehren M, Patnaik A, Padavic K, Hill M, Mays T, McCoy T, Fox NL. Phase I pharmacokinetic and biologic correlative study of mapatumumab, a fully human monoclonal antibody with agonist activity to tumor necrosis factor-related apoptosis-inducing ligand receptor-1. J Clin Oncol. 2007;25:1390-1395. [PubMed] [DOI] |
| 8. | Rowinsky EK. Targeted induction of apoptosis in cancer management: the emerging role of tumor necrosis factor-related apoptosis-inducing ligand receptor activating agents. J Clin Oncol. 2005;23:9394-9407. [PubMed] [DOI] |
| 9. | Hunter TB, Manimala NJ, Luddy KA, Catlin T, Antonia SJ. Paclitaxel and TRAIL synergize to kill paclitaxel-resistant small cell lung cancer cells through a caspase-independent mechanism mediated through AIF. Anticancer Res. 2011;31:3193-3204. [PubMed] |
| 10. | Forero-Torres A, Shah J, Wood T, Posey J, Carlisle R, Copigneaux C, Luo FR, Wojtowicz-Praga S, Percent I, Saleh M. Phase I trial of weekly tigatuzumab, an agonistic humanized monoclonal antibody targeting death receptor 5 (DR5). Cancer Biother Radiopharm. 2010;25:13-19. [PubMed] [DOI] |
| 11. | Horinaka M, Yoshida T, Nakata S, Shiraishi T, Tomosugi M, Yoshikawa S, Wakada M, Sakai T. Aclarubicin enhances tumor necrosis factor-related apoptosis-inducing ligand-induced apoptosis through death receptor 5 upregulation. Cancer Sci. 2012;103:282-287. [PubMed] [DOI] |
| 12. | Nam SY, Jung GA, Hur GC, Chung HY, Kim WH, Seol DW, Lee BL. Upregulation of FLIP(S) by Akt, a possible inhibition mechanism of TRAIL-induced apoptosis in human gastric cancers. Cancer Sci. 2003;94:1066-1073. [PubMed] [DOI] |
| 13. | Xu L, Qu X, Zhang Y, Hu X, Yang X, Hou K, Teng Y, Zhang J, Sada K, Liu Y. Oxaliplatin enhances TRAIL-induced apoptosis in gastric cancer cells by CBL-regulated death receptor redistribution in lipid rafts. FEBS Lett. 2009;583:943-948. [PubMed] [DOI] |
| 14. | Xu L, Qu X, Luo Y, Zhang Y, Liu J, Qu J, Zhang L, Liu Y. Epirubicin enhances TRAIL-induced apoptosis in gastric cancer cells by promoting death receptor clustering in lipid rafts. Mol Med Rep. 2011;4:407-411. [PubMed] |
| 15. | Lee KC, Hamstra DA, Bhojani MS, Khan AP, Ross BD, Rehemtulla A. Noninvasive molecular imaging sheds light on the synergy between 5-fluorouracil and TRAIL/Apo2L for cancer therapy. Clin Cancer Res. 2007;13:1839-1846. [PubMed] [DOI] |
| 16. | Ashkenazi A, Holland P, Eckhardt SG. Ligand-based targeting of apoptosis in cancer: the potential of recombinant human apoptosis ligand 2/Tumor necrosis factor-related apoptosis-inducing ligand (rhApo2L/TRAIL). J Clin Oncol. 2008;26:3621-3630. [PubMed] [DOI] |
| 17. | Li M, Song T, Yin ZF, Na YQ. XIAP as a prognostic marker of early recurrence of nonmuscular invasive bladder cancer. Chin Med J (Engl). 2007;120:469-473. [PubMed] |
| 18. | Schimmer AD, Dalili S, Batey RA, Riedl SJ. Targeting XIAP for the treatment of malignancy. Cell Death Differ. 2006;13:179-188. [PubMed] [DOI] |
| 19. | Zhang Y, Wang Y, Gao W, Zhang R, Han X, Jia M, Guan W. Transfer of siRNA against XIAP induces apoptosis and reduces tumor cells growth potential in human breast cancer in vitro and in vivo. Breast Cancer Res Treat. 2006;96:267-277. [PubMed] [DOI] |
| 20. | Shrikhande SV, Kleeff J, Kayed H, Keleg S, Reiser C, Giese T, Büchler MW, Esposito I, Friess H. Silencing of X-linked inhibitor of apoptosis (XIAP) decreases gemcitabine resistance of pancreatic cancer cells. Anticancer Res. 2006;26:3265-3273. [PubMed] |
| 21. | Lee TJ, Lee JT, Park JW, Kwon TK. Acquired TRAIL resistance in human breast cancer cells are caused by the sustained cFLIP(L) and XIAP protein levels and ERK activation. Biochem Biophys Res Commun. 2006;351:1024-1030. [PubMed] [DOI] |
| 22. | Vogler M, Walczak H, Stadel D, Haas TL, Genze F, Jovanovic M, Gschwend JE, Simmet T, Debatin KM, Fulda S. Targeting XIAP bypasses Bcl-2-mediated resistance to TRAIL and cooperates with TRAIL to suppress pancreatic cancer growth in vitro and in vivo. Cancer Res. 2008;68:7956-7965. [PubMed] [DOI] |
| 23. | Amm HM, Zhou T, Steg AD, Kuo H, Li Y, Buchsbaum DJ. Mechanisms of drug sensitization to TRA-8, an agonistic death receptor 5 antibody, involve modulation of the intrinsic apoptotic pathway in human breast cancer cells. Mol Cancer Res. 2011;9:403-417. [PubMed] [DOI] |