修回日期: 2012-01-12
接受日期: 2012-02-27
在线出版日期: 2012-02-28
目的: 探讨利用窄带成像技术(narrow band imaging, NBI)观察毛细血管形态(capillary patterns, CP)对结直肠息肉样病变鉴别诊断的价值.
方法: 75例患者接受NBI结肠镜检查共发现病变部位116处. 根据Yoshiki的分型方法, 将结直肠病变的CP分为6种: 蜂窝状结构型、模糊结构型、网状结构型、密度增高型、不规则结构型、稀疏结构型. 利用NBI下观察到的CP进行鉴别诊断, 并与病理结果对照判定其敏感性、特异性及准确率.
结果: 在116例结直肠病变中增生性息肉毛细血管形态多表现为模糊结构型, 而腺瘤性息肉的毛细血管形态表现为网状结构型和密度增高型, 癌症的毛细血管形态多表现为不规则型和稀疏结构型. 利用此分型方法鉴别肿瘤性病变和非肿瘤性病变的敏感性和特异性分别是94.6%和78.6%, 准确性88.8%, 阳性预测值(positive predictive value, PPV)88.6%, 阴性预测值(negative predictive value, NPV)89.2%(P<0.01). 同样, 对于腺瘤性息肉和癌症的鉴别诊断的敏感性和特异性分别是100.0%和87.5%, 准确性91.4%(P<0.01). 将直径<10 mm的小息肉按毛细血管的有无进行鉴别诊断的敏感性和特异性分别是89.7%和80.5%, PPV81.4%, NPV89.2%, 准确性85.0%(P<0.01).
结论: NBI结肠镜观察结直肠病变CP对于鉴别肿瘤性病变与非肿瘤性病变, 以及腺瘤性息肉与癌症具有可靠的诊断价值. 对于直径<10 mm小息肉的肿瘤性及非肿瘤性的鉴别诊断方面NBI结肠镜也具有很好作用.
引文著录: 任晶, 江学良. 利用窄带成像技术观察毛细血管形态在结直肠息肉样病变鉴别诊断中的价值. 世界华人消化杂志 2012; 20(6): 473-478
Revised: January 12, 2012
Accepted: February 27, 2012
Published online: February 28, 2012
AIM: To evaluate the value of narrow-band imaging (NBI) in tissue characterization and differential diagnosis.
METHODS: A series of 75 patients with 116 colorectal lesions were studied. According to Yoshiki Wada's typing method, the vascular patterns of colorectal lesions were divided into six species: honey-comb, faint, network, dense, irregular, and sparse. During NBI, the microvascular architecture on the surface of the detected lesions was observed. Results of NBI were compared with histological results.
RESULTS: Most hyperplastic polyps showed a faint pattern. The vascular patterns of adenomas were mainly the network or dense pattern. The major vascular patterns of cancers were the irregular and sparse patterns. When we assumed that the faint pattern was diagnostic for hyperplastic polyps, we could differentiate between neoplastic and non-neoplastic lesions with a sensitivity of 94.6% and a specificity of 78.6%. The accuracy, positive predictive value and negative predictive value of capillary patterns (CP) under NBI were 88.8%, 88.6% and 89.2%, respectively (P < 0.01). Likewise, irregular and sparse patterns were assumed to be indices of cancer, and the sensitivity. specificity and accuracy were 100.0%, 87.5% and 91.4%, respectively (P < 0.01). When lesions < 10 mm were classified into 2 groups: polyps with invisible or faintly visible meshed capillary (MC) vessels as nonneoplastic and those with clearly visible MC vessels as neoplastic, the sensitivity, specificity, positive predictive value, negative predictive value and accuracy were 89.7%, 80.5%, 81.4%, 89.2% and 85.0%, respectively (P < 0.01).
CONCLUSION: NBI is valuable for distinguishing between neoplastic and non-neoplastic lesions, as well as between cancers and adenomas, and for differential diagnosis of lesions < 10 mm.
- Citation: Ren J, Jiang XL. Narrow-band imaging of meshed capillary vessels for differential diagnosis of colorectal lesions. Shijie Huaren Xiaohua Zazhi 2012; 20(6): 473-478
- URL: https://www.wjgnet.com/1009-3079/full/v20/i6/473.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i6.473
一些研究证实增生性息肉和一些非肿瘤性结直肠息肉无需内镜下处理, 因为他们属于良性病变且没有恶变趋势[1,2]. 相反的, 腺瘤-癌的发展顺序说明大肠癌是从腺瘤性息肉发展而来, 为预防大肠癌的发生应该常规切除腺瘤性息肉[3,4]. 因此就要求内镜医生具有在结肠镜检查过程中及时准确鉴别出肿瘤性与非肿瘤性病变的能力[5]. 窄带成像技术(narrow band imaging, NBI)可在无任何染料的情况下达到增强黏膜表面的组织形态结构尤其是毛细血管形态结构的效果[6]. 过去观察者经常通过色素内镜观察结直肠黏膜表面的腺管开口形态[7], 利用此方法来鉴别大肠息肉样病变的肿瘤性与非肿瘤性[8,9]. 现在我们可以通过NBI观察病变黏膜表面毛细血管形态来鉴别病变的性质. 本实验的研究目的即是评价NBI结肠镜在结直肠病变中的诊断价值.
自2010-07/2011-05共有75例患者来我院接受NBI结肠镜检查. 该组患者均由同一位有经验的内镜医师进行检查, 共发现116处大肠新生物或息肉样病变, 其中男51例, 女24例, 年龄22-82岁, 平均年龄54.5岁±11岁. 所有病变均采用传统白光成像和NBI成像2种方法进行观察. 通过辨认阑尾开口、Y型盲肠皱襞和回盲瓣结构以及末端小肠进境来证实插镜到达盲肠. 选择患有结肠新生物或息肉性疾病并愿意进行NBI大肠镜检查的患者被纳入本研究. 排除对象: (1)炎症性肠病患者(溃疡性结肠炎, 克罗恩病等)、家族性大肠腺瘤病患者; (2)肠道准备欠佳, 影响进镜观察的患者; (3)不能忍受内镜痛苦而未送达回盲部的患者. 采用内镜下治疗或外科手术治疗将病变切除. 116例病变中94例采用内镜下切除方法, 22例采用外科手术切除法.
1.2.1 检查: 使用Olympus公司生产的CF-Q260AZI肠镜及NBI和放大系统检查. 术前4-6 h口服聚乙二醇电解质散剂做肠道清洁准备. 常规观察模式下进镜至回盲部, 发现黏膜异常后, 按序进行: (1)用普通白光成像观察结直肠黏膜, 发现病变后观察病变的大体形态; (2)通过面板开关切换成NBI观察模式, 观察腺管开口形态及毛细血管形态并进行评价分型; (3)对病灶多点活检(必要时可行高频电切除后再送检)、病理切片、HE染色, 由一位有经验的病理科医生进行病理组织学诊断.
1.2.2 分型标准: 本研究借鉴了Yoshiki的分型方法[10]. 将病变的毛细血管形态分为6种: 正常肠黏膜的毛细血管走形呈现蜂窝状; 增生性息肉的毛细血管显示不清晰称为"模糊结构型"; 管状腺瘤毛细血管形态显示为规则的"网状结构型"; 绒毛状腺瘤和管状-绒毛状腺瘤的毛细血管发展的更粗一些, 称为"密度增高型" ; 隆起型的黏膜下浸润癌毛细血管形态表现为增粗和极不规则, 称为"不规则结构型", 这种毛细血管形态具有网状结构中断, 毛细血管弯曲走形, 毛细血管直径显著增粗(是周围网状毛细血管直径的2倍以上)的特征; 相反的, 凹陷型病变, 尤其是凹陷型浸润性癌的特点表现为毛细血管的减少, 称为"稀疏结构型".
1.2.3 处理方法: 病变内镜下诊断为非肿瘤性病变和进展期癌变的采用活体检查术; 病变经鉴定为腺瘤性息肉的采用热活检切除术、EMR术; 扁平隆起型病变或>5 mm的病变多采用热圈套切除术、ESD或EMR术[11,12]. 术后行病理学检查, 以显微镜下诊断为准, 作为最后诊断, 并做对比, 进行其准确性分析.
统计学处理 应用SPSS16.0统计软件进行分析, 以病理学检查结果作为金标准. 计数资料用频数表示. 计算NBI对病变性质判定的敏感性、特异性、准确性、阳性预测值和阴性预测值. 评价NBI的鉴别诊断能力采用χ2检验, P<0.05认为差异有统计学意义.
患者的病理情况统计结果见表1.
| 病理诊断 | |||
| 增生性息肉 | 腺瘤性息肉 | 癌 | |
| 数量n(%) | 42(36.2) | 52(44.8) | 22(19.0) |
| 大小(cm) | 0.46±0.29 | 0.91±0.90 | 4.96±1.52 |
| 位置 | |||
| 右半结肠 | 16 | 7 | 0 |
| 左半结肠 | 16 | 20 | 5 |
| 直肠 | 110 | 25 | 17 |
在本研究中, 89.2%增生性息肉的CP为模糊结构型, 82.4%腺瘤性息肉的CP表现为网状结构型和密度增高型, 78.6%浸润癌的CP表现为不规则型和稀疏结构型(表2).
| 毛细血管形态 | 病理诊断(n) | |||
| 癌 | 腺瘤性息肉 | 增生性息肉 | 总计 | |
| 模糊结构型 | 0 | 4 | 33 | 37 |
| 网状结构型 | 0 | 35 | 9 | 44 |
| 密度增高型 | 0 | 7 | 0 | 7 |
| 不规则结构型 | 13 | 6 | 0 | 19 |
| 稀疏结构型 | 9 | 0 | 0 | 9 |
| 总计 | 22 | 52 | 42 | 116 |
假设CP为模糊结构型的病变诊断为增生性息肉, 鉴别肿瘤性病变和非肿瘤性病变的敏感性和特异性分别是94.6%(70/74)和78.6%(33/42), 总准确度是88.8%(70+33/116). 诊断肿瘤性病变的准确性, 阳性预测值(PPV)88.6%(70/79); 诊断非肿瘤性病变的准确性, 阴性预测值(NPV)89.2%(33/37)(χ2 = 66.03, P<0.01, 表3).
当假设不规则型和稀疏结构型是肿瘤性病变中的癌症时, 其敏感性和特异性分别是100.0%(22/22)和87.5%(42/48), 准确性是91.4%(22+42/70)(χ2 = 48.13, P<0.01, 表4).
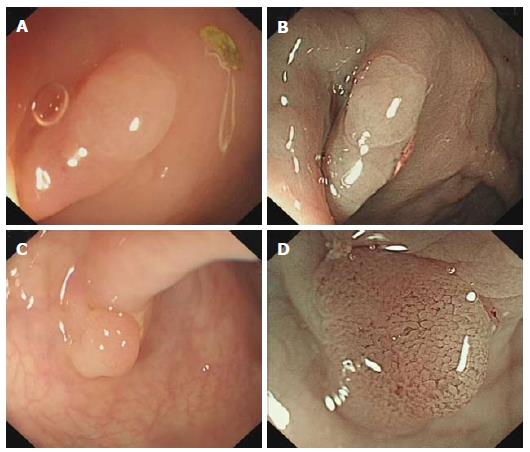
对于直径<10 mm的小息肉, 进行重新整理与分析发现通过观察毛细血管的有无可判断其病变的性质(图1). 其中45个患者的80处病变, 经鉴定共80个病变中包括41(51.3%)个增生性息肉和39(48.7%)个腺瘤性息肉. 利用NBI结肠镜观察毛细血管的有无作为诊断结直肠病变肿瘤性与非肿瘤性的标准, 其敏感性和特异性分别是89.7%(35/39)和80.5%(33/41), 准确性是85.0%(35+33/80), PPV81.4%(35/43), NPV89.2%(33/37), (χ2 = 39.66, P<0.01, 表5) .
染色内镜是目前用于组织学特征观察和鉴别诊断的方法. Kudo等[13]报道染色放大内镜是一种对结直肠肿瘤性病变提供准确且即时的组织学评估方法, 但临床上染色加放大内镜检查耗时长且繁琐. 近年来, 很多报道指出NBI技术可作为一种新进的有效的检出结直肠病变的方法[14]. 然而, Adler等[15]报道指出, NBI结肠镜与染色内镜相比在提高腺瘤性息肉的检出率方面并无明显优势. 但本研究的宗旨在于利用白光成像发现病变后通过NBI结肠镜来观察病变的组织学特点.
一些报道证实NBI技术在肿瘤性和非肿瘤性病变的鉴别诊断方面具有一定的作用. Machida等[16]报道NBI技术在肿瘤性病变和非肿瘤性病变的鉴别诊断方面等同于色素内镜. Hirata等[17]报道NBI放大内镜对于结直肠肿瘤性病变腺窝开口的诊断标准与色素放大内镜的诊断标准相似. Sano等[18]报道NBI结肠镜在诊断病变性质方面的准确性与色素内镜相似. East等[19]报道NBI技术还可用于溃疡性结肠炎患者的黏膜表面肿瘤性病变和非肿瘤性病变的鉴别诊断. 这些报道均证实了NBI技术在无需任何染料的情况下对于普通内镜无法观察的病变可更清晰的显示出来.
先前很多的报道评价NBI在检出率方面的作用, 但很少有报道提及NBI结合放大内镜对于病变性质的预测方面的作用. 有研究人员指出NBI对腺窝开口的形态结构有增强的作用[19]. 但NBI是基于胃肠道黏膜表面毛细血管结构放大而发明的. 因此, 用NBI观察到的是病变的毛细血管形态, 而毛细血管形态的可视化是非常重要的, 因为他与结直肠病变的组织学特征联系的很紧密, 可以及时且准确判断出病变的组织学分型, 从而指导临床处理方式的正确选择.
另外, 本研究对于<10 mm的小息肉进行了单独对比研究, 虽然大>10 mm的腺瘤性息肉普遍认为应该被切除, 但对于<10 mm的小息肉的处理方式还存在很多的争议. 有很多的处理方式包括切除、只做活检或者不处理. 近年来, 有很多报道显示, 通过结肠镜检查发现<10 mm的结肠癌的发现率上升至7%[20-22]. 这就警告我们对于小型病变的检查更为重要, 需要选择性进行处理. 日本研究发现6-9 mm的小息肉与黏膜内癌有同样发展成为进展期癌的危险性, 而
<6 mm的小息肉恶变的危险性与结肠镜检查过程中未发现息肉的患者的危险性相当[23]. 因为腺瘤性息肉被认为是大肠癌的癌前病变, 常规应切除病变. 但也有研究表明在结肠镜的检查过程中发现的息肉样病变约有10%-30%为非肿瘤性息肉, 而这些息肉并不需要切除[24]. 这就要求内镜医生在结肠镜的检查过程中对于<10 mm的小息肉的性质也具有较强的判断能力. 然而普通白光成像对小息肉性质的判断能力相对较差, 无论是增生性息肉还是腺瘤性息肉均显示为表面光滑的广基隆起, 几乎无法判断息肉的性质. 但在NBI结肠镜下可清晰地显示出息肉黏膜表面的毛细血管形态, 而我们只需要通过观察毛细血管的有无来鉴别诊断病变的肿瘤性与非肿瘤性, 方法简便且准确性相对较高. 本研究的80个小型息肉中肿瘤性病变占到48.8%. 利用NBI结肠镜观察的结果分析过程中, 发现有4例无毛细血管的病变被误诊为非肿瘤性病变, 而这些息肉的病理诊断是腺瘤性息肉. 在分析过程中发现这些病变均是直径<3 mm的息肉, 而对于这些息肉的毛细血管的目测观察比较困难. 另一方面, 有8个息肉被误诊为肿瘤性病变(存在毛细血管), 而这些病变的病理诊断是增生性息肉. 可能在操作过程中这些小的息肉在组织学上定位是比较困难[25], 并且在热活检切除术的操作过程中, 不可避免地有大部分组织被烧毁而导致病理检查无法准确的判断. 然而, 对于<3 mm的息肉和一些不典型的增生性息肉, 使用NBI结肠镜观察在诊断上所遇到的困难有待于将来的研究解决.
过去一些研究显示, 进行结肠镜检查发现的息肉中50%以上是小息肉[26], 而小息肉中有50%以上表现为腺瘤性息肉[27]. 因此, 依靠病理诊断来判断患者的小息肉性质成为了临床诊断的关键. 依照美国胃肠内镜检查协会2005年出版的指南中指出, 进行结肠镜检查的过程中当遇到息肉、较大的病变或结肠狭窄时应尽量获得其组织学诊断[28]. 然而, 如果在结肠镜的检查过程中就能准确地判断出病变的肿瘤性和非肿瘤性, 这就可大大减少不必要的活检术或切除术. 在本研究的基础上, 利用NBI结肠镜观察毛细血管形态可大大减少资源的浪费, 降低活检数量, 降低检查总时间和不必要的息肉切除所带来并发症的风险.
本研究中, 我们通过区别毛细血管形态的不同来鉴别结直肠病变的肿瘤性和非肿瘤性. East等[29]报道显示, 毛细血管形态的增强对于病变鉴别诊断的准确性被证实和腺窝开口形态诊断的准确性是一致的. 这就表明NBI代替色素内镜是有可能的. 在将来的研究中需要评估的是NBI和色素内镜在结直肠病变的鉴别诊断方面哪一个更好, 哪一种评估手段更易重复、简单和快速.
总之, NBI结肠镜在肿瘤性病变和非肿瘤性病变的鉴别诊断, 以及癌症和腺瘤性息肉的鉴别诊断方面是非常有价值的. 在决定处理方式的选择上(内镜下处理或外科手术处理), NBI技术对于毛细血管形态的分析也是非常有希望的工具.
目前应用窄带成像技术(narrow band imaging, NBI)结肠镜可以在结直肠息肉样病变的表面观察到毛细血管, 但其临床的应用价值尚不确定, 尤其是针对直径<10 mm的小息肉的鉴别诊断能力尚不明确.
姜春萌, 教授, 大连医科大学附属第二医院消化内科; 姜相君, 主任医师, 青岛市市立医院消化内科
Machida等研究表明NBI技术在肿瘤性病变和非肿瘤性病变的鉴别诊断方面等同于色素内镜.
本研究发现利用NBI结肠镜观察直径小于10 mm的小息肉的毛细血管, 通过判断其毛细血管的有无来鉴别诊断其性质的方法简便且实用, 使临床上对于小息肉的处理方式上存在的争议得到了很好的解决.
利用NBI结肠镜观察结直肠息肉样病变表面的毛细血管形态, 可对该病变的性质作出及时且准确的判断, 尤其是对于小息肉的临床处理方式的选择有较好的指导作用.
作者利用窄带成像技术鉴别结直肠肿瘤性病变与非肿瘤性病变, 国内研究较少. 本文立题新颖、研究内容有实际意义.
编辑: 张姗姗 电编:闫晋利
| 1. | Bond JH. Polyp guideline: diagnosis, treatment, and surveillance for patients with colorectal polyps. Practice Parameters Committee of the American College of Gastroenterology. Am J Gastroenterol. 2000;95:3053-3063. [PubMed] [DOI] |
| 2. | Tung SY, Wu CS, Su MY. Magnifying colonoscopy in differentiating neoplastic from nonneoplastic colorectal lesions. Am J Gastroenterol. 2001;96:2628-2632. [PubMed] [DOI] |
| 3. | Morson B. President's address. The polyp-cancer sequence in the large bowel. Proc R Soc Med. 1974;67:451-457. [PubMed] |
| 4. | Winawer SJ, Zauber AG, Ho MN, O'Brien MJ, Gottlieb LS, Sternberg SS, Waye JD, Schapiro M, Bond JH, Panish JF. Prevention of colorectal cancer by colonoscopic polypectomy. The National Polyp Study Workgroup. N Engl J Med. 1993;329:1977-1981. [PubMed] [DOI] |
| 5. | Emura F, Saito Y, Taniguchi M, Fujii T, Tagawa K, Yamakado M. Further validation of magnifying chromocolonoscopy for differentiating colorectal neoplastic polyps in a health screening center. J Gastroenterol Hepatol. 2007;22:1722-1727. [PubMed] [DOI] |
| 6. | Gono K, Obi T, Yamaguchi M, Ohyama N, Machida H, Sano Y, Yoshida S, Hamamoto Y, Endo T. Appearance of enhanced tissue features in narrow-band endoscopic imaging. J Biomed Opt. 2004;9:568-577. [PubMed] [DOI] |
| 7. | Kudo S, Hirota S, Nakajima T, Hosobe S, Kusaka H, Kobayashi T, Himori M, Yagyuu A. Colorectal tumours and pit pattern. J Clin Pathol. 1994;47:880-885. [PubMed] [DOI] |
| 8. | Tanaka S, Haruma K, Nagata S. Diagnosis of invasion depth in early colorectal carcinoma by pit pattern analysis with magnifying endoscopy. Dig Endosc. 2001;13:S2-S5. [DOI] |
| 9. | Fu KI, Sano Y, Kato S, Fujii T, Nagashima F, Yoshino T, Okuno T, Yoshida S, Fujimori T. Chromoendoscopy using indigo carmine dye spraying with magnifying observation is the most reliable method for differential diagnosis between non-neoplastic and neoplastic colorectal lesions: a prospective study. Endoscopy. 2004;36:1089-1093. [PubMed] [DOI] |
| 10. | Wada Y, Kudo SE, Kashida H, Ikehara N, Inoue H, Yamamura F, Ohtsuka K, Hamatani S. Diagnosis of colorectal lesions with the magnifying narrow-band imaging system. Gastrointest Endosc. 2009;70:522-531. [PubMed] [DOI] |
| 11. | Soetikno RM, Gotoda T, Nakanishi Y, Soehendra N. Endoscopic mucosal resection. Gastrointest Endosc. 2003;57:567-579. [PubMed] [DOI] |
| 12. | Uraoka T, Fujii T, Saito Y, Sumiyoshi T, Emura F, Bhandari P, Matsuda T, Fu KI, Saito D. Effectiveness of glycerol as a submucosal injection for EMR. Gastrointest Endosc. 2005;61:736-740. [PubMed] [DOI] |
| 13. | Kudo S, Tamura S, Nakajima T, Yamano H, Kusaka H, Watanabe H. Diagnosis of colorectal tumorous lesions by magnifying endoscopy. Gastrointest Endosc. 1996;44:8-14. [PubMed] [DOI] |
| 14. | Sano Y, Horimatsu T, Katagiri A, Muto M, Tajiri H, Yoshida S. Magnified observation of microvascular architecture using narrow band imaging (NBI) for the differential diagnosis between non-neoplastic and neoplastic colorectal lesion. Gastrointestinal Endoscopy. 2006;63:AB102. [DOI] |
| 15. | Adler A, Pohl H, Papanikolaou IS, Abou-Rebyeh H, Schachschal G, Veltzke-Schlieker W, Khalifa AC, Setka E, Koch M, Wiedenmann B. A prospective randomised study on narrow-band imaging versus conventional colonoscopy for adenoma detection: does narrow-band imaging induce a learning effect? Gut. 2008;57:59-64. [PubMed] [DOI] |
| 16. | Machida H, Sano Y, Hamamoto Y, Muto M, Kozu T, Tajiri H, Yoshida S. Narrow-band imaging in the diagnosis of colorectal mucosal lesions: a pilot study. Endoscopy. 2004;36:1094-1098. [PubMed] [DOI] |
| 17. | Hirata M, Tanaka S, Oka S, Kaneko I, Yoshida S, Yoshihara M, Chayama K. Magnifying endoscopy with narrow band imaging for diagnosis of colorectal tumors. Gastrointest Endosc. 2007;65:988-995. [PubMed] [DOI] |
| 18. | Sano Y, Muto M, Tajiri H, Ohtsu A, Yoshida S. Optical/digital chromoendoscopy during colonoscopy using narrow-band imaging system. Digestive Endoscopy. 2005;17:43-48. [DOI] |
| 19. | East JE, Suzuki N, von Herbay A, Saunders BP. Narrow band imaging with magnification for dysplasia detection and pit pattern assessment in ulcerative colitis surveillance: a case with multiple dysplasia associated lesions or masses. Gut. 2006;55:1432-1435. [PubMed] [DOI] |
| 20. | Shida H, Ban K, Matsumoto M, Masuda K, Imanari T, Machida T, Yamamoto T, Inoue T. Asymptomatic colorectal cancer detected by screening. Dis Colon Rectum. 1996;39:1130-1135. [PubMed] [DOI] |
| 21. | Emura F, Saito Y, Matsuda T, Uraoka T, Nakajima T, Hisatomo H, Mashimo Y, Fujii T, Saito D. Colorectal Cancer Less Than 10 mm. Should We Look At Small Lesions During Screening Colonoscopy? Gastrointest Endosc. 2006;63:AB199. [DOI] |
| 22. | Baba Y, Suzuki Y, Kobayashi M, Azumaya M, Takeuchi M, Shioji K, Honma T, Narisawa R, Ajioka Y, Asakura H. Superficial depressed-type cancer monitored by colonoscopy through the early phase of invasion. Endoscopy. 2002;34:738-741. [PubMed] [DOI] |
| 23. | Fujii T, Sano Y, Lishi H. Colerectal cancer screening in Japan: results of the multicenter retrospective cohort study. Gastroenterology. 2002;122:A481. |
| 24. | Vatn MH, Stalsberg H. The prevalence of polyps of the large intestine in Oslo: an autopsy study. Cancer. 1982;49:819-825. [PubMed] [DOI] |
| 25. | Tamura S, Onishi T, Kuratani Y, Mizuta H, Hiqashidani Y, Onishi S, Hiroi M. Evaluation of the diagnostic accuracy rate of minute colonic adenomas: high-resolution magnifying chromoendoscopy vs histopathology of a biopsy forceps specimen. Gastrointest Endosc. 2007;65:AB94. [DOI] |
| 26. | Weston AP, Campbell DR. Diminutive colonic polyps: histopathology, spatial distribution, concomitant significant lesions, and treatment complications. Am J Gastroenterol. 1995;90:24-28. [PubMed] |
| 27. | Waye JD, Lewis BS, Frankel A, Geller SA. Small colon polyps. Am J Gastroenterol. 1988;83:120-122. [PubMed] |
| 28. | Davila RE, Rajan E, Adler D, Hirota WK, Jacobson BC, Leighton JA, Qureshi W, Zuckerman MJ, Fanelli R, Hambrick D. ASGE guideline: the role of endoscopy in the diagnosis, staging, and management of colorectal cancer. Gastrointest Endosc. 2005;61:1-7. [PubMed] [DOI] |
| 29. | East JE, Suzuki N, Saunders BP. Comparison of magnified pit pattern interpretation with narrow band imaging versus chromoendoscopy for diminutive colonic polyps: a pilot study. Gastrointest Endosc. 2007;66:310-316. [PubMed] [DOI] |