修回日期: 2011-11-20
接受日期: 2012-02-27
在线出版日期: 2012-02-28
目的: 探讨猪急性肝损伤肝脏内不同程度炎症反应对移植骨髓间充质干细胞(mesenchymal stem cells, MSCs)存活率和疗效的影响.
方法: 16头中华实验小型猪随机分为2组(n = 8): 对照组和移植组. 每组均按照低浓度D氨基半乳糖胺(D-gal, 0.25 g/kg)、高浓度D氨基半乳糖胺(D-gal, 0.35 g/kg)给药, 分别建立2种急性肝损伤模型, 诱导24 h后, 对照组动物门静脉注射生理盐水40 mL, 移植组动物门静脉移植40 mL PBS(约8×107同种异体GFP-MSCs).
2 wk内观察猪肝功能变化、病理变化、血清炎症指标和移植MSCs定植存活情况.
结果: 低浓度D-gal组血清IL-1、TNF-α水平明显低于高浓度D-gal组, 差异有显著性. 低浓度D-gal移植组与低浓度D-gal对照组比较, ALT、TB和NH3在早期有显著差异(D2: 232.6±57.6 vs 334.4±42.3, 12.2±3.3 vs 16.0±1.2, 79.7±9.3 vs 127.8±28.2, P<0.05); 高浓度D-gal移植组与高浓度D-gal对照组比较, 肝功能指标有改善, 但无显著意义. 低浓度D-gal移植组MSCs定植存活率和肝细胞增殖率显著高于高浓度D-gal移植组.
结论: 骨髓间充质干细胞移植治疗肝损伤的疗效在很大程度上取决于肝脏炎症反应的程度, 炎症反应越严重, 移植细胞越不易存活; 相反, 较低的体内炎症环境有益于MSCs定植、存活和肝细胞再生.
引文著录: 檀家俊, 施晓雷, 肖江强, 丁义涛. 急性肝损伤肝脏炎症环境对骨髓间充质干细胞移植疗效的影响. 世界华人消化杂志 2012; 20(6): 460-466
Revised: November 20, 2011
Accepted: February 27, 2012
Published online: February 28, 2012
AIM: To evaluate the influence of inflammatory reaction on the survival of transplanted mesenchymal stem cells (MSCs) and on the efficacy of MSC transplantation for acute liver injury.
METHODS: Sixteen Chinese experimental mini-pigs were randomly divided into two groups: control group and MSC transplantation group. All the animals were given 0.25 g/kg and 0.35 g/kg of D-galactosamine (D-gal) to induce acute liver injury with inflammatory reaction of varying degrees. In the control group, 100 mL of normal saline was injected into the liver via the portal vein 24 h after model induction. In the MSC transplantation group, 8 × 107 MSCs (in 40 mL PBS) were injected into the liver via the portal vein. Liver function, serum inflammatory markers, survival of MSCs and pathological changes were examined after injection.
RESULTS: Serum levels of inflammation factors (IL-1, TNF-alpha) were significantly higher in the high-concentration D-gal group than in the low-concentration group. For animals given low-concentration D-gal, serum ALT, TB and NH3 differed significantly between the MSC transplantation group and control group (D2: 232.6 ± 57.6 vs 334.4 ± 42.3, 12.2 ± 3.3 vs 16.0 ± 1.2, 79.7 ± 9.3 vs 127.8 ± 28.2, all P < 0. 05). In contrast, for animals given high-concentration D-gal, there was no difference in the above parameters between the MSC transplantation group and control group. Hepatic engraftment of MSCs in the mild inflammation group was obviously different from that in the severe inflammation group, and the growth of hepatocytes was significantly improved in the mild inflammation group compared to the severe inflammation group.
CONCLUSION: MSC transplantation is at least partially useful for the management of acute liver injury. Severe inflammatory reaction is harmful to hepatic engraftment of MSCs, while mild inflammatory reaction is useful for the transplanted cells.
- Citation: Tan JJ, Shi XL, Xiao JQ, Ding YT. Influence of inflammation on the efficacy of mesenchymal stem cell transplantation for acute liver injury. Shijie Huaren Xiaohua Zazhi 2012; 20(6): 460-466
- URL: https://www.wjgnet.com/1009-3079/full/v20/i6/460.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i6.460
近年来, 骨髓干细胞(mesenchymal stem cells, MSCs)因其自我更新、多向分化能力及采集方便被广泛关注. 并且随着Petersen等[1]指出骨髓MSCs能够在受体肝脏内转化为肝样细胞, 有关MSCs移植治疗肝脏疾病的基础研究广泛开展. 但不容乐观的是移植MSCs在急性肝损伤动物受体内的植入率和转化率相当有限[2,3], 严重制约其疗效. 进一步的研究发现炎症反应在急性肝损伤的病理过程中发挥重要作用, 本研究欲在此认识基础上探讨MSCs移植效果是否与肝损伤体内严重的炎症反应有密切的关系, 以期为提高干细胞移植效率提供理论依据.
健康家猪16头, 雌雄不限, 体质量15 kg, 由南京大学医学院附属鼓楼医院实验动物中心提供. L-DMEM培养液、特级胎牛血清、胰蛋白酶购自Gibco公司; 淋巴细胞分离液购自TBD公司; 小鼠抗猪mAb PCNA(Cell signaling公司); 猪IL-1β、TNF-α ELISA试剂盒(Life Science公司); 兔GFP-antibody(美国Abcam公司).
1.2.1 猪骨髓MSCs的分离、培养及扩增: 具体方法同参考文献[4].
1.2.2 慢病毒介导GFP基因转染猪MSCs细胞构建稳定表达GFP的MSCs细胞系: 猪第5代MSCs细胞按1.1×104cells/well铺1块24孔板. 16 h后倾倒部分培养基, 以80的MOI加入携带GFP的慢病毒载体LVT7-L.V. 每孔加2.5 μL polybrene以促进DNA的转染. 24 h更换培养液, 3-5 d后传代继续培养. 传代细胞中加入嘌呤霉素筛选成功转染GFP蛋白的MSCs细胞系.
1.2.3 猪急性肝损伤模型的建立: 所有试验猪动物分别以0.25 g/kg和0.35 g/kg剂量的D-Gal静脉给药. D-Gal按10%的浓度溶于50 g/L葡萄糖溶液, 并调节溶液pH值至6.8, 经耳背大静脉注射到动物体内; 造模24 h后分别行MSCs门静脉移植手术和生理盐水假手术, 术后定期观察肝功能变化.
1.2.4 实验分组及处理: 所有动物随机分为2组(n = 8): 对照组和移植组. 对照组(低浓度D-Gal对照组和高浓度D-Gal对照组): 诱导24 h后, 剖腹门静脉注射生理盐水40 mL; 移植组(低浓度D-Gal移植组和高浓度D-Gal移植组): 诱导24 h后, 剖腹门静脉移植同种异体MSCs细胞悬液40 mL(约8×107MSCs).
1.2.5 组织学检查: 于1、2 wk末处死动物, 取出肝脏, 随机取肝内血管及周围组织, 石蜡切片行HE染色了解肝损伤情况, 免疫组织化学显示肝脏再生和GFP-MSCs定植存活情况, 冰冻切片免疫荧光染色显示GFP-MSCs分布和存活情况.
统计学处理 采用SPSS16.0统计学软件进行数据处理, 组间比较应用独立样本t检验, P<0.05为差异有统计学意义.
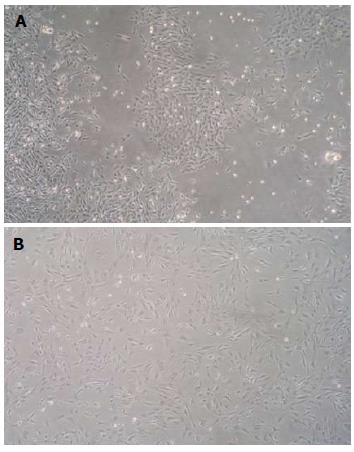
原代接种1 d后换液, 镜下可见类圆形散在分布的集落样生长细胞; 培养3 d后, 可见细胞集落面积增大, 触角展开呈梭形或多角形, 细胞核清晰(图1A); 7-10 d后, 集落进一步扩大并形成融合单层. 传代后, 细胞呈均匀生长, 形态类似成纤维细胞, 混有较多杂质细胞; 传至第3-5代, MSCs逐渐纯化(图1B).
感染24 h后弃病毒培养液, 换液培养3 d后, 可见较弱的绿色荧光; 嘌呤霉素筛选出GFP-MSCs细胞系后荧光强度逐渐增强, 并长期维持较高水平. 流式细胞分析显示MOI 80时, 感染效率为80%, 平均荧光强度为11 076. 本研究组前期预实验构建了多种滴度和孵育时间的GFP-MSCs, 综合转染效率和后期的增殖速度考虑MOI 200时病毒毒性较大, MSCs易死亡; MOI 80以下转染的效率过低, MOI 40时MSCs增殖速度较慢, 最终采用MOI 80带有嘌呤霉素抗性的慢病毒孵育24 h的转染方式, 成功构建GFP-MSCs, 得到稳定表达GFP的MSCs, 有利于试验中示踪鉴定移植细胞.
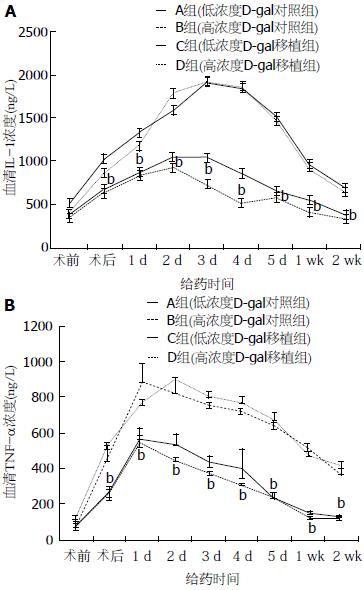
各组IL-1、TNF-α均在第1-3天迅速升至高峰, 其后缓慢下降, 低浓度D-Gal组2 wk恢复正常水平, 高浓度D-Gal组仍停留在较高水平; 低浓度D-Gal动物在各时间点IL-1、TNF-α水平均低于高浓度D-Gal动物, 差异有显著性(P<0.01). 以低浓度D-Gal移植组和高浓度D-Gal移植组为例, 2组IL-1指标在第1、2、3、4、5天和第1、2周时间点上有显著差异, t值分别为4.297、3.763、4.908、5.238、4.798、4.802和3.697(图2).
高浓度D-Gal移植组较高浓度D-Gal对照组肝功能指标有改善, 但无显著意义; 低浓度D-Gal移植组与低浓度D-Gal对照组在AST、ALT、TB、血氨指标上存在显著性差异(表1, 2, P<0.05).
| 参数 | 分组 | 给药时间 | ||||||||
| 术前 | 术中 | 1 d | 2 d | 3 d | 4 d | 5 d | 1 wk | 2 wk | ||
| ALT (U/L) | 对照组 | 43.1± 14.1 | 996.3± 145.3 | 715± 82.4 | 334.4± 42.3 | 152.6± 27.6 | 62.6± 8.6 | 48.5± 9.3 | 46.2± 16.0 | 45.1± 8.3 |
| 移植组 | 33.2± 6.5 | 947.3± 182.8 | 577.5± 50.3a | 232.6± 57.6a | 62.3± 21.2a | 50.7± 12.1 | 47.6± 15.3 | 40.1± 16.6 | 41.1± 12.5 | |
| TB (μmol/L) | 对照组 | 2.3± 0.8 | 17.6± 3.7 | 22.7± 5.0 | 16.0± 1.2 | 6.3± 0.1 | 4.6± 0.5 | 1.5± 0.1 | 1.8± 0.9 | 0.8± 0.3 |
| 移植组 | 1.1± 0.1 | 18.5± 3.3 | 20.9± 7.5 | 12.2± 3.3a | 3.1± 1.2a | 2.9± 1.4a | 1.1± 0.4 | 1.3± 0.5 | 0.8± 0.1 | |
| NH3 (μmol/L) | 对照组 | 31.3± 15.2 | 235.5± 33.7 | 179.3± 16.9 | 127.8± 28.2 | 90.5± 7.1 | 71.3± 8.5 | 61± 12.6 | 47.5± 10.3 | 40± 13.9 |
| 移植组 | 34.5± 14.4 | 263.6± 55.6 | 130.7± 12.6a | 79.7± 9.3a | 59.0± 8.2a | 56.5± 7.6 | 50.7± 9.9 | 42.5± 1.9 | 37.8± 9.2 | |
| 参数 | 分组 | 给药时间 | ||||||
| 术前 | 术中 | 1 d | 3 d | 5 d | 1 wk | 2 wk | ||
| ALT(U/L) | 对照组 | 47.9±21.1 | 2871.9±406.8 | 1975.4±199.6 | 868.7±188.9 | 288.1±47.5 | 173.8±33.7 | 75.9±24.8 |
| 移植组 | 40.9±20.2 | 2630.1±372.6 | 1789.2±417.1 | 670.4±176.5 | 181.2±32.8 | 76.4±11.5a | 41.8±17.8 | |
| TB(μmol/L) | 对照组 | 2.35±0.9 | 28.5±6.9 | 36.4±7.9 | 15.9±4.9 | 6.9±3.5 | 3.9±1.1 | 0.9±0.3 |
| 移植组 | 1.4±0.6 | 22.7±3.1 | 40.0±7.9 | 13.5±4.5 | 4.45±1.8 | 2.58±0.5 | 1.1±0.4 | |
| NH3(μmol/L) | 对照组 | 34.5±4.9 | 389±88.3 | 306.8±109.1 | 167±78.9 | 86±29.2 | 74.2±15.6 | 87.8±27.8 |
| 移植组 | 43.1±15.1 | 369.5±48.3 | 191.2±15.4a | 101.2±16.0a | 113.5±14.9 | 99.7±16.6 | 76±22.1 | |
| PT (s) | 对照组 | 11.4±0.5 | 20.1±3.2 | 37.1±6.2 | 22.1±3.5 | 12.4±0.7 | 12.1±1.4 | 11.8±0.7 |
| 移植组 | 11.1±0.7 | 24.7±1.3 | 35.8±3.4 | 16.7±0.8a | 11.2±0.3 | 12.2±0.7 | 11.3±0.4 | |
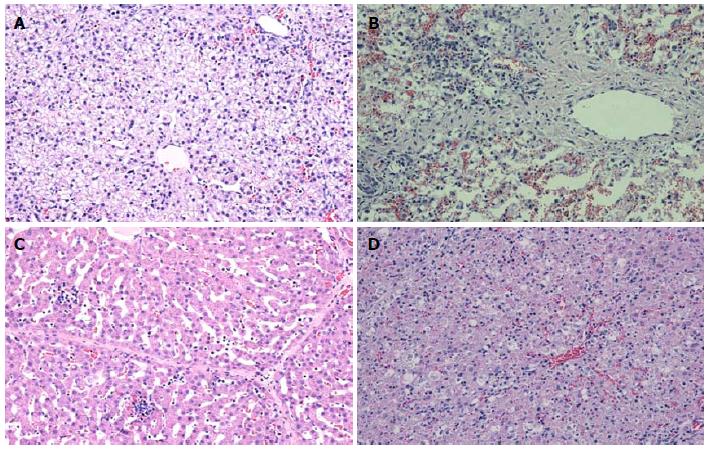
动物存活至1、2 wk时, 分别人为处死取肝组织常规石蜡切片行HE染色和免疫组化检测. HE染色(1 wk): 低浓度D-Gal对照组汇管区中性粒细胞广泛浸润, 肝小叶结构基本正常; 低浓度D-Gal移植组肝组织、肝小叶结构尚存, 小叶内肝细胞未见明显坏死, 部分肝窦扩展, 汇管区见中性粒细胞浸润; 高浓度D-Gal组可见肝组织、肝小叶轮廓不清, 肝细胞坏死严重而广泛, 呈空泡样改变, 坏死区含有红细胞, 肝窦明显扩张充血, 小叶内及汇管区有大量淋巴细胞和巨噬细胞为主的炎细胞浸润(图3).
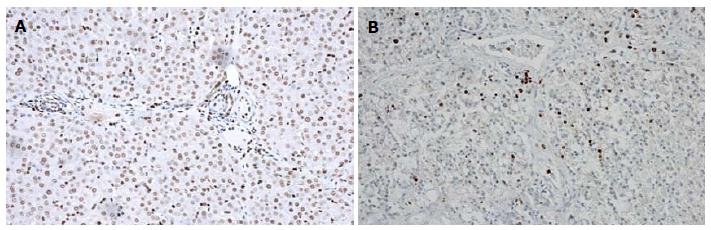
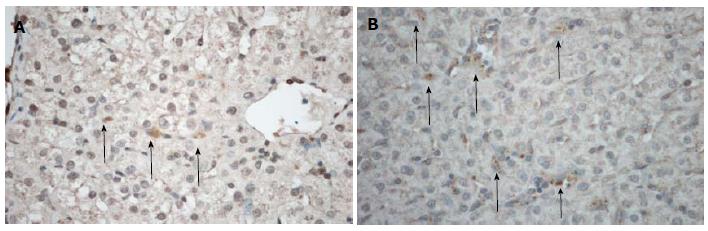
PCNA免疫组织化学染色: 核着棕黄色者为阳性表达的细胞, 染色大而圆者为肝细胞. 正常肝组织多为阴性表达, 偶见阳性表达. 急性肝损伤1 wk后肝细胞多处于增殖顶峰, 可见低浓度D-Gal组肝组织广泛增殖, 形态规则; 高浓度D-Gal组存在阳性表达, 但数量减少, 核着色形态不规则(图4).
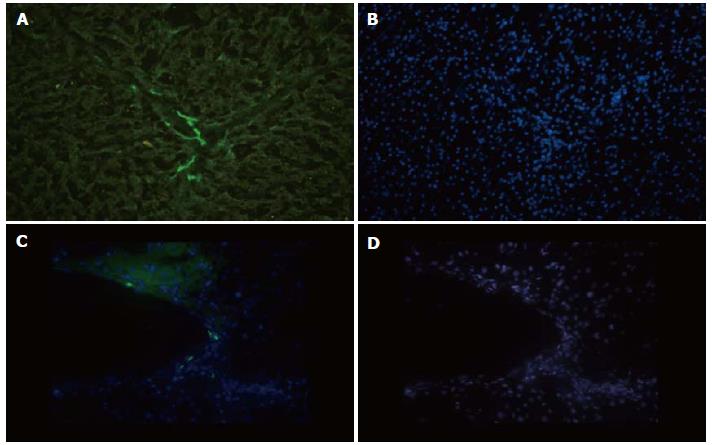
GFP-MSCs免疫组织化学和免疫荧光染色: 免疫组织化学染色棕黄色为阳性表达, 免疫荧光检测黄绿色为阳性细胞. 两者均显示低浓度D-Gal组1 wk末移植细胞较多沿血管周围分布, 呈聚集生长, 肝小叶内也可见阳性细胞; 高浓度D-Gal组肝脏结构紊乱, 肝血窦扩展, 可见零星分布在血管周围的MSCs, 高倍镜下细胞计数可见阳性细胞率低于1%(图5, 6).
长期以来, 干细胞因其强大的自我更新、多项分化能力和采集方便特点受到各领域研究的关注. 随着Petersen等[1]和Theise等[2]的研究指出骨髓间充质干细胞和造血干细胞能在受体肝脏内转化为肝细胞, MSCs在治疗肝脏疾病方面得到广泛应用. 不少基础和临床研究也肯定了MSCs对急慢性肝脏疾病的疗效[5-9]: 骨髓干细胞移植后, 肝细胞增殖加快, 肝功能指数改善, 黄疸指数下降, 肝纤维化得到改善. 但Zhang等[10]建立了一种急性肝损伤模型, 并使用retrorsine抑制内源性肝细胞再生, 结果MSCs移植28 d后肝脏质量和白蛋白表达量没有增加, 这说明移植细胞在急性肝损伤的肝内并没有增殖, 更无转化为表达白蛋白的功能肝细胞; Sato等[11]将人MSCs通过肝脏输注给肝衰的SD大鼠, 发现只有0.5%的MSCs向肝细胞转化.
不同的是di Bonzo等[3]将人MSCs通过尾静脉输注给慢性肝损伤裸鼠, 显示慢性肝损伤能促进干细胞归巢, 而急性肝损伤裸鼠内干细胞的植入率明显减少. 本研究将GFP-MSCs移植入急性肝损伤猪肝内, 2 wk后免疫组织化学显示低浓度D-Gal组阳性细胞植入率明显高于高浓度D-Gal组(分别为3%-5%和<1%), 更有趣的是, 目前关于MSCs移植对急性肝损伤治疗的文献报道明显少于其对慢性肝脏疾病治疗的报道, 究其原因在于急性肝损伤的移植效果不佳.
与慢性肝病长期而缓和的肝损伤不同, 急性肝损伤是一种以短期剧烈肝功能丧失为特点的临床重症. 近来研究报道急性肝损伤(特别是急性肝衰竭)是一种伴有大量免疫炎症因子参与的炎性疾病, 相对过急的肝内免疫炎症反应被认为是其发病关键的病理机制[12-16]; 发生急性肝损伤时IL-1、TNF-α较慢性肝炎和常人显著升高[17].
由此可见, MSCs移植效果不佳的主要原因是其在体内活性、植入率及转化率太低, 而这又与急性肝损伤体内严重的炎症反应有密切的关系. 本研究结果显示高浓度D-Gal移植组较高浓度D-Gal对照组肝功能指标有改善, 但无显著意义, 提示移植MSCs并不适合高浓度D-gal给药环境, 免疫组织化学染色显示高浓度D-gal组肝细胞增殖数明显少于低浓度D-gal组. 既往使用抗炎物质如IL-1Ra[18]、IL-6、TNF-α抑制剂或内科综合治疗[4]联合MSCs移植治疗急性肝脏疾病的研究却均显示出较好的治疗效果. 由此可见, 肝损伤和肝衰竭时严重的免疫炎症因子不仅对自体肝细胞再生有细胞毒性作用, 同时对移植入体内的干细胞存活并向肝脏细胞分化也有毒性损害[19,20].
但不可忽视的是IL-1、TNF-α等炎症指标是肝细胞生长分化与再生所必需的调节因子[21-23]; 同时体外试验提示肝衰血清有促进干细胞生长和分化的功能[24-27]; di Bonzo等[3]从尾静脉移植MSCs给正常裸鼠和慢性肝损伤裸鼠, 结果前者肝脏内移植细胞植入率较后者明显减少. 由此可见适度的肝脏内炎症环境对肝细胞再生修复、移植细胞归巢和分化都有促进作用.
总之, 抑制过激的炎症反应似乎可以促进干细胞对急性肝脏疾病的治疗作用. 研究显示IL-1是激活免疫炎症反应的中心枢纽, 对各种免疫细胞均有激活作用[28,29], 而IL-1Ra是其天然的拮抗剂[30,31]. 应用IL-1Ra下调炎症反应, 为移植细胞创造平衡的体内环境, 减少肝损伤时的病理损害是前景良好的治疗策略. 但IL-1Ra有半衰期短、价格昂贵、易失活等缺陷, 关于何种途径给药, 如何延长半衰期、减少用药量及具体的联合治疗机制是进一步需要研究的问题.
骨髓间充质干细胞(mesenchymal stem cells, MSCs)移植治疗肝病临床和实验均有较多报道, 但越来越多的研究显示移植细胞肝内存活率和转化率低, 并且移植细胞的治疗机制不甚明了, 种种问题严重制约干细胞在肝衰竭方面的治疗前景.
单云峰, 副主任医师, 温州医学院第一附属医院肝胆外科
MSCs由于强大的自我更新、多项分化能力和采集方便等原因逐渐成为继内科综合治疗和肝移植后治疗肝衰竭的新方法. 但近年越来越多的研究显示细胞移植后肝脏内的存活率和转化率较低, 严重影响细胞疗效发挥, 这一问题亟待解决.
大量的基础和临床研究总体显示MSC移植对肝功能改善有积极意义, 同时也有抗炎因子和干细胞移植联合治疗的报道, 显示出不错的治疗效果.
本研究通过探讨猪急性肝损伤肝脏内不同程度炎症反应对移植MSCs存活率和疗效的影响, 发现轻度炎症反应利于干细胞在肝内的存活和对肝功能的改善.
本试验提示通过改善肝衰竭过激的炎症环境将会促进移植MSCs的存活和转化,为提高干细胞疗效提供实践依据和理论依据, 也对细胞移植的临床试验有重要指导意义.
本研究发现轻度炎症反应利于MSCs在肝内的存活和对肝功能的改善, 选题新颖、设计合理、论据充分, 结果对临床有指导意义.
编辑: 张姗姗 电编:闫晋利
| 1. | Petersen BE, Bowen WC, Patrene KD, Mars WM, Sullivan AK, Murase N, Boggs SS, Greenberger JS, Goff JP. Bone marrow as a potential source of hepatic oval cells. Science. 1999;284:1168-1170. [PubMed] [DOI] |
| 2. | Theise ND, Nimmakayalu M, Gardner R, Illei PB, Morgan G, Teperman L, Henegariu O, Krause DS. Liver from bone marrow in humans. Hepatology. 2000;32:11-16. [PubMed] [DOI] |
| 3. | di Bonzo LV, Ferrero I, Cravanzola C, Mareschi K, Rustichell D, Novo E, Sanavio F, Cannito S, Zamara E, Bertero M. Human mesenchymal stem cells as a two-edged sword in hepatic regenerative medicine: engraftment and hepatocyte differentiation versus profibrogenic potential. Gut. 2008;57:223-231. [PubMed] [DOI] |
| 5. | El-Ansary M, Abdel-Aziz I, Mogawer S, Abdel-Hamid S, Hammam O, Teaema S, Wahdan M. Phase II Trial: Undifferentiated Versus Differentiated Autologous Mesenchymal Stem Cells Transplantation in Egyptian Patients with HCV Induced Liver Cirrhosis. Stem Cell Rev. 2011; Oct 12. [Epub ahead of print]. [PubMed] |
| 6. | Hwang S, Hong HN, Kim HS, Park SR, Won YJ, Choi ST, Choi D, Lee SG. Hepatogenic differentiation of mesenchymal stem cells in a rat model of thioacetamide-induced liver cirrhosis. Cell Biol Int. 2012;36:279-288. [PubMed] [DOI] |
| 7. | Melo CO, Silva DM, da Cruz AD. Challenges in clinical and laboratory diagnosis of androgen insensitivity syndrome: a case report. J Med Case Reports. 2011;5:446. [PubMed] [DOI] |
| 8. | Peng L, Xie DY, Lin BL, Liu J, Zhu HP, Xie C, Zheng YB, Gao ZL. Autologous bone marrow mesenchymal stem cell transplantation in liver failure patients caused by hepatitis B: short-term and long-term outcomes. Hepatology. 2011;54:820-828. [PubMed] [DOI] |
| 9. | Ju S, Teng GJ, Lu H, Jin J, Zhang Y, Zhang A, Ni Y. In vivo differentiation of magnetically labeled mesenchymal stem cells into hepatocytes for cell therapy to repair damaged liver. Invest Radiol. 2010;45:625-633. [PubMed] [DOI] |
| 10. | Zhang B, Inagaki M, Jiang B, Miyakoshi M, Arikura J, Ogawa K, Kasai S. Effects of bone marrow and hepatocyte transplantation on liver injury. J Surg Res. 2009;157:71-80. [PubMed] [DOI] |
| 11. | Sato Y, Araki H, Kato J, Nakamura K, Kawano Y, Kobune M, Sato T, Miyanishi K, Takayama T, Takahashi M. Human mesenchymal stem cells xenografted directly to rat liver are differentiated into human hepatocytes without fusion. Blood. 2005;106:756-763. [PubMed] [DOI] |
| 12. | Vollmar B, Menger MD. The hepatic microcirculation: mechanistic contributions and therapeutic targets in liver injury and repair. Physiol Rev. 2009;89:1269-1339. [PubMed] [DOI] |
| 13. | Jaeschke H, Williams CD, Ramachandran A, Bajt ML. Acetaminophen hepatotoxicity and repair: the role of sterile inflammation and innate immunity. Liver Int. 2012;32:8-20. [PubMed] [DOI] |
| 14. | Williams CD, Antoine DJ, Shaw PJ, Benson C, Farhood A, Williams DP, Kanneganti TD, Park BK, Jaeschke H. Role of the Nalp3 inflammasome in acetaminophen-induced sterile inflammation and liver injury. Toxicol Appl Pharmacol. 2011;252:289-297. [PubMed] [DOI] |
| 15. | Ramalho FS, Fernandez-Monteiro I, Rosello-Catafau J, Peralta C. Hepatic microcirculatory failure. Acta Cir Bras. 2006;21 Suppl 1:48-53. [PubMed] [DOI] |
| 16. | Hasegawa T, Ito Y, Wijeweera J, Liu J, Malle E, Farhood A, McCuskey RS, Jaeschke H. Reduced inflammatory response and increased microcirculatory disturbances during hepatic ischemia-reperfusion injury in steatotic livers of ob/ob mice. Am J Physiol Gastrointest Liver Physiol. 2007;292:G1385-G1395. [PubMed] |
| 17. | Vodovotz Y, Constantine G, Faeder J, Mi Q, Rubin J, Bartels J, Sarkar J, Squires RH, Okonkwo DO, Gerlach J. Translational systems approaches to the biology of inflammation and healing. Immunopharmacol Immunotoxicol. 2010;32:181-195. [PubMed] [DOI] |
| 18. | 郑 玉宝. 羊水间充质干细胞对肝衰竭治疗的基础研究-体外人源性羊水与骨髓间充质干细胞生物特性及肝细胞方向诱导分化能力比较研究-转IL-1Ra基因羊水间充质干细胞对急性肝衰竭大鼠动物模型的治疗研究. 中山大学. 2009;1-114. |
| 19. | Czeczot H, Tudek B, Lambert B, Laval J, Boiteux S. Escherichia coli Fpg protein and UvrABC endonuclease repair DNA damage induced by methylene blue plus visible light in vivo and in vitro. J Bacteriol. 1991;173:3419-3424. [PubMed] |
| 20. | Streetz KL, Wüstefeld T, Klein C, Manns MP, Trautwein C. Mediators of inflammation and acute phase response in the liver. Cell Mol Biol (Noisy-le-grand). 2001;47:661-673. [PubMed] |
| 21. | 靳 海英, 任 锋, 丁 美, 赵 军, 张 晶, 陈 煜, 武 志明, 段 钟平. N-乙酰半胱氨酸对猪急性肝衰竭血清肿瘤坏死因子-α、白介素-1β的影响. 药品评价. 2007;4:153-156. |
| 23. | Iimuro Y, Fujimoto J. TLRs, NF-κB, JNK, and Liver Regeneration. Gastroenterol Res Pract. 2010;2010. Epub 2010 Sep 26. [PubMed] |
| 25. | Mohsin S, Shams S, Ali Nasir G, Khan M, Javaid Awan S, Khan SN, Riazuddin S. Enhanced hepatic differentiation of mesenchymal stem cells after pretreatment with injured liver tissue. Differentiation. 2011;81:42-48. [PubMed] [DOI] |
| 26. | 王 莹, 赵 文静, 叶 冬霞, 刘 淑荣. 急性肝衰竭大鼠血清诱导骨髓间充质干细胞表达甲胎蛋白和白蛋白. 中国组织工程研究与临床康复. 2010;14:8369-8372. |
| 27. | Shi XL, Gu JY, Zhang Y, Han B, Xiao JQ, Yuan XW, Zhang N, Ding YT. Protective effects of ACLF sera on metabolic functions and proliferation of hepatocytes co-cultured with bone marrow MSCs in vitro. World J Gastroenterol. 2011;17:2397-2406. [PubMed] [DOI] |
| 28. | Girard S, Kadhim H, Larouche A, Roy M, Gobeil F, Sébire G. Pro-inflammatory disequilibrium of the IL-1 beta/IL-1ra ratio in an experimental model of perinatal brain damages induced by lipopolysaccharide and hypoxia-ischemia. Cytokine. 2008;43:54-62. [PubMed] [DOI] |
| 29. | Kay J, Calabrese L. The role of interleukin-1 in the pathogenesis of rheumatoid arthritis. Rheumatology (Oxford). 2004;43 Suppl 3:iii2-iii9. [PubMed] [DOI] |
| 30. | Hu J, Yan D, Gao J, Xu C, Yuan Y, Zhu R, Xiang D, Weng S, Han W, Zang G. rhIL-1Ra reduces hepatocellular apoptosis in mice with acetaminophen-induced acute liver failure. Lab Invest. 2010;90:1737-1746. [PubMed] [DOI] |
| 31. | Arend WP. The balance between IL-1 and IL-1Ra in disease. Cytokine Growth Factor Rev. 2002;13:323-340. [PubMed] [DOI] |