修回日期: 2012-01-04
接受日期: 2012-02-16
在线出版日期: 2012-02-18
目的: 构建整合素连接激酶(integrin-linked kinase, ILK)基因RNA干扰(RNA interference, RNAi)重组质粒并检测其对胰腺癌PANC-1细胞ILK基因表达的干扰效率, 为进一步研究胰腺癌中ILK基因功能奠定实验基础和理论依据.
方法: 设计并构建3条含有针对ILK基因的小干扰RNA(small interfering RNA, siRNA)序列的重组质粒并进行DNA测序. 通过阳离子脂质体Lipofectamine 2000将重组质粒转入人胰腺癌细胞株Panc-1细胞中, G418压力筛选至得到稳定转染细胞克隆, 利用Real-Time PCR和Western blot检测ILK基因的表达抑制情况. 筛选出干扰效率最高的重组质粒.
结果: 经DNA测序证实胰腺癌PANC-1细胞ILK基因的RNA干扰重组质粒构建成功; 重组质粒稳定转染Panc-1细胞后(各组转染效率均>90%), 各实验组ILK基因表达均被有效地抑制, 其中重组质粒-2的干扰效率最高, 其mRNA及ILK表达显著下调, 其抑制率分别为93.01%和65.69%; ILK mRNA表达较阴性对照组、空质粒组表达量显著下降(0.090±0.009 vs 1.147±0.110, 1.005±0.121, P<0.01).
结论: 成功构建ILK基因RNA干扰重组质粒, 重组质粒能有效抑制胰腺癌Panc-1细胞ILK基因表达. 为进一步研究ILK在胰腺癌中的基因功能奠定基础.
引文著录: 刘宁, 刘伟, 马刚, 郭克建, 宋少伟. 靶向胰腺癌PANC-1细胞整合素连接激酶基因RNA干扰质粒的构建及鉴定. 世界华人消化杂志 2012; 20(5): 374-379
Revised: January 4, 2012
Accepted: February 16, 2012
Published online: February 18, 2012
AIM: To construct plasmids carrying small interfering RNAs (siRNAs) targeting the integrin-linked kinase (ILK) gene and assess their effect on ILK expression in pancreatic cancer cells.
METHODS: Three pairs of siRNAs for ILK were designed and used to construct plasmids carrying siRNAs targeting the ILK gene. The recombinant plasmids and negative control plasmids were stably transfected into Panc-1 cells using cationic liposome Lipofectamine. After transfection, ILK mRNA and protein expression was detected by RT-PCR and Western blotting, respectively.
RESULTS: DNA sequencing results indicated that the recombinant plasmids were constructed correctly. After stable transfection of the recombinant plasmids into Panc-1 cells, ILK mRNA and protein expression was significantly inhibited. Transfection of the recombinant plasmid that had the highest knockdown efficiency reduced ILK mRNA and protein expression by 93.01% and 65.69%, respectively. Compared to the non-transfected group and empty plasmid-transfected group, ILK mRNA expression was significantly down-regulated in the experimental group (0.090 ± 0.009 vs 1.147 ± 0.110, 1.005 ± 0.121, both P < 0.01).
CONCLUSION: Three plasmids carrying siRNAs targeting the ILK gene have been constructed successfully and provide a useful tool for studying the function of ILK.
- Citation: Liu N, Liu W, Ma G, Guo KJ, Song SW. Construction and identification of plasmids carrying small interfering RNAs targeting the ILK gene. Shijie Huaren Xiaohua Zazhi 2012; 20(5): 374-379
- URL: https://www.wjgnet.com/1009-3079/full/v20/i5/374.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i5.374
胰腺癌是恶性程度最高的致死性肿瘤之一, 致死率位居美国癌症相关死亡的第4位[1]. 其发生、发展和侵袭转移机制尚未阐明. 研究发现整合素连接激酶(integrin-linked kinase, ILK)作为整合素和生长因子受体信号转导途径中的一个重要效应物, 调节着细胞的黏附、生存、分化和凋亡, 对肿瘤的发展、转移及预后等发挥着重要作用[2-8]. 在人类神经源性肿瘤、胃癌、前列腺癌、卵巢肿瘤、黑色素瘤、肺癌中, ILK表达明显增高且表达量与肿瘤的恶性程度及转移显著正相关[9-15]. 有效地抑制ILK表达或降低其生物学活性是抗肿瘤治疗的关键[16]. 因此, 构建针对ILK的RNA干扰质粒用于研究胰腺癌ILK功能有重要价值.
人胰腺癌细胞株Panc-1(北京肿瘤研究所); DMEM高糖培养基(美国Gibco公司), 胎牛血清(海克隆生物化学制品北京有限公司), Lipofectamine 2000、TRIzol试剂、Real Time-RCR试剂盒和G418(Invitrogen公司); ILK抗体(Sigma公司), 质粒提取试剂盒(QIAGEN公司).
1.2.1 细胞培养: Panc-1细胞培养于含150 mL/L胎牛血清的高糖DMEM培养液中, 置于37 ℃、含50 mL/L CO2的培养箱中. 细胞贴壁生长良好, 3 d后按1:3进行传代, 对数生长期细胞用于实验.
1.2.2 ILK干扰质粒构建: 参照siRNA的设计原则, 根据GeneBank中报道的ILK mRNA核苷酸序列, 应用siSearch和sFold两种在线设计软件设计3对针对ILK mRNA的siRNA, 作用靶点分别位于ILK基因第7外显子和第10外显子, 长度均为19 bp, 该序列均通过基因Blast筛查证实与人类基因外显子无同源性. 由上海吉凯基因化学技术有限公司采用化学合成方法合成以pGCsi-U6/Neo/GFP质粒为骨架的3个干扰载体和1个空白对照载体, 并提取DNA进行测序鉴定. siRNA序列如下: ILK-1 sence: GATCCCAAGCTCAACGAGAATCACTCTTTCAAGAGAAGAGTGATTCTCGTTGAGCTTTTTTTGGAT; Antisence: CTAGGGTTCGAGTTGCTCTTAGTGAGAAAGTTCTCTTCTCACTAAGAGCAACTCGAAAAAAACCTA. ILK-2 sence: GATCCCGACGAAGCTCAACGAGAATCATTCAAGAGATGATTCTCGTTGAGCTTCGTCTTTTTGGAT; Antisence: CTAGGGCTGCTTCGAGTTGCTCTTAGTAAGTTCTCTACTAAGAGCAACTCGAAGCAGAAAAACCTA. ILK-3 sence: GATCCCTAGCCGTAGTGTAATGATTGATTCAAGAGATCAATCATTACACTACGGCTATTTTTGGAT; Antisence: CTAGGGATCGGCATCACATTACTAACTAAGTTCTCTAGTTAGTAATGTGATGCCGATAAAAACCTA.
1.2.3 细胞转染及稳定转染细胞株的筛选: 用于转染的试剂及其他物品必须经严格高温高压灭菌, 转染前24 h将约5×105个Panc-1细胞接种至6孔板, 转染时细胞融合度达70%-90%, 每孔终体积2 mL. 转染步骤严格按照Invitrogen的Lipofectamine 2000产品使用说明书操作. 培养8 h后弃去转染液, 换新鲜培养液继续培养. 转染后的细胞用含G418浓度600 mg/L(G418浓度梯度试验所得筛选浓度)的DMEM培养液, 于37 ℃、含50 mL/L CO2的培养箱中继续培养、传代. 4 wk后荧光显微镜下可看到成团荧光时挑取阳性单克隆细胞, 用含G418浓度600 μg/mL的DMEM培养液继续培养4 wk. 此组细胞命名为Panc-1/pGCsi-ILK. 相同操作步骤转染空白对照质粒(empty vector)并对转染细胞行筛选、挑取阳性单克隆扩大培养和检测, 此组细胞命名Panc-1/pGCsi-Non. 各组细胞均继续用含G418浓度200 μg/mL的DMEM培养液培养于37 ℃、含50 mL/L CO2的培养箱中压力筛选培养, 直至获得稳定转染单克隆细胞株, 再传至培养瓶中扩大培养. 倒置荧光显微镜下观察绿色荧光计算GFP表达率.
1.2.4 Real-Time PCR检测ILK mRNA: TRIzol一步法对3个稳定转染实验组、2个对照组5组细胞分别进行总RNA提取, 具体操作根据Invitrogen公司的TRIzol操作说明书进行. 经紫外分光光度仪测定、计算RNA含量并根据Promega公司的M-MLV操作说明书逆转录为cDNA. ILK引物和GAPDH引物采用软件Beacon designer 2设计, 引物序列信息如下: ILK-F: TCCACCTGCTCCTCATCC; ILK-R: CCTCATCAATCATTACACTACGG; GAPDH-F: TGACTTCAACAGCGACACCCA; GAPDH-R: CACCCTGTTGCTGTAGCCAAA. 设定程序为两步法Real-Time PCR: 预变性95 ℃, 15 s; 之后每一步变性95 ℃, 5 s; 退火延伸60 ℃, 30 s; 共进行45个循环. 每次在延伸阶段读取吸光度值. 制作熔解曲线: PCR结束后, 95 ℃变性1 min, 然后冷却至55 ℃, 使DNA双链充分结合. 从55 ℃开始到95 ℃, 每一步增加0.5 ℃, 保持4 s, 同时读取吸光度值. 以Panc-1/pGCsi-Non为阴性对照组, 用2-△△Ct分析法进行Real-Time PCR数值分析.
1.2.5 Western blot定量检测ILK蛋白的表达: 分别收集足量稳定转染的3个实验组、2个对照组细胞, 裂解提取总蛋白, 测定蛋白浓度, 所得总蛋白经SDS-PAGE凝胶电泳、转膜、牛奶封闭, 一抗、二抗孵育, 增强化学发光显色系统显色, Bio-Rad软件对条带的吸光度值作分析, 以β-actin作为内参照, 每个样本重复3次.
统计学处理 采用SPSS13.0软件进行数据统计分析, 以P<0.05表示差异具有统计学意义.
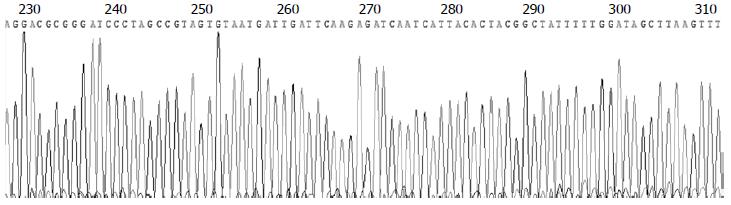
将重组子pGCsi-ILK测序, 测得DNA序列证实含有目的片断序列, 表示质粒构建成功. 截取部分pGCsi-ILK-2测序结果见图1.
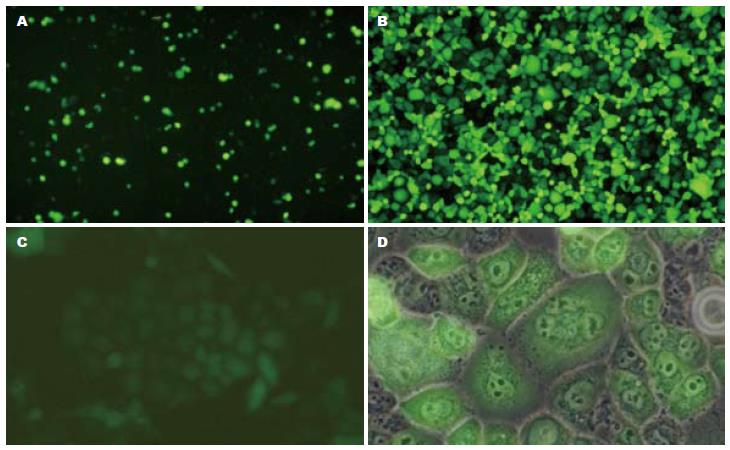
转染24 h后, 通过倒置荧光显微镜观察到各组均有绿色荧光蛋白表达, 提示均转染成功(图2A). 用600 μg/mL终浓度G418筛选4 wk, 挑取转染阳性单克隆细胞培养4 wk, 荧光显微镜下观察计数并用流式细胞仪检测, Panc-1/pGCsi-Non的GFP表达率为94.3%, Panc-1/pGCsi-ILK的GFP表达率分别为96.7%, 97.9%, 93.7%(图2B, C, D).
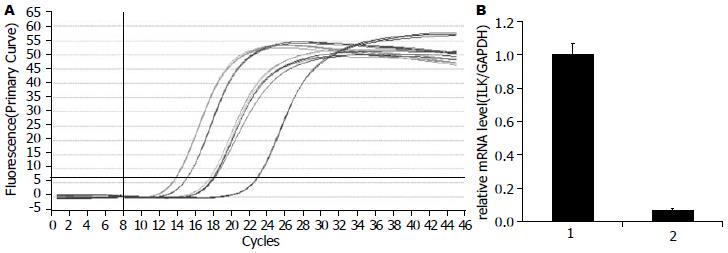
以GAPDH作为内参照, 用2-△△Ct分析法进行Real-time PCR数值分析. 3组Panc-1/pGCsi-ILK ILK mRNA表达均低于Panc-1/pGCsi-Non和Panc-1. 其中Panc-1/pGCsi-ILK-2 ILK mRNA表达最低, 实验组、阴性对照组、空白对照组ILK扩增产物的强度与内对照GAPDH的比值分别为: 0.090±0.009, 1.147±0.110, 1.005±0.121, 与空白对照组Panc-1/pGCsi-Non相比表达水平差异有统计学意义(P<0.01), ILK mRNA表达抑制率为93.01%; 阴性对照组PANC-1和空白对照组Panc-1/pGCsi-Non中ILK mRNA表达水平差异无统计学意义(P>0.05, 图3).
以β-actin作为内参照, 进行灰度值分析. 3组Panc-1/pGCsi-ILK ILK表达均低于Panc-1和Panc-1/pGCsi-Non, 其中Panc-1/pGCsi-ILK-2的ILK表达最低, 与空白对照组Panc-1/pGCsi-Non相比表达水平差异有统计学意义(P<0.01), ILK蛋白表达抑制率为65.69%. 阴性对照组PANC-1和空白对照组Panc-1/pGCsi-Non中ILK表达水平差异无统计学意义(P>0.05, 图4).
ILK作为一种丝/苏氨酸蛋白激酶, 是多种致瘤相关因素的上游交叉点, 与肿瘤的形成、血管生成、侵袭转移和肿瘤细胞的恶性增殖、凋亡不足密切相关, 成为近年来的又一个研究热点[2-8]. 目前发现, ILK在多种人类肿瘤中表达显著增高. Ito等[17]发现ILK在胃癌中高度表达, 而在正常胃黏膜中表达低下, 且表达与肿瘤浸润深度及淋巴结转移呈正相关. Graff等[15]认为ILK表达增高加速了不依赖雄激素的人类前列腺癌细胞系进程, 与前列腺肿瘤的分级相关, 而且ILK表达的增加还与前列腺癌患者的预后相联系, 与患者的5年生存率成反比例关系. Ahmed等[11]则发现ILK在卵巢癌中高度表达, 与癌的分级相关. Takanami等[18]亦认为ILK促进非小细胞肺癌的生长、侵袭, ILK高表达是非小细胞肺癌的不良预后因素, ILK高表达患者生存情况较ILK低表达者差. 对经治疗的肿瘤患者的观察发现其血清中ILK有下调现象发生, 例如经卡铂治疗后卵巢癌患者血清ILK含量明显下降, 甚至基本达到健康者的正常水平[19]. 上述研究提示ILK作为整合素和生长因子受体信号转导途径中的一个重要效应物, 调节着细胞的黏附、生存、分化和凋亡, 对肿瘤的发展、转移及预后等发挥着重要作用. 因此有效抑制ILK的表达或降低其生物学活性是抗肿瘤治疗的关键.
RNA干扰作为最近发展起来的一项革命性技术, 是一种重要的转录后基因沉默机制, 是指由双链RNA介导的可高效特异降解对应序列mRNA, 从而特异性地抑制相应基因表达的技术. 他具有高度的序列专一性, 能够特异地使目的基因沉默, 获得功能丧失, 同时不影响其他基因[20-22]. RNA干扰具有效果强、持续时间长, 在细胞内表达的稳定性、可传递性等优点. 给人们带来了治疗肿瘤和艾滋病的新希望.
杨凤武等[23]成功构建ILK基因的特异性RNA干扰重组质粒, 并稳定转染结肠癌HT-29细胞, 特异、有效地干扰了ILK基因mRNA和蛋白的表达, 抑制了结肠癌细胞HT-29的增殖, 并诱导其凋亡. 陈亮等[24]在前期证实ILK在膀胱正常组织中表达极低, 而在膀胱癌组织中高度表达, 并且与肿瘤的分级、分期呈正相关, 该研究组针对ILK设计了干扰质粒, 并稳定转染膀胱癌BIU-87细胞, 有效地抑制BIU-87细胞mRNA和蛋白表达, 并通过流式细胞术、MTT比色法检测发现膀胱癌BIU-87细胞的恶性增殖表型逆转. 吕磊等[25]也发现以ILK为靶向的siRNA能够有效下调ILK基因的mRNA和蛋白表达水平, 显著抑制前列腺癌PC3细胞的增殖, 并能在一定程度上诱导其凋亡.
本课题组前期检测了60例胰腺癌组织和32例癌旁胰腺组织中ILK的表达并分析了其与临床病理参数的关系. 研究发现ILK在胰腺癌组织中的表达明显高于癌旁胰腺组织, 且与肿瘤淋巴结转移和肿瘤临床分期正相关. 这与ILK在其他恶性肿瘤中表达的研究结果是一致的[26]. 我们推测ILK在胰腺癌的侵袭和转移中起了重要的作用, 并与肿瘤的恶性程度相关. 其作为一种肿瘤相关抗原, 具有潜在的生物标记功能, 可能作为一种新的肿瘤标志物. 临床应用ILK多克隆抗体, 可以通过对细胞内ILK表达量的测定, 作为某些肿瘤初筛诊断及临床治疗效果监测的指标. 而ILK表达急速增高则可能作为某些肿瘤复发的有力指标. 随后我们在PANC-1、SW1990、Capan-2、AsPC-1 4株胰腺癌细胞株中检测发现ILK均有较高表达, 其中PANC-1细胞株ILK表达量最高. 因此我们设计构建并鉴定了针对ILK基因的特异性RNA干扰重组质粒, 并在胰腺癌PANC-1细胞株中成功阻断ILK基因的表达以达到基因沉默的效果, 为研究ILK基因在胰腺癌的作用开辟了新的途径.
RNA干扰是一种转录后基因沉默机制, 现已经成为研究基因功能和寻找药物靶点的重要工具. 研究表明ILK与包括胰腺癌在内的多种消化系肿瘤的形成、生长、侵袭、转移、复发关系密切.
高国全, 教授, 中山大学中山医学院生化系; 汤华, 研究员, 重庆医科大学感染性疾病分子生物学教育部重点实验室
近年来, 很多学者将RNAi技术用于治疗胰腺肿瘤的研究领域. 该技术在胰腺肿瘤研究内容涉及肿瘤的发生发展、侵袭与转移、信号传导、周期调控、调亡和治疗等方面.
研究证明, 使用RNAi方法可降低结肠癌、前列腺癌、膀胱癌等恶性肿瘤中ILK的表达, 并一定程度上抑制了肿瘤的生长.
本文利用RNA干扰技术研究其对胰腺癌细胞中ILK表达的影响, 为RNAi技术在胰腺癌中进行基因治疗和新药研发开辟新途径.
本文应用RNA干扰技术从mRNA和蛋白水平上显著地抑制了胰腺癌PANC-1细胞ILK基因表达, 为RNAi技术在胰腺癌体内抗IlK基因作用研究提供了实验基础和理论依据.
本研究立题较好, 研究方法先进可靠, 文章逻辑层次清楚.
编辑: 张姗姗 电编:闫晋利
| 1. | Raimondi S, Maisonneuve P, Lowenfels AB. Epidemiology of pancreatic cancer: an overview. Nat Rev Gastroenterol Hepatol. 2009;6:699-708. [PubMed] [DOI] |
| 2. | Hannigan GE, Leung-Hagesteijn C, Fitz-Gibbon L, Coppolino MG, Radeva G, Filmus J, Bell JC, Dedhar S. Regulation of cell adhesion and anchorage-dependent growth by a new beta 1-integrin-linked protein kinase. Nature. 1996;379:91-96. [PubMed] [DOI] |
| 3. | Abboud ER, Coffelt SB, Figueroa YG, Zwezdaryk KJ, Nelson AB, Sullivan DE, Morris CB, Tang Y, Beckman BS, Scandurro AB. Integrin-linked kinase: a hypoxia-induced anti-apoptotic factor exploited by cancer cells. Int J Oncol. 2007;30:113-122. [PubMed] |
| 4. | Assi K, Mills J, Owen D, Ong C, St Arnaud R, Dedhar S, Salh B. Integrin-linked kinase regulates cell proliferation and tumour growth in murine colitis-associated carcinogenesis. Gut. 2008;57:931-940. [PubMed] [DOI] |
| 5. | Belvindrah R, Nalbant P, Ding S, Wu C, Bokoch GM, Müller U. Integrin-linked kinase regulates Bergmann glial differentiation during cerebellar development. Mol Cell Neurosci. 2006;33:109-125. [PubMed] [DOI] |
| 6. | Blattner SM, Kretzler M. Integrin-linked kinase in renal disease: connecting cell-matrix interaction to the cytoskeleton. Curr Opin Nephrol Hypertens. 2005;14:404-410. [PubMed] [DOI] |
| 7. | Dai DL, Makretsov N, Campos EI, Huang C, Zhou Y, Huntsman D, Martinka M, Li G. Increased expression of integrin-linked kinase is correlated with melanoma progression and poor patient survival. Clin Cancer Res. 2003;9:4409-4414. [PubMed] |
| 8. | Friedrich EB, Liu E, Sinha S, Cook S, Milstone DS, MacRae CA, Mariotti M, Kuhlencordt PJ, Force T, Rosenzweig A. Integrin-linked kinase regulates endothelial cell survival and vascular development. Mol Cell Biol. 2004;24:8134-8144. [PubMed] [DOI] |
| 9. | Marotta A, Parhar K, Owen D, Dedhar S, Salh B. Characterisation of integrin-linked kinase signalling in sporadic human colon cancer. Br J Cancer. 2003;88:1755-1762. [PubMed] [DOI] |
| 10. | Oloumi A, Syam S, Dedhar S. Modulation of Wnt3a-mediated nuclear beta-catenin accumulation and activation by integrin-linked kinase in mammalian cells. Oncogene. 2006;25:7747-7757. [PubMed] [DOI] |
| 11. | Ahmed N, Riley C, Oliva K, Stutt E, Rice GE, Quinn MA. Integrin-linked kinase expression increases with ovarian tumour grade and is sustained by peritoneal tumour fluid. J Pathol. 2003;201:229-237. [PubMed] [DOI] |
| 12. | Koul D, Shen R, Bergh S, Lu Y, de Groot JF, Liu TJ, Mills GB, Yung WK. Targeting integrin-linked kinase inhibits Akt signaling pathways and decreases tumor progression of human glioblastoma. Mol Cancer Ther. 2005;4:1681-1688. [PubMed] [DOI] |
| 13. | Troussard AA, McDonald PC, Wederell ED, Mawji NM, Filipenko NR, Gelmon KA, Kucab JE, Dunn SE, Emerman JT, Bally MB. Preferential dependence of breast cancer cells versus normal cells on integrin-linked kinase for protein kinase B/Akt activation and cell survival. Cancer Res. 2006;66:393-403. [PubMed] [DOI] |
| 14. | Liu J, Costello PC, Pham NA, Pintillie M, Jabali M, Sanghera J, Tsao MS, Johnston MR. Integrin-linked kinase inhibitor KP-392 demonstrates clinical benefits in an orthotopic human non-small cell lung cancer model. J Thorac Oncol. 2006;1:771-779. [PubMed] [DOI] |
| 15. | Graff JR, Deddens JA, Konicek BW, Colligan BM, Hurst BM, Carter HW, Carter JH. Integrin-linked kinase expression increases with prostate tumor grade. Clin Cancer Res. 2001;7:1987-1991. [PubMed] |
| 16. | Blattner SM, Kretzler M. kinase: a cancer therapeutic target unique among its ILK. Nat Rev Cancer. 2005;5:51-63. [PubMed] [DOI] |
| 17. | Ito R, Oue N, Zhu X, Yoshida K, Nakayama H, Yokozaki H, Yasui W. Expression of integrin-linked kinase is closely correlated with invasion and metastasis of gastric carcinoma. Virchows Arch. 2003;442:118-123. [PubMed] |
| 18. | Takanami I. Increased expression of integrin-linked kinase is associated with shorter survival in non-small cell lung cancer. BMC Cancer. 2005;5:1. [PubMed] [DOI] |
| 19. | Ahmed N, Oliva K, Rice GE, Quinn MA. Cell-free 59 kDa immunoreactive integrin-linked kinase: a novel marker for ovarian carcinoma. Clin Cancer Res. 2004;10:2415-2420. [PubMed] [DOI] |
| 20. | Elbashir SM, Lendeckel W, Tuschl T. RNA interference is mediated by 21- and 22-nucleotide RNAs. Genes Dev. 2001;15:188-200. [PubMed] [DOI] |
| 21. | Pai SI, Lin YY, Macaes B, Meneshian A, Hung CF, Wu TC. Prospects of RNA interference therapy for cancer. Gene Ther. 2006;13:464-477. [PubMed] [DOI] |
| 22. | Jorgensen R. Altered gene expression in plants due to trans interactions between homologous genes. Trends Biotechnol. 1990;8:340-344. [PubMed] [DOI] |