修回日期: 2012-01-10
接受日期: 2012-02-06
在线出版日期: 2012-02-08
目的: 构建ATP4B-SV40T-IRES-GFP重组质粒并进行鉴定.
方法: 根据小鼠ATP4B启动子序列设计引物, 获得的小鼠ATP4B基因启动子序列, 并加入限制性内切酶酶切位点. 将其装入载体IRES-GFP, 获得重组载体ATP4B-IRES-GFP并进行酶切鉴定. 之后将SV40T基因克隆入ATP4B-IRES-GFP载体, 并用限制性内切酶PstI和AseⅠ进行验证.
结果: 将小鼠ATP4B启动子序列插入IRES-GFP载体, 经过酶切验证获得正确的ATP4B-IRES-GFP质粒; 将SV40T片段插入ATP4B-IRES-GFP, 质粒测序及酶切结果验证获得正确的ATP4B-SV40T-IRES-GFP重组质粒. 显微注射入小鼠受精卵可获得阳性小鼠.
结论: 成功构建ATP4B-SV40T-IRES-GFP重组质粒, 可用于下一步构建原发性胃癌转基因小鼠.
引文著录: 张隆, 赵成根, 李大力, 王金玉, 李琦, 范忠泽. 转基因重组质粒ATP4B-SV40T-IRES-GFP的构建及鉴定. 世界华人消化杂志 2012; 20(4): 314-318
Revised: January 10, 2012
Accepted: February 6, 2012
Published online: February 8, 2012
AIM: To construct and identify ATP4B-SV40T-IRES-GFP transgenic vector.
METHODS: The mouse ATP4B gene promoter was amplified and inserted into IRES-GFP vector after the addition of restriction enzyme sites to result in ATP4B-IRES-GFP. After restriction enzyme digestion, the SV40T gene sequence was inserted into ATP4B-IRES-GFP. The resultant recombinant plasmid was identified by digestion with restriction enzymes PstI and AseⅠ.
RESULTS: The recombinant plasmids ATP4B-IRES-GFP and ATP4B-SV40T-IRES-GFP have been successfully constructed and can be used to generate transgenic mice.
CONCLUSION: The recombinated plasmid ATP4B-SV40T-IRES-GFP was constructed successfully and it could be used to construct the transgenic mice with primary gastric cancer.
- Citation: Zhang L, Zhao CG, Li DL, Wang JY, Li Q, Fan ZZ. Construction and identification of ATP4B-SV40T-IRES-GFP transgenic vector. Shijie Huaren Xiaohua Zazhi 2012; 20(4): 314-318
- URL: https://www.wjgnet.com/1009-3079/full/v20/i4/314.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i4.314
胃癌是世界范围内最常见的恶性肿瘤之一, 每年约有100多万患者死于胃癌. 在我国, 胃癌死亡率一直居恶性肿瘤死亡的第1位, 上海市也是全国胃癌相对高发区之一, 胃癌死亡率为35. 32/10万. 胃癌是个多因素的疾病, 与140多种基因及其蛋白产物密切相关, 随着对癌基因研究的不断深入, 转基因动物模型在肿瘤学中应用越来越广泛. 转基因动物在胃癌形成、发展机理研究中有独特的优势, 因此是一种极为理想的胃癌模型. SV40T被广泛用于肿瘤发病机制的研究与转基因动物模型的建立[1-3]; H+/K+ ATP酶(H+/K+ ATPase)基因在胃黏膜上皮细胞中特异性表达, 和胃酸的合成与分泌有着直接的关系[4,5]. 本研究旨在构建胃黏膜上皮细胞H+/K+ ATPaseβ亚基启动子驱动下的SV40T-GFP融合基因的真核表达载体, 为下一步构建原发性胃癌的转基因绿色荧光小鼠动物模型, 研究胃癌发生机制奠定实验基础.
pIRES-GFP载体、pCDNA3. 1-SV40T载体由华东师范大学生命医学研究所李大力副教授惠赠, 大肠杆菌感受态细胞DH5α由上海中医药大学肿瘤介入研究所保存. 人血基因组DNA纯化试剂盒、组织/细胞基因组DNA纯化试剂盒购自深圳尚能生物科技有限公司; 质粒抽提试剂盒、PCR产物回收试剂盒购自美国AXYGEN公司; pMD-18T载体试剂盒、Taq DNA聚合酶、dNTP、T4连接酶、限制性内切酶AseⅠ、XhoⅠ、NheⅠ、XbalⅠ、SacⅠ、BmaHI和PstI购自日本TAKARA公司; 转染用脂质体Lipofectamine 2000购自美国Invitrogen公司; 胰蛋白酶购于上海闪晶生物; 新生牛血清、RPMI-1640干粉培养基购自美国Gibco公司; 琼脂粉(Agar)、胰蛋白胨(Tryptone)、酵母浸出粉(Yeast Extract)购自英国OXOID公司; 文中所用的引物均由上海生工生物技术有限公司合成. 电泳仪(MiniproteanⅢ型, 美国Bio-Rad公司)、银质梯度PCR仪(Mastercycler, 德国Eppendorf公司)、CO2细胞培养箱(Galaxy S+ 英国RS Biotech公司)、荧光倒置显微镜(CKX41/CKX-RFA, 日本Olympus公司)、凝胶成像系统(Gel-Doc EQ, 美国Bio Rad公司)、空气浴摇床(SI50, 上海欧比特仪器有限公司)、化学发光仪(GloMax 20/20 Luminometer, 美国Promega公司)、生物分光光度计(RS232c, 德国Eppendorf公司)、电热恒温培养箱(DNP 9032, 上海精宏实验设备有限公司)、高速低温离心机(Centrifuge 5804R, 德国Eppendorf公司).
1.2.1 基因组DNA提取: 利用基因组抽提试剂盒从小鼠组织中提取基因组DNA, 结果用1%琼脂糖凝胶电泳检测DNA纯度及完整性, 利用分光光度计测定产物在260 nm的吸光度(A)值, 以计算其浓度.
1.2.2 ATP4B基因启动子的克隆: 根据小鼠ATP4B基因启动子区序列, 设计引物: 上游5'-GCTCTTTCCTCTGGGTCTGT-3', 下游5'-GAAGCGTCCTCTAGGGCTTA-3', 以小鼠基因组DNA为模板. PCR反应体积50 µL, PCR扩增参数如下: 95 ℃ 5 min, 95 ℃ 60 s, 57 ℃ 90 s, 72 ℃ 90 s, 35个循环, 72 ℃ 10 min. 结果用1%琼脂糖凝胶电泳检测, 将正确的条带切下用PCR产物回收试剂盒回收, -20 ℃保存备用. 按照TAKARA pMD18-T载体试剂盒说明书将获得的PCR产物与pMD18-T载体连接, 将获得载体命名为pMD18T-ATP4B1.
1.2.3 ATP4B-IRES-GFP载体的构建: 由于IRES-GFP载体包含AseⅠ和XhoⅠ酶切位点, 根据ATP4B基因启动子序列设计引物, 加入AseⅠ和XhoⅠ酶切位点: 上游5'-GCATTAATTTCCTCTGGGTCTGTTTGGT-3', 下游5'-TTCTCGAGGCCCAGGAAGCGTCCTCTAGGGCTTA3', 以pMD18T-ATP4B1载体为模板. PCR反应体积50 µL, PCR扩增参数如下:95 ℃ 5 min; 95 ℃ 60 s, 57 ℃ 90 s, 72 ℃ 90 s, 35 个循环; 72 ℃ 10 min. 结果用1%琼脂糖凝胶电泳检测, 将正确的条带切下用PCR产物回收试剂盒回收. 按照TAKARA pMD18-T载体试剂盒说明书将获得的PCR产物与pMD18-T载体连接, 并用NheⅠ和XbalⅠ进行酶切验证, 将正确的载体命名为pMD18T-ATP4B2. 利用限制性内切酶AseⅠ和XhoⅠ, 酶切pMD18T-ATP4B2将片段插入IRES-GFP载体, 将重组子转化入大肠杆菌DH5α. 抽提质粒, 用两对限制性内切酶AseⅠ、XhoⅠ及SacⅠ、NheⅠ进行酶切验证, 酶切验证正确后命名为ATP4B-IRES-GFP.
1.2.4 ATP4B-SV40T-IRES-GFP载体构建: 将pcDNA3.1-SV40T质粒经BamHI酶切后, 回收SV40T基因片段, 将其插入ATP-IRES-GFP载体, 用限制性内切酶PstⅠ和AseⅠ进行酶切验证, 酶切验证正确后命名为ATP4B-SV40T-IRES-GFP并送测序.
1.2.5 显微注射及验证: 将ATP4B-SV40T-IRES-GFP载体显微注射入受精卵, 剪取出生10 d小鼠脚趾, 抽提基因组DNA进行PCR验证. 验证引物SG: 上游引物: CTCCCTTGTGTTTGTAGAGGCGAT, 下游引物: CCTCCAAAGTCAGGTTGATGAGCA; 验证引物AS: 上游引物: GGCTCTCCTCAAGCGTATTCAACA, 下游引物: TGGTGCAGATGAACTTCAGGGTCA. 以基因组DNA为模板, PCR反应体积50 µL, PCR扩增参数如下: 95 ℃ 5 min; 95 ℃ 30 s, 56 ℃ 40 s, 72 ℃ 45 s, 35 个循环; 72 ℃ 10 min. 结果用1%琼脂糖凝胶电泳检测.
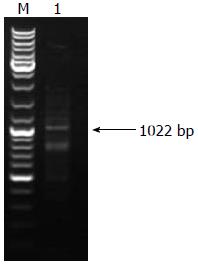
根据小鼠ATP4B基因启动子区设计引物, 以小鼠基因组DNA为模板, 扩增ATP4B基因启动子区. 结果用1%琼脂糖凝胶电泳检测(图1), 可见一条1 022 bp的条带, 将其回收制备pMD-18T-ATP4B1载体.
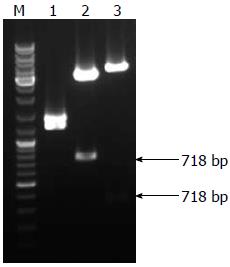
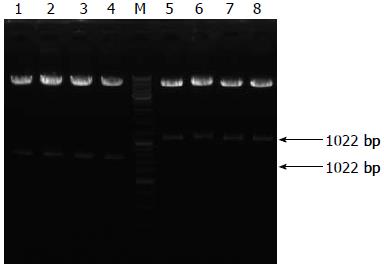
由于IRES-GFP载体含有AseⅠ和XhoⅠ的酶切位点, 通过引物设计, 在ATP4B启动子序列插入酶切位点, 将条带回收制备pMD-18T-ATP4B2载体, 并用结果AseⅠ和XhoⅠ进行酶切验证, 验证结果用1%琼脂糖凝胶电泳检测(图2), 所获得的700 bp和300 bp的质粒均为正确克隆. 之后将正确克隆AseⅠ和XhoⅠ酶切的片段回收插入IRES-GFP载体, 将重组子转化入大肠杆菌DH5α. 抽提质粒, 用两对限制性内切酶AseⅠ、XhoⅠ及SacⅠ、NheⅠ进行酶切验证, 验证结果用1%琼脂糖凝胶电泳检测(图3), 可分别获得1 022 bp和718 bp的片段.
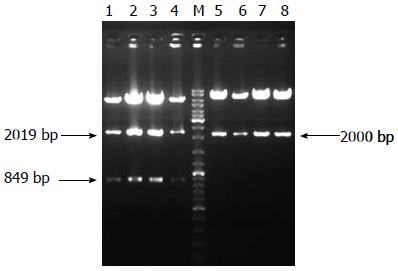
将SV40T基因片段插入ATP4B-IRES-GFP载体, 用限制性内切酶PstⅠ和AseⅠ分别进行酶切验证, 验证结果用1%琼脂糖凝胶电泳检测(图4), 可分别获得2 000 bp及2049 bp、849 bp的片段. 测序结果表明条带正确, 质粒构建成功(测序结果略).
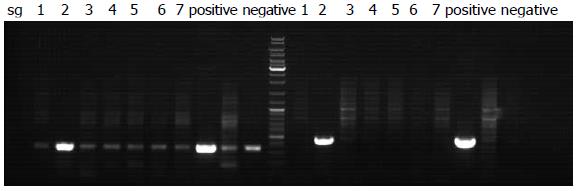
将ATP4B-SV40T-IRES-GFP载体显微注射入受精卵, 剪取出生10 d小鼠脚趾, 抽提基因组DNA进行PCR验证. 正确的小鼠可分别获得343 bp和384 bp的条带. 结果表明2号小鼠为阳性小鼠(图5).
胃癌是个多因素的疾病, 与140多种基因及其蛋白产物密切相关, 随着对癌基因研究的不断深入, 转基因动物模型在肿瘤学中应用越来越广泛. 转基因动物在胃癌形成、发展机制研究中有独特的优势: 如探讨化学药物与基因蛋白表达产物、幽门螺杆菌等在胃癌形成中的相互作用, TGF-α抑制剂在NF-kB信号传导通路中的作用等, 因此是一种极为理想的胃癌模型[6,7]. 转基因胃癌模型是直接将调控胃癌的相关基因转染到动物胚胎中而形成肿瘤, 如转染了腺病毒12Ela/Elb转基因大鼠, 在扁平上皮和圆柱形上皮的结合点附近形成了类似于人自然发生的胃癌, 用长424 bp的CEA促进剂SV40T抗原转基因构建的胃腺癌小鼠, 癌肿位于幽门部, 传代成瘤率达100%[8,9].
SV40(simian virus 40)是20世纪60年代初发现并分离出的猿猴肾细胞病毒, 具有转化动物细胞和诱发肿瘤的特性[10-12]. SV40T被广泛用于肿瘤发病机制的研究与转基因动物模型的建立, 如利用SV40T基因已建立了小鼠脑脉络丛乳头状瘤、胰腺癌、肝癌、前列腺癌等转基因动物模型. H+/K+ ATP酶(H+/K+ ATPase)基因在胃黏膜上皮细胞中特异性表达, 和胃酸的合成与分泌有着直接的关系[13-16].
绿色荧光蛋白(green fluorescent protein, GFP)基因是1992年被克隆鉴定的新的报告基因. 研究表明, GFP所产生的荧光无种属特异性, 不干扰细胞的生长与功能, 可耐受光漂白, 表达检测时不需要任何协同因子, 也不需要底物. 所以用GFP做阳性选择报告基因, 既对胚胎无损伤, 又经济简捷, 是提高基因转移与筛选效率的理想途径[17].
本研究通过将H+/K+ ATP酶基因的启动子、SV40T基因克隆入IRES-GFP载体, 构建ATP4B-SV40T-IRES-GFP质粒, 用来制备原发性胃癌转基因小鼠模型. 制备成功后, 小鼠的胃黏膜细胞将特异性的表达SV40T基因, 经过3-6 mo, 能够产生原发性胃癌. 由于载体包含GFP基因, 对于观察SV40T基因表达部位、表达水平、小鼠胃癌的发病情况提供了非常便捷的方法, 为后续的胃癌发病机制研究及胃癌的诊断和治疗奠定了实验基础.
目前胃癌的基础研究主要集中在细胞及分子水平, 个体水平的研究主要受限于没有合适的动物模型. 因此原发性胃癌动物模型的制备对于胃癌的基础研究至关重要, 而转基因技术能够帮助构建合适的原发性胃癌模型.
李革, 副教授, 延边大学附属医院普外一科
转基因动物在胃癌形成、发展机理研究中有独特的优势: 如探讨化学药物与基因蛋白表达产物、幽门螺杆菌等在胃癌形成中的相互作用, TGF-α抑制剂在NF-κB信号传导通路中的作用等.
研究表明转染了腺病毒12Ela/Elb转基因大鼠, 在扁平上皮和圆柱形上皮的结合点附近形成了类似于人自然发生的胃癌, 癌肿位于幽门部, 传代成瘤率达100%.
本研究旨在构建胃黏膜上皮细胞H+/K+ ATPase启动子驱动下的SV40T-GFP融合基因的真核表达载体, 为下一步构建原发性胃癌的转基因绿色荧光小鼠动物模型, 研究胃癌发生机制奠定实验基础.
本实验成功构建ATP4B-SV40T-IRES-GFP重组质粒, 为下一步构建原发性胃癌转基因小鼠打下基础, 试验设计合理, 技术方法先进, 结论可靠, 有一定的学术价值.
编辑: 曹丽鸥 电编:闫晋利
| 1. | Bian C, Zhao K, Tong GX, Zhu YL, Chen P. Immortalization of human umbilical vein endothelial cells with telomerase reverse transcriptase and simian virus 40 large T antigen. J Zhejiang Univ Sci B. 2005;6:631-636. [PubMed] [DOI] |
| 2. | Hofmann MC, Braydich-Stolle L, Dettin L, Johnson E, Dym M. Immortalization of mouse germ line stem cells. Stem Cells. 2005;23:200-210. [PubMed] [DOI] |
| 3. | Fujii S, Maeda H, Wada N, Kano Y, Akamine A. Establishing and characterizing human periodontal ligament fibroblasts immortalized by SV40T-antigen and hTERT gene transfer. Cell Tissue Res. 2006;324:117-125. [PubMed] [DOI] |
| 4. | Canfield VA, Levenson R. Structural organization and transcription of the mouse gastric H+, K(+)-ATPase beta subunit gene. Proc Natl Acad Sci U S A. 1991;88:8247-8251. [PubMed] [DOI] |
| 5. | Kirchhoff C, Araki Y, Huhtaniemi I, Matusik RJ, Osterhoff C, Poutanen M, Samalecos A, Sipilä P, Suzuki K, Orgebin-Crist MC. Immortalization by large T-antigen of the adult epididymal duct epithelium. Mol Cell Endocrinol. 2004;216:83-94. [PubMed] [DOI] |
| 6. | Kowolik CM, Liang S, Yu Y, Yee JK. Cre-mediated reversible immortalization of human renal proximal tubular epithelial cells. Oncogene. 2004;23:5950-5957. [PubMed] [DOI] |
| 7. | Takaishi S, Wang TC. Gene expression profiling in a mouse model of Helicobacter-induced gastric cancer. Cancer Sci. 2007;98:284-293. [PubMed] [DOI] |
| 8. | Taketo MM. Mouse models of gastrointestinal tumors. Cancer Sci. 2006;97:355-361. [PubMed] [DOI] |
| 9. | Azzoni AR, Ribeiro SC, Monteiro GA, Prazeres DM. The impact of polyadenylation signals on plasmid nuclease-resistance and transgene expression. J Gene Med. 2007;9:392-402. [PubMed] [DOI] |
| 10. | Markovics JA, Carroll PA, Robles MT, Pope H, Coopersmith CM, Pipas JM. Intestinal dysplasia induced by simian virus 40 T antigen is independent of p53. J Virol. 2005;79:7492-7502. [PubMed] [DOI] |
| 11. | Ishii K, Shappell SB, Matusik RJ, Hayward SW. Use of tissue recombination to predict phenotypes of transgenic mouse models of prostate carcinoma. Lab Invest. 2005;85:1086-1103. [PubMed] [DOI] |
| 12. | Robinson C, van Bruggen I, Segal A, Dunham M, Sherwood A, Koentgen F, Robinson BW, Lake RA. A novel SV40 TAg transgenic model of asbestos-induced mesothelioma: malignant transformation is dose dependent. Cancer Res. 2006;66:10786-10794. [PubMed] [DOI] |
| 13. | McCabe MT, Low JA, Daignault S, Imperiale MJ, Wojno KJ, Day ML. Inhibition of DNA methyltransferase activity prevents tumorigenesis in a mouse model of prostate cancer. Cancer Res. 2006;66:385-392. [PubMed] [DOI] |
| 14. | Boissan M, Wendum D, Arnaud-Dabernat S, Munier A, Debray M, Lascu I, Daniel JY, Lacombe ML. Increased lung metastasis in transgenic NM23-Null/SV40 mice with hepatocellular carcinoma. J Natl Cancer Inst. 2005;97:836-845. [PubMed] [DOI] |
| 15. | Tani Y, Suttie A, Flake GP, Nyska A, Maronpot RR. Epithelial-stromal tumor of the seminal vesicles in the transgenic adenocarcinoma mouse prostate model. Vet Pathol. 2005;42:306-314. [PubMed] [DOI] |
| 16. | Kim SH, Kim MO, Lee SR, Kim KS, Lee TH, Lee HT, Ha JH, Kim TY, Ryoo ZY. Characterization of a brain tumor cell line established from transgenic mice expressing the vasopressin SV-40 T antigen. Exp Mol Med. 2006;38:196-202. [PubMed] |
| 17. | Sun Q, Feng J, Wei XL, Zhang R, Dong SZ, Shen Q, Dong J, Li HD, Hu YH. Generation and characterization of a transgenic mouse model for pancreatic cancer. World J Gastroenterol. 2006;12:2785-2788. [PubMed] |