修回日期: 2012-01-03
接受日期: 2012-02-06
在线出版日期: 2012-02-08
目的: 探讨上调或下调FMNL2表达与大肠癌细胞侵袭能力, 以及该基因与Src、Talin表达的相关性.
方法: 将FMNL2-CT过表达重组慢病毒颗粒转染SW480和HT29大肠癌细胞, 构建FMNL2干扰质粒沉默SW620大肠癌细胞, 通过侵袭实验观察FMNL2表达量与细胞侵袭能力关系; Western blot检测转染前后细胞Talin、Src表达情况, 及PP1处理前后Talin、Src、FMNL2三种蛋白表达变化; 荧光免疫共定位检测FMNL2、Src、Talin大肠癌细胞内定位.
结果: 高表达FMNL2的癌细胞侵袭能力较低表达者显著提高(51.20±8.00 vs 38.00±4.00, P<0.05). 随着大肠癌细胞内FMNL2蛋白表达量的升高或降低, Src蛋白也上升或降低(F = 15.659, P<0.05), Talin则反之(SW480F = 540.595, HT29F = 163.816, SW620F = 125.507, P<0.01). PP1处理阻断Src通路后, FMNL2、Src蛋白含量均无明显变化, 而Talin蛋白表达量随之减低. 免疫共定位检测FMNL2与Src或Talin在胞浆和胞膜上存在共定位关系.
结论: FMNL2可以显著促进结直肠癌细胞的侵袭能力, FMNL2处于上游参与调控Src、Talin表达, 并可能通过Src间接影响Talin的表达进而参与对黏附斑转换的调控.
引文著录: 李静宇, 罗皓, 彭海连, 余力. FMNL2、Src、Talin在大肠癌细胞中的表达及其与调控的关系. 世界华人消化杂志 2012; 20(4): 289-295
Revised: January 3, 2012
Accepted: February 6, 2012
Published online: February 8, 2012
AIM: To study the role of FMNL2 in regulating the migration of colorectal cancer cells by overexpressing and silencing FMNL2 in these cells, and to evaluate the correlation between the expression of FMNL2 gene and that of Src and Talin.
METHODS: FMNL2-expressing lentivirus was infected into SW480 and HT29 cell lines. RNAi plasmid that expresses a siRNA targeting the FMNL2 gene was designed, constructed, and transfected into SW620 cells line. In vitro invasion assay was performed to investigate the influence of FMNL2 expression on colorectal cell invasion. Western blot was used to detect the expression of FMNL2, Src and Talin in cells and to assess the effect of PP1 on Talin, Src, and FMNL2 expression. Immuno-colocalization assay was used to analyze the interaction of FMNL2 with Src and Talin.
RESULTS: Cell invasion was significantly increased in cells overexpressing FMNL2 (51.20 ± 8.00 vs 38.00 ± 4.00, P < 0.05). FMNL2 expression was positively correlated with Src expression (F = 15.659, P < 0.05), but negatively correlated with Talin expression. Treatment with PP1 prominently decreased Talin expression (SW480F = 540.595, HT29F = 163.816, SW620F = 125.507, all P < 0.01), but did not change FMNL2 and Src expression. FMNL2 and Talin were co-localized in the cytoplasm, and FMNL2 and Src were co-localized in the plasma membrane.
CONCLUSION: FMNL2 significantly promotes invasion of colorectal cells. FMNL2 can regulate Src and Talin expression and indirectly control the transition of focal adhesions by regulating Src.
- Citation: Li JY, Luo H, Peng HL, Yu L. FMNL2 regulates cell migration and Src and Talin expression in colorectal cancer cells. Shijie Huaren Xiaohua Zazhi 2012; 20(4): 289-295
- URL: https://www.wjgnet.com/1009-3079/full/v20/i4/289.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i4.289
Formins家族成员FMNL2基因作为细胞移动、侵袭主要调节因子之一, 与大肠癌转移密切相关[1], 主要通过调节细胞骨架的构建影响细胞极化、细胞黏附和运动. 而FMNL2与细胞移动、黏着斑转换的关系尚不明确, 因此我们选用了分别干扰和过表达FMNL2基因的3组大肠癌细胞株, 观察FMNL2表达量与大肠癌细胞的侵袭能力及与细胞内Talin、Src表达的相关性, 探讨FMNL2基因在大肠癌转移的作用及黏附斑转换的作用机制.
细胞株SW620、SW480、HT29为南方医科大学病理实验室保存; pGenesil-FMNL21、pGenesil-FMNL22表达质粒由南方医科大学病理实验室梁丽教授提供; 胎牛血清、DMEM培养基购自Gibco; Opti-MEM培养基、lipofectaminTM2000均购自Invitrogen公司; FMNL2单克隆抗体购自Abnova公司; Talin、Src抗体购自abcom公司; PVDF膜购自millpore公司; Transwell小室购自Corning公司; 4-Amino-5-(methylphenyl)-7-(t-butyl)pyrazolo-(3, 4-d)pyrimidine(PP1)、ECM、荧光标记的鬼笔环肽购自Sigma公司; DyLight549 Conjugated Goat anti-Rabbit IgG(H+L)和DyLight488 Conjugated Goat anti-Mouse IgG(H+L)购自浙江联科生物技术有限公司; FSV-100激光共聚焦显微镜为Olympus公司产品.
1.2.1 建立FMNL2干扰及过表达的细胞模型: SW620是FMNL2高表达细胞株, HT29、SW480是FMNL2低表达细胞株[2]. 取生长状况好的SW620细胞, 使用pGenesil-FMNL21、pGenesil-FMNL22表达质粒、TRL ollipofectamineTM2000试剂盒沉默FMNL2.24 h后加含G418(浓度为800 mg/L)进行筛选, 筛选2 wk后形成抗性单克隆, 扩大培养, Western blot法检测干扰效率, 选择干扰效率最高的细胞, 命名为SW620/FMNL2 siRNA, 简称SW620/FMNL2↓. 用pGC-FU-EGFP-3Flag-FMNL2-CT慢病毒颗粒感染HT29、SW480大肠癌细胞, 获得FMNL2-CT高表达的HT29/FMNL2-CT, SW480/FMNL2-CT(简称HT29/FMNL2↑, SW480/FMNL2↑; 由南方医科大学病理实验室曾元凤提供), 有限稀释法筛选稳定细胞株, Western blot法检测.
1.2.2 体外侵袭实验: 用预冷的无血清培养基稀释细胞外基质(ECM)胶, 加入到Transwell小室中, 十字法摇匀, 37 ℃孵育3 h, 小心吸取小室内多余液体, 用DMEM培养基洗涤1次, 室温风干半小时. 取生长状况良好的SW620、SW620/FMNL2↓、SW480、SW480/FMNL2↑、HT29、HT29/FMNL2↑细胞(用无血清培养基饥饿24 h), PBS洗涤3次, 消化, 用无血清培养基重悬. 上室加入200 μL细胞悬液(1×105个), 下室加入500 μL含20%胎牛血清培养基, 于培养箱中培养48 h后取出小室, 吸掉培养液, 用棉签轻轻擦掉上室内细胞. 40 g/L多聚甲醛固定, 苏木素染色, 光镜下随机取5个视野计数, 取其均值代表细胞侵袭数值.
1.2.3 用Src通道抑制剂PP1处理细胞: 取3个对应组人大肠癌细胞SW620、SW620/FMNL2↓; SW480、SW480/FMNL2↑; HT29、HT29/FMNL2↑; 采用DMEM培养基(含10%胎牛血清), 在37 ℃、50 mL/LCO2条件下培养, 取生长状态良好的细胞的培养基中加入PP1(10 μmol/L)[3], 培养24 h, 收集细胞.
1.2.4 Western blot: 收集细胞并提取蛋白, 进行SDS-聚丙烯酰胺凝胶电泳, 转膜后, 取出PVDF膜, 甲醇浸泡1 min, 放入5%脱脂奶粉中封闭1.5 h. 加入FMNL2抗体(1:500), Src抗体(1:1 000)和Talin抗体(1:5 000), 4 ℃孵育过夜, TBST洗膜8 min×3次, 加入二抗室温孵育1 h, TBST洗膜, 经化学发光自显影方法进行成像.
1.2.5 激光共聚焦扫描观察FMNL2与Src、Talin、F-actin在大肠癌细胞中的定位: 将生长状况良好的细胞消化接种在共聚焦皿中, 吸尽共聚焦皿中的培养基, PBS洗涤5 min×3次, 40 g/L多聚甲醛固定10 min, PBS洗涤5 min×3次, 0.1% Triton-100打孔8 min, PBS洗涤5 min×3次, 含1%BSA的PBS封闭1 h, 加100 μL一抗稀释液(1:100)孵育, 4 ℃冰箱过夜, PBS洗涤5 min×3次, 同时加入DyLight549 Conjugated Goat anti-Rabbit IgG(H+L)红色荧光二抗和DyLight488 Conjugated Goat anti-Mouse IgG(H+L)绿色荧光二抗(1:100)及荧光标记的鬼笔环肽(5 mg/L)室温孵育1 h, PBS洗涤5 min×3次. 取DAPI 200 μL染核5 min, PBS洗涤8 min×3次, 激光共聚焦显微镜观察.
统计学处理 运用SPSS统计软件包进行数据分析, 所有结果均以mean±SD表示, 侵袭实验组间均数比较用两样本t检验, 各细胞组间蛋白分析用析因分析. P<0.05差异有统计学意义.
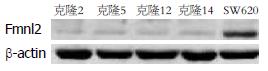
挑选20个SW620抗性单克隆细胞株, Western blot法检测FMNL2干扰效率, 选择干扰效率最高的细胞克隆2(图1), 命名为SW620/FMNL2↓, 慢病毒颗粒感染HT29、SW480大肠癌细胞, HT29/FMNL2↑, SW480/FMNL2↑, 有限稀释法筛选稳定细胞株.
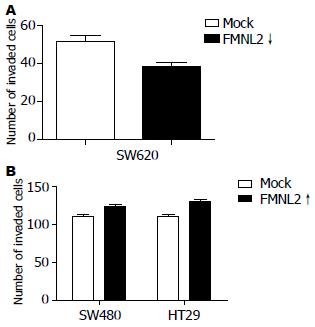
体外侵袭小室检测细胞侵袭能力, SW620的细胞侵袭数值: 51.20±8.00; SW620/FMNL2↓细胞侵袭数值: 38.00±4.00, 侵袭能力低于SW620(t = 3.655, P<0.05, 图2A). HT29细胞侵袭数值: 111.20±5.00; HT29/FMNL2↑细胞侵袭数值: 130.80±7.00. SW480细胞侵袭数值: 110.40±6.00; SW480/FMNL2↑细胞侵袭数值: 124.20±4.00, FMNL2过表达后侵袭能力上升(P<0.05, 图2B).
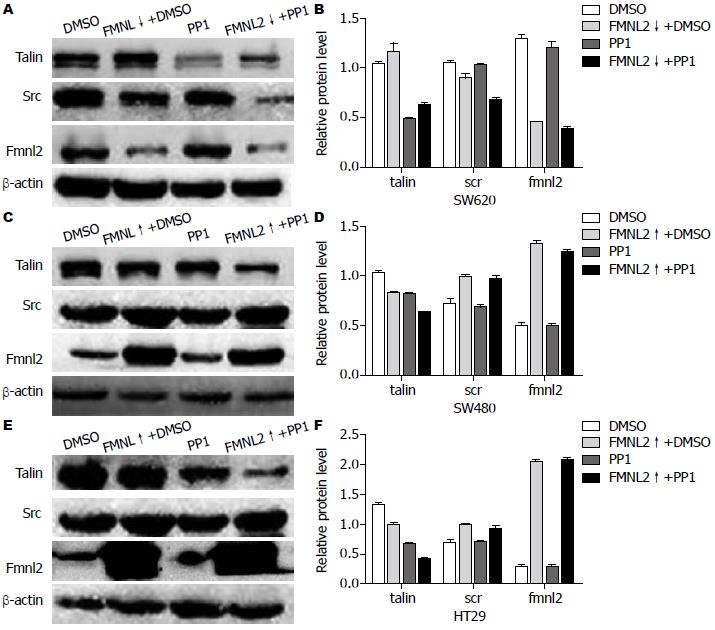
沉默后的SW620/FMNL2↓细胞内的Src蛋白较SW620细胞内的降低(F = 73.56, P<0.01), 而Talin蛋白增高(F = 7.772, P<0.05, 图3A, B); 过表达后的SW480/FMNL2↑、HT29/FMNL2↑细胞内的Src蛋白比SW480、HT29细胞内的上调(SW480F = 147.567, SW480P<0.01; HT29F = 147.567, HT29P<0.01), 而Talin蛋白表达量降低(SW480F = 1631.542, SW480P<0.01; HT29F = 150.603, HT29P<0.01, 图3C-F). 使用PP1处理前后, 细胞内FMNL2蛋白含量无明显变化(P>0.05), Src蛋白含量在SW480、HT29对应组中无明显变化, 在SW620对应组中略下降(F = 15.659, P = 0.04), 而Talin蛋白在加PP1后表达量在各对照组中明显减低(SW480F = 540.595, SW480P<0.01; HT29F = 163.816, HT29P<0.01; SW620F = 125.507, SW620P<0.01).
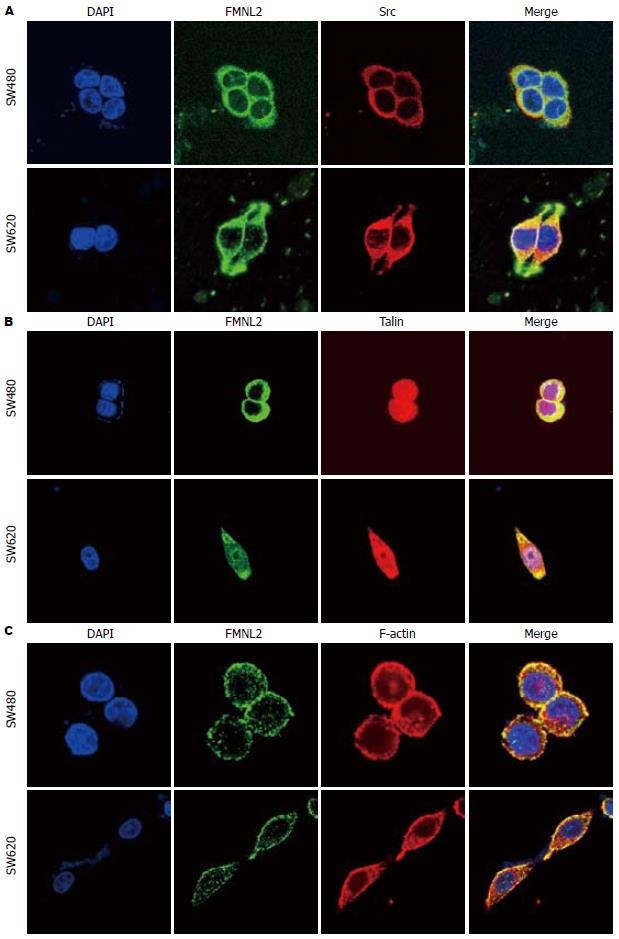
FMNL2、Src、Talin在不同形态的大肠癌细胞中分布与定位略有不同, 类圆形细胞(SW480细胞)中FMNL2、Src均匀分布于胞浆、胞膜, Talin则定位于整个细胞中(图4A, B); 而在双极细胞(SW620细胞)中, FMNL2、Src、Talin则表现出细胞两端突起聚集高表达现象(图4), 且FMNl2与两者存在显著共定位. 同时观察FMNL2与F-actin的分布与定位(图4C), 类圆形细胞(SW480细胞)中, FMNL2与F-actin在靠近胞膜的位置存在散在共定位, 而在SW620细胞中, Fmnl2与F-actin共定位于细胞膜, 比较连续, 且集中在细胞两端突起(图4C).
癌细胞的侵袭过程需要依赖一系列细胞肌动蛋白骨架变化, 包括局部收缩力的产生和传导、微丝参与的细胞-基质黏附的转换、激活多种Rho相关信号通路以及产生介导降解细胞外基质的独特的瞬间黏附; 近年来Diaphanous相关的formins(Diaphanous-related formins, DRFs)家族蛋白作为细胞骨架装配和组建的关键调控分子, 其在肿瘤转移中的作用已引起人们的广泛关注[4-8].
FMNL2是新鉴定的蛋白编码基因, 属Formins家族成员之一. Katoh等[9]通过生物信息学研究发现FMNL2与恶性肿瘤转移相关, 推测通过Rho相关信号通路, 参与肿瘤细胞极性控制、浸润、迁移. Kitzing等[10]通过实验证实FMNL2为RhoC的下游靶效应子, 通过介导单细胞阿米巴模式运动调控细胞移动. Li等[11]进一步研究显示在大肠癌细胞系, FMNL2通过TGF-β-诱导上皮细胞间质化(Epithelial-mesenchymal transition, EMT)和通过Smad3或联合MAPK/MEK路径参与大肠癌细胞侵袭.
本研究通过体外侵袭实验, 进一步证实FMNL2蛋白表达量与大肠癌细胞的侵袭能力呈正相关. 细胞的极化和变形是细胞迁移的初始步骤, 我们注意到在SW480的类圆形细胞FMNL2与F-actin在细胞膜上有散在共表达; 而在SW620的形态狭长、完全伸展开来的双极细胞中, 二者在细胞膜上连续共表达并在细胞两极突起的顶端聚集, 提示FMNL2可能与其家族其他成员一样通过调控细胞骨架来增强细胞的移动[12-16].
细胞的移动不仅靠调整肌动蛋白骨架产生局部收缩力, 细胞与细胞外基质间的黏附与去黏附也是细胞转移的关键因素. 这是因为黏附斑形成为机械力及牵拉力提供一个抛锚位点[17], Talin是一种膜结合蛋白, 其功能是参与黏着斑的形成. 首先, Talin和整合蛋白胞内段相互作用可以导致整合蛋白胞外段构象改变, 从而增加细胞膜表面对细胞外配体的亲和力[18-21]. 另外, Talin可以与整合蛋白胞内段及肌动蛋白细胞骨架的连接从而扮演着一个分子桥角色, 也是细胞获力以及穿过基底层时细胞牵引、运动所必须[22,23]. Frame等[17]的实验表明, 如果没有Talin进一步的肌动蛋白丝重组, 黏附斑的形成将会严重破坏, 导致细胞不能充分依附于基质. 当Talin缺失时, 虽然依赖Src的细胞伸展依然存在, 但并不持久. 当细胞平板接种后15-20 min后胞质边缘向细胞核收拢, 只有当细胞内存在完整的Talin蛋白时, 细胞才能拥有成熟的黏附能力及保持细胞伸展的狭长的细胞形态. 很多实验表明Src家族激酶是调节整合素诱导的肌动蛋白重组的关键角色[24], 活化的Src可以催化FAK的磷酸化使FAK完全活化, 从而提高细胞的黏附及迁移. 有实验证实阻断Src的功能可以消减mDia2和ROCK介导的张力细丝的形成, 影响细胞移动[25], 推测是由于缺乏c-Src, 细胞不能形成新的附着点供张力纤维附着而导致[26-28].
目前还未见有关FMNl2与Talin相互关系及其调控机制的研究报道, 结合本研究的实验结果及既往研究, FMNL2极可能通过Src通路影响Talin参与黏附斑的转换. 研究中发现, 当大肠癌细胞FMNL2被干扰或过表达时, Src降低或提高, 而Talin的表达则反之; 当用PP1处理阻断Src通路后, Talin蛋白表达量随之明显减低, 说明Talin位于Src下游. 其调控机制可能与Src家族激酶作用于整合蛋白的磷酸化机制有关, 这是因为整合蛋白的β尾部NPxY基元的酪氨酸磷酸化会抑制Talin与整合蛋白的结合, 非磷酸化的NPxY基元的尾部结构可以保持与Talin结合的活性, 而Src家族激酶的作用可以使整合蛋白的β尾部NPXY基元的酪氨酸磷酸化, 这减少了细胞附着, 导致整合蛋白从黏附斑置换下来[29]. 在以双极细胞样细胞形态为主的SW620细胞中观察到, FMNL2与Src的表达聚集共定位于细胞突起的两极顶端, 我们推断Src可能雷同与mDia2组成复合物一样与FMNL2组成复合物, 通过肌动蛋白束运送至黏附斑调控黏附斑转换[25].
本文实验工作主要在南方医科大学病理实验室完成, 期间得到梁丽教授、李祖国教授、李建明教授的热情指导, 特此志谢.
Formins家族成员FMNL2基因为新认定的大肠癌转移相关基因, 主要通过调节细胞骨架的构建影响细胞极化、细胞黏附和运动. 而FMNL2与细胞移动、黏着斑转换的关系尚不明确.
王娅兰, 教授, 重庆医科大学基础医学院病理教研室; 颜宏利, 教授, 中国人民解放军第二军医大学
FMNL2可能通过Rho相关信号通路参与肿瘤细胞极性控制、浸润、迁移和转移. 然而FMNL2和Rho蛋白之间存在怎样的调控关系, 参与Rho细胞运动信号通路的哪个作用环节, 是否参与黏附斑转换的调节, 目前尚不清楚..
朱曦龄等研究发现FMNL2基因沉默后, 5种肿瘤细胞增殖、侵袭相关的基因显著上调或下调. Kitzing等通过实验证实FMNL2为RhoC的下游靶效应子.
本研究发现FMNL2参与Src相关细胞运动信号通路, 并可能处于talin上游直接或通过Src相关通路调控Talin相关黏附斑的转换.
确定FMNL2在大肠癌细胞的迁移、黏附中的作用, 有助于阐明FMNL2在大肠癌转移中的作用机制, 为大肠癌转移预测和靶向治疗提供理论基础.
Diaphanous相关的formins家族蛋白(Diaphanous-related formins, DRFs): Formins是一类普遍存在、高度保守的多功能蛋白家族, DRFs属于formins家族中的一个亚类, 其成员有十多种, FMNL2是其中之一.
本文采用基因沉默和过表达方法, 研究FMNL2不同表达状态下大肠癌细胞侵袭能力改变以及与src、Talin表达的相关性, 探讨FMNL2与大肠癌细胞侵袭能力的相关性和可能的机制.
编辑: 张姗姗 电编:闫晋利
| 1. | Zhu XL, Zeng YF, Guan J, Li YF, Deng YJ, Bian XW, Ding YQ, Liang L. FMNL2 is a positive regulator of cell motility and metastasis in colorectal carcinoma. J Pathol. 2011;224:377-388. [PubMed] [DOI] |
| 2. | Zhu XL, Liang L, Ding YQ. [Expression of FMNL2 and its relation to the metastatic potential of human colorectal cancer cells]. Nanfang Yike Daxue Xuebao. 2008;28:1775-1778. [PubMed] |
| 3. | Kong L, Deng Z, Shen H, Zhang Y. Src family kinase inhibitor PP2 efficiently inhibits cervical cancer cell proliferation through down-regulating phospho-Src-Y416 and phospho-EGFR-Y1173. Mol Cell Biochem. 2011;348:11-19. [PubMed] [DOI] |
| 4. | Carreira S, Goodall J, Denat L, Rodriguez M, Nuciforo P, Hoek KS, Testori A, Larue L, Goding CR. Mitf regulation of Dia1 controls melanoma proliferation and invasiveness. Genes Dev. 2006;20:3426-3439. [PubMed] [DOI] |
| 5. | Kitzing TM, Sahadevan AS, Brandt DT, Knieling H, Hannemann S, Fackler OT, Grosshans J, Grosse R. Positive feedback between Dia1, LARG, and RhoA regulates cell morphology and invasion. Genes Dev. 2007;21:1478-1483. [PubMed] [DOI] |
| 6. | Gardberg M, Talvinen K, Kaipio K, Iljin K, Kampf C, Uhlen M, Carpén O. Characterization of Diaphanous-related formin FMNL2 in human tissues. BMC Cell Biol. 2010;11:55. [PubMed] [DOI] |
| 8. | Vasiliev JM. Cytoskeletal mechanisms responsible for invasive migration of neoplastic cells. Int J Dev Biol. 2004;48:425-439. [PubMed] [DOI] |
| 9. | Katoh M, Katoh M. Identification and characterization of human FMNL1, FMNL2 and FMNL3 genes in silico. Int J Oncol. 2003;22:1161-1168. [PubMed] |
| 10. | Kitzing TM, Wang Y, Pertz O, Copeland JW, Grosse R. Formin-like 2 drives amoeboid invasive cell motility downstream of RhoC. Oncogene. 2010;29:2441-2448. [PubMed] [DOI] |
| 11. | Li Y, Zhu X, Zeng Y, Wang J, Zhang X, Ding YQ, Liang L. FMNL2 enhances invasion of colorectal carcinoma by inducing epithelial-mesenchymal transition. Mol Cancer Res. 2010;8:1579-1590. [PubMed] [DOI] |
| 12. | Seth A, Otomo C, Rosen MK. Autoinhibition regulates cellular localization and actin assembly activity of the diaphanous-related formins FRLalpha and mDia1. J Cell Biol. 2006;174:701-713. [PubMed] [DOI] |
| 13. | Sagot I, Rodal AA, Moseley J, Goode BL, Pellman D. An actin nucleation mechanism mediated by Bni1 and profilin. Nat Cell. Biol. 2002;4:626-631. [PubMed] |
| 14. | Sato A, Khadka DK, Liu W, Bharti R, Runnels LW, Dawid IB, Habas R. Profilin is an effector for Daam1 in non-canonical Wnt signaling and is required for vertebrate gastrulation. Development. 2006;133:4219-4231. [PubMed] [DOI] |
| 15. | Moseley JB, Goode BL. Differential activities and regulation of Saccharomyces cerevisiae formin proteins Bni1 and Bnr1 by Bud6. J Biol Chem. 2005;280:28023-28033. [PubMed] [DOI] |
| 16. | Goode BL, Eck MJ. Mechanism and function of formins in the control of actin assembly. Annu Rev Biochem. 2007;76:593-627. [PubMed] [DOI] |
| 17. | Frame M, Norman J. A tal(in) of cell spreading. Nat Cell Biol. 2008;10:1017-1019. [PubMed] [DOI] |
| 18. | Calderwood DA. Talin controls integrin activation. Biochem Soc Trans. 2004;32:434-437. [PubMed] [DOI] |
| 19. | Han J, Lim CJ, Watanabe N, Soriani A, Ratnikov B, Calderwood DA, Puzon-McLaughlin W, Lafuente EM, Boussiotis VA, Shattil SJ. Reconstructing and deconstructing agonist-induced activation of integrin alphaIIbbeta3. Curr Biol. 2006;16:1796-1806. [PubMed] [DOI] |
| 20. | Tadokoro S, Shattil SJ, Eto K, Tai V, Liddington RC, de Pereda JM, Ginsberg MH, Calderwood DA. Talin binding to integrin beta tails: a final common step in integrin activation. Science. 2003;302:103-106. [PubMed] [DOI] |
| 21. | Wegener KL, Partridge AW, Han J, Pickford AR, Liddington RC, Ginsberg MH, Campbell ID. Structural basis of integrin activation by talin. Cell. 2007;128:171-182. [PubMed] [DOI] |
| 22. | Critchley DR, Gingras AR. Talin at a glance. J Cell Sci. 2008;121:1345-1347. [PubMed] [DOI] |
| 23. | Tanentzapf G, Brown NH. An interaction between integrin and the talin FERM domain mediates integrin activation but not linkage to the cytoskeleton. Nat Cell Biol. 2006;8:601-606. [PubMed] [DOI] |
| 24. | Shattil SJ. Integrins and Src: dynamic duo of adhesion signaling. Trends Cell Biol. 2005;15:399-403. [PubMed] [DOI] |
| 25. | Tominaga T, Sahai E, Chardin P, McCormick F, Courtneidge SA, Alberts AS. Diaphanous-related formins bridge Rho GTPase and Src tyrosine kinase signaling. Mol Cell. 2000;5:13-25. [PubMed] [DOI] |
| 26. | Yamana N, Arakawa Y, Nishino T, Kurokawa K, Tanji M, Itoh RE, Monypenny J, Ishizaki T, Bito H, Nozaki K. The Rho-mDia1 pathway regulates cell polarity and focal adhesion turnover in migrating cells through mobilizing Apc and c-Src. Mol Cell Biol. 2006;26:6844-6858. [PubMed] [DOI] |
| 27. | Kasahara K, Nakayama Y, Kihara A, Matsuda D, Ikeda K, Kuga T, Fukumoto Y, Igarashi Y, Yamaguchi N. Rapid trafficking of c-Src, a non-palmitoylated Src-family kinase, between the plasma membrane and late endosomes/lysosomes. Exp Cell Res. 2007;313:2651-2666. [PubMed] [DOI] |
| 28. | Wagner S, Storbeck CJ, Roovers K, Chaar ZY, Kolodziej P, McKay M, Sabourin LA. FAK/src-family dependent activation of the Ste20-like kinase SLK is required for microtubule-dependent focal adhesion turnover and cell migration. PLoS One. 2008;3:e1868. [PubMed] |
| 29. | O'Toole TE, Ylanne J, Culley BM. Regulation of integrin affinity states through an NPXY motif in the beta subunit cytoplasmic domain. J Biol Chem. 1995;270:8553-8558. [PubMed] [DOI] |