修回日期: 2012-11-16
接受日期: 2012-12-03
在线出版日期: 2012-12-18
目的: 探讨考来烯胺对2型糖尿病大鼠肝胆汁酸代谢的影响.
方法: 高脂饲料和小剂量链脲佐菌素(streptozotocin, STZ)注射成功诱导2型糖尿病后, SD♂大鼠随机分糖尿病组(diabetes mellitus group, DM组)和考来烯胺治疗组(cholestyramine treatment group, CT组)各10只, 分别喂以高脂饲料和含2.5%考来烯胺的高脂饲料. 另外10只正常SD♂大鼠作为对照组(control group, Con组), 喂养标准饲料. 继续饲养4 wk, 各组大鼠麻醉后, 股动脉采血并留取部分肝组织. RT-PCR检测胆汁酸代谢有关基因LXRα、FXR、SHP、CYP7A1、CYP27A1、ABCG5和ABCG8的mRNA表达, Western blot检测CYP7A1和CYP27A1的蛋白表达.
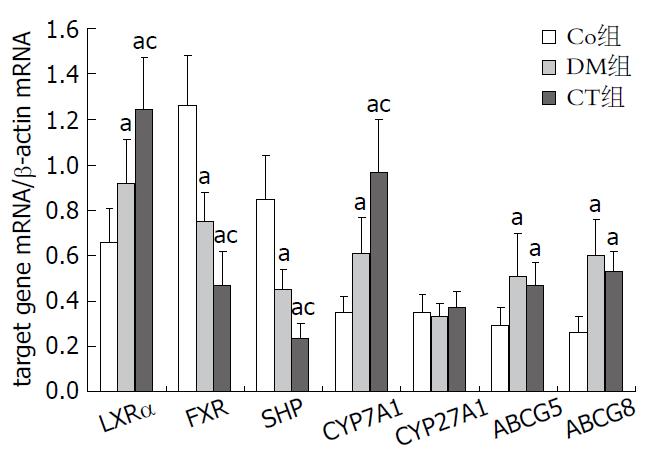
结果: 与Con组相比, DM组大鼠LXRα、CYP7A1、ABCG5和ABCG8的mRNA表达增加(均P<0.05), 而FXR和RXR的mRNA表达减少(均P<0.05). 与DM组相比, CT组LXRα和CYP7A1 mRNA表达进一步增加(均P<0.05), FXR和SHP的mRNA进一步减少(均P<0.05), ABCG5和ABCG8的mRNA表达不变. 各组CYP27A1的mRNA表达没有差异. Western blot表明Con组、DM组、CT组CYP7A1的蛋白表达依次增加(均P<0.05), 而各组CYP27A1蛋白表达均未改变.
结论: 2型糖尿病状态下, 肝胆汁酸合成增加是CYP7A1表达增加的结果, 而与CYP27A1无关, 考来烯胺治疗进一步促进了CYP7A1表达. 核受体LXRα的mRNA表达增加, FXR的mRNA表达减少与CYP7A1表达增加有关.
引文著录: 王晓凌, 崔海平. 考来烯胺对2型糖尿病大鼠胆汁酸代谢的影响. 世界华人消化杂志 2012; 20(35): 3575-3579
Revised: November 16, 2012
Accepted: December 3, 2012
Published online: December 18, 2012
AIM: To investigate the effect of cholestyramine therapy on bile acid metabolism in rats with type 2 diabetes.
METHODS: Type 2 diabetes was induced in Sprague-Dawley (SD) rats by feeding a high-fat diet and intraperitoneally injecting streptozotocin (30 mg/kg). The rats were then randomly divided into diabetes mellitus group (DM group) and cholestyramine treatment group (CT group), with 10 rats in each group. Rats in the DM group and CT group were fed a high-fat diet and a high-fat diet containing 2.5% cholestyramine, respectively. Ten normal male SD rats were used as controls (Con group) and fed standard rodent chow. Four weeks later, rats of each group were euthanized, and artery blood and liver samples were taken for further analysis. The mRNA levels of LXRα, FXR, SHP, CYP7A1, CYP27A1, ABCG5 and ABCG8, which are involved in bile acid metabolism, were evaluated by RT-PCR. The expression of CYP7A1 and CYP27A1 protein was detected by Western blot.
RESULTS: Compared to the Con group, rats in the DM group had increased mRNA levels of LXRα, CYP7A1, ABCG5 and ABCG8 (all P < 0.05), and reduced mRNA levels of FXR and SHP (both P < 0.05). Compared to the DM group, the CT group had increased mRNA levels of LXRα and CYP7A1 (both P < 0.05), reduced mRNA levels of FXR and RXR (both P < 0.05), and non-significantly changed expression of ABCG5 and ABCG8 mRNAs. The mRNA level of CYP27A1 showed no significant difference among each group. Western blot analysis showed that the protein expression of CYP7A1 was increased most significantly in the Con group, followed by the DM group and CT group (all P < 0.05), and that of CYP27A1 showed no significant difference among each group.
CONCLUSION: In type 2 diabetic rats, hepatic bile acid synthesis increases possibly as a result of increased expression of CYP7A1. Cholestyramine therapy further promotes the expression of CYP7A1. The increased mRNA expression of LXRα and decreased mRNA expression of FXR are related to the increased expression of CYP7A1.
- Citation: Wang XL, Cui HP. Cholestyramine therapy alters bile acid metabolism in streptozotocin-induced diabetic rats. Shijie Huaren Xiaohua Zazhi 2012; 20(35): 3575-3579
- URL: https://www.wjgnet.com/1009-3079/full/v20/i35/3575.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i35.3575
2型糖尿病患者常合并血胆固醇水平增高和肝脂质沉积[1,2]. 胆汁酸合成是胆固醇最主要的转化排泄途径, 促进胆汁酸的排泄能间接减少肝胆固醇的含量, 必然对胆固醇和胆汁酸代谢平衡产生影响. 胆汁酸除能促进脂类物质的消化吸收外, 也是一种信息物质, 通过其受体调节物质代谢和能量代谢[3], 因此胆汁酸的变化对糖尿病患者的糖脂代谢会产生影响, 从而影响糖尿病的发展. 考来烯胺是一种阴离子交换树脂, 在肠道中能与多种胆汁酸结合, 使胆汁酸不再重吸收而随粪便排出, 改变胆汁酸肠肝循环状态, 降低血胆固醇水平, 提高外周组织胰岛素敏感性, 改善糖尿病症状[4,5]. 正常生理条件下考来烯胺可通过改变肝细胞中某些核受体的表达, 促进胆固醇转化为胆汁酸[6]. 糖尿病状态下考来烯胺对胆汁酸代谢有关基因的影响如何, 缺乏报道. 我们利用考来烯胺促进2型糖尿病肥胖大鼠胆汁酸的排泄, 对肝胆汁酸代谢有关基因的表达变化进行研究, 旨在明确考来烯胺对2型糖尿病大鼠肝胆汁酸代谢的影响.
SD♂大鼠购自河北省实验动物中心; OptiumTM血糖/血酮仪为美国Abbott Diabetes Care INC.生产; Mastercycler Pro PCR仪为德国Effendorf公司产品; GIS-1000凝胶成像分析系统为天能科技(上海)有限公司生产; AMV逆转录酶、Taq DNA聚合酶购自Fermentas; 链脲佐菌素(STZ)为Sigma公司产品; 胰岛素放射免疫试剂盒购自北方生物技术研究所; 血糖、甘油三酯和胆固醇测定试剂盒购自浙江东瓯生物工程有限公司; 胰高血糖素样肽-1(glucagon-like peptide 1, GLP-1)的ELISA试剂盒为美国Millipore公司产品; 一抗和HRP标记的二抗购自美国Santa Cruz公司; 考来烯胺为南京厚生药业产品.
1.2.1 分组和建模: 3 mo♂SD大鼠用高脂饲料(热量组成为糖20.1%, 脂肪59.8%, 蛋白质20.1%, 其中脂肪主要为猪油)喂养8 wk, 通过口服糖耐量实验(oral glucose tolerance test, OGTT)和胰岛素释放实验(insulin releasing test, IRT)、胰岛素敏感指数(insulin sensitivity index, ISI)验证是否产生胰岛素抵抗, 胰岛素敏感指数 = ln1/(空腹血糖浓度×空腹血胰岛素浓度). 产生胰岛素抵抗的大鼠空腹注射小剂量STZ(30 mg/kg), 3 d后禁食12 h, 测定空腹血糖. 血糖值>7.8 mmol/L的大鼠随机分为糖尿病组(diabetes mellitus group, DM组)和考来烯胺治疗组(cholestyramine treatment group, CT组). DM组大鼠继续喂养高脂饲料, CT组喂养高脂添加2.5%考来烯胺的高脂饲料, 共4 wk. 另有平行饲养的10只♂SD大鼠作为对照组(control group, Con组), 喂养标准饲料(热量组成为糖65.5%, 脂肪0.3%, 蛋白质24.2%).
1.2.2 取材: 分别从Con组、DM组和CT组随机选取10只大鼠, 1.2 g/kg乌拉坦腹腔注射麻醉, 股动脉采血, 3 000 r/min分离血清, 用于检测血液生化指标; 从相同部位迅速留取部分肝组织, 置于液氮中, 分装后-80 ℃冻存, 用于测定胆汁酸代谢有关基因的表达.
1.2.3 血清生化指标的测定: 按试剂盒说明, 用HITACHI 7170A型全自动生化分析仪测定血清葡萄糖、甘油三酯、总胆固醇浓度. 人工放射免疫法测定胰岛素水平, GLP-1采用酶联免疫吸附法测定.
1.2.4 胆汁酸代谢有关基因的mRNA表达: 用TRIzol法提取肝组织总RNA, 用随机引物进行逆转录, 以逆转录的单链cDNA为模板, PCR扩增以下基因: (1)调节脂质代谢的肝孤核受体α(liver x receptor α, LXRα), LXRα Forward, ACAACCCTGGGAGTGAGA, LXRα Reverse, TAGCATCCGTGGGAACAT; (2)胆汁酸的核受体法尼醇X受体(farnesoid X receptor, FXR)及其靶基因微小异源二聚体伙伴基因(small heterodimer partner gene, SHP), FXR Forward, CAAGTGACCTCCACGACCAAG, FXR Reverse, TCCGCTGAA CGAAGGAACAT, SHP Forward, AAGGCACTATCCTCTTCAACC, SHP Reverse, ATGCTCCCATCCCTACCC; (3)胆汁酸经典合成途径的限速酶-胆固醇7α羟化酶(Cholesterol 7α-hydroxylase, CYP7A1)和替代合成途径的限速酶-胆固醇27α羟化酶(CYP27A1), CYP7A1 Forward, TGCCTTCTGTTACCGAGTG, CYP7A1 Reverse, AATAGCGAGGTGCGTCTT, CYP27A1 Forward, TCTACGAGGCTATGTGCT, CYP27A1 Reverse, ATCCGCTGATTCAAACTA; (4)参与肝细胞将胆固醇转移到胆汁中的ATP结合盒转运体G5和G8(ABCG5和ABCG8), ABCG5 Forward, TGCCAGATTTGGATACTTC, ABCG5 Reverse, GACAAGAGTCGGGATGAA, ABCG8 Forward, CCTCGCTACAGCAACCCT, ABCG8 Reverse, GCGTGGCCGTAGTAAAGG; (5)内参基因β-actin, β-actin Forward, GCCATGTACGTAGCCATCCA, β-actin Reverse, GAACCGCTCATTGCCGATAG. PCR产物经2%琼脂糖凝胶电泳, 经成像分析系统分析, 分别得到目的基因扩增产物与内参照β-actin基因扩增产物的积分光密度值(IA), 以二者的比值作为目的基因的相对表达量.
1.2.5 Western bolt检测肝CYP27A1和CYP27A1的表达: 100 mg肝组织加入1 mL RIPA裂解液, 冰浴匀浆, 12 000 g离心10 min, 吸取上清液, 测定蛋白浓度. 采用10%聚丙烯酰胺分离胶不连续系统进行电泳分离样品蛋白质, 胶中蛋白质电转移至PVDF膜, 50 g/L的脱脂奶粉于37 ℃封闭1 h. 印迹膜分别浸入兔抗人CYP7A1多抗、羊抗人CYP27A1多抗和兔抗大鼠β-actin多抗溶液, 4 ℃结合过夜. TTBS溶液洗膜, 然后分别加入HRP标记羊抗兔二抗或HRP标记驴抗羊二抗, 37 ℃反应1 h. TTBS溶液洗膜, 化学发光法处理. X片感光成像后, 经成像分析系统分析.
统计学处理 所有数据均用mean±SD表示, 采用SPSS13.0软件进行统计学处理分析, 多组间比较用单因素方差分析, 两两比较采用LSD法, P<0.05为差异有统计学意义.
与Con组相比, DM组大鼠空腹血糖、甘油三酯、胆固醇明显升高, 胰岛素敏感指数下降, 体质量明显增高(P<0.05), 表明该模型大鼠为2型糖尿病肥胖大鼠. 使用考来烯胺后, 空腹血糖、胆固醇有所下降, 胰岛素敏感指数有所升高(P<0.05). DM组GLP-1浓度下降, 使用考来烯胺后, GLP-1浓度有所上升(P<0.05, 表1).
| 项目 | 对照组 | 糖尿病组 | 考来烯胺治疗组 |
| 体质量(g) | 441.50±32.60 | 483.40±34.50a | 461.70±26.60 |
| 空腹血糖(mmol/L) | 5.29±0.46 | 15.84±2.47a | 10.83±1.9ac |
| 甘油三酯(mmol/L) | 1.01±0.30 | 2.23±0.51a | 2.11±0.41a |
| 胆固醇(mmol/L) | 1.75±0.15 | 2.95±0.49a | 1.82±0.12c |
| 胰岛素(µIU/mL) | 18.69±3.95 | 20.97±5.32 | 22.02±5.17 |
| 胰岛素敏感指数 | -4.57±0.26 | -5.76±0.37a | -5.43±0.30ac |
| GLP-1(pmol/L) | 12.69±2.30 | 6.18±1.22a | 9.67±2.08ac |
与Con组相比, DM组大鼠LXRα、CYP7A1、ABCG5和ABCG8的mRNA表达增加(P<0.05), 而FXR和SHP的mRNA表达减少(P<0.05). 与DM组相比, CT组LXRα和CYP7A1 mRNA表达进一步增加(P<0.05), FXR和SHP的mRNA进一步减少(P<0.05, 图1), ABCG5和ABCG8的mRNA表达不变. CYP27A1在各组中的mRNA没有差异.
Western bolt结果显示, DM组CYP7A1的蛋白表达量明显高于Con组(1.06±0.06 vs 0.79±0.04, P<0.01), CT组CYP7A1的表达量(1.16±0.04)比DM组进一步增加(P<0.05, 图2). 而CYP27A1在各组的蛋白表达量无差异.
GLP-1是肠道上皮内分泌L细胞分泌的一种肠促胰岛素, 是胰高血糖素原基因表达后的加工产物. GLP-1与细胞膜表面受体结合发挥作用, 可促进胰腺分泌胰岛素, 并抑制胰高血糖素的分泌, GLP-1也可促进肝细胞中糖原合成酶由磷酸化形式转变为脱磷酸化形式, 促进了糖原的合成, 因此有明显的降低血糖的效应[7]. 本研究表明糖尿病情况下大鼠血中GLP-1水平降低, 使用考来烯胺后GLP-1水平明显升高, 这可能与CT组空腹血糖水平的下降和胰岛素抵抗的改善有关. 作为一种信号分子, 胆汁酸主要通过激活细胞膜受体TGR5和肝X受体(liver X receptor , LXR)来发挥作用. TGR5属于G蛋白偶联受体家族, 与胆汁酸结合后可激活下游的cAMP信号通路[8]. TGR5在多种组织和细胞有表达, 例如人的胆囊上皮细胞、单核/吞噬细胞, 鼠的肝血窦内皮细胞、枯否细胞、树突状细胞、肠道L细胞等. 文献报道[9], 肠道L细胞主要存在于大肠, 胆汁酸可通过激活L细胞的膜受体TGR5信号传递系统促进GLP-1的分泌. 正常情况下胆汁酸主要在小肠下端被重吸收, 只有很少的胆汁酸可以到达大肠, 考来烯胺与胆汁酸结合形成不吸收形式, 使大量胆汁酸到达大肠, 这可能是其促进GLP-1分泌明显增加的原因.
胆汁酸是机体胆固醇转化排出体外的最主要形式, 考来烯胺增加了随粪便排出的胆汁酸量, 促进了胆固醇转变为胆汁酸, 可降低血胆固醇含量. 与对照组相比糖尿病大鼠血清胆固醇浓度升高, 经考来烯胺治疗后胆固醇浓度有明显下降. 肝通过"经典途径"和"替代途径"合成胆汁酸, 经典途径是主要途径, 限速酶是CYP7A1, 替代途径是次要途径, 其限速酶之一为CYP27A1[10]. LXRα是CYP7A1的正性调控因子, FXR是其负性调控因子[11,12]. CYP7A1是核受体LXRα的下游基因, LXRα被其配体激活后, 先与维甲酸X受体(retinoid X receptor, RXR)形成异二聚体, 再作用到下游基因CYP7A1的顺式元件, 促进CYP7A1转录. 羟化胆固醇是LXRα的内源性配体, 糖尿病状态下肝细胞可能生成大量羟化胆固醇, 从而激活LXRα[13]. 胆汁酸是内源性FXR配体, 二者结合后通过SHP、JNK和FGF-15抑制CYP7A1的表达[14]. 本研究结果表明糖尿病状态下LXRα表达增加, 而FXR、SHP表达减少, 使用考来烯胺后这种变化进一步增大, 因此DM组和CT组CYP7A1表达增加与核受体LXRα的mRNA表达增加和FXR的mRNA表达减少有关. 有文献报道小鼠胆汁酸替代合成途径不受肠道胆汁酸含量的变化的影响[15], 本研究中胆汁酸替代合成途径的关键酶CYP27A1在DM组和CT组均未发生变化, 说明胆汁酸替代合成途径没有发生改变, 因此, DM组和CT组胆汁酸合成增加是经典途径代谢增强引起的. ABCG5、ABCG8是ABC转运蛋白G家族的成员, 在二者的启动子部位存在LXRα的顺式作用元件[16]. 糖尿病状态下ABCG5、ABCG8表达增加, 促进肝细胞中的胆固醇排入胆汁, 使用考来烯胺后ABCG5、ABCG8的表达没有进一步增加, 其机制尚需进一步研究.
总之, 考来烯胺在肠道与多种胆汁酸结合, 改变了胆汁酸肠肝循环状态, 能降低2型糖尿病大鼠血糖和血脂水平, 提高组织对胰岛素的敏感性. 2型糖尿病状态下肝胆汁酸合成增加是CYP7A1表达增加的结果, 而与CYP27A1无关, 考来烯胺治疗进一步促进了CYP7A1表达. 核受体LXRα的mRNA表达增加, FXR的mRNA表达减少与CYP7A1表达增加有关.
近十年来发现胆汁酸不仅能促进脂类物质的消化吸收, 而且还是一种信号分子, 通过核受体法尼醇X受体和膜受体TGR5, 调节糖、脂类和能量代谢. 最近的观察表明2型糖尿病存在胆汁酸平衡失调, 考来烯胺通过改变胆汁酸肠肝循环状态对物质代谢发挥调节作用.
于珮, 主任医师, 天津医科大学代谢病医院
Shang等揭示兔CYP7A1基因启动子区的肝X受体α(LXRα)结合区内含有FTF结合元件, 激活FXR可能通过SHP/FTF异源二聚体消除LXRα对CYP7A1基因表达的调控作用, 提示FXR和LXRα在调节CYP7A1表达时可能存在关联.
本研究发现考来烯胺引起2型糖尿病大鼠胆汁酸生成增加是通过"经典途径"完成的, 而"替代途径"没有改变. 核受体LXRα的mRNA表达增加, FXR的mRNA表达减少与"经典途径"的限速酶CYP7A1表达增加有关.
本研究对考来烯胺影响糖和脂类代谢的机制进行了探讨, 对于探索胆汁酸螯合剂在代谢性疾病中的应用有一定参考价值.
肝X受体α(LXRα): 属于核受体超家族成员, 主要在肝、肾等组织表达. 主要通过对其下游基因的调控, 调节胆固醇的吸收、转运和转化. LXRα除了与胆固醇代谢有关外, 还与脂肪酸的生成有关. 脂肪酸生成的关键酶乙酰CoA羧化酶、脂肪酸合成酶都是他的下游基因.
本论文研究了考来烯胺在肠道与多种胆汁酸结合, 改变了胆汁酸肠肝循环状态, 能降低2型糖尿病大鼠血糖和血脂水平, 提高组织对胰岛素的敏感性. 结果科学, 结论明确, 实验证据较充足.
编辑: 翟欢欢 电编:闫晋利
| 1. | Loomba R, Abraham M, Unalp A, Wilson L, Lavine J, Doo E, Bass NM. Association between diabetes, family history of diabetes, and risk of nonalcoholic steatohepatitis and fibrosis. Hepatology. 2012;56:943-951. [PubMed] [DOI] |
| 3. | Prawitt J, Caron S, Staels B. Bile acid metabolism and the pathogenesis of type 2 diabetes. Curr Diab Rep. 2011;11:160-166. [PubMed] [DOI] |
| 4. | Takebayashi K, Aso Y, Inukai T. Role of bile acid sequestrants in the treatment of type 2 diabetes. World J Diabetes. 2010;1:146-152. [PubMed] [DOI] |
| 7. | Lee YS, Shin S, Shigihara T, Hahm E, Liu MJ, Han J, Yoon JW, Jun HS. Glucagon-like peptide-1 gene therapy in obese diabetic mice results in long-term cure of diabetes by improving insulin sensitivity and reducing hepatic gluconeogenesis. Diabetes. 2007;56:1671-1679. [PubMed] [DOI] |
| 8. | Pols TW, Noriega LG, Nomura M, Auwerx J, Schoonjans K. The bile acid membrane receptor TGR5: a valuable metabolic target. Dig Dis. 2011;29:37-44. [PubMed] [DOI] |
| 9. | Harach T, Pols TW, Nomura M, Maida A, Watanabe M, Auwerx J, Schoonjans K. TGR5 potentiates GLP-1 secretion in response to anionic exchange resins. Sci Rep. 2012;2:430. [PubMed] [DOI] |
| 10. | Norlin M, Wikvall K. Enzymes in the conversion of cholesterol into bile acids. Curr Mol Med. 2007;7:199-218. [PubMed] [DOI] |
| 11. | Wooton-Kee CR, Coy DJ, Athippozhy AT, Zhao T, Jones BR, Vore M. Mechanisms for increased expression of cholesterol 7alpha-hydroxylase (Cyp7a1) in lactating rats. Hepatology. 2010;51:277-285. [PubMed] [DOI] |
| 12. | Shang Q, Pan L, Saumoy M, Chiang JY, Tint GS, Salen G, Xu G. An overlapping binding site in the CYP7A1 promoter allows activation of FXR to override the stimulation by LXRalpha. Am J Physiol Gastrointest Liver Physiol. 2007;293:G817-G823. [PubMed] [DOI] |
| 13. | Guan JZ, Tamasawa N, Murakami H, Matsui J, Yamato K, Suda T. Clofibrate, a peroxisome-proliferator, enhances reverse cholesterol transport through cytochrome P450 activation and oxysterol generation. Tohoku J Exp Med. 2003;201:251-259. [PubMed] [DOI] |
| 14. | Chiang JY. Bile acids: regulation of synthesis. J Lipid Res. 2009;50:1955-1966. [PubMed] [DOI] |
| 15. | Schwarz M, Russell DW, Dietschy JM, Turley SD. Alternate pathways of bile acid synthesis in the cholesterol 7alpha-hydroxylase knockout mouse are not upregulated by either cholesterol or cholestyramine feeding. J Lipid Res. 2001;42:1594-1603. [PubMed] |
| 16. | Freeman LA, Kennedy A, Wu J, Bark S, Remaley AT, Santamarina-Fojo S, Brewer HB. The orphan nuclear receptor LRH-1 activates the ABCG5/ABCG8 intergenic promoter. J Lipid Res. 2004;45:1197-1206. [PubMed] [DOI] |