修回日期: 2012-11-11
接受日期: 2012-11-23
在线出版日期: 2012-12-08
目的: 筛选与胰腺癌干细胞相关的差异表达miRNAs, 并进行生物信息学分析.
方法: 以MIA-PaCa2(TIChigh)与BxPc-3(TIClow)为研究胰腺癌干细胞的工具细胞制备总RNA, 经质量鉴定后进行荧光标记; 采用Agilent人类miRNA芯片进行杂交实验, 获得miRNA表达谱; 以Gene Spring Software 11.0软件和Quantile算法分析芯片实验数据, 筛选与胰腺癌干细胞相关的差异miRNAs; 荧光定量PCR验证部分差异表达miRNAs; 基于Sanger数据库预测差异miRNA靶基因, 基于Gene Ontology数据库进行GO注释, 基于KEGG数据库进行Pathway注释.
结果: 获得符合基因芯片实验质量标准的RNA样品, 基因芯片杂交及数据分析共鉴定到940个miRNAs, 得到91个差异表达miRNAs(P<0.05, fold change≥2), 其中MIA-PaCa2(TIChigh)中下调表达45个, 上调表达46个. 荧光定量PCR验证21条差异miRNAs, 其中19条均与芯片结果相符. TargetScan 6.0数据库靶基因预测共得到2 895条靶基因, GO注释显示他们主要涉及轴突导向、血管生成、转录后蛋白修饰等功能. Pathway注释显示主要涉及癌症途径、细胞-基质黏附途径、Hedgehog信号途径、MAPK信号途径等信号通路.
结论: 筛选出的胰腺癌干细胞相关差异表达miRNAs调控多种具有不同细胞功能和参与不同信号通路的基因, 有可能成为胰腺癌新的治疗靶点.
引文著录: 江建新, 高珊, 王敏, 李旭, 孙诚谊. 胰腺癌干细胞差异microRNAs的表达及生物信息学. 世界华人消化杂志 2012; 20(34): 3354-3360
Revised: November 11, 2012
Accepted: November 23, 2012
Published online: December 8, 2012
AIM: To screen and identify differentially expressed miRNAs in pancreatic cancer stem cells and to analyze them by bioinformatics.
METHODS: Total RNA was prepared from MIA-PaCa2 (TIChigh) and BxPc-3 (TIClow) cells. After quality identification and fluorescent labeling, the RNA samples were hybridized with Agilent human miRNA microarrays. Raw data were normalized using Quantile algorithm and Gene Spring Software 11.0. Part of differentially expressed miRNAs were validated by SYBR Green real-time PCR. Sanger database was used to predict target genes for differentially expressed miRNAs. Gene Ontology database and KEGG database were used for GO annotations and Pathway annotations of target genes, respectively.
RESULTS: A total of 940 miRNAs were identified and among them 91 were differentially expressed (P < 0.05, fold change ≥ 2), including 45 up-regulated and 46 down-regulated ones in MIA-PaCa2 (TIChigh). Twenty-one miRNAs were validated by real-time PCR, and the results for 19 miRNAs were consistent with those of chip detection. 2 895 target genes were predicted for 91 differentially expressed miRNAs, and these genes were mainly involved in events, such as axon guidance, angiogenesis, and post-translational protein modification, and in pathways such as cancer, focal adhesion, Hedgehog signaling pathway, and MAPK signaling pathway.
CONCLUSION: Many differentially expressed miRNAs in pancreatic cancer stem cells have been identified, and their target genes are involved in a variety of biological events and in multiple signal pathways. These differentially expressed miRNAs may become new therapeutic targets for pancreatic cancer.
- Citation: Jiang JX, Gao S, Wang M, Li X, Sun CY. Identification of differentially expressed microRNAs in pancreatic cancer stem cells. Shijie Huaren Xiaohua Zazhi 2012; 20(34): 3354-3360
- URL: https://www.wjgnet.com/1009-3079/full/v20/i34/3354.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i34.3354
胰腺癌是高度恶性、预后最差的恶性肿瘤之一, 5年生存率不到5%[1]. 大多数患者因确诊时伴有局部和/或远处的侵袭、转移而丧失手术时机[2]; 即使临床手术根治性切除的胰腺癌患者术后也大多数因出现复发和远处转移预后极差, 其原因为术前就有微转移灶形成及其化疗抵抗[3]; 胰腺癌的早期转移、对传统的治疗抵抗以及较易复发是其致死的关键因素. 肿瘤干细胞理论解释了上述现象. 胰腺癌干细胞研究表明[4]: 在原发肿瘤里存在一个亚群细胞, 这群细胞具有自我更新、分化潜能以及在异位重新成瘤能力; 同时, 这群细胞还具有侵袭转移和化疗抵抗特性. 最新的研究表明: 胰腺癌在形成之前通过上皮-间质转化(epithelial-to-mesenchymal transition, EMT)形成胰腺癌干细胞, 是其早期发生转移, 治疗抵抗, 复发的根本原因[5]. microRNA/miRNA在肿瘤干细胞的"干性"相关基因调控方面发挥重要作用, 被称为干细胞miRNAs(stem cells miRNAs)[6]. 已有的研究表明: 具有CD44+/CD24-表型的胰腺癌细胞具有肿瘤干细胞特性, 胰腺癌细胞系MIA-PaCa2的CD44+/CD24-表达率95.5%, 而BxPc-3的表达率17.5%. 因此, MIA-PaCa2(TIChigh)与BxPc-3(TIClow)可以直接作为研究胰腺癌干细胞的工具细胞, 不需要进一步富集[7]. 本研究采用miRNA芯片技术, 以MIA-PaCa2(TIChigh)和BxPc-3(TIClow)为研究对象, 筛选胰腺癌干细胞相关的miRNAs, 并对其进行生物信息学分析, 为进一步研究胰腺癌干细胞的发生和调控机制, 寻找新的治疗靶点奠定基础.
人胰腺癌细胞株BxPc-3(TIClow)和MIA-PaCa2(TIChigh)由本室保存; 细胞培养按照文献[8,9]采用DMEM培养基(Gibico公司), 含10%的56 ℃热灭活胎牛血清, 25 mmol/L HEPES, 2 mmol/L L-谷氨酰胺, 青霉素50 U/mL及链霉素50 µg/mL.
1.2.1 RNA抽提、纯化和质检: 采用mirVanaTM miRNA Isolation Kit(Ambion, Austin, TX, USA)(专用于抽提普通组织、细胞的miRNA)并且根据生产厂商提供的标准操作流程进行样品总的RNA抽提, 抽提所得总RNA经Agilent Bioanalyzer 2100(Agilent technologies, Santa Clara, CA, USA)电泳质检合格后备用.
1.2.2 miRNA芯片杂交、清洗、扫描及数据提取(由上海生物芯片工程有限公司完成): 按Agilent公司建议的方法与程序操作. 将符合芯片分析质量标准的总RNA样品用Cy3标记(miRNA Complete Labeling and Hyb Kit), 然后与Agilent人类miRNA芯片[Agilent human miRNA (8*15K) V12 Kit]55 ℃, 20 r/min, 滚动杂交20 h. 杂交后的芯片清洗扫描, 洗片所用的试剂为Gene Expression Wash Buffer Kit(Agilent technologies, USA), 芯片结果采用Agilent Microarray Scanner(Agilent technologies, USA)进行扫描, 用Feature Extraction software 10.7(Agilent technologies, USA)读取数据, 软件设置Scan resolution = 5 μm, PMT 100%, 5%采用Gene Spring Software 11.0(Agilent technologies, USA)进行归一化处理, 所用的算法为Quantile, 杂交信号以数据形式输出. 差异miRNA使用了limma进行显著性水平的计算, 设置参数P<0.05, fold change≥2[foldchange = Signal MIA-PaCa2(TIChigh)/Signal BxPc-3(TIClow)].
1.2.3 SYBR Green荧光定量PCR验证部分差异microRNAs: 引物设计(由上海生物芯片工程有限公司设计)(表1), U6作为单拷贝基因对照, 引物序列由上海英骏生物技术有限公司合成. 总RNA提取如上述所示, miScript Reverse Transcription Kit和miScript SYBR® Green PCR Kit(Qiagen, Hilden, Germany)按试剂盒操作说明书在ABI Prism 7900 Real-Time PCR system(Applied Biosystems)进行.
| miRNAs | 引物 |
| U6 | ttcgtgaagcgttccatatttt |
| hsa-miR-125b | tccctgagaccctaacttgtga |
| hsa-miR-126 | tcgtaccgtgagtaataatgcg |
| hsa-miR-1290 | tggatttttggatcaggga |
| hsa-miR-140-3p | taccacagggtagaaccacgg |
| hsa-miR-140-5p | cagtggttttaccctatggtag |
| hsa-miR-148a | tcagtgcactacagaactttgt |
| hsa-miR-181a | acattcaacgctgtcggtgagt |
| hsa-miR-181b | aacattcattgctgtcggtgg |
| hsa-miR-195 | tagcagcacagaaatattggc |
| hsa-miR-23b | atcacattgccagggattacc |
| hsa-miR-27b | ttcacagtggctaagttctgc |
| hsa-miR-30a* | ctttcagtcggatgtttgcag |
| hsa-miR-362-5p | aatccttggaacctaggtgtgagt |
| hsa-miR-455-3p | gcagtccatgggcatatacac |
| hsa-miR-532-5p | catgccttgagtgtaggacc |
| hsa-miR-584 | ttatggtttgcctgggactgag |
| hsa-miR-625 | gcagggggaaagttctatagtcc |
| hsa-miR-660 | tacccattgcatatcggagttg |
| hsa-miR-744 | tgcggggctagggctaac |
| hsa-miR-10a | taccctgtagatccgaatttgtg |
| hsa-miR-10b | taccctgtagaaccgaatttgtg |
1.2.4 生物信息学分析: (1)差异microRNA靶基因预测: 基于Sanger数据库对差异microRNA进行靶基因预测; (2)功能分析(GO-Analysis): 将上述差异microRNA预测的靶基因基于Gene Ontology数据库进行GO注释, 得到基因参与的所有的GO; (3)信号转导通路分析(Pathway-Analysis): 将上述差异microRNA预测的靶基因基于KEGG数据库进行Pathway注释, 得到差异基因所参与的所有的Pathway.
统计学处理 数据用mean±SD表示, 应用SPSS17.0统计软件分析, 基因芯片分析进行t检验.
所抽提的总RNA, 经分光光度计检测A260/280的吸光度, 确定样品的浓度和纯度; 运用Agilent 2100系统进行电泳质检. 经测定, RNA的A260/280比值介于2.03-2.09, 18S、28S电泳条带清晰, 28S条带无明显降解; RNA完整性评分(RNA integrity number)介于8.7-9.3, RNA样品平均浓度>60 mg/L, 总RNA质量完好, 结果合格, 可以进行芯片实验.
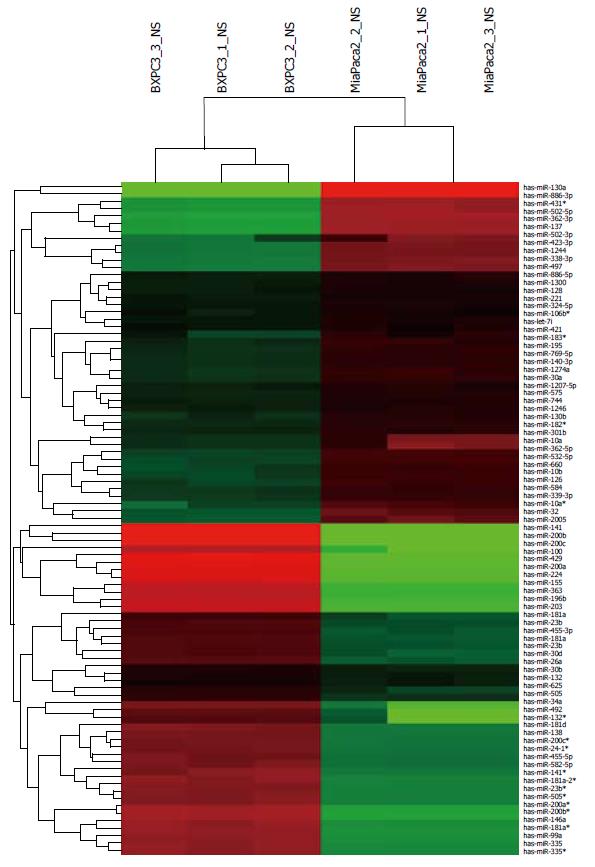
miRNA芯片杂交代表性图像显示荧光信号分布均匀, 信号点饱满, 背景较低, 杂交效果理想(图1). 将芯片扫描图像导入Feature Extraction software 10.7读取数据, 从中共鉴定到940个miRNAs, 将数据导人Gene Spring Software 11.0分析, 得到差异表达miRNAs 91个(P<0.05, fold change≥2), 其中MIA-PaCa2(TIChigh)中下调表达45个, 上调表达46个. 聚类分析MIA-PaCa2(TIChigh)与BxPc-3(TIClow)差异表达miRNAs(图2). 荧光定量PCR验证21条差异microRNAs, 其中hsa-miR-195、hsa-miR-1290与芯片结果不相符, 其余19条均与芯片结果相符(表2).
| Sample Name | Average Ct | ΔCt | 2 -ΔCt* | ||||
| BXPC3 | Miapaca2 | BXPC3 | Miapaca2 | BXPC3 | Miapaca2 | ||
| U6 | 24.54 | 23.59 | |||||
| hsa-miR-126 | 26.85 | 24.38 | 2.31 | 0.78 | 0.20 | 0.58 | |
| hsa-miR-140-3p | 27.76 | 25.68 | 3.22 | 2.09 | 0.11 | 0.24 | |
| hsa-miR-140-5p | 31.90 | 29.81 | 7.36 | 6.22 | 0.006 | 0.013 | |
| hsa-miR-30a* | 23.99 | 22.54 | -0.60 | -1.06 | 1.46 | 2.08 | |
| hsa-miR-532-5p | 29.01 | 26.33 | 4.46 | 2.74 | 0.05 | 0.15 | |
| hsa-miR-584 | 29.33 | 26.92 | 4.79 | 3.33 | 0.04 | 0.10 | |
| hsa-miR-660 | 27.25 | 24.67 | 2.71 | 1.07 | 0.15 | 0.48 | |
| hsa-miR-744 | 24.34 | 22.98 | -0.20 | -0.61 | 1.15 | 1.53 | |
| hsa-miR362-5p | 28.11 | 24.76 | 3.57 | 1.17 | 0.08 | 0.45 | |
| hsa-mir-10a | 25.62 | 23.67 | 1.08 | 0.08 | 0.47 | 0.95 | |
| hsa-mir-10b | 27.03 | 24.03 | 2.47 | 0.43 | 0.18 | 0.74 | |
| hsa-miR1290 | 20.61 | 20.22 | -3.93 | -3.37 | 15.24 | 10.35 | |
| hsa-miR455-3p | 23.42 | 27.15 | -1.12 | 3.56 | 2.17 | 0.08 | |
| hsa-mir-125b | 24.00 | 28.22 | -0.55 | 4.63 | 1.46 | 0.04 | |
| hsa-miR-148a | 25.64 | 29.18 | 1.09 | 5.59 | 0.47 | 0.02 | |
| hsa-miR-181a | 22.08 | 25.29 | -2.46 | 1.70 | 5.51 | 0.31 | |
| hsa-miR-181b | 21.84 | 24.72 | -2.71 | 1.13 | 6.53 | 0.45 | |
| hsa-miR-195 | 23.47 | 23.20 | -1.07 | -0.39 | 2.10 | 1.31 | |
| hsa-miR-23b | 19.05 | 21.07 | -5.50 | -2.52 | 45.20 | 5.74 | |
| hsa-miR-27b | 21.64 | 25.95 | -2.90 | 2.35 | 7.47 | 0.20 | |
| hsa-miR-625 | 25.35 | 27.51 | 0.80 | 3.92 | 0.57 | 0.07 | |
基于Sanger数据库对差异microRNAs进行靶基因预测, 共得到2 895个靶基因; 将上述差异microRNA预测的靶基因基于Gene Ontology数据库进行GO注释, 并进行了生物学功能分类与整合, 其中主要涉及轴突导向(axon guidance)、血管发生(angiogenesis)、转录后蛋白修饰、小分子代谢过程、O-连寡糖过程(O-glycan processing)、胰岛素受体信号转导途径、对缺氧的反应、信号转导、对药物反应等. 将上述差异microRNA预测的靶基因基于KEGG数据库进行Pathway注释, 其中主要涉及癌症途径(pathways in cancer)、细胞-基质黏附途径(focal adhesion)、Hedgehog信号途径、MAPK信号途径、O-连寡糖生物合成、胰岛素信号通路、胞吞作用、黏附连接、细胞外基质受体相互作用、类固醇激素生物合成等信号通路.
肿瘤发起细胞, 又称肿瘤干细胞, 具有成瘤、侵袭转移及治疗抵抗作用[10]. 新近的研究表明: 胰腺癌在形成之前, 源于具有潜在癌变分子基础的上皮细胞(如: PanIN2和3级中胰腺上皮细胞), 在各种因素的作用(如慢性胰腺炎)下发生EMT, 导致细胞内相关基因发生重新编程, 获得侵袭转移能力和肿瘤干细胞的特性, 形成胰腺癌干细胞[5]. Kallifatidis等[7]从胰腺癌细胞标志分子CD44(+)/CD24(-), CD44(+)/CD24(+)或CD44(+)/CD133(+)的表达与裸鼠成瘤能力、分化程度、克隆性生长、肿瘤微球体形成、ALDH活性以及治疗抵抗等肿瘤干细胞特性的关系进行系列研究, 认为具有CD44+/CD24-表型的胰腺癌细胞具有肿瘤干细胞特性; 胰腺癌细胞系MIA-PaCa2的CD44+/CD24-表达率95.5%, 而BxPc-3的表达率17.5%; 并认为MIA-PaCa2(TIChigh)与BxPc-3(TIClow)可以直接作为研究胰腺癌干细胞的工具细胞, 不需要进一步富集. 因此, 本研究基于上述研究基础, 直接以MIA-PaCa2(TIChigh)与BxPc-3(TIClow)作为研究胰腺癌干细胞的工具细胞, 未做CD44(+)/CD24(-)标志物筛选.
microRNA/miRNA为22个左右核苷酸的小分子RNA, 具有强大的调节功能, 成为当前研究的热点. miRNA与目的基因3'非编码区(3'UTR)结合降解mRNA和抑制其翻译, 控制着细胞的分化、增殖和凋亡等生命活动, 与肿瘤的发生、发展密切相关[11]; miRNA在肿瘤干细胞的"干性"相关基因和信号通路调控方面发挥重要作用, 被称为Stem Cells miRNAs[6]. 例如: miR-135a和miR-135b在结肠腺瘤和腺癌中表达上调, 他们调控APC基因的表达, 参与Wnt信号通路的激活, 在结肠癌干细胞中发挥重要作用[12]. let-7在乳腺癌干细胞中表达缺失, 导致他负性调控的HMGA2基因高表达, 而后者对于乳腺癌干细胞的自我更新发挥重要作用[13]. miR-34族在胰腺癌中低表达, 他们通过靶向Bcl-2、HMGA2和Notch信号通路在胰腺癌干细胞中起抑制作用[14]. 我们的研究基于上述研究观点, 采用miRNA芯片技术分析MIA-PaCa2(TIChigh)与BxPc-3(TIClow)之间的显著性差异miRNAs, 这些miRNAs可能从一个侧面反映其与胰腺癌干细胞"干性"的关系.
Jung等[15]采用无血清培养法, 获得来源于人胰腺癌细胞系Capan-1和HPAC的胰腺癌干细胞微球体, 以及来源于人正常胰腺导管上皮细胞系hYGIC6的胰腺导管上皮细胞微球体, 采用miRNA芯片分析与胰腺导管上皮细胞微球体、胰腺癌干细胞微球体形成相关miRNA(与黏附培养细胞相比较), 其中14个miRNAs(包括hsa-miR-155)与胰腺癌和胰腺导管上皮细胞的微球体形成均相关, 22个miRNAs只与胰腺癌的微球体形成相关. 我们的芯片研究显示: 与BxPc-3(TIClow)比较, 在MIA-PaCa2(TIChigh)中, 具有显著性差异且差异倍数在2倍及以上的miRNAs 91个, 其中上调表达46个, 下调表达45个. 我们进一步采用荧光定量PCR验证21条差异microRNAs, 其中hsa-miR-195、hsa-miR-1290与芯片结果不相符, 其余19条均与芯片结果相符, 表明实验芯片结果基本可靠. 我们结果与Jung等研究比较发现,与胰腺癌干细胞相关的hsa-miR-155、hsa-miR-100、hsa-miR-99a、hsa-miR-125b、hsa-miR-625、hsa-miR-195均下调, 检测结果一致, 这表明他们在不同细胞系来源的胰腺癌干细胞中均发挥调控作用, 更有研究价值. 此外, Ji等[14]研究表明, hsa-miR-34a在BxPc-3(TIClow)和MIA-PaCa2(TIChigh)中表达均较低, 但在后者比前表达更低, 几乎无表达, 再表达miR-34a能抑制MIA-PaCa2的肿瘤干细胞系列功能, 包括显著抑制其克隆性生长, 诱导凋亡, 抑制细胞周期G1和G2/M, 抑制细胞侵袭转移能力, 增加放化疗敏感性. 我们的芯片结果与上述检测一致, 这也从一个侧面表明, 我们的芯片结果检测可靠性和研究的重要意义, 因此, 对这些显著性差异miRNAs在胰腺癌干细胞中的调控功能研究是接下来我们的研究重点. 文献报道表明: miR-100在大多数肿瘤中表达下调. 在宫颈癌、卵巢癌中miR-100表达下调与其分期、淋巴结转移、较差的预后相关[16,17], 他通过转录后调控Polo样激酶1(polo-like kinase 1, PLK1)的表达在卵巢癌中起肿瘤抑制作用. 在头颈部鳞癌中表达下调, 外源性导入miR-100到HNSCC细胞系, 能抑制细胞的增殖和侵袭转移能力, 促进细胞凋亡, 其机制是负性调控胰岛素样生长因子受体1(Insulin-like growth factor 1 receptor, IGF1R)和mTOR基因[18]; 在肝癌发生的多阶段分析中发现, miR-100的表达下调和其靶基因PLK1的表达上调是肝癌发生的早期事件[19]; miR-100通过靶向PLK1基因能增敏多西他赛耐药肺腺癌细胞的化疗[20]; 然而, 在胃癌中miR-100表达上调[21]; 在胰腺癌[22-24]miR-100较癌旁的正常胰腺组织显著高表达, 经治疗后, 其血浆表达水平显著下调, 这些研究表明: miR-100在许多恶性肿瘤, 包括胰腺癌的发生和维持胰腺癌的"无限增殖分化的癌性"方面可能起重要作用. Mueller等[25]发现, 胰腺癌干细胞的mTOR信号通道异常活跃, 雷帕霉素是mTOR的抑制物, 阻断该信号通道可以抑制部分胰腺癌干细胞. 因此, miR-100负性调控"干性"mTOR基因可能与胰腺癌干细胞的发生机制相关, 其在胰腺癌中的表达下调, 导致mTOR信号通道异常激活, 虽然抑制了胰腺癌的肿瘤性生长, 但也选择性的维持了胰腺癌干细胞的生存, 导致胰腺癌患者的放化疗抵抗、复发和远处转移. 此外, 我们还采用Agilent人全基因4×44K芯片检测了MIA-PaCa2(TIChigh)与BxPc-3(TIClow)之间的显著性差异mRNAs也发现, miR-100靶向负性调控的mTOR在前者表达上调(数据未显示). 这些研究表明上述筛选的差异miR-100与胰腺癌干细胞的"干性"相关, 也从一个侧面提示上述筛选的差异miRNAs可能参与胰腺癌干细胞的"干性", 有深入研究的价值.
miRNAs作为新的治疗靶点主要优点就是调控多个基因和信号通路[26], 而siRNA则是通过特异的序列作用于单个靶基因. 因此, 对miRNAs调控靶基因及其信号通路的生物信息学分析尤为重要. 基于Sanger数据库对差异microRNA进行靶基因预测是常用的预测microRNA靶基因方法, Sanger数据库即miRBase, 他是整合了microCosm、TargetScan和Pictar 3个数据库, 我们选用了TargetScan 6.0数据库进行靶基因预测共得到2 895条靶基因, 将上述差异microRNA预测的靶基因基于Gene Ontology数据库进行GO注释, 并进行了生物学功能分类与整合, 使我们了解这些microRNA在整体水平发挥的主要生物学功能, 我们的分析结果显示他们主要涉及轴突导向、血管发生、转录后蛋白修饰等. 信号通路的研究一直是研究生物学功能的机制及设计药物治疗靶点的主要方法, 我们将上述差异microRNA预测的靶基因基于KEGG数据库进行Pathway注释, 其中主要涉及癌症途径、细胞-基质黏附途径、Hedgehog信号途径、MAPK信号途径等, 对这些信号通路在胰腺癌干细胞的"干性"中的作用深入研究, 有望发现新的胰腺癌干细胞发生机制.
总之, 我们通过芯片技术筛选了91条与胰腺癌干细胞相关的miRNAs, 并对他们进行了生物信息学分析, 这些miRNAs及其靶向的基因和信号通路可能涉及调控胰腺癌干细胞的各种生物学特性, 进一步对他们的生物学功能和调控机制进行研究, 并结合全基因组学及蛋白组学方法, 有助于从整体上分析胰腺癌干细胞的发生机制, 寻找并设计新的治疗靶点.
胰腺癌进展快、预后差的主要原因是其早期转移、对传统的治疗抵抗以及较易复发. 当前的研究表明胰腺癌干细胞是上述现象的理论基础. microRNA/miRNA在肿瘤干细胞的"干性"相关基因调控方面发挥重要作用, 被称为干细胞miRNAs. 研究胰腺癌干细胞相关microRNAs可能有助于揭示胰腺癌干细胞发生的部分分子机制, 寻找新的治疗靶点.
高国全, 教授, 中山大学中山医学院生物化学教研室
目前关于胰腺癌干细胞相关microRNAs可见部分文献报道, 该文依据新近发表的2篇高质量文献, 采用芯片技术从一个方面来探讨胰腺癌干细胞相关microRNAs, 为后续的分子机制研究奠定基础. 芯片技术在差异microRNAs筛选方面具有独特的优势.
Kallifatidis等研究, 认为具有CD44+/CD24-表型的胰腺癌细胞具有肿瘤干细胞特性; 胰腺癌细胞系MIA-PaCa2的CD44+/CD24-表达率为95.5%, 而BxPc-3的表达率为17.5%; 并认为MIA-PaCa2(TIChigh)与BxPc-3 (TIClow)可以直接作为研究胰腺癌干细胞的工具细胞.
目前关于采用胰腺癌细胞系TIChigh与TIClow作为研究胰腺癌干细胞的工具细胞, 采用miRNA芯片分析胰腺癌干细胞相关的miRNA尚未见报道. 本研究结合文献研究有助于发现新的胰腺癌干细胞相关的miRNA.
本研究筛选的miR-100在许多恶性肿瘤, 包括胰腺癌的发生和维持胰腺癌的"无限增殖分化的癌性"方面可能起重要作用. 通过生物信息学分析, miR-100可负性调控"干性"mTOR基因, 深入研究miR-100靶向"干性"mTOR基因在胰腺癌干细胞中的作用机制具有一定价值.
本文选题较为新颖, 研究方法合理, 对胰腺癌干细胞相关microRNAs的探讨具有一定的意义.
编辑: 翟欢欢 电编:闫晋利
| 1. | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012. CA Cancer J Clin. 2012;62:10-29. [PubMed] [DOI] |
| 2. | Tuveson DA, Neoptolemos JP. Understanding metastasis in pancreatic cancer: a call for new clinical approaches. Cell. 2012;148:21-23. [PubMed] [DOI] |
| 3. | Lim KH, Chung E, Khan A, Cao D, Linehan D, Ben-Josef E, Wang-Gillam A. Neoadjuvant therapy of pancreatic cancer: the emerging paradigm? Oncologist. 2012;17:192-200. [PubMed] [DOI] |
| 4. | Rasheed ZA, Matsui W. Biological and clinical relevance of stem cells in pancreatic adenocarcinoma. J Gastroenterol Hepatol. 2012;27 Suppl 2:15-18. [PubMed] [DOI] |
| 5. | Rhim AD, Mirek ET, Aiello NM, Maitra A, Bailey JM, McAllister F, Reichert M, Beatty GL, Rustgi AK, Vonderheide RH. EMT and dissemination precede pancreatic tumor formation. Cell. 2012;148:349-361. [PubMed] [DOI] |
| 6. | DeSano JT, Xu L. MicroRNA regulation of cancer stem cells and therapeutic implications. AAPS J. 2009;11:682-692. [PubMed] [DOI] |
| 7. | Kallifatidis G, Rausch V, Baumann B, Apel A, Beckermann BM, Groth A, Mattern J, Li Z, Kolb A, Moldenhauer G. Sulforaphane targets pancreatic tumour-initiating cells by NF-kappaB-induced antiapoptotic signalling. Gut. 2009;58:949-963. [PubMed] [DOI] |
| 8. | Rausch V, Liu L, Kallifatidis G, Baumann B, Mattern J, Gladkich J, Wirth T, Schemmer P, Büchler MW, Zöller M. Synergistic activity of sorafenib and sulforaphane abolishes pancreatic cancer stem cell characteristics. Cancer Res. 2010;70:5004-5013. [PubMed] [DOI] |
| 9. | Zhang C, Kolb A, Büchler P, Cato AC, Mattern J, Rittgen W, Edler L, Debatin KM, Büchler MW, Friess H. Corticosteroid co-treatment induces resistance to chemotherapy in surgical resections, xenografts and established cell lines of pancreatic cancer. BMC Cancer. 2006;6:61. [PubMed] [DOI] |
| 10. | Cioffi M, Dorado J, Baeuerle PA, Heeschen C. EpCAM/CD3-Bispecific T-cell engaging antibody MT110 eliminates primary human pancreatic cancer stem cells. Clin Cancer Res. 2012;18:465-474. [PubMed] [DOI] |
| 11. | Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell. 2004;116:281-297. [PubMed] [DOI] |
| 12. | Nagel R, le Sage C, Diosdado B, van der Waal M, Oude Vrielink JA, Bolijn A, Meijer GA, Agami R. Regulation of the adenomatous polyposis coli gene by the miR-135 family in colorectal cancer. Cancer Res. 2008;68:5795-5802. [PubMed] [DOI] |
| 13. | Yu F, Yao H, Zhu P, Zhang X, Pan Q, Gong C, Huang Y, Hu X, Su F, Lieberman J. let-7 regulates self renewal and tumorigenicity of breast cancer cells. Cell. 2007;131:1109-1123. [PubMed] [DOI] |
| 14. | Ji Q, Hao X, Zhang M, Tang W, Yang M, Li L, Xiang D, Desano JT, Bommer GT, Fan D. MicroRNA miR-34 inhibits human pancreatic cancer tumor-initiating cells. PLoS One. 2009;4:e6816. [PubMed] [DOI] |
| 15. | Jung DE, Wen J, Oh T, Song SY. Differentially expressed microRNAs in pancreatic cancer stem cells. Pancreas. 2011;40:1180-1187. [PubMed] [DOI] |
| 16. | Huang L, Lin JX, Yu YH, Zhang MY, Wang HY, Zheng M. Downregulation of six microRNAs is associated with advanced stage, lymph node metastasis and poor prognosis in small cell carcinoma of the cervix. PLoS One. 2012;7:e33762. [PubMed] [DOI] |
| 17. | Peng DX, Luo M, Qiu LW, He YL, Wang XF. Prognostic implications of microRNA-100 and its functional roles in human epithelial ovarian cancer. Oncol Rep. 2012;27:1238-1244. [PubMed] |
| 18. | Chen Z, Jin Y, Yu D, Wang A, Mahjabeen I, Wang C, Liu X, Zhou X. Down-regulation of the microRNA-99 family members in head and neck squamous cell carcinoma. Oral Oncol. 2012;48:686-691. [PubMed] [DOI] |
| 19. | Petrelli A, Perra A, Schernhuber K, Cargnelutti M, Salvi A, Migliore C, Ghiso E, Benetti A, Barlati S, Ledda-Columbano GM. Sequential analysis of multistage hepatocarcinogenesis reveals that miR-100 and PLK1 dysregulation is an early event maintained along tumor progression. Oncogene. 2012;31:4517-4526. [PubMed] [DOI] |
| 20. | Feng B, Wang R, Chen LB. MiR-100 resensitizes docetaxel-resistant human lung adenocarcinoma cells (SPC-A1) to docetaxel by targeting Plk1. Cancer Lett. 2012;317:184-191. [PubMed] [DOI] |
| 21. | Ueda T, Volinia S, Okumura H, Shimizu M, Taccioli C, Rossi S, Alder H, Liu CG, Oue N, Yasui W. Relation between microRNA expression and progression and prognosis of gastric cancer: a microRNA expression analysis. Lancet Oncol. 2010;11:136-146. [PubMed] [DOI] |
| 22. | Bloomston M, Frankel WL, Petrocca F, Volinia S, Alder H, Hagan JP, Liu CG, Bhatt D, Taccioli C, Croce CM. MicroRNA expression patterns to differentiate pancreatic adenocarcinoma from normal pancreas and chronic pancreatitis. JAMA. 2007;297:1901-1908. [PubMed] [DOI] |
| 23. | LaConti JJ, Shivapurkar N, Preet A, Deslattes Mays A, Peran I, Kim SE, Marshall JL, Riegel AT, Wellstein A. Tissue and serum microRNAs in the Kras(G12D) transgenic animal model and in patients with pancreatic cancer. PLoS One. 2011;6:e20687. [PubMed] [DOI] |
| 24. | Panarelli NC, Chen YT, Zhou XK, Kitabayashi N, Yantiss RK. MicroRNA expression aids the preoperative diagnosis of pancreatic ductal adenocarcinoma. Pancreas. 2012;41:685-690. [PubMed] |
| 25. | Mueller MT, Hermann PC, Witthauer J, Rubio-Viqueira B, Leicht SF, Huber S, Ellwart JW, Mustafa M, Bartenstein P, D'Haese JG. Combined targeted treatment to eliminate tumorigenic cancer stem cells in human pancreatic cancer. Gastroenterology. 2009;137:1102-1113. [PubMed] [DOI] |
| 26. | Ji Q, Hao X, Meng Y, Zhang M, Desano J, Fan D, Xu L. Restoration of tumor suppressor miR-34 inhibits human p53-mutant gastric cancer tumorspheres. BMC Cancer. 2008;8:266. [PubMed] [DOI] |