修回日期: 2012-11-08
接受日期: 2012-11-23
在线出版日期: 2012-12-08
目的: 检测C型、D型和E型腺管开口肠上皮化生胃黏膜组织中Ki67、CDX2的表达情况, 评估肠上皮化生程度(intestinal metaplasia, IM)与腺管开口形态的相关性.
方法: 应用免疫组织化学EnVision二步法检测Ki67、CDX2蛋白在452例不同腺管开口胃黏膜病变中的表达情况; 苏木素-伊红染色法评估IM的程度.
结果: 在非萎缩性胃炎胃小凹腺管开口呈B型(B型腺管开口胃炎)、萎缩性胃炎伴IM胃小凹腺管开口呈C型(C型腺管IM)、萎缩性胃炎伴IM胃小凹腺管开口呈D型(D型腺管IM)、萎缩性胃炎伴IM胃小凹腺管开口呈E型(E型腺管IM)、低级别上皮内瘤变和胃窦腺癌组织中Ki67蛋白的表达阳性率分别为16.2%、40.5%、44.0%、64.3%、71.4%和87.1%, E型腺管IM组分别与C、D组之间差别有统计学意义(P = 0.002, = 0.008), 而C与D组差异无统计学意义; 以上6组中CDX2蛋白的表达阳性率分别为21.6%、75.0%、78.6%、81.0%、80.4%和84.3%, E型腺管IM组与C、D组之间没有统计学上的差异, 但与B型腺管开口胃炎组的差异有统计学意义(P = 0.000). IM程度 E型>D型>C型, 差异有统计学意义(P = 0.000).
结论: CDX2可能与胃黏膜IM组织的微形态无关; E型腺管IM黏膜比C型、D型的Ki67表达高, IM程度重, 胃镜随访检查时应重视这些黏膜改变的活检.
引文著录: 赵燕如, 赵治国, 马军, 黄煌, 刘超, 钟亚莉, 崔静, 李振峰, 任景丽, 吴会芳, 胡桂明. Ki67、CDX2在C型、D型和E型腺管开口肠上皮化生胃黏膜组织中的差异表达. 世界华人消化杂志 2012; 20(34): 3310-3316
Revised: November 8, 2012
Accepted: November 23, 2012
Published online: December 8, 2012
AIM: To detect the expression of Ki67 and CDX2 in intestinal metaplasia (IM) among gastric mucosa appearing as type C, D or E pit pattern, and to assess the correlation between the degree of IM and the morphology of gastric pits.
METHODS: Immunohistochemistry was used to examine the expression of Ki67 and CDX2 proteins in 452 cases of gastric mucosal lesions with different pit patterns. The degree of IM was evaluated by hematoxylin and eosin staining.
RESULTS: The positive rates of Ki67 in non-atrophic gastritis (NAG) appearing as type B pit pattern (BG), atrophic gastritis (AG) with IM appearing as type C pit pattern (CIM), AG with IM appearing as type D pit pattern (DIM), AG with IM appearing as type E pit pattern (EIM), low intraepithelial neoplasia (LIN), and gastric antrum adenocarcinoma (GAAC) were 16.2%, 40.5%, 44.0%, 64.3%, 71.4%, and 87.1%, respectively. The positive rate of Ki67 protein in EIM was significantly different from those in CIM and DIM (P = 0.002, 0.008), but there was no difference between CIM and DIM. The positive rates of CDX2 protein were 21.6%, 75.0%, 78.6%, 81.0%, 80.4%, and 84.3% in the above groups, respectively. The positive rate of CDX2 protein in EIM was significantly different from that in BG (P = 0.000), but not different from those in CIM and DIM. The degree of IM was significantly higher in EIM than in DIM and CIM (P = 0.000).
CONCLUSION: CDX2 may have no relationship with micromorphology of IM in gastric mucosa. The expression of Ki67 protein and the degree of IM in EIM were higher than those in CIM and DIM.
- Citation: Zhao YR, Zhao ZG, Ma J, Huang H, Liu C, Zhong YL, Cui J, Li ZF, Ren JL, Wu HF, Hu GM. Differential expression of Ki67 and CDX2 proteins in intestinal metaplasia among gastric mucosa appearing as type C, D, or E pit pattern. Shijie Huaren Xiaohua Zazhi 2012; 20(34): 3310-3316
- URL: https://www.wjgnet.com/1009-3079/full/v20/i34/3310.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i34.3310
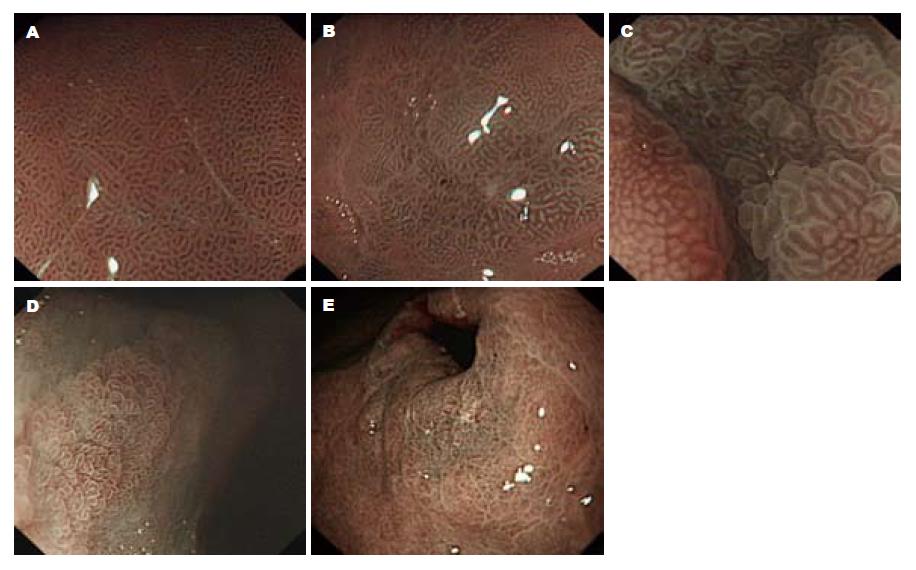
肠上皮化生(intestinal metaplasia, IM)被认为是胃癌发展过程中的关键阶段, 与肠型胃癌关系密切, 近年来随着高清晰放大胃镜及窄带成像技术(narrow band imaging, NBI)的临床应用, 胃黏膜的表面结构、黏膜表面的微细腺管开口特点及微血管形态能够清晰地显示[1-4], 这使得内镜下诊断IM已成为可能. 本文主要针对NBI放大胃镜下IM黏膜的不同微形态对IM进行分类研究, 比较不同胃窦腺管开口的IM黏膜中增殖因子Ki67及肠化因子CDX2的表达情况, 判断哪种类型小凹的增殖活性高, 从而为临床随访、胃镜直视下靶向活检提供依据. 本文根据胃小凹腺管开口形态将IM黏膜分为: 萎缩性胃炎伴IM胃小凹腺管开口呈C型(简称C型腺管IM)、萎缩性胃炎伴IM胃小凹腺管开口呈D型(简称D型腺管IM)和萎缩性胃炎伴IM胃小凹腺管开口呈E型(简称E型腺管IM)(图1). 其中胃黏膜小凹开口形态分型参照Sakaki标准[5]: A型: 圆点状小凹; B型: 短小棒状或管状小凹; C型: 树枝状或条纹状小凹; D型: 斑块状或脑回状小凹; E型: 绒毛状小凹.
回顾性搜集、分析我院消化内镜中心2009-06/2012-06胃镜图像, 呈C型、D型和E型腺管开口的各84例, 病理诊断均为萎缩性胃炎伴IM, 并且有完整、清晰的NBI放大胃镜资料, 其中男135例, 女117例, 年龄20-80岁, 中位年龄46.3岁. 为便于比较, 我们又选择了非萎缩性胃炎74例(腺管开口呈B型), 低级别上皮内瘤变(low intraepithelial neoplasia, LIN)56例, 胃窦腺癌(gastric antrum adenocarcinoma, GAAC)70例(15例高分化腺癌, 36例中等分化腺癌, 19例高-中分化混合型). 所有胃镜图像均由3名经验丰富的胃镜医师对胃黏膜腺管开口进行分型分组, 至少2名医师分型一致才能确定为某型; 在病理科找到相应的胃黏膜活检原始组织蜡块重新切片分别做苏木素-伊红(HE)染色和免疫组织化学检查. 幽门螺旋杆菌(Helicobacter pylori, H. pylori)检测结果来源于原始胃镜档案(快速尿素酶法, 检测试纸购自上海凯创生物技术有限公司). 所用胃镜设备为日本东京Olympus公司生产, 型号如下: 主机CV-260SL, 光源为CLV-260SL, 内镜为H260AZI; 兔抗人CDX2单克隆抗体(1:450)购自英国Abcam公司; 小鼠抗人Ki67多克隆抗体(1:100)和通用型二抗及DAB显色剂均购自丹麦Dako公司.
1.2.1 免疫组织化学EnVision二步法: 严格按照EnVision试剂盒标准步骤进行. 为排除实验中的假阳性和假阴性, 按照试剂说明书Ki67、CDX2均采用结肠癌标本做阳性对照, 采用PBS代替一抗做阴性对照.
1.2.2 结果判定: 采用双盲法, 由2名经验丰富的病理学专家独立观察, 在400倍光学显微镜下观察5个视野, 每个视野计数100个细胞, 计算阳性细胞百分率, 计数相差10%以上重新计数. CDX2蛋白阳性染色部位定位于细胞核, 根据染色强度和染色面积共同评分: (1)无着色为0分, 淡黄色为1分, 棕黄色为2分, 棕褐色为3分; (2)阳性面积范围: <5%为0分, 5%-25%为1分, 26%-50%为2分, 51%-75%为3分, >75%为4分, 两项结果相加, 0-3分记为(-), ≥4分记为(+). Ki67阳性表现为细胞核呈棕黄色, 阳性细胞数≤10%为阴性(-), 阳性细胞数>10%为阳性(+).
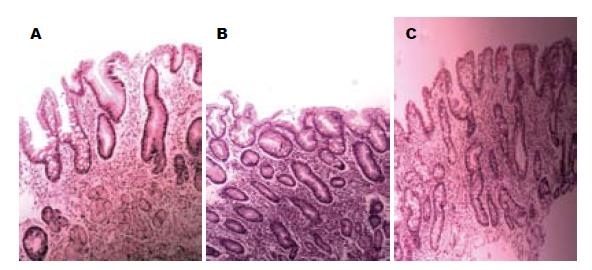
1.2.3 肠上皮化生程度分度: 参照2006年中国慢性胃炎共识意见[6], 将IM分为无、轻、中、重4度. IM部分占腺体和表面上皮总面积1/3以下者为轻度; 1/3-2/3为中度; 2/3以上为重度. 由2名胃肠病理医师分别阅读所有萎缩性胃炎伴IM的HE玻片进行IM的分度, 意见一致者为最后结果, 有争议的送病理会诊, 以会诊结果为准.
统计学处理 所有数据采用SPSS20.0统计软件进行统计学分析, 比较胃窦不同腺管开口黏膜病变中Ki67、CDX2的表达差异以及不同腺管开口黏膜病变中H. pylori感染率的差别用行列表χ2检验, 比较不同腺管开口IM黏膜的肠化程度分布用Kruskal-Wallis秩和检验, 以上两两比较时用四格表χ2检验. 统计IM程度、H. pylori感染与腺管开口形态是否相关用多分类资料的关联分析, 分别计算关联系数r. P<0.05认为差异有统计学意义.
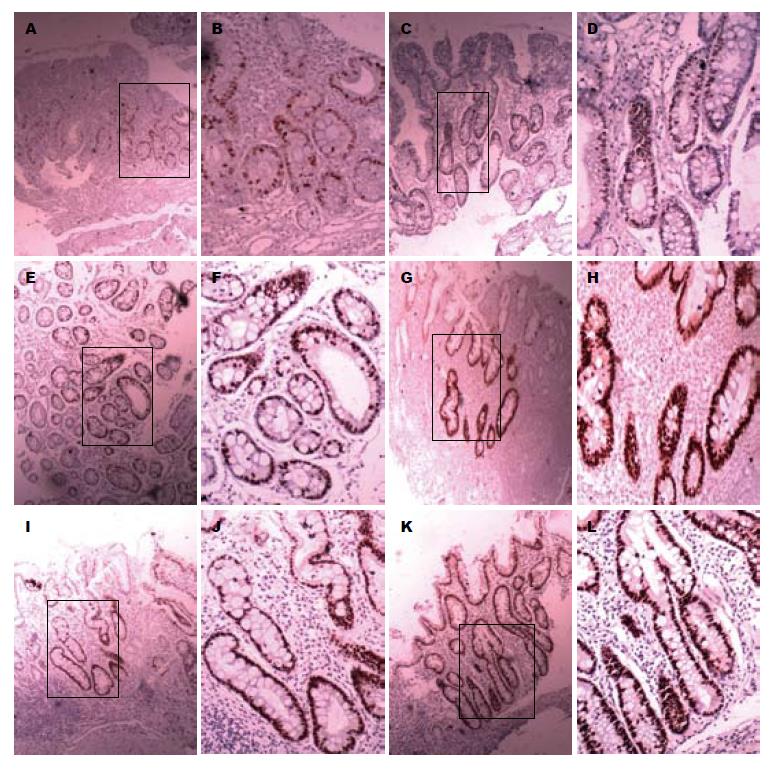
6组标本中Ki67蛋白的表达阳性率分别为16.2%、40.5%、44.0%、64.3%、71.4%和87.1%, 其中E型腺管IM与LIN组差异无统计学意义, 而与其他4组间的比较差异均有统计学意义(P<0.05); CDX2蛋白的表达阳性率依次为21.6%、75.0%、78.6%、81.0%、80.4%和84.3%, E型腺管IM与C型腺管IM、D型腺管IM、LIN、GAAC组比较差别无统计学意义, 而仅与胃炎组比较差别有统计学意义(P<0.05, 图2, 表1).
| 分组 | n | Ki67 | CDX2 | ||||||
| + | - | χ2 | P值 | + | - | χ2 | P值 | ||
| B型腺管开口胃炎 | 74 | 12 | 62 | 37.375 | 0.000 | 16 | 58 | 55.618 | 0.000 |
| C型腺管IM | 84 | 34 | 50 | 9.545 | 0.002 | 63 | 21 | 0.867 | 0.352 |
| D型腺管IM | 84 | 37 | 47 | 6.929 | 0.008 | 66 | 18 | 0.147 | 0.701 |
| E型腺管IM1 | 84 | 54 | 30 | - | - | 68 | 16 | - | - |
| LIN | 56 | 40 | 16 | 0.777 | 0.378 | 45 | 11 | 0.008 | 0.930 |
| GAAC | 70 | 61 | 9 | 10.548 | 0.001 | 59 | 11 | 0.293 | 0.588 |
结果显示(图3, 表2), C型腺管IM组有54例轻度IM, 15例中度IM和15例重度IM; D型腺管IM组有18例轻度IM, 53例中度IM和13例重度IM; 而E型腺管IM组有6例轻度IM, 18例中度IM和60例重度IM. 3组间IM程度的分布不同(H = 79.978, P<0.05), 两两比较结果差异均有统计学意义(P = 0.000, = 0.000, = 0.000). 另外将不同腺管开口形态与IM程度进行关联分析, 结果显示χ2 = 1.273E2, P<0.05, 关联系数r = 0.579.
| 分组 | 轻度 | 中度 | 重度 | 合计 |
| C型腺管IM | 54 | 15 | 15 | 84 |
| D型腺管IM | 18 | 53 | 13 | 84 |
| E型腺管IM | 6 | 18 | 60 | 84 |
| 合计 | 78 | 86 | 88 | 252 |
表3中显示, H. pylori感染阳性率在以下6组中分别为47.3%、53.6%、58.3%、82.1%、76.8%和72.9%, E型腺管IM组与B型腺管开口胃炎组、C型和D型腺管IM组的表达差异有统计学意义(P<0.05), 而与LIN、GAAC组的差异没有统计学意义. 比较H. pylori感染与腺管开口形态(B、C、D、E)的相关分析结果显示χ2 = 23.757, P<0.05, r = 0.261.
借助窄带成像放大内镜(narrow band Imaging system with magnifying endoscopy, NBI-ME)可以清晰地显示IM黏膜的腺管开口形态, 近年来越来越多的文献报道了IM黏膜的腺管开口可呈C型、D型和E型, 而不典型增生胃黏膜小凹多呈不规则或模糊不清(有研究称F型), 少部分见于E型、D型和C型[7-11]. 这些IM黏膜形态的细微差别是否存在分子生物学的不同, 目前尚未见研究报道.
CDX2是公认的肠化因子, 特异性地表达于小肠和结肠上皮中, 对调节正常生物体肠黏膜上皮细胞的分化和增殖起到关键作用[12]. 目前在胃黏膜IM和胃癌方面的研究很多, 但说法不一. CDX2在胃IM组织中表达高, 在Ⅲ型IM中的表达显著低于Ⅰ型[13,16], 因此认为其可以间接表明IM类型. CDX2在胃癌、结肠癌、食管癌的表达较IM有降低趋势, 且恶性肿瘤分化越低表达越低, 大多数学者认为CDX2有抑癌作用[14-20], 而最近的一项研究认为CDX2的表达与IM严重程度有关, 而与IM亚型无关; 其在胃窦异型增生和胃窦癌中的表达高于对照组, 而在胃体差异无统计学意义[21]. 本实验研究结果显示CDX2蛋白表达在B型腺管开口胃炎、C型、D型、E型腺管IM、LIN和GAAC中的阳性率分别为21.6%、75.0%、78.6%、81.0%、80.4%和84.3%, 与以往报道的胃癌组织中CDX2蛋白表达下调不相符, 有可能是在纳入研究对象的时候, 刻意将弥漫型胃癌排除在外的原因. 其中C、D、E 3型腺管IM黏膜CDX2的表达差异无统计学意义, 我们认为他的存在可能与胃黏膜IM组织的微形态形成无关, 不参与胃小凹腺管开口形态的变化. 此外实验中发现CDX2蛋白的表达贯穿着从胃黏膜炎症-肠化生-癌变的整个过程, 提示他参与了胃窦腺癌的癌变, 与胃癌的关系密切, 因此对高表达CDX2的IM黏膜定期随访, 有可能早期发现胃癌.
Ki67是经典的反应细胞增殖的因子, 存在于除G0期以外的细胞周期, 其表达可反映肿瘤细胞增殖活性、组织分型和核分裂指数[22-25]. 目前一致认为他在胃癌、食管癌、乳腺癌等组织中的表达高于癌旁正常组织[26-28], 但是Ki67蛋白在不同IM黏膜的微形态中的表达未见报道. 本研究结果显示, Ki67在B型腺管开口胃炎、C型腺管IM、D型腺管IM、E型腺管IM、LIN和GAAC组织中的表达呈渐进性增高, 与以往的研究结果大致相符29. 其中E型腺管IM与除LIN组外的其余4组差别有统计学意义, 而C型与D型之间差别无统计学意义. 我们推测E型腺管IM黏膜比C型、D型的增殖活性高, 发生异型增生或胃癌的可能性大, 胃镜活检时, 选取E型腺管IM黏膜进行随访, 更利于早期发现胃癌.
本研究结果还显示, IM程度在C、D、E 3组中的分布各不相同, 其中71.4%的E型腺管IM黏膜表现为重度, 63.1%的D型表现为中度, C型腺管IM黏膜中轻度IM约占64.3%, 所以我们认为E型黏膜的IM程度较C型、D型重. 相关分析结果提示IM程度与腺管开口形态有关, 这与黄永辉等[30]研究结果一致. 由此我们推测, 在胃黏膜发生IM过程中, 由于致病因素持续存在, 导致杯状细胞逐渐增多, 杯状细胞对其周围细胞及腺体周围间质产生影响, 从而使得正常胃黏膜腺体减少、扭曲, 最终产生一系列的腺管开口形态的变化. H. pylori感染率在C、D、E 3型IM中依次增高, 且E型与C型D型差异均有统计学意义. 相关分析结果也提示2者有关联, 与文献报道一致[11]. 我们猜想H. pylori可能通过某种途径参与了胃窦小凹腺管开口形态的变化, 使得胃黏膜病变严重程度增加, 最后导致癌变, 但是具体机制仍不清楚, 仍需进一步观察研究.
同时本实验有以下局限性: (1)如果增加ki67、CDX2 mRNA定量研究与本文结果一致的话, 更具说服力; (2)该研究涉及的分子生物学指标少, 如果再纳入一些IM相关指标如MUC2、MUC5AC、MUC6等可能使其更完善. 根据我们对胃镜下IM黏膜细微结构变化存在差异的初步理解设想可能存在相关分子生物学变化所设计的这项实验仅是初步探索.
胃癌是中国最常见的恶性肿瘤之一, 严重威胁人民的身体健康, 其早期诊断极为重要, 随着内镜技术的不断提高, 窄带成像放大内镜(NBI-ME)在早期胃癌的诊断中越来越受到重视. 本文通过研究NBI-ME内镜下胃黏膜细微结构改变, 试图寻找早期胃癌的特异性黏膜改变.
黄颖秋, 教授, 本溪钢铁(集团)总医院消化内科
NBI-ME内镜在胃癌诊断方面的应用价值是当前研究的热点. 通过辨别NBI-ME内镜下胃小凹腺管开口的细微差异有望早期发现胃癌.
目前已有大量研究证实放大内镜下肠上皮化生的胃黏膜的腺管开口可呈C型、D型和E型, 且E型胃小凹的肠化程度高.
本实验创新之处在于将肠上皮化生的胃黏膜进行微形态的分类, 然后结合分子生物学表达的差异来评估其增殖活性及与胃癌的关系.
本研究为临床随访、胃镜直视下靶向活检提供依据, 有利于早期发现胃癌.
胃小凹: 整个胃黏膜表面遍布不规则的点状或线状的细小凹陷称胃小凹. 胃小凹平均宽度为70 µm, 深200 µm. 胃腺即开口于胃小凹的底部. 一般1个胃小凹的底部有3-5条腺管相连, 胃小凹就是这些腺管的开口.
本文初步探讨了不同类型腺管开口肠上皮化生胃黏膜的Ki67、CDX2的表达情况, 对判断胃黏膜增殖活性, 胃镜直视下靶向活检有很好的参考价值.
编辑: 翟欢欢 电编:闫晋利
| 1. | Zhang J, Guo SB, Duan ZJ. Application of magnifying narrow-band imaging endoscopy for diagnosis of early gastric cancer and precancerous lesion. BMC Gastroenterol. 2011;11:135. [PubMed] [DOI] |
| 2. | Li HY, Ge ZZ, Fujishiro M, Li XB. Current clinical applications of magnifying endoscopy with narrow band imaging in the stomach. Diagn Ther Endosc. 2012;2012:271914. [PubMed] |
| 3. | Nass JP, Connolly SE. Current status of chromoendoscopy and narrow band imaging in colonoscopy. Clin Colon Rectal Surg. 2010;23:21-30. [PubMed] [DOI] |
| 4. | Gono K, Obi T, Yamaguchi M, Ohyama N, Machida H, Sano Y, Yoshida S, Hamamoto Y, Endo T. Appearance of enhanced tissue features in narrow-band endoscopic imaging. J Biomed Opt. 2004;9:568-577. [PubMed] [DOI] |
| 5. | Sakaki N, Iida Y, Okazaki Y, Kawamura S, Takemoto T. Magnifying endoscopic observation of the gastric mucosa, particularly in patients with atrophic gastritis. Endoscopy. 1978;10:269-274. [PubMed] [DOI] |
| 7. | Yang JM, Chen L, Fan YL, Li XH, Yu X, Fang DC. Endoscopic patterns of gastric mucosa and its clinicopathological significance. World J Gastroenterol. 2003;9:2552-2556. [PubMed] |
| 8. | 李 娜, 张 亚历, 刘 思德, 姜 泊, 潘 德寿, 智 发朝, 陈 村龙, 李 明松, 姚 永莉, 陈 烨. 放大内镜下萎缩性胃炎胃窦黏膜小凹开口形态变化及其影响因素的分析. 中华消化内镜杂志. 2008;25:201-203. |
| 12. | Zhang MQ, Lin F, Hui P, Chen ZM, Ritter JH, Wang HL. Expression of mucins, SIMA, villin, and CDX2 in small-intestinal adenocarcinoma. Am J Clin Pathol. 2007;128:808-816. [PubMed] [DOI] |
| 13. | Kang JM, Lee BH, Kim N, Lee HS, Lee HE, Park JH, Kim JS, Jung HC, Song IS. CDX1 and CDX2 expression in intestinal metaplasia, dysplasia and gastric cancer. J Korean Med Sci. 2011;26:647-653. [PubMed] [DOI] |
| 14. | Hayes S, Ahmed S, Clark P. Immunohistochemical assessment for Cdx2 expression in the Barrett metaplasia-dysplasia-adenocarcinoma sequence. J Clin Pathol. 2011;64:110-113. [PubMed] [DOI] |
| 15. | Park do Y, Srivastava A, Kim GH, Mino-Kenudson M, Deshpande V, Zukerberg LR, Song GA, Lauwers GY. CDX2 expression in the intestinal-type gastric epithelial neoplasia: frequency and significance. Mod Pathol. 2010;23:54-61. [PubMed] |
| 16. | Qin R, Wang NN, Chu J, Wang X. Expression and significance of homeodomain protein Cdx2 in gastric carcinoma and precancerous lesions. World J Gastroenterol. 2012;18:3296-3302. [PubMed] |
| 18. | Liu Q, Teh M, Ito K, Shah N, Ito Y, Yeoh KG. CDX2 expression is progressively decreased in human gastric intestinal metaplasia, dysplasia and cancer. Mod Pathol. 2007;20:1286-1297. [PubMed] [DOI] |
| 19. | Xiao ZY, Ru Y, Sun JT, Gao SG, Wang YF, Wang LD, Feng XS. Expression of CDX2 and villin in gastric cardiac intestinal metaplasia and the relation with gastric cardiac carcinogenesis. Asian Pac J Cancer Prev. 2012;13:247-250. [PubMed] [DOI] |
| 20. | Baba Y, Nosho K, Shima K, Freed E, Irahara N, Philips J, Meyerhardt JA, Hornick JL, Shivdasani RA, Fuchs CS. Relationship of CDX2 loss with molecular features and prognosis in colorectal cancer. Clin Cancer Res. 2009;15:4665-4673. [PubMed] [DOI] |
| 21. | Lee BH, Kim N, Lee HS, Kang JM, Park HK, Jo HJ, Shin CM, Lee SH, Park YS, Hwang JH. The Role of CDX2 in Intestinal Metaplasia Evaluated Using Immunohistochemistry. Gut Liver. 2012;6:71-77. [PubMed] [DOI] |
| 22. | Zheng Y, Wang L, Zhang JP, Yang JY, Zhao ZM, Zhang XY. Expression of p53, c-erbB-2 and Ki67 in intestinal metaplasia and gastric carcinoma. World J Gastroenterol. 2010;16:339-344. [PubMed] [DOI] |
| 23. | Duchrow M, Schlüter C, Key G, Kubbutat MH, Wohlenberg C, Flad HD, Gerdes J. Cell proliferation-associated nuclear antigen defined by antibody Ki-67: a new kind of cell cycle-maintaining proteins. Arch Immunol Ther Exp (Warsz). 1995;43:117-121. [PubMed] |
| 24. | Gerdes J, Lemke H, Baisch H, Wacker HH, Schwab U, Stein H. Cell cycle analysis of a cell proliferation-associated human nuclear antigen defined by the monoclonal antibody Ki-67. J Immunol. 1984;133:1710-1715. [PubMed] |
| 25. | Preusser M, Heinzl H, Gelpi E, Höftberger R, Fischer I, Pipp I, Milenkovic I, Wöhrer A, Popovici F, Wolfsberger S. Ki67 index in intracranial ependymoma: a promising histopathological candidate biomarker. Histopathology. 2008;53:39-47. [PubMed] [DOI] |
| 26. | Igarashi N, Takahashi M, Ohkubo H, Omata K, Iida R, Fujimoto S. Predictive value of Ki-67, p53 protein, and DNA content in the diagnosis of gastric carcinoma. Cancer. 1999;86:1449-1454. [DOI] |
| 27. | Forones NM, Carvalho AP, Giannotti-Filho O, Lourenço LG, Oshima CT. Cell proliferation and apoptosis in gastric cancer and intestinal metaplasia. Arq Gastroenterol. 2005;42:30-34. [PubMed] [DOI] |
| 28. | Tut VM, Braithwaite KL, Angus B, Neal DE, Lunec J, Mellon JK. Cyclin D1 expression in transitional cell carcinoma of the bladder: correlation with p53, waf1, pRb and Ki67. Br J Cancer. 2001;84:270-275. [PubMed] [DOI] |