修回日期: 2012-10-25
接受日期: 2012-11-02
在线出版日期: 2012-11-18
目的: 研究瘦素、瘦素受体(obesity receptor, OB-R)以及PI3-K/Akt信号通路在非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD) 患者体内的表达.
方法: 应用免疫组织化学方法研究30例NAFLD患者及对照组肝组织中瘦素, OB-R, PI3-K(p85)及Akt的表达以及其相关性. 同时检测空腹血糖、总胆固醇、甘油三酯、C肽和血清瘦素水平等.
结果: NAFLD患者肝组织中瘦素, OB-R和PI3-K显著高于对照组(P<0.05), 且与血清瘦素水平成正相关. NAFLD患者肝组织中Akt的表达显著低于对照组(P<0.05). 此外, PI3-K的表达与瘦素(r = 0.365, P<0.05)呈正相关, 但与Akt呈负相关(r = -0.854, P<0.01).
结论: 瘦素的过度表达不能活化NAFLD患者的Akt, 瘦素/PI3-K激活Akt的缺陷可能是NAFLD患者瘦素抵抗的一种新机制.
引文著录: 徐丹, 黄晓东, 罗和生, 袁静萍, 张姮, 吴杰. 一种新的瘦素抵抗机制: 非酒精性脂肪肝瘦素/PI3-K/Akt信号通路的激活缺陷. 世界华人消化杂志 2012; 20(32): 3095-3100
Revised: October 25, 2012
Accepted: November 2, 2012
Published online: November 18, 2012
AIM: To accurately evaluate the expression of leptin, obesity receptor (OB-R) and components of the PI3-K/Akt signaling pathway in non-alcoholic fatty liver disease (NAFLD).
METHODS: Expression of leptin, OB-R, PI3-kinase p85 (PI3-K) and phospho-Akt-kinase (PAktK) proteins were assessed by immunohistochemistry in 30 cases of NAFLD and control tissue. Correlations between the expression of these proteins were analyzed. Other parameters such as serum C-peptide, glucose, lipoprotein levels, and serum leptin were also detected.
RESULTS: In agreement with significantly elevated serum leptin level in NAFLD patients (P < 0.05), expression of leptin, OB-R and PI3-K was significant higher in NAFLD than in control tissue (all P < 0.05). In contrast, expression of PAktK was significantly down-regulated in NAFLD (P < 0.05). Moreover, PI3-K expression was significantly positively correlated with leptin (r = 0.365, P <0.05) but negatively with PAktK (r = -0.854, P < 0.01).
CONCLUSION: Overexpression of leptin seems not to necessarily lead to activation of PAktK in NAFLD, and the defective leptin/PI3-K activation of PAktK may be a novel mechanism of hepatic leptin resistance in NAFLD.
- Citation: Xu D, Huang XD, Luo HS, Yuan JP, Zhang H, Wu J. Impaired activation of phosphatidylinositol 3-kinase by leptin in NAFLD: A novel mechanism of hepatic leptin resistance. Shijie Huaren Xiaohua Zazhi 2012; 20(32): 3095-3100
- URL: https://www.wjgnet.com/1009-3079/full/v20/i32/3095.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i32.3095
非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD)包括肝细胞内的脂肪堆积、不同程度的肝脏炎症以及肝纤维化等广泛的病理改变过程. 非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)是最严重的NAFLD疾病, 是病因不明的肝硬化的最主要原因. 肥胖和胰岛素抵抗可能在NAFLD的演变过程中起重要作用[1,2], 然而NAFLD的发病机制仍不清楚. 瘦素在能量摄入和消耗中起关键的调节作用. 瘦素主要由脂肪组织产生[3], 通过与瘦素受体(obesity receptor, OB-R)结合发挥其作用[4]. OB-R信号可以调节多种细胞内信号通路, 包括JAK-STAT、MAPK以及PI3-K信号通路[5-7]. 有学者证明瘦素/PI3-K激活Akt缺陷可能是糖尿病患者瘦素抵抗的一种新机制[8]. 最近的研究表明, 2型糖尿病合并NAFLD与人类OB-R G3057A基因多态性有关[9]. 瘦素可能参与了肝脏脂肪浸润、炎症以及纤维变性的过程, 从而导致肝脏损伤[10]. 然而, 瘦素、OB-R、PI3-K以及他们下游的Akt在NAFLD的发病机制中所起的作用仍不清楚, 本研究旨在阐明其机制.
武汉市中心医院2007-05/2007-09肝胆外科收治的患者60例, 为胆囊结石(静止期)及胆囊息肉, 术前B超诊断为脂肪肝, 术中肝穿刺活组织检查证实为NAFLD 30例、正常肝脏30例. NAFLD诊断符合非酒精性脂肪性肝病诊疗指南(中华医学会肝脏病学分会脂肪肝和酒精性肝病学组修订). 上述NAFLD 30例划归为NAFLD组, 年龄38-56岁, 平均41.97岁±8.36岁; 男15例, 女15例; 30例正常肝脏划归为对照组, 年龄39-55岁, 平均43.90岁±8.35岁; 男14例, 女16例. 术中经皮肝穿刺活组织检查均征得患者同意.
1.2.1 实验室测试: 过夜禁食14 h, 于清晨空腹卧位取肘静脉血4 mL, 不抗凝, 分离血浆, -70 ℃低温冰箱保存. 全自动生化分析测定常规生化指标, 包括空腹血糖(fasting blood glucose, FBG)、总胆固醇(total cholesterol, TC)、甘油三酯(triglyceride, TG)和C肽(C-peptide).
1.2.2 血浆Lp测定: 采用放射免疫法(radioimmunoassay, RIA), 可测定范围: 0.10-100.00 ng/mL, 批间CV<8.3%, 批内CV<6.2%. 包括人瘦素标准品、人瘦素对照品、抗瘦素125I反应原、96孔人瘦素标准酶标板等. 操作按说明书进行, 各项质控指标均符合要求. 测定结果计算: 以标准品吸光度(A)值和浓度做 log-log标准曲线, 在标准曲线上查出待测标本的瘦素浓度(ng/mL) .
1.2.3 免疫组织化学方法: 将组织取出后放入4%多聚甲醛固定液, 4 ℃, 16-18 h; 脱水、透明、包埋、切片、常规脱水; 3%H2O2孵育10 min用蒸馏水冲洗, PBS浸泡, 再滴加封闭用正常血清工作液, 室温孵育10 min, 倾去; 然后分别滴加抗瘦素多克隆抗体(1:100), 抗PI3-K多克隆抗体(1:100), 抗OB-R多克隆抗体(1:100)及抗Akt多克隆抗体(1:100); 置湿盒密闭, 4 ℃过夜; 加入生物素化的抗鼠免疫球蛋白以及辣根过氧化物酶标记的链霉亲和素(1:50), 常温下作用1 h, 避光, PBS冲洗; 50%甘油封片在ZEISS显微镜下观察并照相. 应用计算机病理图像分析系统, 测定瘦素、OB-R、PI-3K(p85α)以及Akt阳性表达的平均A值, 随机测定5个高倍视野后计算平均值, 作为该切片的代表值.
统计学处理 采用SPSS11.5统计软件, 根据研究目的和数据类型不同分别进行t检验和直线相关分析, P<0.05为差异有统计学意义.
NAFLD组, 年龄38-56岁, 平均41.97岁±8.36岁; 男15例, 女15例; 30例正常肝脏划归为对照组, 年龄39岁-55岁, 平均43.90±8.35岁; 男14例, 女16例. 两组之间没有年龄和性别差异. 实验结果证明了NAFLD组和对照组的FBG、TC、TG、C肽没有统计学差异. NAFLD患者血清瘦素水平显著高于对照组, 差异具有显著性(P<0.05).
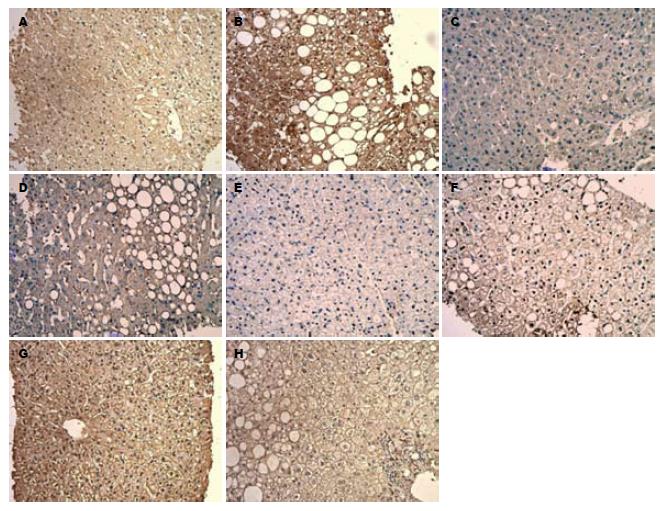
免疫组织化学结果表明瘦素、OB-R、PI3-K/Akt等主要表达于肝细胞质(图1); 同时我们观察到NAFLD患者瘦素以及PI3-K强表达于细胞核(图1A, B, E, F). 相比对照组, NAFLD患者的瘦素, OB-R以及PI3-K的表达明显增高(P<0.05), 但NAFLD患者肝组织中Akt激酶的表达显著低于对照组(P<0.05)(表1, 2). 图1显示了瘦素、OB-R、PI3-K和Akt激酶在NAFLD患者组和对照组中的表达.
| 总胆固醇(mmol/L) | 甘油三酯(mmol/L) | C肽(nmol/L) | 空腹血糖(mmol/L) | 血清瘦素(ng/mL) | |
| 对照组 | 3.97±0.63 | 1.30±0.38 | 1.78±0.34 | 5.03±0.68 | 5.55±1.96 |
| NAFLD组 | 4.11±0.85 | 1.54±0.62 | 1.73±0.29 | 5.42±0.94 | 10.90±3.39 |
| P值 | 0.446 | 0.075 | 0.505 | 0.072 | <0.05 |
| 血清瘦素(ng/mL) | 肝脏瘦素 | 瘦素受体 | PI3-K | A值 | |
| 对照组 | 5.55±1.96 | 0.29±0.03 | 0.31±0.33 | 0.25±0.05 | 0.48±0.04 |
| NAFLD组 | 10.90±3.39 | 0.47±0.09 | 0.48±0.08 | 0.45±0.08 | 0.25±0.05 |
| P值 | <0.005 | <0.05 | <0.05 | <0.05 | <0.05 |
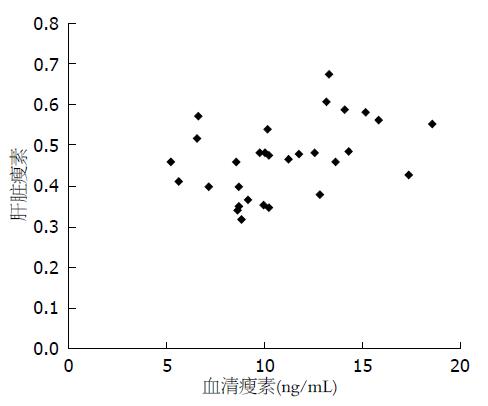
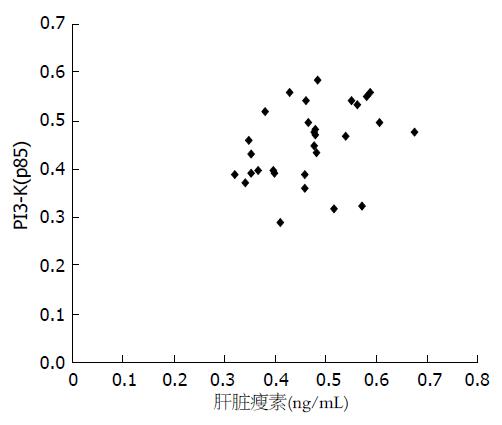
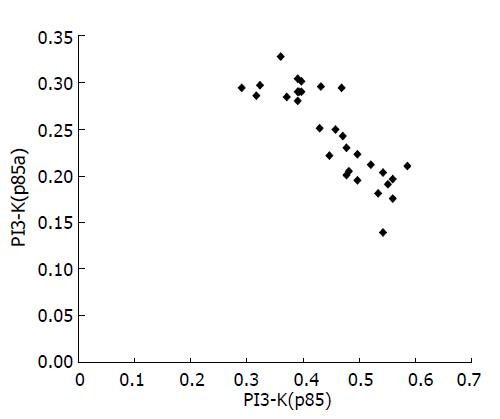
根据测得的瘦素、OB-R、PI3-K、Akt激酶的A值分析其与血清瘦素的相关性, 表明NAFLD患者血清瘦素水平与肝脏组织中瘦素的A显著正相关(r = 0.413, P<0.05, 图2). 与此同时, 我们发现NAFLD患者的瘦素和PI3-K的A值正相关(r = 0.365, P<0.05, 图3), 而NAFLD患者肝组织中PI3-K(p85a)和Akt激酶的A值负相关(r = -0.854, P<0.01, 图4).
目前NAFLD的确切发病机制仍不清楚. 有学者证明瘦素通过促进胰岛素抵抗和改变肝细胞中的胰岛素信号, 从而促进肝细胞中脂肪酸含量增加, 在肝脂肪变性发展中起着关键作用[11-13]. 最近的研究表明, 瘦素可以激活肝脏和其他组织中的PI3-K[14-18], 在下丘脑中瘦素通过PI3-K发挥作用同样得到证实[19-20].
Hegyi等[5]观察到对普通大鼠的肝脏进行瘦素灌流可以显著减少肝脏的脂肪沉积, PI-3K活性增强胰岛素受体1酪氨酸磷酸化增强, 若特异性阻断PI-3K的活性, 瘦素的作用随之消失, 但是对肥胖大鼠的肝脏进行瘦素灌流, 即使用更大剂量也不能减少肝脏的脂肪沉积, 同时观察到肥胖大鼠的肝脏瘦素不能活化PI-3K, 推测瘦素抵抗的一个可能机制是外周PI-3K的活化障碍.
NAFLD患者血清瘦素浓度增高, 可溶性OB-R降低, 存在瘦素抵抗, 瘦素抵抗会直接或间接加重NAFLD[21]. 本研究应用免疫组织化学方法研究30例NAFLD患者及对照组中瘦素、OB-R、PI3-K(p85)以及Akt的表达以及其表达的相关性. 我们发现随着NAFLD患者血清瘦素水平升高, 肝脏中的瘦素及OB-R也过量表达, 与PI3-K的表达显著正相关, 而与Akt表达显著负相关, 表明NAFLD中瘦素的过度表达不能激活Akt, 提示在NAFLD中存在瘦素/PI3-K/Akt信号通路激活缺陷.
在瘦素/PI3-K/Akt信号通路中, 瘦素通过活化酪氨酸激酶受体激活PI3-K/Akt通路. 活化的磷酸化PI3-K激活中间产物包括PI3、4P2、PI3、4和5P3, 从而进一步激活下游基因表达, 即Akt[22,23].
PI-3K是由分子量85 kDa的调解亚基(p85)和分子量110 kDa催化亚基(p110)组成的异二聚体复合物. PI-3K的p85亚基能与胰岛素受体底物(insulin receptor substrate, IRS)结合, 从而接近胰岛素受体并被锚定在细胞膜上, 进而激活p110亚基, 通过一系列信号传导调节脂肪细胞和肝细胞对葡萄糖的摄取[24,25]. p85α是p85表达最丰富的一个亚基. 过度表达的PI-3K p85亚基能够竞争性抑制p85-p110二聚体与胰岛素受体底物1(IRS-1)结合, 从而抑制PI-3K的活性[26-29]. 相反, 部分抑制p85亚基表达, 提高p85-p110二聚体/p85单体的比例可以改善PI-3K介导的胰岛素信号转导, p85α过度表达是营养诱导IR发病机制中一个早期分子步骤.
有人提出饮食诱导肥胖患者的瘦素抵抗发展与瘦素信号的缺陷有关[6]. 在本研究中我们发现随着NAFLD患者血清瘦素升高, 肝脏中的瘦素, OB-R以及PI3-K(p85)的表达增加, 与此相反, Akt的表达下降(P<0.05). 通过相关性分析, 进一步验证了NAFLD患者体内过度表达PI3-K(p85), 导致Akt表达下降, 我们推测这可能是由于自由p85和p85-p110复合物之间的失衡造成.
我们推测NAFLD患者体内瘦素增多, 瘦素与OB-R结合, 可以过度激活PI3-K, 导致Akt表达减少, 下调的Akt与NAFLD的进展相关. 因此, 瘦素/PI3-K/Akt信号通路激活缺陷可能是NAFLD的一种新的瘦素抵抗机制.
非酒精性脂肪肝(NAFLD)中瘦素可能参与了肝脏脂肪浸润, 炎症以及纤维变性过程, 从而导致肝脏损伤. 瘦素与瘦素受体(OB-R)结合可以调节多种细胞内信号通路, 包括PI3-K信号通路. 瘦素、OB-R、PI3-K以及他们下游的Akt在NAFLD发病机制中所起的作用仍不清楚,本研究旨在阐明瘦素参与NAFLD形成中可能的机制.
金山, 主任医师, 内蒙古医学院附属医院普通外科; 王铮, 副研究员, 西安交通大学医学院第一附属医院肝胆病院肝胆外科
肥胖、胰岛素抵抗以及瘦素抵抗可能在NAFLD的演变过程中起重要作用, 然而NAFLD的发病机制仍不清楚.
有学者证明瘦素/PI3-K激活Akt的缺陷可能是糖尿病患者瘦素抵抗的一种新机制, 糖尿病与NAFLD被认为是代谢障碍性疾病, 因此, 本研究推测在NAFDL中可能存在同样的机制.
本文研究了瘦素在NAFLD中可能的作用, 为瘦素作为临床治疗NAFLD提供了理论指导.
本研究对于临床NAFLD的治疗有一定指导意义.
编辑: 李军亮 电编:闫晋利
| 1. | Marchesini G, Marzocchi R, Agostini F, Bugianesi E. Nonalcoholic fatty liver disease and the metabolic syndrome. Curr Opin Lipidol. 2005;16:421-427. [PubMed] [DOI] |
| 2. | Campanati A, Ganzetti G, Sario AD, Damiani A, Sandroni L, Rosa L, Benedetti A, Offidani A. The effect of etanercept on hepatic fibrosis risk in patients with non-alcoholic fatty liver disease, metabolic syndrome, and psoriasis. J Gastroenterol. 2012; Oct 13. [Epub ahead of print]. [PubMed] [DOI] |
| 3. | Procaccini C, Galgani M, De Rosa V, Carbone F, La Rocca C, Ranucci G, Iorio R, Matarese G. Leptin: the prototypic adipocytokine and its role in NAFLD. Curr Pharm Des. 2010;16:1902-1912. [PubMed] [DOI] |
| 4. | Medici V, Ali MR, Seo S, Aoki CA, Rossaro L, Kim K, Fuller WD, Vidovszky TJ, Smith W, Jiang JX. Increased soluble leptin receptor levels in morbidly obese patients with insulin resistance and nonalcoholic fatty liver disease. Obesity (Silver Spring). 2010;18:2268-2273. [PubMed] [DOI] |
| 5. | Hegyi K, Fülöp K, Kovács K, Tóth S, Falus A. Leptin-induced signal transduction pathways. Cell Biol Int. 2004;28:159-169. [PubMed] [DOI] |
| 6. | Frühbeck G. Intracellular signalling pathways activated by leptin. Biochem J. 2006;393:7-20. [PubMed] [DOI] |
| 7. | Gorska E, Popko K, Stelmaszczyk-Emmel A, Ciepiela O, Kucharska A, Wasik M. Leptin receptors. Eur J Med Res. 2010;15 Suppl 2:50-54. [PubMed] |
| 8. | Huang W, Dedousis N, Bhatt BA, O'Doherty RM. Impaired activation of phosphatidylinositol 3-kinase by leptin is a novel mechanism of hepatic leptin resistance in diet-induced obesity. J Biol Chem. 2004;279:21695-21700. [PubMed] [DOI] |
| 9. | Lu H, Sun J, Sun L, Shu X, Xu Y, Xie D. Polymorphism of human leptin receptor gene is associated with type 2 diabetic patients complicated with non-alcoholic fatty liver disease in China. J Gastroenterol Hepatol. 2009;24:228-232. [PubMed] [DOI] |
| 10. | Carbone M, Campagnolo L, Angelico M, Tisone G, Almerighi C, Telesca C, Lenci I, Moscatelli I, Massoud R, Baiocchi L. Leptin attenuates ischemia-reperfusion injury in the rat liver. Transpl Int. 2012; Sep 13. [Epub ahead of print]. [PubMed] [DOI] |
| 11. | Kaplan LM. Leptin, obesity, and liver disease. Gastroenterology. 1998;115:997-1001. [PubMed] [DOI] |
| 12. | Machado MV, Coutinho J, Carepa F, Costa A, Proença H, Cortez-Pinto H. How adiponectin, leptin, and ghrelin orchestrate together and correlate with the severity of nonalcoholic fatty liver disease. Eur J Gastroenterol Hepatol. 2012;24:1166-1172. [PubMed] [DOI] |
| 13. | Tsuchiya H, Ikeda Y, Ebata Y, Kojima C, Katsuma R, Tsuruyama T, Sakabe T, Shomori K, Komeda N, Oshiro S. Retinoids ameliorate insulin resistance in a leptin-dependent manner in mice. Hepatology. 2012;56:1319-1330. [PubMed] [DOI] |
| 14. | Burcelin R, Kamohara S, Li J, Tannenbaum GS, Charron MJ, Friedman JM. Acute intravenous leptin infusion increases glucose turnover but not skeletal muscle glucose uptake in ob/ob mice. Diabetes. 1999;48:1264-1269. [PubMed] [DOI] |
| 15. | Zhao AZ, Shinohara MM, Huang D, Shimizu M, Eldar-Finkelman H, Krebs EG, Beavo JA, Bornfeldt KE. Leptin induces insulin-like signaling that antagonizes cAMP elevation by glucagon in hepatocytes. J Biol Chem. 2000;275:11348-11354. [PubMed] [DOI] |
| 16. | Kim YB, Uotani S, Pierroz DD, Flier JS, Kahn BB. In vivo administration of leptin activates signal transduction directly in insulin-sensitive tissues: overlapping but distinct pathways from insulin. Endocrinology. 2000;141:2328-2339. [PubMed] [DOI] |
| 17. | Anderwald C, Müller G, Koca G, Fürnsinn C, Waldhäusl W, Roden M. Short-term leptin-dependent inhibition of hepatic gluconeogenesis is mediated by insulin receptor substrate-2. Mol Endocrinol. 2002;16:1612-1628. [PubMed] [DOI] |
| 18. | Procaccini C, Lourenco EV, Matarese G, La Cava A. Leptin signaling: A key pathway in immune responses. Curr Signal Transduct Ther. 2009;4:22-30. [PubMed] [DOI] |
| 19. | Zhao AZ, Huan JN, Gupta S, Pal R, Sahu A. A phosphatidylinositol 3-kinase phosphodiesterase 3B-cyclic AMP pathway in hypothalamic action of leptin on feeding. Nat Neurosci. 2002;5:727-728. [PubMed] |
| 20. | Williams KW, Sohn JW, Donato J, Lee CE, Zhao JJ, Elmquist JK, Elias CF. The acute effects of leptin require PI3K signaling in the hypothalamic ventral premammillary nucleus. J Neurosci. 2011;31:13147-13156. [PubMed] [DOI] |
| 21. | Huang XD, Fan Y, Zhang H, Wang P, Yuan JP, Li MJ, Zhan XY. Serum leptin and soluble leptin receptor in non-alcoholic fatty liver disease. World J Gastroenterol. 2008;14:2888-2893. [PubMed] [DOI] |
| 22. | Alvarez G, Visitación Bartolomé M, Miana M, Jurado-López R, Martín R, Zuluaga P, Martinez-Martinez E, Nieto ML, Alvarez-Sala LA, Millán J. The effects of adiponectin and leptin on human endothelial cell proliferation: a live-cell study. J Vasc Res. 2012;49:111-122. [PubMed] [DOI] |
| 23. | Udagawa J, Ono A, Kawamoto M, Otani H. Leptin and its intracellular signaling pathway maintains the neurosphere. Neuroreport. 2010;21:1140-1145. [PubMed] [DOI] |
| 24. | Gupta A, Dey CS. PTEN, a widely known negative regulator of insulin/PI3K signaling, positively regulates neuronal insulin resistance. Mol Biol Cell. 2012;23:3882-3898. [PubMed] [DOI] |
| 25. | de la Monte S, Derdak Z, Wands JR. Alcohol, insulin resistance and the liver-brain axis. J Gastroenterol Hepatol. 2012;27 Suppl 2:33-41. [PubMed] [DOI] |
| 26. | Ueki K, Fruman DA, Brachmann SM, Tseng YH, Cantley LC, Kahn CR. Molecular balance between the regulatory and catalytic subunits of phosphoinositide 3-kinase regulates cell signaling and survival. Mol Cell Biol. 2002;22:965-977. [PubMed] [DOI] |
| 27. | Ueki K, Algenstaedt P, Mauvais-Jarvis F, Kahn CR. Positive and negative regulation of phosphoinositide 3-kinase-dependent signaling pathways by three different gene products of the p85alpha regulatory subunit. Mol Cell Biol. 2000;20:8035-8046. [PubMed] [DOI] |
| 28. | Mauvais-Jarvis F, Ueki K, Fruman DA, Hirshman MF, Sakamoto K, Goodyear LJ, Iannacone M, Accili D, Cantley LC, Kahn CR. Reduced expression of the murine p85alpha subunit of phosphoinositide 3-kinase improves insulin signaling and ameliorates diabetes. J Clin Invest. 2002;109:141-149. [PubMed] |
| 29. | Ueki K, Fruman DA, Yballe CM, Fasshauer M, Klein J, Asano T, Cantley LC, Kahn CR. Positive and negative roles of p85 alpha and p85 beta regulatory subunits of phosphoinositide 3-kinase in insulin signaling. J Biol Chem. 2003;278:48453-48466. [PubMed] [DOI] |