修回日期: 2012-09-26
接受日期: 2012-10-08
在线出版日期: 2012-10-18
目的: 采用核素标记相对和绝对定量(isobaric rags for relative and absolute quantitation, iTRAQ)蛋白组学技术分析乙型肝炎病毒(hepatitis B virus, HBV)肝纤维化患者和健康人血清中的差异表达蛋白.
方法: 肝纤维患者与正常人血清各30例, 去除血清中14种高丰度蛋白, 运用液相色谱基质辅助激光解析/电离-飞行时间质谱技术(matrix-assisted laser desorption/ionization time-of-fight mass spectrometry, MALDI-TOF-MS)筛选并鉴定差异表达蛋白, 并对差异表达蛋白进行生物学分析.
结果: 共鉴定血清蛋白274个, 符合条件的差异蛋白20个. 其中, 在肝纤维患者血清中有11个蛋白表达上调, 7个蛋白表达下调. 20种差异表达蛋白参与48种生物学过程、8种细胞组分和12种分子途径; 蛋白功能交互网图显示APOC3、CLU、C4B、CRP和APOE在网图中处于功能网络交叉点.
结论: 处于差异蛋白功能交互网中交叉点位置的载脂蛋白C-Ⅲ(apolipoprotein C-Ⅲ, APOC3)、聚集素(clusterin, CLU)、补体C4B(complement C4-B, C4B)、C-反应蛋白(c-reactive protein, CRP)、载脂蛋白E(apolipoprotein E, APOE), 可能在HBV肝纤维化的发生发展过程中发挥重要作用.
引文著录: 张维维, 何晓, 吕小平, 李茵, 李洪涛, 罗蓉, 李翠萍, 何敏. 基于iTRAQ结合质谱筛选HBV肝纤维化的差异表达蛋白. 世界华人消化杂志 2012; 20(29): 2789-2794
Revised: September 26, 2012
Accepted: October 8, 2012
Published online: October 18, 2012
AIM: To screen differentially expressed serum proteins in patients with hepatitis B virus (HBV)-related liver fibrosis using isobaric tags for relative and absolute quantitation (iTRAQ) combined with mass spectrometry.
METHODS: Thirty patients with HBV-related liver fibrosis and 30 healthy volunteers were selected, and their serum samples, after removal of 14 kinds of high-abundant proteins, were used for screening serum differentially expressed serum proteins using iTRAQ labeling and MALDI-TOF-MS. Differentially expressed serum proteins were then analyzed using biological methods.
RESULTS: A total of 274 serum proteins were identified in both healthy volunteers and patients with HBV-related liver fibrosis by mass spectrometry, of which 20 were differentially expressed between the two groups of subjects. Of the 20 differentially expressed serum proteins, 13 were up-regulated and 7 down-regulated. These differentially expressed proteins are involved in 48 biological processes, 8 cellular components, and 12 molecular pathways. APOC3, CLU, C4B, CRP, and APOE were found to be located in the connected nodes of the protein functional interaction network.
CONCLUSION: Serum proteins of APOC3, CLU, C4B, CRP and APOE may play an important role in the development and progression of HBV-related liver fibrosis.
- Citation: Zhang WW, He X, Lv XP, Li Y, Li HT, Luo R, Li CP, He M. Screening of differentially expressed serum proteins in patients with HBV-related liver fibrosis by iTRAQ combined with mass spectrometry. Shijie Huaren Xiaohua Zazhi 2012; 20(29): 2789-2794
- URL: https://www.wjgnet.com/1009-3079/full/v20/i29/2789.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i29.2789
中国是病毒性肝炎的高发区, 约25%慢性乙型肝炎患者将最终发展为肝硬化, 甚至肝癌[1]. 肝硬化发展过程中必然经历肝纤维化[2]. 目前, 肝纤维化诊断的"金标准"仍是肝穿刺肝组织活检, 但由于肝穿刺组织活检有诸多明显不足因而限制了其应用和普及[3]. 临床肝纤维化涉及的主要血清标志蛋白包括: 透明质酸(hyaluronic acid, HA)、Ⅲ型前胶原(type Ⅲ procollagen, PCⅢ)、Ⅳ型胶原(type Ⅳ collagen, CⅣ)、层粘蛋白(laminin, LN)和转化生长因子β(transforming growth factor-β, TGF-β), 但这些标志物对肝纤维化的诊断的特异性、敏感性、准确性皆不尽如人意, 不能真实的反映肝纤维化的实际情况[4].
蛋白组学的质谱技术为疾病过程的分子鉴定提供了一个丰富的信息来源, 该方法在癌症生物标志物的发现中已经证明了其潜力. 血清蛋白组学以研究血清整体蛋白质成分和数量的变化为对象, 其高通量、高效率的特性为研究肝纤维化过程提供了新思路, 通过质谱全面动态的分析血清样品中的差异蛋白, 有助于发现与疾病诊断及预后相关的生物标志物及治疗靶点[5].
选取2010-12/2011-12广西医科大学第一附属医院消化内科经肝穿刺活检证实为肝纤维化的患者30例, 肝组织的病理诊断符合2000年病毒性肝炎防治方案中肝纤维化的诊断标准[6]; 排除丙型肝炎病毒(hepatitis C virus, HCV)感染史、长期大量饮酒史及全身性疾病. 正常对照组来自同时期广西医科大学第一附属医院的健康体检者, 既往无肝脏相关病史, 肝功能及B超未见异常, 全身体检中未发现患有其他疾病. 将30例乙型肝炎病毒(hepatitis B virus, HBV)肝纤维化患者血清随机10例等量混合为一组, 分为肝纤维化1、2、3组; 根据例数、性别、年龄匹配原则, 将健康人血清分为对照1、2、3组. 标本采集经医院伦理委员会批准和患者本人或家属知情同意. 本研究所用乙腈、氯化钾、乙醇、三氟乙酸、磷酸二氢钾等均购自Sigma公司; 多重亲和MARS human 14色谱柱购自Aglient公司; 强阳离子交换柱(strong cation exchange column, SCX)购自PolyLC公司; Magic C18AQ液相色谱柱购自Michrom公司; Nanodrop2000点靶仪为Thermo scientific公司产品; C18 spin column除盐柱购自The Nest Group公司; iTRAQ试剂、5800Plus MALDI-TOF/TOF质谱仪和ProteinPilot 2.0软件均购自ABI公司.
1.2.1 样本处理: 清晨空腹采集2 mL全血, 4 ℃静置1-2 h待血液凝固析出血清, 3 000 g离心10 min, 收集上清液, 冰上分装后存至-80 ℃备用.
1.2.2 去除高丰度蛋白: 按照多重亲和去除系统human14色谱柱操作说明, 去除高丰度蛋白, 将收集到的馏分用冻干机浓缩.
1.2.3 脱盐和蛋白含量检测: 用3000 MWCO超滤离心管, 加入50 mmol/L pH 8.5三乙胺碳酸氢缓冲液, 反复3次, 脱盐和收集蛋白片段; 采用BCA法测定蛋白含量, 每组低丰度蛋白取100 μg/管, 冻干.
1.2.4 蛋白酶解和标记iTRAQ: 将干燥样品加入胰蛋白酶, 37 ℃消化过夜; 将酶解样品真空干燥后, 溶于iTRAQ溶液缓冲液中; iTRAQ试剂113、115分别标记样品健康对照组和肝纤维化组, 3组试验标记一致; 标记后的样品经过C18 spin column除盐柱除盐, 冻干.
1.2.5 离线二位液相色谱分离与点靶: 干燥的标记样品用上样缓冲液A(10 mmol/L KH2PO4, 25% CAN, pH 2.7)复溶并稀释10倍, 上样到SCX预装柱(5 μm, 2.1 mm×200 mm), 经上样缓冲液A洗涤后, 用含有KCl浓度分别为35、50、75、100、125、150、175、200、250和300 mmol/L的缓冲液B分布洗脱, 收集不同梯度浓度条件下洗脱的多肽. 收集到的各组份样品稀释后进行反相C 18柱(5 μm, 77 μm×150 mm)梯度淋洗和点靶.
1.2.6 质谱分析与数据处理: 标记肽段的串联质谱鉴定和相对定量分析采用ABI公司的5800 MALDI-TOF/TOF蛋白分析仪. 质谱分析数据用Protein Pilot 2.0对SWISSPROT数据库进行检索鉴定蛋白, 报告置信度高于95%的蛋白, 同时用113、115试剂报告离子的峰面积积分进行相对定量分析, 以113为对照, 按照115∶113的比值, 选择P≤0.05的结果进行报告. 运用富集分析算法对初步鉴定的蛋白数据进行分组, 鉴定的蛋白与数据库进行对比, 选择GO的生物过程、细胞成分和分子功能注释对蛋白进行分类和富集分析.
统计学处理 应用SPSS14.0软件进行统计学分析. 计量数据以mean±SD表示, 两样本均属间的比较采用t检验. 以P≤0.05为差异有统计学意义.
各组标本详情见表1. 肝纤维化1组与对照1组之间, 肝纤维化2组与对照2组之间, 肝纤维化3组与对照3组之间, 在例数、年龄分布和性别比例方面经比较后, 差异均无统计学意义.
| 分组 | 性别(男/女) | 年龄(岁) | ALT(IU/L) | AST(IU/L) | |
| 1组 | 肝纤维化 | 10/0 | 55.70±10.22 | 58.63±46.07 | 93.38±93.76 |
| 对照组 | 10/0 | 55.30±10.25 | |||
| 2组 | 肝纤维化 | 8/2 | 48.40±10.56 | 38.71±16.72 | 55.57±32.92 |
| 对照组 | 8/2 | 47.70±11.35 | |||
| 3组 | 肝纤维化 | 10/2 | 47.50±8.46 | 29.30±3.47 | 42.40±14.14 |
| 对照组 | 10/2 | 47.50±8.36 |
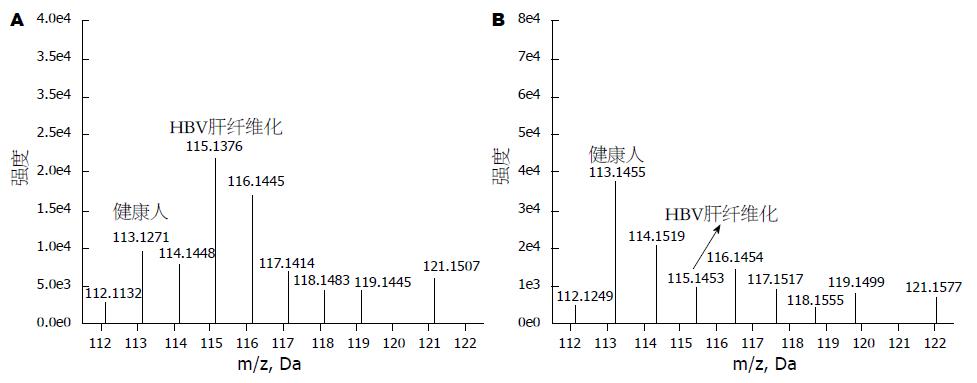
质谱数据用Protein Pilot 2.0对SWISSPROT数据库进行检索鉴定蛋白, 质谱分析结果显示在HBV肝纤维化血清和健康对照人群血清筛选和鉴定出274个蛋白. 剔除了所有多重亲和MARS human14色谱柱应该去除的14种高丰度蛋白, 同时满足如下条件的结果进入统计分析: peptides>2, Unused>1.3, Pval<0.05, 115∶113>1.2和115∶113<0.8. 经分析肝纤维化患者血清和正常人血清差异表达蛋白20个, 与对照组对比, 在HBV肝纤维化血清中表达上调的蛋白有13个, 表达下调的蛋白有7个. HBV肝纤维化组比健康对照组上调>1.2倍的蛋白, 肝纤维化组比健康对照组下调<0.8倍的蛋白质见表2; 其中APOE和CLU这两个蛋白的肽段相对定量信息见图1A和图1B.
| 编号 | 蛋白名称 | 115∶113 | 生物学过程 | 细胞成分 | 分子功能 |
| P01011 | -1抗糜蛋白酶 | 7.1779 | 炎症反应、脂质代谢 | 细胞外区 | 丝氨酸型内肽酶抑制剂的活性 |
| P06727 | 载脂蛋白A-IV | 1.2942 | 脂代谢过程 | 细胞外区 | 脂质转运活动 |
| P04114 | 载脂蛋白B-100 | 4.3251 | 脂代谢和转运 | 细胞外区 | 胆固醇转运活动 |
| P02649 | 载脂蛋白E | 3.0200 | 胆固醇代谢过程 | 内涵体 | 脂质转运活性 |
| P00450 | 铜蓝蛋白 | 4.3251 | 铜离子转运 | 细胞外区 | 铜离子结合 |
| P02747 | 补体C1q子组件亚基C | 2.2909 | 补体活化途径 | 细胞外途 | 结合免疫复合物 |
| P10643 | 补体C7 | 12.942 | 补体活化途径 | 细胞外区 | 膜攻击复合物 |
| P02748 | 补体C9 | 2.3121 | 补体活化途径 | 细胞外区 | 膜攻击复合物 |
| P02741 | C-反应蛋白 | 15.417 | 急性时相反应 | 细胞外区 | 低密度脂蛋白粒子结合 |
| P02671 | 纤维蛋白原链 | 2.2699 | 血液凝固、血小板活化 | 细胞外区 | 受体结合 |
| P01880 | 免疫球蛋白三角链C区 | 5.4450 | 免疫反应 | 膜的组成成分 | 抗原结合 |
| B9A064 | 免疫球蛋白样多肽5 | 5.2000 | 免疫反应 | 细胞外区 | |
| P51884 | 光蛋白聚糖 | 2.0893 | 软骨发育 | 细胞外基质 | 胶原蛋白结合 |
| P02656 | 载脂蛋白 C-III | 0.3133 | 脂质代谢过程 | 细胞外区 | 磷脂结合 |
| P10909 | 聚集素 | 0.4446 | 细胞凋亡过程 | 细胞膜 | 错误折叠的蛋白结合 |
| P0C0L5 | 补体C4-B | 0.2582 | 补体活化 | 细胞外区 | 肽链内切酶抑制剂活性 |
| P05546 | 肝素辅因子2 | 0.4966 | 肽链内切酶活性负调控 | 细胞外区 | 丝氨酸型内肽酶抑制剂的活性 |
| P35858 | 胰岛素样生长因子结合蛋白复合物的酸不稳定亚基 | 0.3221 | 细胞粘附、信号转导 | 细胞外区 | 胰岛素样生长因子结合 |
| P19827 | 间-胰蛋白抑制剂重链H1 | 0.5495 | 肽酶活性的负调控 | 细胞外区 | 丝氨酸型内肽酶抑制剂活性 |
| P19823 | 间-胰蛋白抑制剂重链H2 | 0.1019 | 肽酶活性的负调控 | 细胞外区 | 丝氨酸型内肽酶抑制剂活性 |
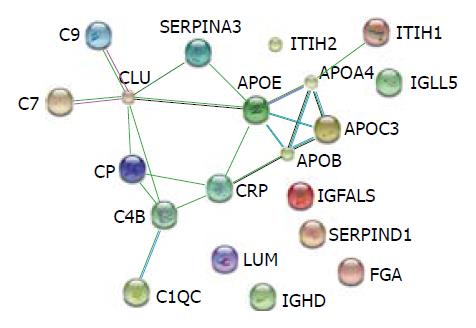
通过DAVID富集分析系统对本实验获得的20种差异表达蛋白进行GO分析和Pathway分析. 这些蛋白主要参与48种生物学过程、8种细胞组分和12种分子途径, 主要涉及3大生物代谢途径: 脂代谢途径、补体调节途径和信号转导途径. 运用STRING 9.0检索蛋白质相互作用(图2); 蛋白: 载脂蛋白C-Ⅲ(apolipoprotein C-Ⅲ, APOC3)、聚集素(clusterin, CLU)、补体C4B(complement C4-B, C4B)、C-反应蛋白(c-reactive protein, CRP)、载脂蛋白E(apolipoprotein E, APOE)在网图中处于功能网络交叉点, 他们可能在蛋白相互作用及肝纤维化的发生发展过程中扮演重要角色.
采用比较蛋白质组学的方法寻找差异表达蛋白是当今蛋白质组学研究的一个热点. 与ICAT-MS/MS和2D电泳相比, iTRAQ标记偶联MALDI-MS/MS的方法是发现蛋白标志物的强有力工具, 该方法对低丰度蛋白检测的灵敏度高, 蛋白覆盖率高, 重复性好, 最多可对8种不同样本同时进行定量分析[7]. iTRAQ技术结合多维液相色谱和串联质谱分析, 可采用多种标本来源, 如细胞、组织、血浆、脑脊液、唾液、泪液和鼻分泌物等, 同时分离和鉴定成百上千蛋白质, 最大化的获得蛋白质的"全组信息"[8]; 该技术已被应用于乳腺癌、子宫内膜癌、前列腺癌等血清标志物的研究[9-11]. 本研究中, 通过iTRAQ-MS/MS技术成功筛选出HBV肝纤维化患者与健康人血清中的20种差异表达蛋白, 其中上调超过1.2倍的蛋白13种, 下调超过0.8倍的蛋白7种, 这些蛋白的生物学功能主要包括脂类代谢、补体调节、分子转运和细胞信号转导等.
通过生物信息学分析发现APOC3、CLU、C4B、CRP和APOE位于差异蛋白交互网图作用交汇点, 他们的相互作用及与HBV肝纤维化的发生发展过程中的关系值得关注.
APOC3是由肝脏合成的一种水溶性低分子量蛋白质, 主要存在于富含甘油三酯(triglyceride, TG)的超低密度脂蛋白(very low-density lipoprotein, VLDL)和乳糜微粒(chylomicrons, CM)中[12]. 有报告显示, 在HCV相关的肝纤维化患者中, APOC3表达下降与肝纤维化程度进展有高度相关性[13], APOC3的转运可能受到HCV核心蛋白和HCV相关炎症细胞因子的直接或间接影响[14,15]; 另外, APOC3的降低也可能是HCV引起的VLDL代谢紊乱所致. 本研究显示HBV肝纤维化血清中APOC3的表达下降, 推测HBV对APOC3的影响可能类似于HCV, 患者血清APOC3表达水平检测可能有助于对肝纤维化的诊断.
CLU是Fritz等[16]于1983年发现的一种糖蛋白, 几乎表达于所有的组织和体液中. 他参与包括细胞凋亡、细胞周期调控、DNA修复、细胞黏附、组织重塑、脂质运输和免疫调节等生理功能. 有文献报道[17], HBV相关肝硬化血清中的CLU低于正常人, 也低于HCC和普通HBV感染者, 而HCC患者CLU低于正常人和HBV患者, 本研究结果与该报道一致. 同时, CLU在细胞膜表面表达时对同源补体有抑制作用, 从而保护细胞免于补体介导的损伤[18]. 所以当肝纤维化发生时, 细胞外基质过度沉积, 可能影响肝细胞分泌从而导致CLU表达下降.
肝脏是合成补体成分的主要器官, 90%的补体成分及其调节因子来自于肝脏. C4由α、β和γ通过二硫键链接组成, C4B是补体激活经典途径中C3重要组成部分, 参与微生物膜的攻击复合物的组装, 能清除致病性免疫复合物、凋亡和坏死细胞[19]. Gangadharan等[20]和White等[21]的研究发现, 在HCV相关肝纤维化患者血清中C4β链下降; 张占卿等[22]的研究显示血清C4水平下调对HBV肝纤维化有预测价值; Ali等[23]研究认为, HCV肝炎在出现肝硬化之前, 血清C4水平有一定程度地升高, 在出现肝硬化后则显著下降. 虽然补体系统在保护机体抵抗病毒感染中起一定作用, 但C4B在HBV、HCV相关的肝纤维化的发病机制中的作用尚不清楚. 本研究显示C4B表达下调可能是由于病毒侵袭所致的持续性肝脏损害与炎症反应, 从而引起纤维结缔组织大量增生、降解不足, 同时肝组织免疫系统被激活, 补体激活经典途径消耗C4B, 最终导致其在HBV肝纤维化血清中表达下调.
CRP属于Pentraxin蛋白家族成员, 是由肝脏产生的一种急性期非特异性反应蛋白[24]. Liu等[25]在肝纤维化大鼠模型中发现, CRP作为标志物在早期酒精性脂肪肝、肝纤维化血清中表达上调; Yoneda等[26]研究提示血浆CPR水平可以用于区分普通脂肪肝和非酒精性脂肪变性肝炎(non-alcoholic steatohepatitis, NASH), 高表达的CRP与广泛肝纤维化有相关性, 这与本研究结果一致, 但CRP在肝纤维中升高机制尚未清楚. 可能在肝纤维化时, 肝成纤维细胞和活化的肝星状细胞分泌IL-6升高[27], 而血液循环中IL-6的升高可诱导CRP的大量生成[28].
APOE主要在肝脏合成、分泌和代谢, 参与脂质的运输、储存及排泄过程, 有组织修复、抑制血小板积聚及免疫调节等作用[29]. 有研究显示, 在不同肝病发生过程中, APOE在血清中的含量有明显变化, 在肝功能衰竭中, APOE和低密度脂蛋白表达下降, 然而在肝组织再生的过程中APOE表达却与之相反[30]. Wozniak等[31]的研究提示APOE对HCV病毒引起的肝损伤有一定保护作用, 可以竞争性抑制病毒与肝细胞的结合, 减少病毒的侵入与扩散, 从而降低肝损害. APOE可以通过免疫调节抑制IL-2和影响自然杀伤NK细胞产生干扰素, 从而使HBV持续复制并且难以清除[32]. 由此推测, 本研究中APOE在HBV肝纤维化血清中上调可能是由于病毒致肝损伤因素的存在, 从而引起APOE的反应性升高. 总之, 本研究通过iTRAQ技术联合质谱初步筛选得到一系列HBV肝纤维化血清差异表达蛋白, 表明该技术用于肝病相关生物标志物的血清蛋白质组学研究具有良好的前景. 但这些蛋白在肝纤维化发生、发展中的作用尚未完全清楚, 需要进一步评价这些血清差异蛋白作为诊断肝纤维化的候选标志物的可靠性.
肝纤维化是慢性乙型肝炎进展的主要结果, 其早期诊断仍是临床上的一个难题. 迄今为止, 肝纤维诊断最可靠的方法为肝活检, 但因其为有创检查, 不便常规随访及动态评估而难以开展, 其他辅助诊断如血液生化和影像学检查由于准确性等原因, 不能如实反映肝纤维化实际情况. 临床上迫切需要找到更易推广、特异性及敏感性更高的肝纤维化诊断指标.
张小晋, 主任医师, 北京积水潭医院消化科
核素标记相对和绝对定量(iTRAQ)联合液相色谱基质辅助激光解析/电离-飞行时间质谱技术是近年来最新开发的一种新的蛋白组学定量研究技术, 用于检测样品中低丰度蛋白, 有灵敏度高, 蛋白覆盖率高, 重复性好等优势. 通过iTRAQ技术可能为无创诊断乙型肝炎病毒肝纤维提供更多有价值的标志物.
Yang等利用2-DE和iTRAQ-LC-ESI-MS技术对比研究HCV相关肝纤维化患者和正常人血清, 发现13个差异表达蛋白, 其中载脂蛋白A-IV在HCV相关肝纤维化患者差异明显.
本研究运用血清蛋白质组学对HBV肝纤维化患者与健康人血清进行差异蛋白的筛选与鉴定, 结合生物信息学分析发现APOC3、CLU、C4B、CRP、APOE可以作为HBV肝纤维化的血清候选标志物.
深入研究HBV肝纤维化的候选血清标志物在HBV肝纤维化发生发展过程的作用, 将为肝纤维的无创诊断提供新的
思路.
本文对研究对象的选择较科学, 结果有可比性, 对HBV肝纤维化临床研究很有意义.
编辑: 田滢 电编:鲁亚静
| 3. | Bataller R, Brenner DA. Liver fibrosis. J Clin Invest. 2005;115:209-218. [PubMed] [DOI] |
| 4. | Jarcuska P, Janicko M, Veselíny E, Jarcuska P, Skladaný L. Circulating markers of liver fibrosis progression. Clin Chim Acta. 2010;411:1009-1017. [PubMed] [DOI] |
| 5. | Petricoin EF, Rajapaske V, Herman EH, Arekani AM, Ross S, Johann D, Knapton A, Zhang J, Hitt BA, Conrads TP. Toxicoproteomics: serum proteomic pattern diagnostics for early detection of drug induced cardiac toxicities and cardioprotection. Toxicol Pathol. 2004;32 Suppl 1:122-130. [PubMed] [DOI] |
| 7. | Wu WW, Wang G, Baek SJ, Shen RF. Comparative study of three proteomic quantitative methods, DIGE, cICAT, and iTRAQ, using 2D gel- or LC-MALDI TOF/TOF. J Proteome Res. 2006;5:651-658. [PubMed] [DOI] |
| 9. | Bouchal P, Roumeliotis T, Hrstka R, Nenutil R, Vojtesek B, Garbis SD. Biomarker discovery in low-grade breast cancer using isobaric stable isotope tags and two-dimensional liquid chromatography-tandem mass spectrometry (iTRAQ-2DLC-MS/MS) based quantitative proteomic analysis. J Proteome Res. 2009;8:362-373. [PubMed] [DOI] |
| 10. | DeSouza L, Diehl G, Rodrigues MJ, Guo J, Romaschin AD, Colgan TJ, Siu KW. Search for cancer markers from endometrial tissues using differentially labeled tags iTRAQ and cICAT with multidimensional liquid chromatography and tandem mass spectrometry. J Proteome Res. 2005;4:377-386. [PubMed] [DOI] |
| 11. | Glen A, Gan CS, Hamdy FC, Eaton CL, Cross SS, Catto JW, Wright PC, Rehman I. iTRAQ-facilitated proteomic analysis of human prostate cancer cells identifies proteins associated with progression. J Proteome Res. 2008;7:897-907. [PubMed] [DOI] |
| 12. | Hernandez C, Molusky M, Li Y, Li S, Lin JD. Regulation of hepatic ApoC3 expression by PGC-1β mediates hypolipidemic effect of nicotinic acid. Cell Metab. 2010;12:411-419. [PubMed] [DOI] |
| 13. | Rowell J, Thompson AJ, Guyton JR, Lao XQ, McHutchison JG, McCarthy JJ, Patel K. Serum apolipoprotein C-III is independently associated with chronic hepatitis C infection and advanced fibrosis. Hepatol Int. 2012;6:475-481. [PubMed] |
| 14. | Ooi EM, Barrett PH, Chan DC, Watts GF. Apolipoprotein C-III: understanding an emerging cardiovascular risk factor. Clin Sci (Lond). 2008;114:611-624. [PubMed] [DOI] |
| 15. | Tanaka N, Moriya K, Kiyosawa K, Koike K, Aoyama T. Hepatitis C virus core protein induces spontaneous and persistent activation of peroxisome proliferator-activated receptor alpha in transgenic mice: implications for HCV-associated hepatocarcinogenesis. Int J Cancer. 2008;122:124-131. [PubMed] [DOI] |
| 16. | Fritz IB, Burdzy K, Sétchell B, Blaschuk O. Ram rete testis fluid contains a protein (clusterin) which influences cell-cell interactions in vitro. Biol Reprod. 1983;28:1173-1188. [PubMed] [DOI] |
| 17. | Wang Y, Liu YH, Mai SJ, He LJ, Liao YJ, Deng HX, Guan XY, Zeng YX, Kung HF, Xie D. Evaluation of serum clusterin as a surveillance tool for human hepatocellular carcinoma with hepatitis B virus related cirrhosis. J Gastroenterol Hepatol. 2010;25:1123-1128. [PubMed] [DOI] |
| 18. | Qin X, Gao B. The complement system in liver diseases. Cell Mol Immunol. 2006;3:333-340. [PubMed] |
| 19. | Soto K, Wu YL, Ortiz A, Aparício SR, Yu CY. Familial C4B deficiency and immune complex glomerulonephritis. Clin Immunol. 2010;137:166-175. [PubMed] [DOI] |
| 20. | Gangadharan B, Antrobus R, Chittenden D, Rossa J, Bapat M, Klenerman P, Barnes E, Dwek RA, Zitzmann N. New approaches for biomarker discovery: the search for liver fibrosis markers in hepatitis C patients. J Proteome Res. 2011;10:2643-2650. [PubMed] [DOI] |
| 21. | White IR, Patel K, Symonds WT, Dev A, Griffin P, Tsokanas N, Skehel M, Liu C, Zekry A, Cutler P. Serum proteomic analysis focused on fibrosis in patients with hepatitis C virus infection. J Transl Med. 2007;5:33. [PubMed] [DOI] |
| 23. | Ali OS, Abo-Shadi MA, Hammad LN. The biological significance of serum complements C3 and C4 in HCV-related chronic liver diseases and hepatocellular carcinoma. Egypt J Immunol. 2005;12:91-99. [PubMed] |
| 24. | Pepys MB, Hirschfield GM. C-reactive protein: a critical update. J Clin Invest. 2003;111:1805-1812. [PubMed] [DOI] |
| 25. | Liu SL, Cheng CC, Chang CC, Mai FD, Wang CC, Lee SC, Ho AS, Chen LY, Chang J. Discovery of serum biomarkers of alcoholic fatty liver in a rodent model: C-reactive protein. J Biomed Sci. 2011;18:52. [PubMed] [DOI] |
| 26. | Yoneda M, Mawatari H, Fujita K, Iida H, Yonemitsu K, Kato S, Takahashi H, Kirikoshi H, Inamori M, Nozaki Y. High-sensitivity C-reactive protein is an independent clinical feature of nonalcoholic steatohepatitis (NASH) and also of the severity of fibrosis in NASH. J Gastroenterol. 2007;42:573-582. [PubMed] [DOI] |
| 27. | Moshage H. Cytokines and the hepatic acute phase response. J Pathol. 1997;181:257-266. [PubMed] [DOI] |
| 28. | Ford ES. Body mass index, diabetes, and C-reactive protein among U.S. adults. Diabetes Care. 1999;22:1971-1977. [PubMed] [DOI] |
| 29. | Hauser PS, Narayanaswami V, Ryan RO. Apolipoprotein E: from lipid transport to neurobiology. Prog Lipid Res. 2011;50:62-74. [PubMed] [DOI] |
| 30. | Schiefermeier M, Kollegger H, Madl C, Polli C, Oder W, Kühn H, Berr F, Ferenci P. The impact of apolipoprotein E genotypes on age at onset of symptoms and phenotypic expression in Wilson's disease. Brain. 2000;123 Pt 3:585-590. [PubMed] [DOI] |
| 31. | Wozniak MA, Itzhaki RF, Faragher EB, James MW, Ryder SD, Irving WL. Apolipoprotein E-epsilon 4 protects against severe liver disease caused by hepatitis C virus. Hepatology. 2002;36:456-463. [PubMed] [DOI] |