修回日期: 2012-08-20
接受日期: 2012-09-03
在线出版日期: 2012-10-08
目的: 观察大黄素对结肠炎大鼠模型肠纤维化的影响, 探讨其抗纤维化作用机制.
方法: 以三硝基苯磺酸(trinitrobenzene sulphonic acid, TNBS)诱导的结肠炎大鼠为纤维化模型, 将34只SD大鼠分成正常对照组、模型组和大黄素组, 模型组和大黄素组予以TNBS诱导肠纤维化, 大黄素组每日给予大黄素40 mg/kg灌胃, 其余组则给予等体积盐溶液. 实验过程中观察小鼠体质量、大便性状和活动变化, 给予DAI评分, 实验结束后收集结肠组织标本, 给予大体和组织学评分, 并采用HE染色及Masson胶原三色染色观察大鼠结肠组织损伤和纤维化程度, 采用荧光定量PCR法检测结肠黏膜中TGF-β1、胶原Ⅰ、胶原Ⅲ、Smad3、α-SMA和E-cad mRNA表达.
结果: 与模型组相比, 大黄素组一般情况、结肠组织大体和组织学评分及纤维化程度均出现明显改善. 大黄素组TGF-β1、胶原Ⅰ、胶原Ⅲ、Smad3和α-SMA mRNA表达较模型组明显降低(1.27±0.78 vs 4.56±3.14; 0.60±0.59 vs 2.15±1.22; 0.92±1.38 vs 3.34±1.47; 3.11±2.81 vs 8.77±6.40; 0.87±0.62 vs 2.40±1.15, 均P<0.05), 而E-cad mRNA表达明显升高(1.01±0.34 vs 0.30±0.23, P<0.05).
结论: 大黄素对TNBS诱导的大鼠肠纤维化模型具有一定的抗纤维化作用, 该作用可能与其下调TGF-β1/Smad信号通路抑制EMT发生有关.
引文著录: 田瑗, 郭晓琳, 王丽强, 李颖. 大黄素对TNBS诱导大鼠肠纤维化的影响. 世界华人消化杂志 2012; 20(28): 2703-2708
Revised: August 20, 2012
Accepted: September 3, 2012
Published online: October 8, 2012
AIM: To investigate the anti-fibrotic effects of emodin in rats with experimental colitis, and to explore the possible mechanisms.
METHODS: Rats with colitis induced with trinitrobenzene sulphonic acid (TNBS) were used as the model of intestinal fibrosis. Thirty-four rats were randomly divided into normal group, model group and emodin group. Colitis was induced with TNBS in rats of the model group and emodin group. Rats in the emodin group were gavaged with 40 mg/kg of emodin daily, and the other groups were gavaged with an equal volume of 0.9% NaCl solution. Body weight loss and changes in stool and activities were observed, and DAI was calculated. At the end of the experiment, colon tissue samples were collected, and the general and histological scores were given. The injury and fibrosis of the colon were detected by HE staining and Masson collagen staining, respectively. Expression of transforming growth factor (TGF)-β1, collagenⅠ, collagen Ⅲ, Smad3 and α-SMA was determined by FQ-PCR.
RESULTS: Compared to the model group, the general condition, general and histological scores, and fibrosis were improved significantly in the emodin group. Expression of TGF-β1, collagenⅠ, collagen Ⅲ, Smad3 and α-SMA in colonic mucosa in the emodin group were significantly lower than that in the model group (1.27 ± 0.78 vs 4.56 ± 3.14; 0.60 ± 0.59 vs 2.15 ± 1.22; 0.92 ± 1.38 vs 3.34 ± 1.47; 3.11 ± 2.81 vs 8.77 ± 6.40; 0.87 ± 0.62 vs 2.40 ± 1.15, all P < 0.05), while expression of E-cad was higher in the emodin group (1.01 ± 0.34 vs 0.30 ± 0.23, P < 0.05).
CONCLUSION: Emodin reduces intestinal fibrosis in rats with TNBS-induced colitis possibly by down-regulation of TGF-β1/Smad3 signaling and inhibition of epithelial-mesenchymal transition.
- Citation: Tian Y, Guo XL, Wang LQ, Li Y. Emodin reduces intestinal fibrosis in rats with TNBS-induced colitis. Shijie Huaren Xiaohua Zazhi 2012; 20(28): 2703-2708
- URL: https://www.wjgnet.com/1009-3079/full/v20/i28/2703.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i28.2703
肠纤维化是克罗恩病(Crohn's disease, CD)特征性病理学表现之一, 是肠道反复慢性透壁性炎症刺激导致过多细胞外基质(extracellular matrix, ECM)沉积和瘢痕组织形成, 最终引起肠腔狭窄, 甚至肠梗阻. 目前针对CD肠纤维化的治疗手段有限, 且反复发作的肠道炎症和狭窄严重影响了患者生活质量[1]. 新近研究发现, 转化生长因子β1(transforming growth factor-β1, TGF-β1)通过激活Smad信号通路诱导的肠上皮细胞间质化(epithelial-mesenchymal transition, EMT)参与了肠上皮胶原蛋白在肠壁内的沉积, 导致肠纤维化发生[2]. EMT是肠上皮细胞向间质细胞表型转化, 并获得转移能力的过程, 在此过程中肠上皮细胞表型如E-钙黏蛋白(E-cadherin, E-cad)丧失, 取而代之的是大量纤维化间质细胞经典标志物如平滑肌肌动蛋白α(α-smooth muscle actin, α-SMA)、并获得产生大量胶原蛋白的能力[3].大黄素(emodin)为三羟甲基蒽醌衍生物, 是大黄的主要有效单体, 因其具有抗炎、抗肿瘤、抗氧化、抑制胰酶分泌和血小板聚集等多种功效已广泛应用于临床. 新近研究发现, 大黄素具有抗纤维化作用, 体内外实验已证实其在肝、肾、肺、胰腺纤维化中的疗效[4-7], 但尚缺乏大黄素对CD肠纤维化治疗的相关研究. 为此, 本研究以目前公认的三硝基苯磺酸(trinitro-benzene-sulfonic acid, TNBS)诱导的大鼠肠炎模型作为肠纤维化模型, 探讨大黄素对肠纤维化的影响及可能机制.
8-10 wk SPF级♀SD大鼠34只, 体质量180-220 g, 饲养于吉林大学基础医学院动物实验中心. TNBS和大黄素均购自美国Sigma公司; TRIzol试剂购自Invitrogen公司; RT试剂盒购自Gene公司; 荧光定量聚合酶链反应(FQ-PCR)试剂盒购自ABI公司; PCR引物根据GenBank中的序列合成.
1.2.1 分组和造模: 将SD大鼠于SPF环境下适应性饲养3 d后称质量、编号、随机分成3组, 即正常对照组、模型组、大黄素组, 每组10只. 参照Wengrower等[8]的方法, 利用TNBS诱导大鼠结肠炎进行造模: 大鼠禁食24 h, 在乙醚轻度麻醉下, 将医用聚乙烯管(直径2 mm)自肛门插入8 cm, 模型组和大黄素组大鼠缓慢推入150 mg/kg TNBS 500 mL/L 乙醇溶液, 正常对照组大鼠推入等体积0.9%NaCl溶液, 每次灌肠后保持肛门高位3 min, 以防灌肠溶液自肛门快速流出.
1.2.2 大黄素干预: 将大黄素与羟甲基纤维素钠配制成混悬液, 于造模24 h后, 大黄素组每日分别给予大黄素40 mg/kg灌胃, 正常对照组和模型组大鼠则给予等体积0.9%NaCl溶液, 直至造模后21 d.
1.2.3 标本采集: 实验结束后, 将各组大鼠脱颈椎处死, 收集结肠组织置于40 g/L甲醛中, 常规石蜡包埋, 用于HE和Masson胶原三色染色. 余结肠组织置于液氮中, 用于RT-PCR分析.
1.2.4 一般情况及DAI评分: 实验过程中每日记录大鼠进食、活动、大便性状、体质量变化及死亡等情况, 参照Murano等[9]的标准, 根据大鼠体质量变化、粪便性状及血便情况评价大鼠的疾病活动指数(disease activity index, DAI).
1.2.5 结肠大体损伤评分: 参照Videla等[10]方法, 依据结肠粘连(0-2分)、狭窄(0-2分)、扩张(0-2分)、肠壁增厚(0-2分)、黏膜充血水肿(0-2分)和黏膜溃疡(0-2分)情况, 统计总分(最大12分)作为结肠大体损伤的分值.
1.2.6 组织学评分和Masson胶原染色: 将收集结肠组织置于中性甲醛, 常规石蜡包埋, 切片, HE染色, 光学显微镜观察. 参照Videla和Lawrance等[10,11]方法, 依据溃疡大小(0-2分)、炎症程度(0-3分)、病变深度(0-3分)和纤维化程度(0-2分)进行组织学评分; 并进行Masson胶原三色染色, 通过图像分析, 取任意3个视野的胶原面积比值, 计算平均值, 进行胶原面积比值比较.
1.2.7 TGF-β1、胶原Ⅰ、胶原Ⅲ、Smad3、α-SMA和E-cad mRNA表达的RT-PCR检测: 根据朱梅影等[12]方法, 按TRIzol试剂说明书分别提反应总RNA. 逆转录合成cDNA, 总反应体系为20 µL. 将逆转录合成的cDNA进行荧光定量PCR, 引物设计按如表1所示, 反应总体系如下: real time PCR MIX 15 µL, 上下游引物各0.5 µL, TaqMan荧光探针0.5 µL, TaqDNA聚合酶1 µL, ddH2O 32 µL, cDNA模板5 µL, 总体积50 µL. 反应条件: 50 ℃ 2 min; 95 ℃ 5min; 95 ℃ 15 s, 60 ℃ 45 s, 40个循环. 采用ABI Prism 7500 SDS软件计算基因Ct值, 与内参Ct值计算目标基因mRNA相对表达量.
| 引物 | 序列 | 扩增片段(bp) |
| GAPDH(内参) | F:CCATGACGACTTTGGTATCG | 138 |
| R:GATGCAGGGATGATGTTCTG | ||
| TGF-β1 | F:CTTGCCCTCTACAACCAACA | 102 |
| R:ACTTGCGACCCACGTAGTAGA | ||
| 胶原I | F:CGTGGAAACCTGATGTATGC | 96 |
| R:A GGTTGGGACAGTCCAAGTCT | ||
| 胶原Ⅲ | F:TGGCCTTCCTCAGACTTCTT | 84 |
| R:CCTGATCCATGTAGGCAATG | ||
| Smad3 | F:TAGCACAGGCTCTTTGGATG | 93 |
| R:GAAGCAGAGACTGGGTCCTC | ||
| α-SMA | F: TGCTGTCCCTCTATGCCTCT | 185 |
| R: GAAGGAATAGCCACGCTCAG | ||
| E-cad | F: TTTGGAAGCTTTGGCTGAGT | 250 |
| R: GTTGGCCAGTCACCTGAAAT |
统计学处理 采用SPSS16.0统计软件进行分析, 计量资料以mean±SD表示, 多组间比较采用单因素方差分析, 其中两两比较采用LSD法; 计数资料以百分率表示, 组间比较采用χ2检验或Fisher确切概率法, P<0.05差异具有统计学意义.
在实验过程中, 模型组与正常对照组大鼠相比, 模型组大鼠表现出明显的厌食、活动减少, 并出现精神萎靡和体质量丧失, 且伴有不同程度的腹泻和血便; 而大黄素干预组大鼠则较模型组大鼠饮食和活动明显增加、精神状况好转、腹泻和便血减轻, 且体质量显著增加. 与对照组相比, 模型组大鼠体质量出现明显下降(P<0.05); 与模型组相比, 大黄素组大鼠体质量显著增加(P<0.05), 但仍低于对照组(P<0.05). 同样, 与对照组相比, 模型组大鼠DAI显著升高(P<0.05); 与模型组相比, 大黄素组大鼠DAI明显下降(P<0.05), 且与对照组相比差异无统计学意义(P>0.05, 表2).
模型组大鼠较正常对照组出现不同程度的肠粘连、狭窄和肠壁增厚, 偶可见溃疡病灶, 而大黄素组大鼠结肠以上表现则得到显著改善. 如表3所示, 与对照组相比, 模型组大鼠结肠大体评分显著升高(P<0.05); 与模型组相比, 大黄素组大鼠结肠大体评分显著降低(P<0.05), 但仍高于对照组(P<0.05).
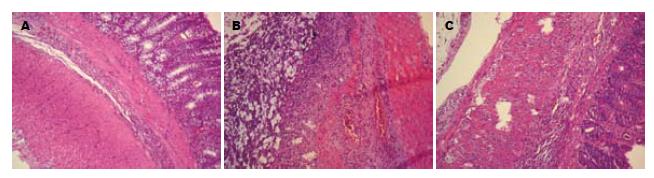
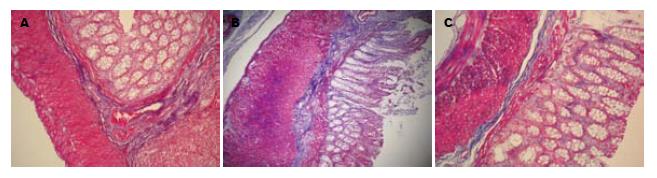
光学显微镜观察, 模型组大鼠可见结肠黏膜上皮破坏、黏膜及黏膜下层大量炎症细胞浸润、腺体破坏、溃疡形成和纤维组织增生, 甚至透壁性溃疡. Masson胶原染色可见黏膜、黏膜下和肌层胶原纤维表达增强; 大黄素干预后结肠黏膜内仍有少量炎症细胞浸润, 偶可见结肠黏膜溃疡形成, 腺体破坏和纤维组织增生较模型组明显减轻, Masson胶原染色显示胶原纤维表达较模型组显著下降(图1, 2). 如表2所示, 与对照组相比, 模型组结肠组织学评分和胶原面积比显著升高(P<0.05); 与模型组相比, 大黄素组结肠组织学评分和胶原面积比显著降低(P<0.05), 但仍高于对照组(P<0.05).
与对照组相比, 模型组大鼠结肠TGF-β1、胶原Ⅰ、胶原Ⅲ、Smad3和α-SMA mRNA表达显著增强(P<0.05), E-cad mRNA表达显著降低(P<0.05); 与模型组相比, 大黄素干预组TGF-β1、胶原Ⅰ、胶原Ⅲ、Smad3和α-SMA mRNA表达明显降低(P<0.05), E-cad mRNA表达明显升高(P<0.05), 其中TGF-β1、胶原Ⅰ、胶原Ⅲ、α-SMA和E-cad与对照组相比差异无统计学意义(表4).
慢性TNBS诱导的肠炎动物模型具有透壁性溃疡、肠腔狭窄、肠壁增厚、近端扩张的特征, 能较好模拟肠纤维化过程[11]. 本实验参照Wengrower等[8]的方法, 采用较常规100 mg/kg大的150 mg/kg TNBS诱导肠纤维化模型, 实验结束后有1只模型组大鼠几近死亡, 病理检查发现, 肠组织黏膜内大量炎症细胞浸润, 以中性粒细胞为主, 可见明显的溃疡, 呈急性炎症表现, 部分出现肠穿孔, 大鼠食欲明显减退、体质量降低、大体及组织评分显著增加, 解剖分析发现肠穿孔和腹腔感染, 这可能与TNBS剂量较大有关. 尽管如此, 实验证实, 模型组大鼠经TNBS诱导后出现体质量丧失, DAI、结肠大体和组织评分明显升高, 胶原面积比显著增加, 这与San-Miguel等[13]研究结果相一致. Wu等[14]研究发现, 停止TNBS引起的炎症刺激并不能减轻肠纤维化, 提示应在抗炎治疗的同时尽早实施抗纤维化治疗. 尽管目前已有多种具有明显抗炎作用的药物用于CD治疗, 但尚缺乏有效的抗纤维治疗手段[15]. 鉴于大黄素能有效对抗肝、肾脏和肺的纤维化[16], 本实验在TNBS诱导大鼠结肠纤维化早期应用大黄素予以干预治疗, 结果表明, 大黄素能改善模型大鼠体质量丧失, 下调DAI、结肠大体和组织评分, 下调胶原面积比和胶原蛋白Ⅰ、Ⅲ表达, 具有明显的抑制肠纤维化作用.
目前认为CD肠纤维化是在易感基因基础上, 由细胞因子、ECM和成纤维细胞等多种因素相互作用引起大量Ⅰ、Ⅰ、Ⅳ、Ⅴ型胶原蛋白在肠壁内沉积所致, 而EMT在此过程中发挥了至关重要的作用[17]. Filer等[18]通过双转基因小鼠制造动物模型, 亦证实EMT是TNBS诱导的结肠炎模型肠纤维化的重要作用机制之一, 且用重组骨成型蛋白-7抑制TGF-β1可阻止肠纤维化进展. 在形态学上, EMT是肠上皮细胞向间质细胞表型转化, 并获得转移能力的过程, 在此过程中肠上皮细胞表型如E-cad、细胞角蛋白(cytokeratin, CK)丧失, 取而代之的是大量纤维化间质细胞经典标志物如α-SMA、成纤维细胞特异蛋白1(fibroblast specific protein, FSP1)、弹性蛋白(Vimentin), 并获得产生大量胶原蛋白的能力. TGF-β1是EMT最强的诱导因子, 体外研究发现, 肠肌纤维母细胞分泌的TGF-β1可诱导EMT的发生[19,20]. 进一步研究发现, TGF-β1和其受体结合导致Smad传导途径激活, TGF-β1受体Ⅰ激酶直接磷酸化Smad-2和Smad-3, 然后与正常的Smad-4结合转入细胞核内, 加强特定的TGF-β目的基因作用, 诱导EMT发生[21]. 与以上研究结果相一致, 本实验研究发现, 模型组小鼠α-SMA表达显著增强, 而E-cad表达下调, 同时发现TGF-β1和Smad3表达增强, 提示TGF-β1通过Smad信号通路介导的EMT参与了TNBS诱导的肠纤维化. 亦有作者研究发现, 大黄素能通过抑制TGF-β1来发挥抗肝纤维化的作用. Dong等[4]研究表明大黄素可通过抑制肝星状细胞的活化缓解肝纤维化的发展. 此外, 大黄素可抑制大鼠HSC增殖和肺成纤维细胞增殖, 还具有抑制肾间质成纤维细胞的增殖和促进其凋亡的作用, 均提示大黄素也可通过抑制EMT, 诱导其凋亡, 从而发挥其抗纤维化作用. 本研究发现, 大黄素能有效降低TNBS诱导大鼠结肠上皮α-SMA表达显著, 上调E-cad表达, 抑制EMT的发生, 同时下调TGF-β1和Smad3表达. 由此我们推测, TGF-β1/Smad3信号通路介导的EMT参与了大黄素抗肠纤维化作用.
本实验研究结果表明, 肠道纤维化过程中伴随着EMT发生和纤维化相关因子TGF-β1和信号分子Smad3表达的改变, 大黄素可能通过下调TGF-β1/Smad信号通路来抑制EMT发生, 从而发挥其抗纤维化作用. 但TGF-β1/Smad信号通路与EMT发生间的具体作用环节尚不清楚, 仍有待于进一步深入研究.
肠纤维化是克罗恩病的重要并发症之一, 目前尚缺乏有效的治疗手段, 大黄素具有对抗肝、肺和肾脏纤维化的功效, 但尚缺乏大黄素对CD肠纤维化治疗的相关研究.
陈海龙, 教授, 大连医科大学附属第一医院
大黄素已应用于实验性肠炎动物模型的治疗, 但其具体作用机制尚不清楚, 临床应用有待深入研究.
新近研究发现, 转化生长因子β1通过激活Smad信号通路诱导的肠上皮细胞间质化参与了肠上皮胶原蛋白在肠壁内的沉积, 导致肠纤维化发生.
既往大多数研究主要集中在大黄素对肝、肾、肺和胰腺纤维化的治疗研究上, 而有关大黄素对肠纤维化的治疗作用研究则较少, 本实验在评估大黄素对抗肠纤维化疗效的基础上, 对其作用机制进行了深入分析.
口服大黄素能有效改善肠道炎症症状, 抑制肠道纤维化, 这与大黄素通过下调TGF-β1/Smad信号通路来抑制EMT发生有关, 具有较好的临床应用前景.
肠纤维化: 克罗恩病特征性病理学表现之一, 是肠道反复慢性透壁性炎症刺激导致过多细胞外基质沉积和瘢痕组织形成, 最终引起肠腔狭窄, 甚至肠梗阻.
本研究选题准确, 技术路线合理, 选用指标得当, 结果可信, 结论可靠.
编辑: 李军亮 电编:闫晋利
| 1. | Rieder F, Lawrance IC, Leite A, Sans M. Predictors of fibrostenotic Crohn's disease. Inflamm Bowel Dis. 2011;17:2000-2007. [PubMed] [DOI] |
| 2. | Rieder F, Kessler SP, West GA, Bhilocha S, de la Motte C, Sadler TM, Gopalan B, Stylianou E, Fiocchi C. Inflammation-induced endothelial-to-mesenchymal transition: a novel mechanism of intestinal fibrosis. Am J Pathol. 2011;179:2660-2673. [PubMed] [DOI] |
| 3. | Piera-Velazquez S, Li Z, Jimenez SA. Role of endothelial-mesenchymal transition (EndoMT) in the pathogenesis of fibrotic disorders. Am J Pathol. 2011;179:1074-1080. [PubMed] [DOI] |
| 4. | Dong MX, Jia Y, Zhang YB, Li CC, Geng YT, Zhou L, Li XY, Liu JC, Niu YC. Emodin protects rat liver from CCl(4)-induced fibrogenesis via inhibition of hepatic stellate cells activation. World J Gastroenterol. 2009;15:4753-4762. [PubMed] [DOI] |
| 5. | Li X, Liu W, Wang Q, Liu P, Deng Y, Lan T, Zhang X, Qiu B, Ning H, Huang H. Emodin suppresses cell proliferation and fibronectin expression via p38MAPK pathway in rat mesangial cells cultured under high glucose. Mol Cell Endocrinol. 2009;307:157-162. [PubMed] [DOI] |
| 6. | Chen XH, Sun RS, Hu JM, Mo ZY, Yang ZF, Jin GY, Guan WD, Zhong NS. Inhibitory effect of emodin on bleomycin-induced pulmonary fibrosis in mice. Clin Exp Pharmacol Physiol. 2009;36:146-153. [PubMed] [DOI] |
| 7. | Wang CH, Gao ZQ, Ye B, Cai JT, Xie CG, Qian KD, Du Q. Effect of emodin on pancreatic fibrosis in rats. World J Gastroenterol. 2007;13:378-382. [PubMed] |
| 8. | Wengrower D, Zanninelli G, Pappo O, Latella G, Sestieri M, Villanova A, Faitelson Y, Pines M, Goldin E. Prevention of fibrosis in experimental colitis by captopril: the role of tgf-beta1. Inflamm Bowel Dis. 2004;10:536-545. [PubMed] [DOI] |
| 9. | Murano M, Maemura K, Hirata I, Toshina K, Nishikawa T, Hamamoto N, Sasaki S, Saitoh O, Katsu K. Therapeutic effect of intracolonically administered nuclear factor kappa B (p65) antisense oligonucleotide on mouse dextran sulphate sodium (DSS)-induced colitis. Clin Exp Immunol. 2000;120:51-58. [PubMed] [DOI] |
| 10. | Videla S, Vilaseca J, Medina C, Mourelle M, Guarner F, Salas A, Malagelada JR. Selective inhibition of phosphodiesterase-4 ameliorates chronic colitis and prevents intestinal fibrosis. J Pharmacol Exp Ther. 2006;316:940-945. [PubMed] [DOI] |
| 11. | Lawrance IC, Wu F, Leite AZ, Willis J, West GA, Fiocchi C, Chakravarti S. A murine model of chronic inflammation-induced intestinal fibrosis down-regulated by antisense NF-kappa B. Gastroenterology. 2003;125:1750-1761. [PubMed] [DOI] |
| 13. | San-Miguel B, Crespo I, Kretzmann NA, Mauriz JL, Marroni N, Tuñón MJ, González-Gallego J. Glutamine prevents fibrosis development in rats with colitis induced by 2,4,6-trinitrobenzene sulfonic acid. J Nutr. 2010;140:1065-1071. [PubMed] [DOI] |
| 14. | Wu F, Chakravarti S. Differential expression of inflammatory and fibrogenic genes and their regulation by NF-kappaB inhibition in a mouse model of chronic colitis. J Immunol. 2007;179:6988-7000. [PubMed] |
| 15. | Szabò H, Fiorino G, Spinelli A, Rovida S, Repici A, Malesci AC, Danese S. Review article: anti-fibrotic agents for the treatment of Crohn's disease - lessons learnt from other diseases. Aliment Pharmacol Ther. 2010;31:189-201. [PubMed] |
| 17. | Bataille F, Rohrmeier C, Bates R, Weber A, Rieder F, Brenmoehl J, Strauch U, Farkas S, Fürst A, Hofstädter F. Evidence for a role of epithelial mesenchymal transition during pathogenesis of fistulae in Crohn's disease. Inflamm Bowel Dis. 2008;14:1514-1527. [PubMed] [DOI] |
| 18. | Flier SN, Tanjore H, Kokkotou EG, Sugimoto H, Zeisberg M, Kalluri R. Identification of epithelial to mesenchymal transition as a novel source of fibroblasts in intestinal fibrosis. J Biol Chem. 2010;285:20202-20212. [PubMed] [DOI] |
| 19. | Xu J, Lamouille S, Derynck R. TGF-beta-induced epithelial to mesenchymal transition. Cell Res. 2009;19:156-172. [PubMed] [DOI] |
| 20. | Sipos F, Galamb O. Epithelial-to-mesenchymal and mesenchymal-to-epithelial transitions in the colon. World J Gastroenterol. 2012;18:601-608. [PubMed] [DOI] |
| 21. | Vincent T, Neve EP, Johnson JR, Kukalev A, Rojo F, Albanell J, Pietras K, Virtanen I, Philipson L, Leopold PL. A SNAIL1-SMAD3/4 transcriptional repressor complex promotes TGF-beta mediated epithelial-mesenchymal transition. Nat Cell Biol. 2009;11:943-950. [PubMed] [DOI] |