修回日期: 2012-07-06
接受日期: 2012-08-01
在线出版日期: 2012-08-28
目的: 观察重度急性抗体介导排斥反应(antibody-mediated rejection, AMR)的病理形态学改变, 回顾分析相关文献, 为小肠移植急性AMR的诊断总结经验.
方法: 切除的失功能移植肠经10%中性福尔马林固定, 石蜡包埋, 4 μm切片并行HE染色. 详细观察移植物中肠壁各层及肠系膜内组织中主要的病理形态学改变, 分级评价急性排斥反应及血管病变, 并进行C4d免疫组织化学染色.
结果: 移植物内各级血管广泛受累, 包括肠壁及肠系膜内各级血管. 受累血管的改变以肠壁浆膜下层内的小血管及动静脉的滋养血管最为显著, 主要表现为小血管壁的纤维素性坏死和/或血管内血栓形成, 受累血管周围组织中性粒细胞浸润, 红细胞漏出, 组织水肿, 部分病变血管周围伴有纤维素性坏死. 免疫组织化学染色可见病变血管内膜C4d沉积. 小肠黏膜固有层内血管显著扩张伴淤血, 偶见血栓形成, 肠黏膜隐窝上皮细胞正常, 未见急性排斥反应.
结论: 血管壁的纤维素性坏死及血管内血栓形成是重度急性AMR的主要病理学改变. 病变可以广泛累及移植物内各级血管; 小肠黏膜内血管的病变可能不代表最严重的病变; 临床早期确诊AMR的发生不能单纯依赖小肠黏膜活检.
引文著录: 梁玉梅, 余琦, 张晓燕, 李元新, 曹兵生, 李宁. 小肠移植中急性抗体介导排斥反应的病理学. 世界华人消化杂志 2012; 20(24): 2310-2317
Revised: July 6, 2012
Accepted: August 1, 2012
Published online: August 28, 2012
AIM: To observe the histopathological changes in transplanted small bowel from a patient developing acute antibody-mediated rejection (AMR) and to perform a literature review.
METHODS: The resected allograft was fixed in 10% buffered formalin, embedded in paraffin, sectioned, and stained with hematoxylin and eosin. Morphological changes in the mucosa, intestinal wall and mesentery were observed by two pathologists separately. Acute rejection, vascular lesions and related changes were assessed. Immunohistochemical staining of C4d was also performed.
RESULTS: AMR lesions were widely distributed in the allograft, involving muscular arteries, arterioles, capillaries, vasa vasorum, venules and veins. The most serious AMR was observed in arterioles located in the submucosa and vasa vasorum. Main morphological changes included fibrous necrosis of blood vessel wall, thrombosis, and leucocyte margination. Neutrophilic granulocyte infiltration was noted in the edematous interstitium surrounding the involved blood vessels, with numerous erythrocytes extravasated. The fibrocollagenous network and part of the smooth muscle cells of the outer layer of the muscularis externa showed fibrous necrosis. Foci of lysis were present in the outer layer of arteries adjacent to the involved vasa vasorum. Foci of medial necrosis in the arteries were also observed. Immunohistochemical staining showed C4d deposition in the involved blood vessels. The blood vessels in the lamina propria showed congestion and significant dilation, and thrombosis was occasionally observed. No morphological changes were found in the crypt epithelium. There was no acute rejection in the mucosa.
CONCLUSION: Fibrous necrosis of blood vessel wall and thrombosis are main morphological changes in the transplanted small bowel after severe AMR. All types of blood vessels in the allograft can be involved, but the lesion in mucosal blood vessels may not reflect the most serious injury. Therefore, early diagnosis of AMR can not rely on the biopsy of intestinal mucosa.
- Citation: Liang YM, Yu Q, Zhang XY, Li YX, Cao BS, Li N. Histological alterations in transplanted small bowel after acute antibody-mediated rejection. Shijie Huaren Xiaohua Zazhi 2012; 20(24): 2310-2317
- URL: https://www.wjgnet.com/1009-3079/full/v20/i24/2310.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i24.2310
目前, 小肠移植已经成为治疗小肠功能衰竭的根本性手段, 然而, 排斥反应仍然是限制小肠移植成功最主要的因素之一[1]. 根据排斥反应中参与成分的不同, 排斥反应分为T细胞介导的细胞性排斥反应(T-cell-mediated rejection)和抗体介导排斥反应(antibody-mediated rejection, AMR/ABMR). AMR是2004年由抗体工作组(antibody working group)推荐应用, 用来描述所有的与体液成分相关的排斥反应, 包括供体特异性抗体或反应性抗体如抗HLA抗体、ABO同种凝集素、抗内皮细胞抗体等, 以取代原来不确切的术语, 如加速性排斥反应、血管性排斥反应等. 根据AMR发生的时间, 分为超急性、急性及慢性AMR. 急性AMR是指发生在手术后24 h以后的排斥反应[2]. 在AMR中, 造成机体损伤的主要机制是补体经典途径的激活. 在这一过程中补体C4活化产生C4b, 并进一步被分解产生C4c和C4d. 其中C4c可以被血流带走, 而C4d则可以共价结合血管内皮细胞或基底膜, 从而造成血管的损害. 目前, AMR在小肠移植中少有报道, 发生急性AMR的患者对于标准的免疫抑制方案反应欠佳, 其病理学的评价标准也在探讨之中. 本文报道了1例发生于小肠移植术后40 h的急性AMR, 详细描述了其病理形态的改变并对相关文献进行了复习.
患者, 男, 59岁, 2010-08因急性出血坏死性小肠炎并发腹膜炎、感染性休克, 行全小肠切除. 术后依赖全肠外营养(total parenteral nutrition, TPN)维持生存, 其间多次因腔静脉导管感染导致脓毒症; 术后4 mo发生TPN导致的淤胆性胆囊炎, 经B超引导下经皮经肝胆囊穿刺置管引流术及抗感染治疗后控制; 术后近9 mo发生急性胰腺炎合并多脏器功能障碍, 经腹腔穿刺引流、重要脏器功能支持, 给予生长抑素、抗感染、TPN营养支持后, 病情逐步好转. 有反复输血史. 术后10 mo余在全麻下行同种异体小肠移植术, 手术顺利. 术后40 h发现移植造口发暗, 术后44 h造口液转为血性, 超声造影不能显示小肠绊血管, 行剖腹探查术见移植肠已失去生机, 遂切除移植肠. 受体O型血型, 移植前群体反应性抗体(panel reactive antibodies, PRA)为0%, 与供体淋巴细胞毒试验为2%, 供体男, O型血, 巨细胞病毒DNA及丙肝RNA阴性.
1.2.1 免疫组织化学染色: 获得标本经10%中性福尔马林固定, 石蜡包埋, 4 μm切片, HE染色并于显微镜下观察. 免疫组织化学C4d抗体购自北京中杉金桥生物有限公司, 采用EnVision两步法进行免疫组织化学染色, DAB显色, 以血管内皮或基底膜的线性棕黄色着色为阳性.
1.2.2 急性排斥反应的病理学评判标准: 参照2003年XⅢ届国际小肠移植会议提出的小肠急性排斥反应(acute cellular rejection, ACR)病理诊断工作方案[3-5]. (1)无ACR依据: 上皮无损伤, 无明显炎症反应, 与正常黏膜结构基本一致; (2)不确定性ACR: 轻度的以淋巴细胞为主的单个核炎细胞浸润. 极少量的上皮损伤及破坏, 通常仅限于隐窝内, 表现为凋亡小体数量增加(<6个凋亡小体/10个隐窝), 隐窝损伤及炎症浸润均为局灶性. 肠黏膜表面上皮无损伤, 无绒毛结构破坏, 无黏膜糜烂及溃疡; (3)轻度ACR: 本级隐窝损伤包括黏液分泌减少、胞浆嗜碱、细胞高度改变由柱状细胞变成立方细胞, 细胞核增大, 染色质增多, 上皮增生致"U"型腺腔, 和/或由于凋亡(>6个凋亡小体/10个隐窝)、修复性变化等造成的隐窝破坏. 上皮细胞的改变通常为弥漫性伴有单个核炎细胞浸润, 炎细胞以淋巴细胞为主, 可见嗜酸性粒细胞, 偶见中性粒细胞的浸润, 可累及黏膜固有层及更深层的肠壁. 炎症程度与排斥反应持续时间长短相关. 轻度绒毛结构破坏, 无黏膜溃疡; (4)中度ACR: 轻度ACR中的改变分布更为广泛、严重. 凋亡小体增多(>6个凋亡小体/10个隐窝), 常见局部的"融合凋亡"现象, 可见中至重度的单个核炎细胞浸润, 可累及黏膜固有层及更深层的肠壁; 炎症程度与排斥反应持续时间无关. 可见局限的黏膜糜烂, 如连续的几个细胞或一个绒毛的局部, 但并非必要条件; (5)重度ACR: 显著的隐窝损伤和破坏, 较长时间的排斥可伴有隐窝消失. 隐窝凋亡程度不一, 部分残存的隐窝可无显著的凋亡, 隐窝上皮通常表现为排斥相关的改变; 出现广泛的黏膜糜烂或溃疡; 广泛、显著的炎细胞浸润, 包括淋巴细胞、嗜酸性粒细胞及中性粒细胞. 长期的排斥反应常导致肠形态结构的完全消失, 仅表现为肉芽组织及纤维化脓性渗出. 可见明显的血管炎, 但并不常见.
1.2.3 小肠AMR血管改变的病理学分级标准[6]: (1)0级: 无血管改变; (2)1级: 轻微血管改变, 极少见到血管中炎细胞黏附现象; (3)2级: 中度血管改变, 可见50%以上的血管存在炎细胞黏附; (4)3级: 重度血管损伤, 可见炎细胞浸润血管壁全层, 伴有血管壁的坏死或纤维素沉积.
送检为手术切除之移植小肠, 于肠系膜内剥离出手术吻合的肠系膜上动脉及肠系膜上静脉, 于肠系膜上动脉内见多处血栓形成, 主要位于血管分叉处, 血栓形成处血管壁僵硬, 弹性消失, 血栓远心端血管壁溶解坏死呈紊状. 剥离的肠系膜上静脉长6 cm, 距血管断端4 cm处可见2个分枝, 第1分枝长3.5 cm, 第2分枝长1.8 cm, 管腔外膜呈灰白色, 管壁软, 弹性消失. 切除的小肠肠管长217 cm, 一侧切缘周径为5.5 cm, 另一侧切缘周径为4 cm, 小肠黏膜呈红褐色, 黏膜皱襞存在, 光滑; 肠壁节段性水肿, 水肿处黏膜皱襞增宽, 黏膜下层显著增厚. 肠系膜内检出淋巴结8枚, 均呈红褐色, 大者直径1.5 cm, 小者直径0.8 cm.
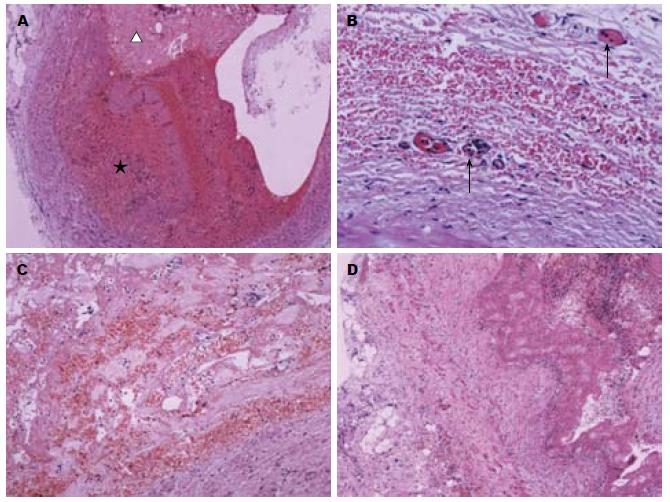
2.2.1 肠系膜上动脉及静脉内变化: 肠系膜上动脉主干及多个分枝动脉内见血栓形成(图1A), 局部血管壁发生纤维素性透壁性坏死. 血管壁的病变呈节段性, 血管壁各层均见不同程度的病变, 以外膜改变最为严重. 病变最重的区域见血管外膜组织结构消失, 呈纤维素样坏死, 其间散在中性粒细胞及多量红细胞(图1B). 病变较轻的区域内尚可见少量脂肪细胞, 于毛细血管中可见中性粒细胞附壁伴有显著淤血, 间质内多量红细胞外渗; 部分毛细血管内皮细胞肿胀, 纤维素性血栓形成(图1C). 血管壁中膜表现为平滑肌细胞纤维素性坏死, 部分表现为纤维素样物质残留, 部分完全溶解消失, 仅残余血管内膜; 坏死灶周围中膜平滑肌黏液变性. 血管内膜水肿, 内皮细胞消失, 局部仅见残留的内弹力层. 血管改变分级为3级.
肠系膜上静脉内见附壁血栓形成, 血管腔内见多量纤维素样物质, 血管内膜可见多量中性粒细胞附壁、聚集; 中膜内少量中性粒细胞浸润; 外膜见毛细血管内淤血, 局部白细胞附壁, 间质内可见中性粒细胞漏出(图1D). 血管改变分级为3级. 肠系膜周围脂肪组织中小血管内亦可见白细胞附壁, 红细胞于血管腔内黏附、堆积伴有血浆样物质渗出, 表现为血栓形成的早期改变; 局部脂肪组织中于淤血的毛细血管周围见纤维素样坏死及多量中性粒细胞浸润.
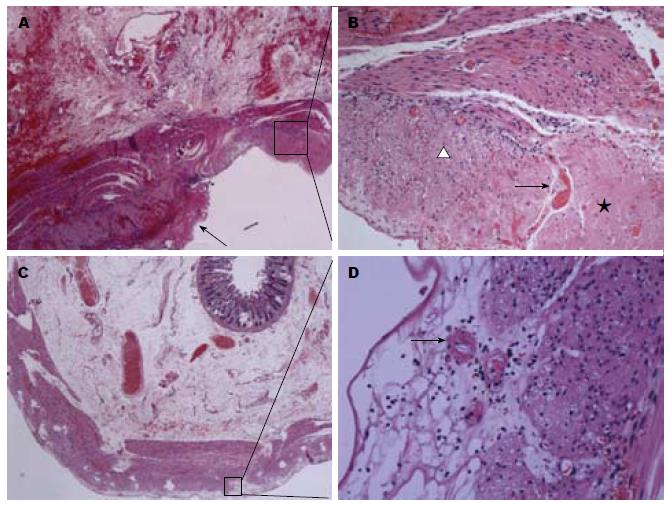
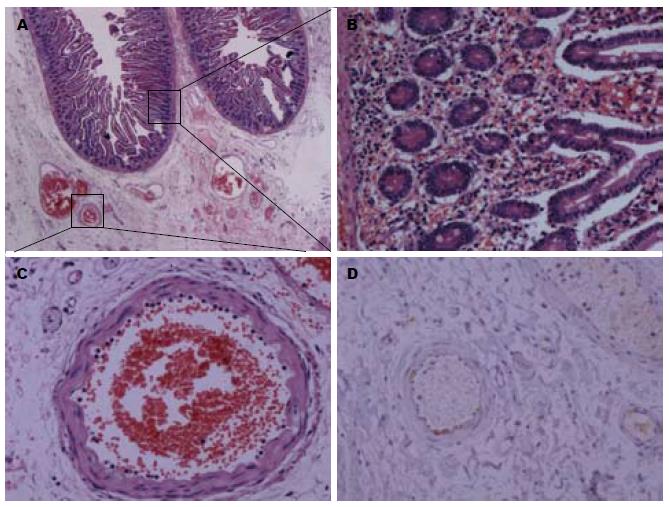
2.2.2 小肠壁内血管变化: 小肠壁内可见3级血管改变, 以浆膜下层病变最为显著(图2A, B). 可见小血管壁纤维素性坏死, 间质水肿伴大量中性粒细胞浸润, 局部小肠深肌层平滑肌细胞纤维素性坏死, 浆膜层可见多量纤维素样物质沉积. 在病变较轻的区域仅见小血管的纤维素性坏死, 间质水肿伴少量淋巴细胞浸润(图2C, D). 黏膜下层显著水肿, 血管淤血扩张, 大量红细胞漏出. 于少量黏膜下层小动脉内可见中性粒细胞边集、附壁现象(图3A, C), 偶见血栓形成; 部分毛细血管内皮细胞肿胀, 偶见纤维素性血栓形成. 伴有中性粒细胞附壁现象及血栓形成的血管与黏膜下层水肿区分布在肠壁不同节段. 在显著水肿区域内的血管中未见血栓形成及中性粒细胞附壁现象, 仅表现为显著的血管扩张及淤血; 在血栓形成及中性粒细胞附壁小血管周围区域仅轻度水肿. 黏膜固有层内见毛细血管显著扩张伴淤血, 偶见白细胞附壁现象及血栓形成, 间质轻度水肿, 大量红细胞外渗.
2.2.3 小肠黏膜的形态观察: 小肠黏膜慢性炎症, 部分绒毛表面上皮脱落, 间质内见少量淋巴细胞及嗜酸性粒细胞浸润, 可见大量漏出的红细胞. 隐窝上皮核分裂象易见, 可见嗜酸性粒细胞浸润隐窝上皮; 未见急性排斥反应(图3B).
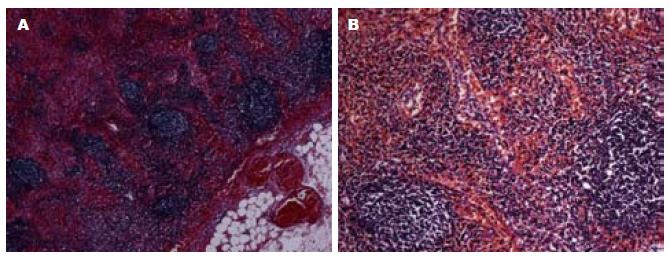
2.2.4 肠系膜淋巴结的变化: 淋巴结被膜内见血管扩张伴显著充血, 未见血栓形成(图4A), 淋巴结内淋巴窦显著扩张伴大量出血(图4B). 淋巴结皮质区、副皮质区及髓质内淋巴组织未见著变.
免疫组织化学染色示部分毛细血管、微动脉、小动脉及肠系膜上静脉的内皮细胞或基底膜见C4d沉积(图3D). 在黏膜下层内伴有白细胞附壁现象的小血管中可见C4d于内皮细胞或基底膜上沉积, 而绒毛及动静脉滋养血管内未见C4d沉积.
本文详细描述了1例发生于术后40 h的重度AMR的病理形态学改变. 其改变主要表现为小血管的纤维素性坏死或血管内血栓的形成, 间质内中性粒细胞浸润, 红细胞漏出. 组织坏死主要表现为纤维素性坏死. 移植物内血管广泛受累, 包括肠壁及肠系膜内的各级血管. 直接受累者以肠壁浆膜下层内的小血管及动静脉的滋养血管病变最为显著. 黏膜固有层内血管显著扩张伴淤血, 偶见血栓形成, 肠黏膜隐窝上皮细胞正常, 未见急性排斥反应.
相较急性排斥反应, 小肠移植中AMR的发生率较低, 在Pittsburgh大学报道的453例患者进行的500例次小肠及多脏器移植中, 仅13例单独小肠移植发生病理证实的AMR[7], 发生排斥反应的患者其淋巴细胞毒试验均强阳性. 严重的超急性排斥仅见于个案报道[8,9]. 在文献中对小肠移植急性AMR的病理学改变的描述主要集中在黏膜固有层中小血管的改变, 包括小血管内白细胞附壁、严重充血、纤维素性血栓形成及血管壁的纤维素性坏死[6,10].
在AMR中造成机体损伤的机制是补体经典途径的激活, C4d是这一过程中的产物之一, 不同于其他因子, C4d可以共价结合血管内皮细胞或基底膜, 可在病变部位存在数天或数周, 这一特性也使在组织中检测C4d成为可能. 2007版Banff工作分类进一步明确了急性及慢性AMR的病理学诊断标准, C4d阳性成为诊断AMR重要条件之一[10]. 在肾移植中, 诊断AMR时, 要求C4d在50%以上的肾小管周围毛细血管中呈弥漫强阳性, C4d的阳性程度也与移植物的预后密切相关, C4d的阳性程度能够反应特异性抗体(donor specific antigen, DSA)的存在[11,12]; C4d还常与急性或慢性排斥反应共同存在[13]. 但在小肠移植中C4d沉积与移植物预后的关系尚待明确. de Serre等[14]对12例小肠移植患者肠黏膜活检标本中C4d沉积与循环抗体关系进行了评估, 发现C4d在37%的病例中表达; 其中部分存在急性排斥反应, 部分病例未发生急性排斥反应; 在血管严重损伤的患者中C4d的阳性率达50%. 所有12例患者均未发现DSA, 仅1例存在抗HLA IB抗体. 在de Serre的研究中未发现C4d的沉积与移植物预后相关, 但在1例存在DSA的小肠移植超急性排斥反应中, 可以检测到C4d在血管内的强阳性沉积[7], 因此, C4d在小肠移植中的意义还有待进一步的研究. 另外, C4d的检测方法有免疫组织化学染色及免疫荧光两种检测方法, 应用免疫荧光检测其敏感性要高于免疫组织化学染色. 但免疫荧光检测仅适用于新鲜标本, 而本例仅有石蜡包埋标本, 因而采用了免疫组织化学染色的方法. 敏感性的降低可能会影响部分血管中C4d的检出, 但在本例中存在3级病变的血管中可以见到C4d的沉积, 提示补体的活化参与了病变的发生. 小肠黏膜中并未发现急性排斥反应, 说明在本病例中C4d的存在与细胞性排斥反应无关.
存在以下因素的患者由于存在对HLA抗原的致敏发生AMR的可能性较大, 包括妊娠、输血史、移植病史等. 在小肠移植中AMR的发生多与DSA的存在相关或存在显著的淋巴细胞毒反应, 但本例无针对HLAⅠ及Ⅱ型抗原的PRA, 淋巴细胞毒反应仅为2%; 考虑此AMR的发生可能与患者此前发生的多次感染或输血相关. 供体与患者原来接触过的抗原存在交叉反应, 移植物激活了体内的记忆性B淋巴细胞并产生抗体, 从而诱发了AMR的发生.
在补体活化的过程中产生的C3a和C5a是强烈的炎症因子, 可以趋化中性粒细胞从而引起炎症反应; 在补体活化的同时还可以激活凝血系统造成组织缺血及血栓形成. 补体活化最终生成的膜攻击复合物可以破坏细胞膜造成细胞及细胞外间质的溶解以及组织的坏死. 在组织中我们可以发现在病变血管周围组织水肿伴有多量中性粒细胞浸润及纤维素样物质沉积, 可能与补体活化后血管通透性增加, 补体活化过程中产生的各种细胞因子漏出至组织液中相关. 血管壁中膜及肠壁深肌层平滑肌细胞的纤维素样坏死可能与补体的细胞溶解作用相关.
小肠黏膜活检是评价移植肠功能状态的常规手段, 通过对小肠黏膜的观察判断是否存在排斥反应. 随着对AMR认识的深入, 小肠移植中AMR病理形态评价体系也在探讨之中, 2003年迈阿密大学的研究者结合其他器官移植中血管排斥反应的病理形态根据病变血管的数量及病变程度对小肠移植中黏膜血管在AVR中的改变进行了分级[6]. 在本例中可以看到病变最为严重的血管并不是黏膜内的血管, 并且黏膜内的病变血管也不是普遍存在. 病变的肠壁呈节段性水肿, 在非水肿区内血管的病变较水肿肠壁内血管病变严重. 因此凭借对黏膜内血管的评估并不能反应真正的病变程度, 黏膜活检的取材部位对病变的判断也有重要的影响. 目前还缺乏早期发现AMR的手段, Selvaggi等[15]介绍通过超声多普勒来检查血管状况, 伴有多发性血栓的患者建议进一步静脉造影. 本例患者在术后40 h超声造影示血管通畅, 4 h后再次造影则小肠绊血管不能显示, 提示血栓形成可能, 因此如何动态监测并及早发现AMR的存在尚需进一步探讨.
肠系膜内淋巴结在肠道免疫防御体系中处于中心地位, 对于肠道内的食物抗原、共生微生物及其产物免疫耐受均在肠系膜淋巴结内诱导产生; 同时滤过肠道共生菌的活菌, 防止其进入全身的免疫循环系统[16]. 肠系膜淋巴结是肠归巢T细胞产生所必需的, 在维持肠道正常免疫状态中具有重要的作用[17,18]. 缺乏肠系膜淋巴结的动物将引起肠道微生物的反复感染, 肠道活菌进入循环系统后造成脾肿大和淋巴结炎[19]. 在小肠移植中, 肠系膜中的淋巴结也为供者与受者之间免疫反应的进行提供了场所. 在移植物肠系膜淋巴结内的供体淋巴细胞将逐步被受体淋巴细胞取代, 在小鼠体内发现移植术后24 h内移植物内淋巴结中IL-2、4、6、10等细胞因子显著升高; 提示在肠系膜淋巴结内的免疫反应可能不受与移植术同时进行的免疫抑制的控制[20]. 在大鼠的实验中发现在发生急性或慢性排斥反应之前, 肠系膜淋巴结中可以出现淋巴细胞的凋亡和细胞因子水平的改变, 这些改变与移植物的预后密切相关. 小肠移植物内的淋巴组织包括Peyer's斑及肠系膜淋巴结中可以发现活化的供体淋巴细胞, 认为这些淋巴组织与移植物抗宿主病的发生密切相关[21]. 更多关于肠系膜淋巴结的报道多集中于移植物抗宿主病, 但在AMR中尚未见关于淋巴结的报道. 本病例中仅见淋巴结被膜内血管显著扩张伴淤血, 淋巴窦内窦组织细胞增生, 伴大量出血, 局灶间质内见含铁血黄素沉积. 所见病变与肠壁和肠系膜内的非特异性反应相同.
早期、轻度的AMR可以得到成功救治. 目前对于AMR的治疗主要基于以下4个方面[22]: (1)抑制T细胞依赖的抗体反应; (2)去除循环抗体; (3)抑制残留的抗体; (4)抑制或去除B细胞. 目前文献报道的治疗方案均为在此基础上进行一定的调整, 但报道的成功率并不一致. 另外, 补体的损伤机制是基于C5的活化及膜攻击体的形成, 因此抗C5抗体eculizumab在AMR中的应用也有报道. 目前这些治疗方案最大的缺陷是均为某一个中心的经验总结, 缺乏多中心的随机对照研究.
总之, 本文详细总结了1例发生在术后40 h的加速性排斥反应, 其病理分类表现为重度急性AMR, 主要病理形态学改变表现为血管壁的纤维素性坏死及血管内血栓形成. 免疫组织化学C4d阳性表达是诊断AMR的重要辅助手段. 病变广泛累及移植物内各级血管, 但肠黏膜固有层内血管并不一定反应最严重的病变, 因此在小肠移植的患者, 除了常规活检监测排斥反应的发生外, 对于存在高危因素的患者还应结合临床及内镜表现以及超声造影等手段, 及早发现AMR的发生, 以便及时救治.
小肠移植是目前解决小肠功能衰竭的根本性手段, 他不同于其他器官移植之处在于与移植物内同时存在的大量供体淋巴组织, 包括小肠内的黏膜相关淋巴组织及肠系膜内淋巴结, 因此, 小肠移植中排斥反应的发生远高于其他器官移植.
朱亮, 副教授, 大连医科大学生理教研室
随着研究的进展, 小肠移植中的细胞性排斥反应的病理学分级及临床治疗均有较大进步, 而抗体介导的排斥反应在小肠移植中少见报道, 治疗方式也在探索之中. 目前文献中未见急性抗体介导排斥反应病理学改变的详细报道.
本研究详细描述了1例急性抗体介导排斥反应的病理学改变, 发现最严重的病变发生于肠壁浆膜层及肠系膜内大血管, 而肠黏膜病变轻微, 提示常规的小肠黏膜活检并不能及时反应抗体介导排斥反应的发生与发展, 对于抗体介导排斥反应的发生与发展的临床监测可能需要其他手段.
抗体介导的排斥反应(AMR): 用以描述所有的与体液成分相关的排斥反应包括供体特异性抗体或反应性抗体如抗HLA抗体、ABO同种凝集素、抗内皮细胞抗体等, 以取代原来不确切的术语如血管性排斥反应、急性加速性排斥反应等.
该论文较全面的显示了1例小肠移植后急性抗体介导排斥反应的病理变化, 有一定的临床借鉴意义.
编辑: 张姗姗 电编:闫晋利
| 1. | Ruiz P, Kato T, Tzakis A. Current status of transplantation of the small intestine. Transplantation. 2007;83:1-6. [PubMed] [DOI] |
| 2. | Montgomery RA, Hardy MA, Jordan SC, Racusen LC, Ratner LE, Tyan DB, Zachary AA. Consensus opinion from the antibody working group on the diagnosis, reporting, and risk assessment for antibody-mediated rejection and desensitization protocols. Transplantation. 2004;78:181-185. [PubMed] [DOI] |
| 3. | Wu T, Abu-Elmagd K, Bond G, Nalesnik MA, Randhawa P, Demetris AJ. A schema for histologic grading of small intestine allograft acute rejection. Transplantation. 2003;75:1241-1248. [PubMed] [DOI] |
| 4. | Ruiz P, Bagni A, Brown R, Cortina G, Harpaz N, Magid MS, Reyes J. Histological criteria for the identification of acute cellular rejection in human small bowel allografts: results of the pathology workshop at the VIII International Small Bowel Transplant Symposium. Transplant Proc. 2004;36:335-337. [PubMed] [DOI] |
| 5. | Ruiz P, Weppler D, Nishida S, Kato T, Selvaggi G, Levi D, Bejarano P, Khaled A, Tryphonopoulos P, Tuteja S. International grading scheme for acute rejection in small bowel transplantation: implementation and experience at the University of Miami. Transplant Proc. 2006;38:1683-1684. [PubMed] [DOI] |
| 6. | Ruiz P, Garcia M, Pappas P, Berney T, Esquenazi V, Kato T, Mittal N, Weppler D, Levi D, Nishida S. Mucosal vascular alterations in isolated small-bowel allografts: relationship to humoral sensitization. Am J Transplant. 2003;3:43-49. [PubMed] [DOI] |
| 7. | Abu-Elmagd KM, Costa G, Bond GJ, Soltys K, Sindhi R, Wu T, Koritsky DA, Schuster B, Martin L, Cruz RJ. Five hundred intestinal and multivisceral transplantations at a single center: major advances with new challenges. Ann Surg. 2009;250:567-581. [PubMed] |
| 8. | Ruiz P, Carreno M, Weppler D, Gomez C, Island E, Selvaggi G, Nishida S, Moon J, Levi D, Tekin A. Immediate antibody-mediated (hyperacute) rejection in small-bowel transplantation and relationship to cross-match status and donor-specific C4d-binding antibodies: case report. Transplant Proc. 2010;42:95-99. [PubMed] [DOI] |
| 9. | Ruiz P, Suarez M, Nishida S, de la Cruz V, Nicolas M, Weppler D, Khaled A, Bejarano P, Kato T, Mittal N. Sclerosing mesenteritis in small bowel transplantation: possible manifestation of acute vascular rejection. Transplant Proc. 2003;35:3057-3060. [PubMed] [DOI] |
| 10. | Mosquera Reboredo JM, Vázquez Martul E. Diagnostic criteria of antibody-mediated rejection in kidney transplants. Nefrologia. 2011;31:382-391. [PubMed] |
| 11. | Solez K, Colvin RB, Racusen LC, Haas M, Sis B, Mengel M, Halloran PF, Baldwin W, Banfi G, Collins AB. Banff 07 classification of renal allograft pathology: updates and future directions. Am J Transplant. 2008;8:753-760. [PubMed] [DOI] |
| 12. | Loupy A, Hill GS, Suberbielle C, Charron D, Anglicheau D, Zuber J, Timsit MO, Duong JP, Bruneval P, Vernerey D. Significance of C4d Banff scores in early protocol biopsies of kidney transplant recipients with preformed donor-specific antibodies (DSA). Am J Transplant. 2011;11:56-65. [PubMed] [DOI] |
| 13. | Zhang PL, Malek SK, Blasick TM, Pennington JR, Masker KK, Lun M, Potdar S. C4d positivity is often associated with acute cellular rejection in renal transplant biopsies following Campath-1H (Alemtuzumab) induction. Ann Clin Lab Sci. 2007;37:121-126. [PubMed] |
| 14. | de Serre NP, Canioni D, Lacaille F, Talbotec C, Dion D, Brousse N, Goulet O. Evaluation of c4d deposition and circulating antibody in small bowel transplantation. Am J Transplant. 2008;8:1290-1296. [PubMed] [DOI] |
| 15. | Selvaggi G, Gyamfi A, Kato T, Gelman B, Aggarwal S, Begliomini B, Bennett J, Nishida S, Tzakis AG. Analysis of vascular access in intestinal transplant recipients using the Miami classification from the VIIIth International Small Bowel Transplant Symposium. Transplantation. 2005;79:1639-1643. [PubMed] [DOI] |
| 16. | Macpherson AJ, Smith K. Mesenteric lymph nodes at the center of immune anatomy. J Exp Med. 2006;203:497-500. [PubMed] [DOI] |
| 17. | Hammerschmidt SI, Ahrendt M, Bode U, Wahl B, Kremmer E, Förster R, Pabst O. Stromal mesenteric lymph node cells are essential for the generation of gut-homing T cells in vivo. J Exp Med. 2008;205:2483-2490. [PubMed] [DOI] |
| 18. | Molenaar R, Greuter M, van der Marel AP, Roozendaal R, Martin SF, Edele F, Huehn J, Förster R, O'Toole T, Jansen W. Lymph node stromal cells support dendritic cell-induced gut-homing of T cells. J Immunol. 2009;183:6395-6402. [PubMed] [DOI] |
| 19. | Macpherson AJ, Uhr T. Induction of protective IgA by intestinal dendritic cells carrying commensal bacteria. Science. 2004;303:1662-1665. [PubMed] [DOI] |
| 20. | Toogood GJ, Rankin AM, Tam PK, Morris PJ, Dallman MJ. The immune response following small bowel transplantation. II. A very early cytokine response in the gut-associated lymphoid tissue. Transplantation. 1997;63:1118-1123. [PubMed] [DOI] |
| 21. | Webster GA, Wood RF, Pockley AG. Identification of localized anti-host responses in the graft mesenteric lymph node and Peyer's patches after rat small bowel transplantation. Immunol Invest. 1997;26:517-529. [PubMed] [DOI] |
| 22. | Singh N, Pirsch J, Samaniego M. Antibody-mediated rejection: treatment alternatives and outcomes. Transplant Rev (Orlando). 2009;23:34-46. [PubMed] [DOI] |