修回日期: 2012-07-03
接受日期: 2012-08-01
在线出版日期: 2012-08-18
目的: 探讨胃癌患者术前腹腔冲洗液中组织金属蛋白酶抑制因子-3(tissue inhibitor of metalloproteinase 3, TIMP-3)基因启动子CpG岛异常甲基化与腹腔微转移的相关性.
方法: 应用甲基化特异性实时荧光聚合酶链反应技术检测92例胃癌患者术前腹腔冲洗液中TIMP-3基因启动子CpG岛甲基化状态, 分析TIMP-3基因异常甲基化与患者临床病理参数及预后之间的关系.
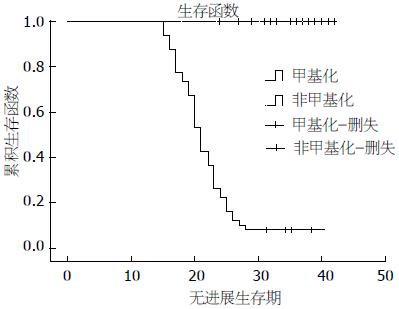
结果: 在92例胃癌患者术前腹腔冲洗液标本中, 有49(53.26%)例检测到了TIMP-3基因甲基化, 且TIMP-3基因甲基化与肿瘤大小(P = 0.013)、静脉侵犯(P = 0.030)和远处转移(P = 0.013)间均存在相关性, 与生长方式、分化程度、淋巴管侵犯、淋巴结转移、浸润深度和临床分期间存在显著相关性(P = 0.000), 而与性别、年龄、Helicobacter pylori感染状况以及肿瘤部位等不存在相关性(P分别为0.833、0.236、0.300、0.236). 生存分析发现TIMP-3基因非甲基化患者具有独立的生存优势(P = 0.000).
结论: 胃癌患者术前腹腔冲洗液游离DNA中TIMP-3基因异常甲基化可反映腹腔微转移发生, 并提示预后不良.
引文著录: 余江流, 韩静, 余齐鸣, 郑智国, 方铣华, 凌志强. 胃癌患者术前腹腔冲洗液游离DNA中TIMP-3基因甲基化与腹腔微转移的相关性. 世界华人消化杂志 2012; 20(23): 2194-2199
Revised: July 3, 2012
Accepted: August 1, 2012
Published online: August 18, 2012
AIM: To investigate the relationship between ectopic methylation of the tissue inhibitor of metalloproteinase 3 (TIMP-3) gene in preoperative peritoneal lavage fluid and peritoneal micrometastasis in patients with gastric cancer.
METHODS: Methylation-specific real-time polymerase chain reaction (qMSP) was used to detect the methylation status of CpG islands in the promoter of the TIMP-3 gene in 92 preoperative peritoneal lavage fluid samples. The relationship between ectopic methylation of the TIMP-3 gene and clinicopathologic features and prognosis was then analyzed.
RESULTS: Abberant TIMP-3 gene methylation occurred in 49 (53.26%) samples. Correlation was observed between TIMP-3 gene methylation and tumor size (P = 0.015), distant metastasis (P = 0.013) and venous invasion (P = 0.030), and there is a significant correlation between TIMP-3 gene methylation and tumor growth pattern, differentiation, lymph node metastasis and clinical stage (P = 0.000). However, the level of TIMP-3 methylation had no significant association with patient's gender and age, Helicobacter pylori infection, or lesion location (P = 0.833, 0.236, 0.300, 0.236, respectively). Survival analysis indicate that patients who had no TIMP-3 gene methylation had a higher survival rate (P = 0.000).
CONCLUSION: Ectopic methylation of TIMP-3 gene in preoperative lavage fluid samples is associated with peritoneal micrometastasis and poor prognosis in patients with gastric cancer.
- Citation: Yu JL, Han J, Yu QM, Zheng ZG, Fang XH, Ling ZQ. Correlation between TIMP-3 hypermethylation in peritoneal lavage fluid and peritoneal micrometastasis in patients with gastric cancer. Shijie Huaren Xiaohua Zazhi 2012; 20(23): 2194-2199
- URL: https://www.wjgnet.com/1009-3079/full/v20/i23/2194.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i23.2194
胃癌(gastric carcinoma)是世界上最常见的恶性肿瘤之一, 其发生发展是一个多基因参与的多阶段过程. 表观遗传学是近年来热门研究领域之一, 业已证实异常表观调控机制在胃癌的发生、发展中起着重要作用[1]. DNA甲基化是表观遗传的主要作用形式之一. DNA甲基化修饰主要发生在基因启动子CpG岛上, 是在甲基转移酶作用下由S-腺苷甲硫氨酸(S-adenosylmethionine, SAM)作为甲基供体将甲基转移到CpG岛胞嘧啶第5位碳原子上的过程[2,3]. 甲基化后的DNA构象发生改变, 从而影响基因表达.
迄今已发现众多肿瘤相关基因的失活都与其启动子区域的异常甲基化有关, 如hMLH1(human mutl homolog 1)、p16、CDH1等. 组织金属蛋白酶抑制因子-3(tissue inhibitor of metalloproteinase, TIMP-3)家族目前有4个已经确定的成员, 分别是TIMP-1、2、3和4, TIMP-1、2、4存在于细胞外空间, 而TIMP-3结合在细胞外基质上, 该家族成员的生物学功能是抑制基质金属蛋白酶(matrix metalloproteinases, MMP)的活性, 并参与调节多种细胞的增殖[4]. 本研究采用甲基化特异性实时荧光PCR(real-time methylation-specific PCR, real-time MSP)技术对92例胃癌患者术前腹腔冲洗液游离DNA中TIMP-3基因启动子区域CpG岛的甲基化状态进行检测, 并探讨其临床意义.
收集2008-01/2009-12浙江省肿瘤医院、浙江省人民医院及杭州市淳安县第一人民医院92例病理确诊的原发性胃腺癌患者术前腹腔冲洗液标本, 病例均经术前内镜活检病理确诊, 术后组织标本均经石蜡切片病理诊断证实, 术前均未行放疗和化疗. 92例患者中男53例、女39例; 年龄36-73岁, 平均年龄53.9岁; 肿瘤位置贲门30例、胃体31例、胃窦31例; 肿瘤直径<5 cm 60例、≥5 cm 32例; 高/中分化62例、低分化30例; 肿瘤生长方式(按Ming氏分型)为膨胀型20例, 浸润型72例; 浸润深度为T1/T2 38例、T3/T4 54例; 淋巴结转移阴性46例, 阳性46例; 静脉侵犯阴性69例, 阳性23例; 淋巴管侵犯阴性25例, 阳性67例; 远处转移阴性85例, 阳性7例; pTNM分期Ⅰ期17例、Ⅱ期29例, Ⅲ期37例、Ⅳ期9例. 收集所有患者术前腹腔冲洗液, 3 000 r/min离心10 min, 分离血液, 再12 000 r/min离心10 min, 取血细胞, 分装每管200 μL置-76 ℃备用.
全部患者由本研究组成员随访负责人专门跟踪随访, 具有完整的随访资料, 均自手术日计生存和随访时间, 至患者死亡或截止时间2011-06.
1.2.1 基因组DNA提取: 采用磁珠法试剂盒(Xygen公司)提取腹腔冲洗液中DNA. 200 μL冲洗液经裂解液处理后, 加入结合液和磁珠, DNA吸附于磁珠上, 以磁体吸附磁珠, 吸弃液体后, 经洗液多次清洗, 最后以洗脱液洗脱DNA, 吸出的上清液即为目的DNA. 以紫外分光光度计测定DNA浓度和纯度, 要求A260/A280比值在1.8-2.0之间. 1.5%琼脂糖凝胶电泳检测DNA完整性.
1.2.2 DNA亚硫酸氢盐修饰及扩增: 采用亚硫酸氢钠法修饰DNA并纯化回收, 按EpiTect Bisulfite(Qiagen公司)使用说明书操作. 10 μg基因组DNA内加入3 mol/L的NaOH裂解液5 μL, 37 ℃变性20 min, 加入2 mol/L(pH 5.0)亚硫酸氢钠520 μL和0.2 mol/L的氢醌30 μL, 50 ℃水浴16-18 h, 于1 mL DNA纯化树脂中加入DNA样品及8%异丙醇2 mL滤析, 3 mol/L的醋酸钠与100%乙醇沉淀, 离心弃上清, 自然干燥, 加20 μL TE溶液溶解, 采用全基因组扩增技术对亚硫酸氢盐修饰DNA进行扩增, -20 ℃保存.
1.2.3 Real-time MSP分析: 设计TIMP-3甲基化及非甲基化特异性引物序列如下: TIMP-3 (M)_(F)5'-CGTTTCGTTATTTTTTGTTTTCGGTTTC-3'; (R)5'-CCGAAAACCCCGCCTCG-3', 扩增子: 116 bp; TIMP-3(UM)_(F)5'-TTTTGTTTTGTTATTTTTTGTTTTTGGTTTT-3'; (R)5'-CCCCCAAAAACCCCACCTCA-3', 扩增子: 122 bp; 引物由Invitrogen公司合成. 在ABI7500 PCR(ABI system, 美国)仪器上对亚硫酸氢钠法修饰DNA进行real-time MSP分析, 按SYBR Premix Ex Taq Kit(TaKaRa公司)说明书进行. 各样品分别使用甲基化、非甲基化引物进行定量分析, 根据所测CT值通过标准曲线计算在各样品DNA中甲基化的拷贝数. 其甲基化百分率计算公式如下: 甲基化百分率(M%) = 100×(甲基化DNA拷贝数÷甲基化与非甲基化DNA拷贝数之和). 甲基化DNA拷贝数+非甲基化DNA拷贝数的总和用作靶基因DNA总拷贝数. M%<20.0为0分, 20.0<M%<40.0为1分, 40.0<M%<60.0为2分, 60.0<M%<80.0为3分, M%>80.0为4分; 0分定义为非甲基化、1-3分为部分甲基化, 4分为完全甲基化. PCR反映结束后由溶解曲线判定扩增结果: 其中出现甲基化扩增信号, 而没有非甲基化信号的判定为甲基化(M); 出现非甲基化产物信号而没有甲基化产物信号的判定为非甲基化(U); 同时出现甲基化和非甲基化产物信号的判定为半甲基化结果(UM). 用在体外经Sss Ⅰ甲基转移酶处理过的人类基因组DNA(NEB公司)作为阳性对照, 未处理的正常人外周血DNA作为阴性对照, 蒸馏水代替模板作为阴性对照.
统计学处理 应用SPSS18.0统计学软件, 各组间率的差异统计学意义比较采用χ2检验、似然比χ2检验或Fisher确切概率法, 用乘积极限法(Kaplan-Meier)进行单因素生存分析并绘制生存曲线, 对数秩检验(Log-Rank Test)进行生存曲线比较, 用Cox比例风险回归模型进行多因素生存分析, 显著性检验采用Wald检验. P<0.05有统计学意义.
在92例胃癌患者的术前腹腔冲洗液标本中, TIMP-3基因启动子区域CpG岛完全甲基化有28(30.43%)例, 部分甲基化有21(22.83%)例, 未甲基化的有43(46.74%)例. 本实验将完全甲基化和部分甲基化均做异常甲基化计, 则92例胃癌患者腹腔冲洗液中TIMP-3基因的异常甲基化率达53.26%(49/92).
患者的年龄、性别、有无幽门螺杆菌(Helicobacter pylori, H. pylori)感染, 以及肿瘤位置与TIMP-3基因的甲基化状态差异无统计学意义(P>0.05), TIMP-3基因甲基化状态与静脉侵犯和远处转移相关(表1, P<0.05), 而TIMP-3基因甲基化状态与肿瘤的生长方式、分化程度、淋巴管侵犯、浸润深度和临床分期之间有显著相关性. 膨胀型和浸润型的甲基化率分别为15%(3/20)和63.9%, 两者差异显著(P = 0.000); 高中分化和低分化的甲基化率分别是38.7%(24/62)和83.3%(25/30), 差异有统计学意义(P = 0.000); TIMP-3基因甲基化与淋巴管侵犯间有显著的相关性(P = 0.000), 阴性患者TIMP-3基因甲基化率为35.82%(24/67), 阳性患者的甲基化率高达100%(25/25); 另外, TIMP-3基因甲基化与胃肿瘤的浸润深度和淋巴结转移也有显著的相关性(P = 0.000), T1、T2患者甲基化率为20.1%, T3、T4患者的甲基化率为75.9%, N0的患者甲基化率是10.9%, N1-N3的患者甲基化率高达95.7%. 在本实验所考虑的13项临床病例和其他特征中, 肿瘤的临床分期与TIMP-3基因甲基化之间的相关性最为显著(P = 0.000), Ⅰ/Ⅱ期患者的甲基化率为8.7%, 而Ⅲ/Ⅳ期患者的甲基化率高达97.8%.
| 临床病理特征 | n | TIMP-3基因(n) | χ2值 | P值 | |
| 甲基化 | 非甲基化 | ||||
| 性别 | 0.106 | 0.833 | |||
| 男 | 53 | 29 | 24 | ||
| 女 | 39 | 20 | 19 | ||
| 年龄 | 1.758 | 0.236 | |||
| <60 | 68 | 39 | 29 | ||
| ≥60 | 24 | 10 | 14 | ||
| H. pylori | 1.218 | 0.300 | |||
| (-) | 50 | 24 | 26 | ||
| (+) | 42 | 25 | 17 | ||
| 肿瘤位置 | 1.753 | 0.236 | |||
| 贲门 | 30 | 18 | 12 | ||
| 胃体/胃窦 | 62 | 31 | 31 | ||
| 肿瘤大小 | 6.829 | 0.015 | |||
| <5 cm | 60 | 26 | 34 | ||
| ≥5 cm | 32 | 23 | 9 | ||
| 生长方式 | 22.033 | 0.000 | |||
| 膨胀型 | 20 | 3 | 17 | ||
| 浸润型 | 72 | 46 | 26 | ||
| 分化程度 | 16.172 | 0.000 | |||
| 高/中 | 62 | 24 | 38 | ||
| 低 | 30 | 25 | 5 | ||
| 淋巴管侵犯 | 30.125 | 0.000 | |||
| 阴性 | 67 | 24 | 43 | ||
| 阳性 | 25 | 25 | 0 | ||
| 静脉侵犯 | 5.254 | 0.030 | |||
| 阴性 | 69 | 32 | 37 | ||
| 阳性 | 23 | 17 | 6 | ||
| 浸润深度 | 26.979 | 0.000 | |||
| T1/T2 | 38 | 8 | 30 | ||
| T3/T4 | 54 | 41 | 13 | ||
| 淋巴结转移 | 66.413 | 0.000 | |||
| N0 | 46 | 5 | 41 | ||
| N1-3 | 46 | 44 | 2 | ||
| 远处转移 | 6.649 | 0.013 | |||
| M0 | 85 | 42 | 43 | ||
| M1 | 7 | 7 | 0 | ||
| 临床分期 | 73.399 | 0.000 | |||
| I/II期 | 46 | 4 | 42 | ||
| III/IV期 | 46 | 45 | 1 | ||
对所有入组病例进行了术后跟踪随访, 以发生复发、转移或死亡作为随访终点事件, 统计无进展生存期(progress free survival, PFS). 随访截止到2011-06, 92例胃癌患者中43例TIMP-3基因未甲基化病例均没有出现疾病进展或者死亡, 49例TIMP-3基因甲基化的患者只有4例没有出现疾病进展, 其他45例随访15-28 mo时全部出现进展或者死亡, 两者之间的差异显著. 作Kaplan-Meier分析, 提示TIMP-3基因非甲基化患者具有明显的生存优势(P = 0.000, 图1). 对实验结果进行Cox回归分析, 分析结果显示肿瘤的临床分期和TIMP-3基因的甲基化状态是胃癌患者术后生存率的独立影响因子, 相对危险度(relative risk, RR)分别为307.058(95%CI: 21.190-4 449.397)和157.300(95%CI: 12.065-2 050.880), 即Ⅲ/Ⅳ期患者术后发生肿瘤进展的可能性是Ⅱ期患者的307.876倍, TIMP-3基因甲基化的患者术后发生肿瘤进展的可能性是非甲基化患者的157.300倍. 肿瘤大小对术后进展的影响较小(RR = 2.425, 95%CI: 1.350-4.359), 其他临床病例特征与术后进展间相关性均无统计学意义.
TIMP-3基因位于22号染色体的q13.1位置, 表达21 kDa蛋白, 具有抑制上皮细胞转移、抑制肿瘤血管生成、抑制细胞增殖及促进细胞分化和凋亡的功能[5-9]. Ebrahem等[10]和Janssen等[5]通过小鼠实验证实TIMP-3抑制血管内皮生长因子调节的血管生成. miRNA调节和DNA甲基化都能引起TIMP-3表达缺失, 从而导致肿瘤的发生发展[11].
肿瘤的发生发展与表观遗传有着密切的联系, 以甲基化、乙酰化和microRNA调控等组成的表观遗传调控网络在恶性肿瘤中起着至关重要的作用[12,13]. CpG岛异常甲基化可导致基因表达沉默, 业已证实众多肿瘤抑制基因, 如DAPK(death-associated protein kinase)、BNIP3、p16和CDH5等基因的异常甲基化与肿瘤的发生发展关系密切, 是肿瘤发生的始动因素之一[14-16]. Gu等[17]对胃癌组织中TIMP-3基因甲基化进行了研究, 发现散发型胃癌患者中存在较高频率的TIMP-3异常甲基化现象, 且与肿瘤细胞低分化和患者低生存率相关(P = 0.04). 本研究发现在胃癌患者术前腹腔冲洗液游离DNA中同样存在较高频率的TIMP-3异常甲基化, 且低分化胃癌患者TIMP-3基因甲基化率显著高于高中分化患者, 提示TIMP-3基因可能调节细胞的分化过程. Bernot等[9]研究发现TIMP-3基因在处于分化状态的细胞中表达量降低, 并在分化完成的细胞中恢复表达, 他们进一步研究显示TIMP-3蛋白可抑制转录因子Klf4基因和增强子结合蛋白β(enhancer-binding protein β, EBPβ)的表达, 从而抑制细胞分化.
TIMP-3基因异常甲基化的胃癌患者术后DFS明显低于TIMP-3非甲基化患者, TIMP-3基因甲基化可以作为胃癌患者独立的预后因子(P = 0.000). Castro等[18]应用甲基化特异性多重连接探针扩增技术对7株肺癌细胞株和54例肺癌组织中TIMP-3基因甲基化状况进行检测, 结果显示TIMP-3基因甲基化率在肺鳞癌和肺腺癌之间存在显著性差异, 且TIMP-3基因异常甲基化与肺癌患者的预后相关. Peterson等[19]实验表明TIMP-2、3与乳腺癌患者生存率相关, 并影响患者的治疗敏感性.
我们将胃癌患者的性别、年龄等13项临床病理特征与TIMP-3基因甲基化水平的关系进行分析, 结果显示TIMP-3基因甲基化与不同年龄、性别、H. pylori感染状况及肿瘤部位之间均不存在显著性差异. 然而, TIMP-3基因甲基化水平在不同肿瘤大小的患者间存在显著性差异, 这与TIMP-3参与细胞增殖调控理论[4]相吻合. TIMP-3基因甲基化与胃癌不同生长方式、淋巴管或静脉管侵犯与否、TNM分期及临床分期之间分别存在显著性差异, 提示胃癌术前冲洗液游离DNA中TIMP-3基因甲基化状态在一定程度上可以反映胃癌的进展情况及恶性程度. Smith等[20]发现食管癌组织中TIPMP-3基因甲基化水平与患者年龄、性别、肿瘤大小、分化程度、临床分期及患者生存率均无相关性. 是否TIMP-3基因在食管癌与胃癌中存在着组织差异性有待进一步研究证实.
总之, TIMP-3基因启动子区域CpG岛异常甲基化是TIMP-3基因表达缺失的主要机制之一, 在胃癌进展中起着重要作用. 胃癌患者术前腹腔冲洗液游离DNA中TIMP-3基因甲基化水平可在一定程度上反映肿瘤的进展程度, 并提示患者预后不良, 可为临床胃癌诊治及预后评估提供客观依据.
DNA甲基化是不涉及DNA序列改变的修饰, 是DNA 的一种可逆变化, 他可以改变DNA分子的高级结构, 改变基因的转录活性, 从而影响基因的表达水平.
陈国忠, 主任医师, 广西中医学院第一附属医院消化内科
目前DNA甲基化研究主要有: 特定基因甲基化与疾病的相关性研究、特定基因甲基化与患者药物敏感性及耐药性研究、甲基化逆转在疾病治疗中的作用.
Gu等研究发现散发型胃癌患者中存在较高频率的TIMP-3异常甲基化现象, 且与肿瘤细胞低分化和患者低生存率相关; Peterson等研究报道TIMP-2、TIMP-3与乳腺癌患者生存率相关, 并影响患者的治疗敏感性.
本研究探讨胃癌患者腹腔冲洗液游离DNA中TIMP-3基因甲基化与患者临床病理特征及预后的关系, 相对于手术切取组织标本, 本实验具有微创性.
胃癌患者术前腹腔冲洗液游离DNA中TIMP-3基因甲基化水平可在一定程度上反映肿瘤的进展程度, 并提示患者预后不良, 可为临床胃癌诊治及预后评估提供客观依据.
CpG岛: 基因组中长度为300-3 000 bp的富含CpG二核苷酸的一些区域, 主要存在于基因5'的启动子区域. 启动子区中CpG岛的未甲基化状态是基因转录所必需的, 而CpG序列中C的甲基化可导致基因转录被抑制.
DNA甲基化是表观遗传学的重要内容之一, 在肿瘤的发生发展转移过程中起着重要作用. 本研究设计合理, 研究方法先进, 具有一定的科学性和创新性.
编辑: 张姗姗 电编:鲁亚静
| 1. | Hou L, Wang H, Sartori S, Gawron A, Lissowska J, Bollati V, Tarantini L, Zhang FF, Zatonski W, Chow WH. Blood leukocyte DNA hypomethylation and gastric cancer risk in a high-risk Polish population. Int J Cancer. 2010;127:1866-1874. [PubMed] [DOI] |
| 2. | Luo J, Li YN, Wang F, Zhang WM, Geng X. S-adenosylmethionine inhibits the growth of cancer cells by reversing the hypomethylation status of c-myc and H-ras in human gastric cancer and colon cancer. Int J Biol Sci. 2010;6:784-795. [PubMed] [DOI] |
| 3. | Corvalan AH, Maturana MJ. Recent patents of DNA methylation biomarkers in gastrointestinal oncology. Recent Pat DNA Gene Seq. 2010;4:202-209. [PubMed] [DOI] |
| 4. | Li F, Curry TE. Regulation and function of tissue inhibitor of metalloproteinase (TIMP) 1 and TIMP3 in periovulatory rat granulosa cells. Endocrinology. 2009;150:3903-3912. [PubMed] [DOI] |
| 5. | Janssen A, Hoellenriegel J, Fogarasi M, Schrewe H, Seeliger M, Tamm E, Ohlmann A, May CA, Weber BH, Stöhr H. Abnormal vessel formation in the choroid of mice lacking tissue inhibitor of metalloprotease-3. Invest Ophthalmol Vis Sci. 2008;49:2812-2822. [PubMed] [DOI] |
| 6. | Zerrouqi A, Pyrzynska B, Febbraio M, Brat DJ, Van Meir. EG.P14ARF inhibits human glioblastoma-induced angiogenesis by upregulating the expression of TIMP3. Clin Invest. 2012;122:1283-1295. [PubMed] [DOI] |
| 7. | Lee JK, Shin JH, Suh J, Choi IS, Ryu KS, Gwag BJ. Tissue inhibitor of metalloproteinases-3 (TIMP-3) expression is increased during serum deprivation-induced neuronal apoptosis in vitro and in the G93A mouse model of amyotrophic lateral sclerosis: a potential modulator of Fas-mediated apoptosis. Neurobiol Dis. 2008;30:174-185. [PubMed] [DOI] |
| 8. | Yang Y, Jalal FY, Thompson JF, Walker EJ, Candelario-Jalil E, Li L, Reichard RR, Ben C, Sang QX, Cunningham LA. Tissue inhibitor of metalloproteinases-3 mediates the death of immature oligodendrocytes via TNF-α/TACE in focal cerebral ischemia in mice. J Neuroinflammation. 2011;8:108. [PubMed] [DOI] |
| 9. | Bernot D, Barruet E, Poggi M, Bonardo B, Alessi MC, Peiretti F. Down-regulation of tissue inhibitor of metalloproteinase-3 (TIMP-3) expression is necessary for adipocyte differentiation. J Biol Chem. 2010;285:6508-6514. [PubMed] [DOI] |
| 10. | Ebrahem Q, Qi JH, Sugimoto M, Ali M, Sears JE, Cutler A, Khokha R, Vasanji A, Anand-Apte B. Increased neovascularization in mice lacking tissue inhibitor of metalloproteinases-3. Invest Ophthalmol Vis Sci. 2011;52:6117-6123. [PubMed] [DOI] |
| 11. | Garofalo M, Di Leva G, Romano G, Nuovo G, Suh SS, Ngankeu A, Taccioli C, Pichiorri F, Alder H, Secchiero P. miR-221& amp; 222 regulate TRAIL resistance and enhance tumorigenicity through PTEN and TIMP3 downregulation. Cancer Cell. 2009;16:498-509. [PubMed] [DOI] |
| 12. | Sharma S, Kelly TK, Jones PA. Epigenetics in cancer. Carcinogenesis. 2010;31:27-36. [PubMed] [DOI] |
| 13. | Wang B, Hsu SH, Majumder S, Kutay H, Huang W, Jacob ST, Ghoshal K. TGFbeta-mediated upregulation of hepatic miR-181b promotes hepatocarcinogenesis by targeting TIMP3. Oncogene. 2010;29:1787-1797. [PubMed] [DOI] |
| 14. | Sugita H, Iida S, Inokuchi M, Kato K, Ishiguro M, Ishikawa T, Takagi Y, Enjoji M, Yamada H, Uetake H. Methylation of BNIP3 and DAPK indicates lower response to chemotherapy and poor prognosis in gastric cancer. Oncol Rep. 2011;25:513-518. [PubMed] [DOI] |
| 15. | Wang X, Lau KK, So LK, Lam YW. CHD5 is down-regulated through promoter hypermethylation in gastric cancer. J Biomed Sci. 2009;16:95. [PubMed] [DOI] |
| 16. | Barzily-Rokni M, Friedman N, Ron-Bigger S, Isaac S, Michlin D, Eden A. Synergism between DNA methylation and macroH2A1 occupancy in epigenetic silencing of the tumor suppressor gene p16(CDKN2A). Nucleic Acids Res. 2011;39:1326-1335. [PubMed] [DOI] |
| 17. | Gu P, Xing X, Tänzer M, Röcken C, Weichert W, Ivanauskas A, Pross M, Peitz U, Malfertheiner P, Schmid RM. Frequent loss of TIMP-3 expression in progression of esophageal and gastric adenocarcinomas. Neoplasia. 2008;10:563-572. [PubMed] |
| 18. | Castro M, Grau L, Puerta P, Gimenez L, Venditti J, Quadrelli S, Sánchez-Carbayo M. Multiplexed methylation profiles of tumor suppressor genes and clinical outcome in lung cancer. J Transl Med. 2010;8:86. [PubMed] [DOI] |
| 19. | Peterson NB, Beeghly-Fadiel A, Gao YT, Long J, Cai Q, Shu XO, Zheng W. Polymorphisms in tissue inhibitors of metalloproteinases-2 and -3 and breast cancer susceptibility and survival. Int J Cancer. 2009;125:844-850. [PubMed] [DOI] |
| 20. | Smith E, De Young NJ, Tian ZQ, Caruso M, Ruszkiewicz AR, Liu JF, Jamieson GG, Drew PA. Methylation of TIMP3 in esophageal squamous cell carcinoma. World J Gastroenterol. 2008;14:203-210. [PubMed] [DOI] |