修回日期: 2011-11-20
接受日期: 2011-12-28
在线出版日期: 2012-01-18
目的: 探讨p38MAPK抑制剂通过Akt(蛋白激酶B)有关的信号途径对结肠癌细胞阿霉素(Doxorubicin)化疗敏感性的影响.
方法: 应用阿霉素(Dox)和p38MAPK特异性抑制剂SB203580及两者联合应用去处理结肠癌HCT-116细胞株. 采用MTT[3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐]法检测化疗药物对肿瘤细胞的生存抑制率, Western blot蛋白免疫印迹技术检测化疗药物处理后癌细胞Akt和磷酸化Akt的表达水平.
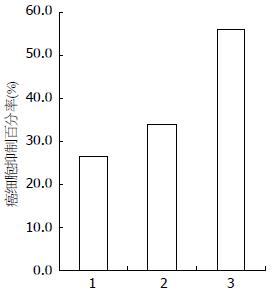
结果: MTT显示阿霉素和抑制剂SB203580对结肠癌细胞均有抑制作用(26.60%, 33.87%), 后者大于前者, 两者相同用量联合后癌细胞抑制率更明显(56.04%). Western blot显带说明阿霉素处理组较联合组的Akt表达水平并无明显差异, 而磷酸化的Akt水平较SB203580组和联合组显著升高. 亦即抑制剂组和联合组方案可降低结肠癌细胞磷酸化Akt的表达水平.
结论: p38MAPK抑制剂SB203580可能通过阻断P13K/Akt信号途径或其他有关Akt的通路以提高结肠癌细胞阿霉素化疗的敏感性.
引文著录: 李金鹏, 周巍, 张军, 于皆平, 于红刚. 联合应用p38MAPK抑制剂对降低结肠癌阿霉素耐药性的影响. 世界华人消化杂志 2012; 20(2): 145-148
Revised: November 20, 2011
Accepted: December 28, 2011
Published online: January 18, 2012
AIM: To evaluate whether SB203580, a p38MAPK inhibitor, reduces resistance of colon cancer HCT-116 cells to doxorubicin and to explore possible mechanisms involved.
METHODS: Doxorubicin alone or in combination with SB203580 was used to treat subcultured HCT-116 cells. After treatment, cell growth was determined by MTT assay, and Akt and p-AKt expression was detected by Western blotting.
RESULTS: Either doxorubicin or SB203580 inhibited HCT-116 cell growth, and the latter had a stronger inhibitory effect than the former (26.60% vs 33.87%). Combined use of doxorubicin and SB203580 had more strong inhibitory effect than treatment with either of them alone (56.04%). Expression of Akt showed no significant difference between cells treated with doxorubicin alone and those treated with combined doxorubicin and SB203580, while the phosphorylation of Akt was significantly higher in the doxorubicin group than in the combination group.
CONCLUSION: The p38 MAPK inhibitor SB203580 could block the Akt signaling pathways and increase the sensitivity of colon cancer cells to doxorubicin.
- Citation: Li JP, Zhou W, Zhang J, Yu JP, Yu HG. Use of p38 MAPK inhibitor reduces resistance of colon cancer cells to doxorubicin. Shijie Huaren Xiaohua Zazhi 2012; 20(2): 145-148
- URL: https://www.wjgnet.com/1009-3079/full/v20/i2/145.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i2.145
阿霉素(Doxorubicin)是一种临床上常用的抗生素类抗肿瘤药物, 但其有效治疗剂量下的心脏毒性和随着作用时间的推移靶癌细胞产生的分子学抵抗机制限制了该药抗癌作用的发挥[1]. 所在课题组的前期研究显示Akt(蛋白激酶B)的活化可能参与了胃癌细胞的抗凋亡信号反应[2]. PI3K/Akt(磷脂酰肌醇3'激酶/蛋白激酶B)和p38MAPK(丝裂原激活化蛋白激酶)通路在细胞生物生长中起着重要的作用, 且两条通路的酶级联反应有交叉作用, 可促进肿瘤细胞的增殖, 其选择性抑制剂LY294002和SB203580对多种实体肿瘤都有杀伤作用[3,4]. 本研究拟单独及联合应用阿霉素和p38MAPK通路抑制剂SB203580, 观察和探讨阿霉素联合应用SB203580体外实验方案对降低结肠癌细胞阿霉素耐药性的影响.
结肠癌HCT-116细胞购自中科院上海细胞库, 并由湖北省消化系疾病重点实验室传代保存. RPMI 1640培养基来源于美国Gibco公司; Akt抗体、磷酸化Akt抗体以及相关二抗试剂盒均为CST公司产品; 四甲基偶氮唑盐(MTT)、二甲基亚砜(DMSO)和抑制剂SB203580购自美国Sigma公司; 阿霉素(Doxorubicin)购自美国Alex公司; 提取总蛋白试剂盒及Western blot所需其他试剂购自碧云天生物技术研究所.
1.2.1 细胞培养: 传代培养结肠癌HCT-116细胞于含100 mL/L小牛血清的RPMI 1640培养液中. 50 mL/L CO2浓度、37 ℃培养环境下培养.
1.2.2 MTT检测细胞增殖: 用含100 mL/L胎牛血清的培养液将贴壁细胞配成单个细胞悬液, 浓度为10 000-20 000/mL, 每孔体积200 mL细胞接种到96孔板. 细胞贴壁后即加药. 每种处理设5个复孔, 对照(不加药物处理)5个孔, 阿霉素组5个孔, 抑制剂组5个孔, 药物联合组5个孔, 共20个孔. 阿霉素2 g/L, 每5个孔加10 mL, SB203580抑制剂20 g/L, 每5个孔加1 mL. 联合组药物用量同单用组. 药物均混匀于无血清培养基后再加入到相应孔中. 作用24 h后, 每孔加MTT[3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐]溶液(5 g/L用PBS配制, pH7.4)10 mL. 继续孵育4 h后终止培养, 小心吸弃孔内培养上清液, 每孔加100 mL DMSO, 置摇床上低速振荡10 min, 使结晶物充分融解. 选择A490nm波长在酶联免疫监测仪上测定各孔吸光度值, 记录结果并计算细胞抑制率 = (空白组吸光度值均值-各浓度组吸光度值均值/空白组吸光度值均值)×100%, 并绘制直方图. 实验重复3次.
1.2.3 6孔板加药处理: 对照组设1个孔(不加任何药物), 实验组阿霉素(2 g/L)10 mL处理2个孔, 抑制剂(20 g/L)1 mL处理1个孔和两者联合(同上浓度同体积)处理2个孔. 以细胞长至80%-90%孔域并处于对数生长期开始加药, 作用24 h后提取各组总蛋白, 行Western blot检测各组蛋白Akt和磷酸化的Akt水平(以b-actin蛋白为内参对照). 步骤包括提取并测定总蛋白浓度, 计算20 mg体积下的上样量, 蛋白电泳, 纤维膜电转和X光胶片显影等.
MTT结果显示阿霉素和抑制剂SB203580对结肠癌细胞的生长较对照组均有抑制作用(26.60%)(33.87%), 后者大于前者, 两药联合处理癌细胞后抑制率则更明显(56.04%, 图1). Western blot结果提示阿霉素处理组较抑制剂组和联合组的Akt表达无显著差异, 而磷酸化的Akt阿霉素组较抑制剂组和联合组显著升高, 也即表明抑制剂组和联合组方案可降低结肠癌细胞磷酸化Akt的表达水平(图2).
阿霉素Doxorubicin(DOX), 是蒽环霉素类抗生素, 也是临床上常用的抗肿瘤化合物. 其主要是干扰快速增长的肿瘤细胞的增殖, 通过结合和嵌入癌细胞DNA分子进而抑制靶细胞的DNA和RNA的生物合成起到抗癌作用. 但是有效治疗剂量下的心脏毒性和随着作用时间的推移癌细胞产生的分子学抵抗机制限制了阿霉素的抗肿瘤应用[1].
磷酸肌醇3'激酶/蛋白激酶B(PI3K/Akt)通路在多种癌细胞中呈现高表达, 蛋白激酶B(Akt)的活化位于PI3K超家族信号转导过程中的下游, 主要负责由PI3K始动的生物信息的传导, 处于这一通路的中心环节. 采用特异性抑制剂降低其下游磷酸化Akt的水平, 从而阻断Akt的磷酸化活化及其下游信号级联反应进而阻断PI3K通路的生物学效应[5]. 一些肿瘤细胞可通过对负责细胞生长和凋亡的细胞信息传导通路进行调控而获得对化疗药物的耐药性[6]. 我们前期的研究[7]发现PI3K/Akt 通路的激活能抑制或下调p27kip1的表达(一种广谱周期蛋白依赖性激酶抑制剂), 进而使肿瘤细胞产生对细胞毒药物的抵抗和继续增值.
研究表明许多肿瘤细胞的生长和增值伴有p38MAPK(丝裂原活化蛋白激酶)的活化, 其特异性抑制剂SB203580则表现出对多种恶性肿瘤细胞(食管癌、子宫内膜癌)的杀伤和促凋亡特性[8,9]. 英国科学家[10]发现p38MAPK抑制剂SB203580与5-氟尿嘧啶联合作用于结直肠癌细胞, 通过上调Bax(一种凋亡蛋白)的表达和caspase酶(半胱氨酸-天冬氨酸蛋白酶, 一种凋亡蛋白酶)的活性可提高后者对癌细胞的杀伤敏感性, 提示SB203580可提高经典化疗药物对结肠癌细胞的杀伤, 可通过不同的信号传导通路起到抗化疗耐药作用. 韩国学者[11]研究认为, SB203580可加强抗肿瘤药物Exisulind(一种新型选择性凋亡性抗肿瘤药物)对结肠癌的敏感性. 被Exisulind处理的结肠癌细胞磷酸化的p38MAPK升高, 而其选择性抑制剂SB203580可抑制p38MAPK的磷酸化和诱导caspase酶的活化, 进而提高该化疗药物的抗肿瘤效果.
p38MAPK和PI3K/Akt作为整体通路参与某些病理生理过程. 且联合抑制该整体通路有抑制癌细胞增值的作用. 研究人员观察到在糖尿病神经病理性疼痛的形成中p38MAPK和PI3K/Akt信号通路都发生了高度激活, p38MAPK特异性抑制药可同时阻断p38MAPK和PI3K/Akt两条信号通路. 此时PI3K/Akt是p38MAPK的下游信号通路[12]. MK2(MAPKAP激酶)和p38MAPK与HSP27组成复合物, 再与Akt结合可以活化之, 进而激活PI3K/Akt通路[13]. 在炎症反应过程中, p38MAPK抑制剂SB203580可以同时阻断AKT和p38MAPK这两个通路[14]. 有学者[15]指出ERK1/2的抑制剂(PD98059)和p38MAPK抑制剂(SB203580可以减少或者清除磷酸化的Akt, 进而阻断其下游信号传导. 研究显示[3]PI3K/Akt与p38MAPK通路在骨骼肌生成过程中起协调作用. 也揭示二者可能存在内在关联. 在骨骼肌的生成和分化过程中Akt在p38MAPK通路下游发挥生物学作用, 阻断p38途径可抑制Akt的激活, 在肌生成过程中发现p38途径可在转录水平和蛋白水平直接影响Akt及其下游的级联反映, 进而影响细胞的生长和增殖. PI3K和p38通路在细胞生物生长中起着重要的作用, 并且相互作用. 对PI3K/Akt和p38MAPK通路的抑制可增加和提高阿霉素诱导的癌细胞凋亡[4]. 国外学者[16]指出GRP78(一种葡萄糖调节蛋白)可作用于MAPK/PI3K通路, 抑制人肿瘤的生长, 这就提示这两个通路之间的是有密切联系的, 这吸引着我们进一步研究.
近年来诸多的研究显示许多癌细胞对经典抗癌药物如阿霉素产生耐药性, 其中就涉及到磷酸化的Akt水平升高[17]. 本课题组前期研究[2]在体外培养的细胞中发现PI3K/Akt通路与胃癌细胞化疗耐药性的形成密切相关, 发现化疗药物作用于结肠癌细胞, 一方面诱导了细胞凋亡, 另一方面也活化了PI3K通路并通过一系列的下游信号分子抑制细胞凋亡. PI3K通路的活化可能是肿瘤细胞抵御外来损伤因子的一种自我保护, 这种自我保护作用降低了化疗药物的敏感性, 这可能是导致化疗药物耐药的机制之一.
我们此次实验观察到运用阿霉素和SB203580以及两者联合处理结肠癌细胞后癌细胞Akt的蛋白表达水平并无显著差异性趋势, 而抑制剂组和联合组癌细胞Akt的磷酸化水平则较对照组和阿霉素组显著下降, 显示该抑制剂可阻断PI3K/Akt或Akt相关的信号通路, 这与文献报道的一致. MTT实验结果显示HCT-116细胞受药物处理后生长明显抑制. 其中SB203580(20 g/L)联合阿霉素(2mg/mL)对细胞的生长抑制作用要显著优于相同浓度的SB203580单用组和阿霉素单用组. 上述实验结果表明p38MAPK抑制剂SB203580也具有抗结肠癌的作用, 且其与阿霉素联合作用后可明显提高阿霉素对结肠癌细胞株的抑制增殖作用. SB203580与阿霉素具有协同抗结肠癌效果, 可能是SB203580通过阻断Akt相关的信号途径, 抑制其磷酸化活化. 进而起到促进癌细胞凋亡和抑制其增殖作用.
针对经典化疗药物的耐药性问题, 解决方法之一是联合应用化疗药物. 如果肿瘤患者接受化疗治疗前能了解此种肿瘤增殖由哪条或哪几条传导通路起主要作用, 就可有针对性地应用传导通路抑制剂, 提高化疗效果[8]. 本研究表明, p38MAPK抑制剂SB203580对结肠癌细胞阿霉素耐药具有逆转作用, 通过降低细胞信号级联反应中的Akt磷酸化途径诱导凋亡可能为其提高阿霉素化疗敏感性的机制之一. 加上该抑制剂的阻断p38MAPK的磷酸化作用, 联合应用阿霉素可达到较为理想的抗肿瘤效果. 故我们认为p38MAPK选择性抑制剂SB203580和传统化疗药物的联合应用在肿瘤的防治方面可提供一种低毒而高效的化疗方案, 但还需进一步的体内实验和临床研究和证实.
以往的流行病学资料显示大肠癌中直肠癌、结肠癌的比例约1.5:1, 然而近年来, 随着国人生活水平的提高, 尤其是高脂高蛋白低纤维素的饮食习惯, 使大肠癌的发病率呈上升趋势.
高泽立, 副教授, 上海交大医学院九院周浦分院
国外学者报道有多种方法可去拮抗经典化疗药物的多重耐药(MDR): (1)对药物的化学结构本身加以改进; (2)联合应用针对耐药表达途径的化疗药物; (3)应用新的载体, 使药物更好地进入肿瘤细胞并予以杀伤.
阿霉素具有抗肿瘤活性, 但易产生多重耐药现象. p38MAPK抑制剂SB203580除了具有拮抗炎症通路作用外, 也具有对多种实体肿瘤的杀伤效应. 如果后者可以去阻断阿霉素的某种耐药机制, 那么两者联合, 不仅可以起到各自的抗肿瘤效果, 而且还可以增强疗效.
本文选题紧扣当前肿瘤治疗热点, 密切联系临床, 选题合理, 实验设计严谨, 统计学应用合理, 参考文献较新, 非常值得临床医生阅读.
编辑: 曹丽鸥 电编:何基才
| 1. | Lin R, Shi Ng L, Wang CH. In vitro study of anticancer drug doxorubicin in PLGA-based microparticles. Biomaterials. 2005;26:4476-4485. [PubMed] [DOI] |
| 3. | Cabane C, Coldefy AS, Yeow K, Dérijard B. The p38 pathway regulates Akt both at the protein and transcriptional activation levels during myogenesis. Cell Signal. 2004;16:1405-1415. [PubMed] [DOI] |
| 4. | Lee ER, Kim JY, Kang YJ, Ahn JY, Kim JH, Kim BW, Choi HY, Jeong MY, Cho SG. Interplay between PI3K/Akt and MAPK signaling pathways in DNA-damaging drug-induced apoptosis. Biochim Biophys Acta. 2006;1763:958-968. [PubMed] |
| 5. | Fresno Vara JA, Casado E, de Castro J, Cejas P, Belda-Iniesta C, González-Barón M. PI3K/Akt signalling pathway and cancer. Cancer Treat Rev. 2004;30:193-204. [PubMed] [DOI] |
| 6. | Poh TW, Pervaiz S. LY294002 and LY303511 sensitize tumor cells to drug-induced apoptosis via intracellular hydrogen peroxide production independent of the phosphoinositide 3-kinase-Akt pathway. Cancer Res. 2005;65:6264-6274. [PubMed] [DOI] |
| 7. | 张 利, 于 红刚, 于 皆平, 罗 和生. PI3K/Akt/p27kip1通道介导胃癌细胞对阿霉素、足叶乙甙化疗的耐药性及其机制. 世界华人消化杂志. 2008;16:575-581. [DOI] |
| 9. | Ogunwobi O, Mutungi G, Beales IL. Leptin stimulates proliferation and inhibits apoptosis in Barrett's esophageal adenocarcinoma cells by cyclooxygenase-2-dependent, prostaglandin-E2-mediated transactivation of the epidermal growth factor receptor and c-Jun NH2-terminal kinase activation. Endocrinology. 2006;147:4505-4516. [PubMed] [DOI] |
| 10. | Yang SY, Miah A, Sales KM, Fuller B, Seifalian AM, Winslet M. Inhibition of the p38 MAPK pathway sensitises human colon cancer cells to 5-fluorouracil treatment. Int J Oncol. 2011;38:1695-1702. [PubMed] |
| 11. | Lim SJ, Lee YJ, Lee E. p38MAPK inhibitor SB203580 sensitizes human SNU-C4 colon cancer cells to exisulind-induced apoptosis. Oncol Rep. 2006;16:1131-1135. [PubMed] |
| 12. | 柯 昌斌, 黄 晓霞, 许 先成, 李 清, 秦 成名, 刘 菊英. P38 MAPK和P13K/Akt信号通路在大鼠糖尿病神经病理性疼痛中的交互作用. 临床麻醉学杂志. 2010;26:790. |
| 13. | Rane MJ, Klein JB. Regulation of neutrophil apoptosis by modulation of PKB/Akt activation. Front Biosci. 2009;14:2400-2412. [PubMed] [DOI] |
| 14. | Wang Y, Zeigler MM, Lam GK, Hunter MG, Eubank TD, Khramtsov VV, Tridandapani S, Sen CK, Marsh CB. The role of the NADPH oxidase complex, p38 MAPK, and Akt in regulating human monocyte/macrophage survival. Am J Respir Cell Mol Biol. 2007;36:68-77. [PubMed] [DOI] |
| 15. | Yang XS, Liu S, Liu YJ, Liu JW, Liu TJ, Wang XQ, Yan Q. Overexpression of fucosyltransferase IV promotes A431 cell proliferation through activating MAPK and PI3K/Akt signaling pathways. J Cell Physiol. 2010;225:612-619. [PubMed] [DOI] |