修回日期: 2011-11-25
接受日期: 2011-12-15
在线出版日期: 2012-01-18
目的: 探讨MID1在人大肠癌中表达的临床意义及其对术后生存时间的影响.
方法: 采用SP免疫组织化学法检测109例大肠癌手术切除组织标本中MID1的表达, 分析MID1的表达与大肠癌的关系, 用Kaplan-Meier和Cox回归分析法进行生存分析.
结果: MID1的表达对大肠癌的术后的生存时间有显著影响(P<0.05); 与大肠癌的淋巴结转移情况呈显著性负相关(r = -0.204, P = 0.034<0.05); 与大肠癌的浸润深度呈显著性负相关(r = -0.223, P = 0.020<0.05); 与大肠癌的分化程度呈显著性正相关(r = 0.236, P = 0.014<0.05); MID1的表达与大肠癌的年龄、性别及其病理类型没有关系. Kaplan-Meier生存曲线结果显示, 随访期内MID1高中低各组7年累积生存率分别为69.2%、45.0%、30.0%; 高中低各表达组患者术后平均生存时间分别为: 91.101 mo±6.127 mo, 69.389 mo±7.512 mo, 50.358 mo±8.091 mo, Log-rank检验证明, 整体水平及各组间水平均有统计学意义(P<0.05); 经多因素Cox回归分析发现, MID1低表达、淋巴结的转移可显著增加患者的死亡风险(P<0.05).
结论: MID1可以作为大肠癌分化、侵袭、淋巴结转移以及预后的一项指标.
引文著录: 赵震, 杨磊, 丁彦青, 于倩. MID1在大肠癌组织中的表达及其对预后的意义. 世界华人消化杂志 2012; 20(2): 113-118
Revised: November 25, 2011
Accepted: December 15, 2011
Published online: January 18, 2012
AIM: To detect the expression of midline 1 (MID1) in human colorectal carcinoma and to assess its prognostic significance.
METHODS: Immunohistochemistry was used to detect the expression of MID1 protein in colorectal carcinoma specimens (n = 109). The relationship between the survival of patients with colorectal cancer and the expression of MID1 was investigated. Survival analyses were performed using the Kaplan-Meier method and Cox regression model.
RESULTS: MID1 expression significantly affected the survival of patients with colorectal carcinoma (P < 0.05). MID1 expression had a significantly negative correlation with lymph node metastasis (r = -0.204, P = 0.034) and depth of invasion (r = -0.223, P = 0.020), but was significantly positively correlated with differentiation degree (r = 0.236, P = 0.014). MID1 expression had no relationship with sex, age or tumor pathologic type. Kaplan-Meier analysis indicated that the 7-year cumulative survival rates for patients with high, medium and low MID1 expression were 69.2%, 45.0% and 30.0%, respectively, and their mean survival time was 91.101 mo ± 6.127 mo, 69.389 mo ± 7.512 mo, 50.358 mo ± 8.091 mo.
CONCLUSION: MID1 expression can be used as a parameter for the judgment of colorectal carcinoma differentiation, invasion and lymph node metastasis, and as a useful prognostic marker in patient with colorectal carcinoma.
- Citation: Zhao Z, Yang L, Ding YQ, Yu Q. Prognostic significance of MID1 expression in colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2012; 20(2): 113-118
- URL: https://www.wjgnet.com/1009-3079/full/v20/i2/113.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i2.113
结直肠癌(colorectal carcinoma, CRC)是一种常见的、严重威胁人类生命健康的消化系统恶性肿瘤. 近年来, 随着国民经济的发展, 人民生活水平的提高, 尤其是膳食结构的改变, 结直肠癌的发病率与死亡率呈逐年上升的趋势[1-3]. 为了获得更高的生存率和更长的生存期, 除了早期诊断、早期治疗外, 选择具有高危预后因素患者进行辅助治疗也是有效的方法之一. 因此准确的预后判断就显得格外重要. MIDl定位于细胞质, 研究发现其在细胞内与形态发生、泛素循环、金属离子及锌离子结合、微管复合体形成等功能有关, 参与了连接酶活化、微管组织等信号转导通路, 与异常增生及多种发育畸形有关[4-6]. MID1是OS(Opitz Syndrome)相关基因, OS主要累及中缝结构, 最初为2种综合征, 以唇、腭裂和智力发育迟缓为特征的BBB综合征和以胃肠道畸形为特征的G综合征[7,8]. 其功能和作用在结直肠癌中未见报道. 本实验室在前期研究中通过在不同转移潜能的细胞系进行基因表达谱分析表明其可能参与大肠癌的发生和转移[9]. 本研究分析随访10年的109例原发性大肠癌患者中年龄、性别、组织类型、淋巴结转移状态、癌细胞浸润深度以及癌组织的分化情况; 分析MID1的表达与临床各病理因素的关系, 以及MID1的表达对术后生存率的影响.
本研究标本取自南方医科大学附属医院南方医院2001-01/2003-12原发性大肠癌石蜡标本109例, 随访至2011-01, 最短随访时间为7年. 其中男性病例69例, 女性病例40例; 平均年龄60.7岁; 死亡58例, 生存51例; 无淋巴结转移64例, 有淋巴结转移45例; 浸润至黏膜层6例, 肌层16例, 浆膜层87例; 低分化大肠癌16例, 中分化大肠癌42例, 高分化大肠癌51例; 黏液癌10例, 腺癌99例.
1.2.1 标本固定和染色: 所有标本均经10%甲醛固定, 4 mm连续切片分别作HE染色和免疫组织化学. 兔抗人MID1多克隆抗体购于美国Abcam生物技术公司, 免疫组织化学染色试剂盒购于福州迈新生物技术开发公司. 免疫组织化学法采用链霉素-生物素免疫组织化学法即SP法. 每个染色流程均有对照作为染色质量控制标准. 取已知含有待检抗原的切片为阳性对照, 空白对照采用PBS代替I抗, 替代对照用正常血清代替一抗.
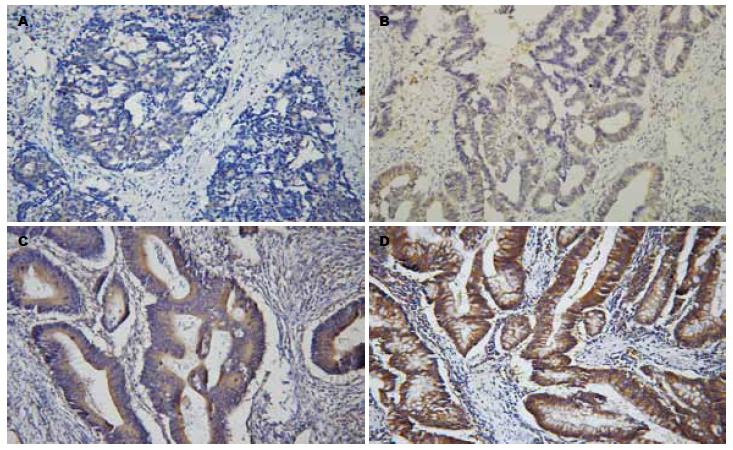
1.2.2 结果判定: 免疫组织化学结果阳性反应为黄色到棕黄色细颗粒. MID1定位于细胞质内, 以细胞质着色为阳性标记. 染色阳性以细胞呈棕黄色颗粒状染色为标准. 免疫组织化学结果判断参照Hirsch等的方法[10-12]. 首先对每张切片不同区域的染色强度进行打分: 阴性为1分, 弱阳性为2分, 中等程度阳性为3分, 强阳性为4分; 同时物镜下计数不同染色强度区域面积百分比, 每张切片的总分为不同区域染色强度分值与所占面积百分比乘积的总和, 总得分1-200为低表达, 201-300为中表达, 301-400为高表达(图1A-D).
统计学处理 本实验所有数据采用SPSS13. 0软件完成各种统计分析. 其中MID1与临床病理因素的关系采用计数资料的c2检验及相关分析法. 生存率分析采用Kaplan Meier法及Log-rank检验.
在109例大肠癌组织中MID1的高中低表达率分别为35.8%(n = 39), 36.7%(n = 40), 27.5%(n = 30), 从表1中可以看到, MID1在大肠癌组织中的表达与大肠癌的年龄、性别、组织类型无相关性; 与大肠癌的淋巴结转移情况呈显著性负相关(r = -0.204, P = 0.034<0.05); 与大肠癌的浸润深度呈显著性负相关(r = -0.223, P = 0.020<0.05); 与大肠癌的分化程度呈显著性正相关(r = 0.236, P = 0.014<0.05).
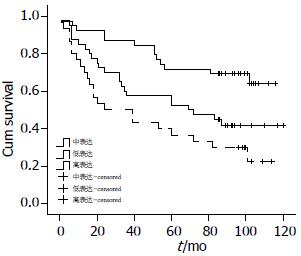
为了确定MID1表达与大肠癌患者预后的关系, 我们绘制了Kaplan-Meier生存曲线(图2). 在随访期内病例最短有效随访时间为7年, 表2中可看到在随访期内MID1高中低各组7年累积生存率分别为69.2%、45.0%、30.0%; 高中低各表达组患者术后平均生存时间分别为: 高表达组91.101 mo±6.127 mo, 中表达组69.389 mo±7.512 mo, 低表达组50.358 mo±8.091 mo, 各组差异经Log-rank检验, 整体水平及各组间水平均有统计学意义(P<0.05).
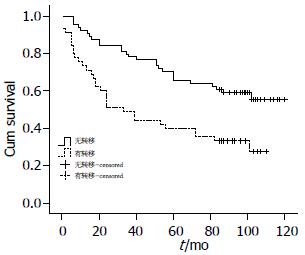
在其他各临床因素中淋巴结转移情况对患者术后生存时间有显著性影响(图3, 表3), 无淋巴结转移组平均生存时间为86.184 mo±5.358 mo、7年累计生存率为60.9%, 有淋巴结转移组术后平均生存时间为51.811 mo±6.588 mo、7年累计生存率为33.3%, 其差异经Log-rank检验有统计学意义(P = 0.001<0.05); 而患者的性别、年龄、组织分化、病理类型及大肠癌的浸润深度对术后生存时间无显著性影响(表3).
| 平均生存时间(mo) | 7年生存率(%) | P值 | |
| 性别 | |||
| 男 | 71.269±5.867 | 47.8 | 0.550 |
| 女 | 74.950±7.008 | 52.5 | |
| 年龄(岁) | |||
| ≤60 | 80.255±6.665 | 53.2 | 0.236 |
| >60 | 66.549±5.954 | 46.8 | |
| 组织类型 | |||
| 腺癌 | 70.742±4.645 | 47.5 | 0.366 |
| 黏液癌 | 85.480±15.164 | 70.0 | |
| 淋巴结转移 | |||
| 有转移 | 51.811±6.588 | 33.3 | 0.001 |
| 无转移 | 86.184±5.358 | 60.9 | |
| 组织分化 | |||
| 高 | 80.796±5.995 | 56.9 | 0.181 |
| 中 | 62.143±6.549 | 42.9 | |
| 低 | 59.281±12.918 | 43.8 | |
| 浸润深度 | |||
| 黏膜层 | 94.000±7.303 | 0.833 | 0.091 |
| 肌层 | 84.500±11.835 | 0.625 | |
| 浆膜层 | 67.406±4.961 | 0.448 |
将MID1的表达、年龄、性别、淋巴结转移、浸润深度、癌组织分化、病理组织类型经多因素Cox回归分析发现, MID1低表达、淋巴结的转移可显著增加患者的死亡风险(P<0.05, 表4).
| B | SE | RR | P值 | |
| 性别 | 0.013 | 0.219 | 1.013 | 0.964 |
| 年龄 | 0.518 | 0.285 | 1.678 | 0.069 |
| MID1 | -0.498 | 0.175 | 0.607 | 0.004 |
| 淋巴结转移 | 0.644 | 0.278 | 1.905 | 0.020 |
| 组织分化 | -0.289 | 0.199 | 0.749 | 0.146 |
| 浸润深度 | 0.278 | 0.345 | 1.321 | 0.420 |
| 组织类型 | 0.912 | 0.557 | 2.489 | 0.102 |
转移是大肠癌的重要生物学行为, 也是肿瘤患者死亡的主要原因之一. 大肠癌的生长分化和侵袭转移过程十分复杂. 肿瘤转移(tumor metastasis)是一个多步骤、多因素、多基因的复杂过程, 每一阶段都受多种基因/蛋白质的调控[13,14]. 转移的肿瘤细胞经历了细胞骨架变化、黏附特性改变、运动能力增强以及蛋白水解酶表达增加等一系列改变[15]. 因此, 确定肿瘤的转移潜能及其相关因素对判断预后、指导治疗、提高患者生活质量具有十分重要的意义. MIDl基因位于Xp22.3, 约300 kb, 包含9个编码外显子, 编码667个氨基酸的蛋白质, 属于B-box家族的一员, 包含1个RING-finger, 2个B-box, 和1个coiled-coil结构域[16-21]. MIDl表达于细胞质, 研究发现他在细胞内与形态发生、泛素循环、金属离子及锌离子结合、微管复合体形成等功能有关, 参与了连接酶活化、微管组织等信号转导通路[22-25]. MID1与异常增生及多种发育畸形有关, 是OS(Opitz Syndrome)相关基因, 参与中缝结构的发育及细胞的转化[26-31]. 本实验室的前期研究发现MID1有可能参与大肠癌的发生和转移. 为了探讨MID1在大肠癌发生发展中的作用, 本研究以石蜡组织为研究对象, 应用免疫组织化学技术, 初步探讨MID1与大肠癌的转移、预后的关系, 为确定一个新的大肠癌肿瘤标记物提供新的线索. 本研究分析了109例原发性大肠癌者中MID1的表达, 其中MID1的高中低表达率分别为35.8%(n = 39), 36.7%(n = 40), 27.5%(n = 30). 免疫组织化学检测结果显示, 在大肠癌组织中随着癌组织分化程度的增高MID1染色越来越强, 阳性率越来越高; 随着其浸润深度的发展MID1的染色越来越低, 阳性率越来越低; 无淋巴结转移的大肠癌的MID1表达比发生淋巴结转移的大肠癌高. 这些结果提示MID1表达与大肠癌的分化正相关, 促进大肠癌向正常细胞的分化; 与大肠癌的浸润程度负相关, 抑制大肠癌的侵袭能力; 与大肠癌的淋巴结转移负相关, 抑制大肠癌向淋巴结的转移. 这表明MID1对大肠癌的转移和发展起着抑制作用. 在预后方面随着MID1表达的降低患者术后的生存时间也缩短, 而有淋巴结转移的患者术后生存时间要明显短于无淋巴结转移组, 这与前面分析MID1的表达与转移情况显著相关吻合, 多因素分析分析表明MID1可作为大肠癌的独立预后因素.
总之, MID1与大肠癌的淋巴结转移、癌组织分化、侵袭能力密切相关, MID1表达下调是大肠癌发生、发展中的重要分子生物学事件, 可作为提示肿瘤分化、侵袭和淋巴结转移的一项指标, 可能成为大肠癌的预后指标和治疗的靶点. 对于MID1在大肠癌中的具体作用机制国内外研究很少, 其对大肠癌细胞生物学特性的影响, 信号通路等尚需进一步研究.
随着我国人口老龄化、生活习惯、饮食结构以及环境的改变. 大肠癌的发病率呈上升趋势. 影响大肠癌预后的主要因素是肿瘤的生长分化和侵袭转移. 其过程十分复杂, 诸多因素参与和调控大肠癌的上述生物学行为.
郝立强, 副教授, 上海长海医院普外二科
研究发现MID1在细胞内与形态发生、泛素循环、金属离子及锌离子结合、微管复合体形成等功能有关, 参与了连接酶活化、微管组织等信号转导通路, 与异常增生及多种发育畸形有关.
MID1是OS(Opitz Syndrome)相关基因, OS主要累及中缝结构, 最初为2种综合征, 即以唇、腭裂和智力发育迟缓为特征的BBB综合征, 和以胃肠道畸形为特征的G综合征. 近期有文章报道其可能参与大肠癌的发生和转移.
本文通过详细长期的随访资料对MID1与大肠癌的各临床参数以及术后生存率作了详细的统计分析, 阐明了MID1与大肠癌的关系.
对于MID1与大肠癌的关系研究较少, 本文提出将MID1作为大肠癌的独立预后因素的观点有一定的临床意义, 对大肠癌预后的判断有一定的帮助, 结论可靠.
编辑: 张姗姗 电编:何基才
| 1. | Jemal A, Thomas A, Murray T, Thun M. Cancer statistics, 2002. CA Cancer J Clin. 2002;52:23-47. [PubMed] [DOI] |
| 2. | Zheng S, Cai SR. Colorectal Cancer Epidemiology and Prevention Study in China. Chin-Ger J Clin Oncol. 2003;2:72-75. [DOI] |
| 3. | Sung JJ, Lau JY, Goh KL, Leung WK. Increasing incidence of colorectal cancer in Asia: implications for screening. Lancet Oncol. 2005;6:871-876. [PubMed] [DOI] |
| 4. | Cainarca S, Messali S, Ballabio A, Meroni G. Functional characterization of the Opitz syndrome gene product (midin): evidence for homodimerization and association with microtubules throughout the cell cycle. Hum Mol Genet. 1999;8:1387-1396. [PubMed] [DOI] |
| 5. | Tao H, Simmons BN, Singireddy S, Jakkidi M, Short KM, Cox TC, Massiah MA. Structure of the MID1 tandem B-boxes reveals an interaction reminiscent of intermolecular ring heterodimers. Biochemistry. 2008;47:2450-2457. [PubMed] [DOI] |
| 6. | Clifford DM, Wolfe BA, Roberts-Galbraith RH, McDonald WH, Yates JR, Gould KL. The Clp1/Cdc14 phosphatase contributes to the robustness of cytokinesis by association with anillin-related Mid1. J Cell Biol. 2008;181:79-88. [PubMed] [DOI] |
| 7. | So J, Suckow V, Kijas Z, Kalscheuer V, Moser B, Winter J, Baars M, Firth H, Lunt P, Hamel B. Mild phenotypes in a series of patients with Opitz GBBB syndrome with MID1 mutations. Am J Med Genet A. 2005;132A:1-7. [PubMed] [DOI] |
| 8. | Schweiger S, Schneider R. The MID1/PP2A complex: a key to the pathogenesis of Opitz BBB/G syndrome. Bioessays. 2003;25:356-366. [PubMed] [DOI] |
| 9. | Hao JM, Chen JZ, Sui HM, Si-Ma XQ, Li GQ, Liu C, Li JL, Ding YQ, Li JM. A five-gene signature as a potential predictor of metastasis and survival in colorectal cancer. J Pathol. 2010;220:475-489. [PubMed] |
| 10. | Okuda K, Sasaki H, Kawano O, Yukiue H, Yokoyama T, Yano M, Fujii Y. Epidermal growth factor receptor gene mutation, amplification and protein expression in malignant pleural mesothelioma. J Cancer Res Clin Oncol. 2008;134:1105-1111. [PubMed] [DOI] |
| 11. | Ionescu DN, Sasatomi E, Cieply K, Nola M, Dacic S. Protein expression and gene amplification of epidermal growth factor receptor in thymomas. Cancer. 2005;103:630-636. [PubMed] [DOI] |
| 12. | Hirsch FR, Varella-Garcia M, Bunn PA, Di Maria MV, Veve R, Bremmes RM, Barón AE, Zeng C, Franklin WA. Epidermal growth factor receptor in non-small-cell lung carcinomas: correlation between gene copy number and protein expression and impact on prognosis. J Clin Oncol. 2003;21:3798-3807. [PubMed] [DOI] |
| 13. | Tsunoda T, Nakamura T, Ishimoto K, Yamaue H, Tanimura H, Saijo N, Nishio K. Upregulated expression of angiogenesis genes and down regulation of cell cycle genes in human colorectal cancer tissue determined by cDNA macroarray. Anticancer Res. 2001;21:137-143. [PubMed] |
| 14. | Hunter K, Welch DR, Liu ET. Genetic background is an important determinant of metastatic potential. Nat Genet. 2003;34:23-24; author reply 25. [PubMed] [DOI] |
| 15. | Herbst RS, Yano S, Kuniyasu H, Khuri FR, Bucana CD, Guo F, Liu D, Kemp B, Lee JJ, Hong WK. Differential expression of E-cadherin and type IV collagenase genes predicts outcome in patients with stage I non-small cell lung carcinoma. Clin Cancer Res. 2000;6:790-797. [PubMed] |
| 16. | Quaderi NA, Schweiger S, Gaudenz K, Franco B, Rugarli EI, Berger W, Feldman GJ, Volta M, Andolfi G, Gilgenkrantz S. Opitz G/BBB syndrome, a defect of midline development, is due to mutations in a new RING finger gene on Xp22. Nat Genet. 1997;17:285-291. [PubMed] [DOI] |
| 17. | Massiah MA, Simmons BN, Short KM, Cox TC. Solution structure of the RBCC/TRIM B-box1 domain of human MID1: B-box with a RING. J Mol Biol. 2006;358:532-545. [PubMed] [DOI] |
| 18. | Perry J, Feather S, Smith A, Palmer S, Ashworth A. The human FXY gene is located within Xp22.3: implications for evolution of the mammalian X chromosome. Hum Mol Genet. 1998;7:299-305. [PubMed] [DOI] |
| 19. | Van den Veyver IB, Cormier TA, Jurecic V, Baldini A, Zoghbi HY. Characterization and physical mapping in human and mouse of a novel RING finger gene in Xp22. Genomics. 1998;51:251-261. [PubMed] [DOI] |
| 20. | Reymond A, Meroni G, Fantozzi A, Merla G, Cairo S, Luzi L, Riganelli D, Zanaria E, Messali S, Cainarca S. The tripartite motif family identifies cell compartments. EMBO J. 2001;20:2140-2151. [PubMed] [DOI] |
| 21. | Ota T, Suzuki Y, Nishikawa T, Otsuki T, Sugiyama T, Irie R, Wakamatsu A, Hayashi K, Sato H, Nagai K. Complete sequencing and characterization of 21,243 full-length human cDNAs. Nat Genet. 2004;36:40-45. [PubMed] [DOI] |
| 22. | Schweiger S, Foerster J, Lehmann T, Suckow V, Muller YA, Walter G, Davies T, Porter H, van Bokhoven H, Lunt PW. The Opitz syndrome gene product, MID1, associates with microtubules. Proc Natl Acad Sci U S A. 1999;96:2794-2799. [PubMed] [DOI] |
| 23. | Trockenbacher A, Suckow V, Foerster J, Winter J, Krauss S, Ropers HH, Schneider R, Schweiger S. MID1, mutated in Opitz syndrome, encodes an ubiquitin ligase that targets phosphatase 2A for degradation. Nat Genet. 2001;29:287-294. [PubMed] [DOI] |
| 24. | Short KM, Cox TC. Subclassification of the RBCC/TRIM superfamily reveals a novel motif necessary for microtubule binding. J Biol Chem. 2006;281:8970-8980. [PubMed] [DOI] |
| 25. | Aranda-Orgillés B, Aigner J, Kunath M, Lurz R, Schneider R, Schweiger S. Active transport of the ubiquitin ligase MID1 along the microtubules is regulated by protein phosphatase 2A. PLoS One. 2008;3:e3507. [PubMed] [DOI] |
| 26. | Cox TC, Allen LR, Cox LL, Hopwood B, Goodwin B, Haan E, Suthers GK. New mutations in MID1 provide support for loss of function as the cause of X-linked Opitz syndrome. Hum Mol Genet. 2000;9:2553-2562. [PubMed] [DOI] |
| 27. | Aranda-Orgillés B, Trockenbacher A, Winter J, Aigner J, Köhler A, Jastrzebska E, Stahl J, Müller EC, Otto A, Wanker EE. The Opitz syndrome gene product MID1 assembles a microtubule-associated ribonucleoprotein complex. Hum Genet. 2008;123:163-176. [PubMed] [DOI] |
| 28. | Lancioni A, Pizzo M, Fontanella B, Ferrentino R, Napolitano LM, De Leonibus E, Meroni G. Lack of Mid1, the mouse ortholog of the Opitz syndrome gene, causes abnormal development of the anterior cerebellar vermis. J Neurosci. 2010;30:2880-2887. [PubMed] [DOI] |
| 29. | Mnayer L, Khuri S, Merheby HA, Meroni G, Elsas LJ. A structure-function study of MID1 mutations associated with a mild Opitz phenotype. Mol Genet Metab. 2006;87:198-203. [PubMed] [DOI] |
| 30. | Ruiter M, Kamsteeg EJ, Meroni G, de Vries BB. A MID1 mutation associated with reduced penetrance of X-linked Opitz G/BBB syndrome. Clin Dysmorphol. 2010;19:195-197. [PubMed] [DOI] |