修回日期: 2012-05-03
接受日期: 2012-06-02
在线出版日期: 2012-07-08
目的: 构建包含突变型CDK4基因的真核绿色荧光表达载体, 作为POLD1基因依赖的细胞周期复制调控的模型, 研究POLD1基因相关的癌性增殖的机制, 为干预细胞恶性增殖提供新的思路.
方法: 设计人突变型CDK4基因全长特异性引物进行PCR扩增人肝癌细胞系SMMC-7721总cDNA, 以pEGFP-C1质粒为模板连接, 得到重组质粒GFP-CDK4后进行测序和生物信息学比对分析; 转染细胞分3组: 实验组(转染突变型CDK4重组真核表达质粒GFP-CDK4), 阴性对照组(转染空载体pEGFP-C1组)和空白对照组(SMMC-7702). 通过MTT试验分析细胞增殖变化; 实时荧光定量PCR技术检测CDK4、POLD1及细胞周期相关因子的表达量, Western blot检测蛋白表达的差异.
结果: 成功构建了人突变型CDK4基因真核表达质粒GFP-CDK4, 转染到肝细胞SMMC-7702后使细胞表达融合绿色荧光的CDK4蛋白; SMMC-7721细胞中突变型的CDK4存在5个碱基突变, 4个碱基插入, 2个碱基缺失, 这使得5个氨基酸序列发生了改变; 与空白对照组及阴性对照组相比, 实验组细胞增殖明显升高(0.826±0.08 vs 0.596±0.06, 0.609±0.10, F = 7.033, 均P<0.05); 实验组CDK4 mRNA表达水平差异明显(1.94±0.11 vs 1.01±0.00, 1.05±0.12, F = 54.046, P<0.01), POLD1 mRNA相应地升高(2.47±0.25 vs 1.16±0.00, 1.26±0.23, F = 135.496, P<0.01); 稳定转染细胞的蛋白水平变化趋势与基因相同, 其中实验组CDK4(0.65±0.03 vs 0.41±0.03, 0.39±0.05, F = 14.665, 均P<0.05), P125(0.54±0.04 vs 0.30±0.07, 0.25±0.06, F = 11.788, 均P<0.05).
结论: 人突变型CDK4基因的真核表达载体GFP-CDK4显著促进肝细胞的增殖能力, 这与POLD1基因及P125蛋白的高表达相关.
引文著录: 李永继, 黄怡, 阮细玲, 廖柳凤, 吴琼, 黄文涛, 徐恒. 人突变型CDK4真核荧光表达质粒的构建及对人肝细胞SMMC-7702中POLD1基因表达的调控. 世界华人消化杂志 2012; 20(19): 1705-1712
Revised: May 3, 2012
Accepted: June 2, 2012
Published online: July 8, 2012
AIM: To construct a eukaryotic expression vector encoding a mutant CDK4 protein and to investigate the effect of transfection of this vector on POLD1 expression in SMMC-7702 cells.
METHODS: The mutant CDK4 gene was amplified by RT-PCR from total RNA isolated from the human hepatocarcinoma cell line SMMC-7721, digested, and inserted into the eukaryotic expression vector pEGFP-C1. The resultant recombinant plasmid was confirmed by sequencing. After the recombinant plasmid was transfected into SMMC-7702 cells using Lipofectamine 2000, the expression of fusion protein was observed by fluorescence microscopy, and expression of CDK4 and POLD1 mRNAs was detected by real-time PCR.
RESULTS: The eukaryotic expression plasmid GFP-CDK4 was successfully constructed. The mutant CDK4 gene contained 5 base mutation sites, 4 base insertions and 2 deletions, which caused 7 amino acids to change. Compared to non-tranfected cells or cells transfected with the pEGFP-C1 vector, cell proliferation was significantly higher in cells transfected with the recombinant vector (0.826 ± 0.08 vs 0.596 ± 0.06, 0.609 ± 0.10, F = 7.033, P < 0.05). The expression levels of CDK4 and POLD1 genes in cells transfected with the recombinant vector was significantly higher than those in the two control groups (1.94 ± 0 .11 vs 1.01 ± 0.00, 1.05 ± 0.12, F = 54.046, P < 0.01; 0.54 ± 0.04 vs 0.30 ± 0.07, 0.25 ± 0.06, F = 11.788, P < 0.05). Similar results were also obtained for the protein expression levels of CDK4 (0.65 ± 0.03 vs 0.41 ± 0.03, 0.39 ± 0.05, F = 14.665, P < 0.05) and P125 (0.54 ± 0.04 vs 0.30 ± 0.07, 0.25 ± 0.06, F = 11.788, P < 0.05).
CONCLUSION: Tranfection of the eukaryotic expression plasmid GFP-CDK4 significantly increases the proliferation and invasion of SMMC-7702 cells possibly by up-regulating POLD1 expression.
- Citation: Li YJ, Huang Y, Ruan XL, Liao LF, Wu Q, Huang WT, Xu H. Transfection of a eukaryotic vector expressing a mutant CDK4 up-regulates POLD1 expression in SMMC-7702 cells. Shijie Huaren Xiaohua Zazhi 2012; 20(19): 1705-1712
- URL: https://www.wjgnet.com/1009-3079/full/v20/i19/1705.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i19.1705
大肝细胞癌(hepatocellular carcinoma, HCC)是一种常见的恶性肿瘤, 也是全球3大肿瘤死因之一, 严重危害人类的健康. 我国近20年来HCC发病率呈上升趋势, HCC患者每年死亡人数约为23万之多, 占我国全部恶性肿瘤死亡率的18.8%, 仅次于胃癌居第2位, 在广西则居第1位[1,2]. DNA聚合酶δ(DNA polymerase δ, Polδ)是真核生物DNA复制的最主要复制酶, POLD1基因编码其活性催化亚基P125[3,4]. 细胞周期蛋白依赖性激酶4(cyclin dependent kinase 4, CDK4)是含丝氨酸/苏氨酸蛋白激酶CDKS家族中的重要一员. 他与细胞周期蛋白D(cyclinD)共同作用于细胞G1期, 成为关键调控蛋白复合物[5]. 目前已在多种肿瘤细胞系中检测到该区位的基因改变, 包括表达丰度的改变、基因重排和点突变[6-8]. 研究表明CDK4参与了细胞恶变中细胞周期改变相关的过程[9,10], 而这个过程最终调控POLD1基因编码P125进行DNA的复制. 因此, 我们推测CDK4参与了POLD1表达的调控, 对细胞恶变具有关键作用的CDK4与POLD1调控模式的研究将有助于我们了解肝细胞癌的发病机制, 从而为阻断肝细胞癌的发生和发展提供新的思路.
肝癌细胞系SMMC-7721、正常肝细胞系SMMC-7702购自中国科学院上海细胞库; 1640培养液购自Thermo scientific公司; 胎牛血清购自杭州四季青生物工程材料技术有限公司; 大肠杆菌Ecoli. DH5α、真核表达载体pEGFP-C1为本课题实验室保存; 胰蛋白胨(Tryptone)及酵母提取液(Yeast Extract)购自OXLID公司; 琼脂糖(Agarose)购自上海Yito公司; 高保真酶(Prime STAR)、T4 DNA连接酶、pMD 18T载体、限制性内切酶(SalⅠ, EcoRⅠ)为Takara公司产品; TRIzol试剂为Invitrogen公司产品; 胶回收试剂盒、质粒小量抽提试剂盒、SYBRGreen荧光定量MIX试剂购自天根(北京)公司. PVDF膜购自美国Millipore公司; 小鼠抗人CDK4抗体、山羊抗人DNA聚合酶δ(P125)抗体为Santa Cruz产品; 兔抗人GAPDH单克隆抗体购自南宁市蓝光生物技术有限公司; 远红外荧光标记的兔抗小鼠、山羊抗兔、兔抗山羊二抗购自美国KPL公司.
1.2.1 细胞培养: 肝癌细胞SMMC-7721和正常肝细胞SMMC-7702培养于含100 mL/L胎牛血清的1640培养基, 在37 ℃、50 mL/L CO2条件下培养.
1.2.2 质粒构建: 用TRIzol、氯仿法提取肝癌细胞SMMC-7721总RNA后逆转录为cDNA, 并以此为模板, 用CDK4特异性引物(表1)进行PCR得到包含CDK4编码区CDS的基因片段. 将质粒pEGFP-C1和PCR产物用限制性内切酶SalⅠ、EcoRⅠ进行双酶切, 然后用T4连接酶链接, 转化到感受态细胞后筛选出重组质粒GFP-CDK4.
| 基因名称 | 引物序列(5'-3') | 产物长度(bp) | |
| CDK4(全长) | 上游 GGAATTCGAATGGCTACCTCTCGATATGA | 下游 ACGCGTCGACGCCCTCTCAGTGTCCAG | 977 |
| CDK4(荧光定量) | 上游 GTTCGTGAGGTGGCTTTACTG | 下游 GTCCTTAGGTCCTGGTCTACATG | 145 |
| POLD1(荧光定量) | 上游 GCTCCGCTCCTACACGCTCAA | 下游 GGTCTGGTCGTTCCCATTCTGC | 109 |
| β-actin(荧光定量) | 上游 AACTCCATCATGAAGTGTGA | 下游 ACTCCTGCTTGCTGATCCAC | 247 |
1.2.3 细胞转染: (1)瞬时转染: 转染前2 d将SMMC-7702细胞接种到6孔板, 转染前1 h用无血清1640培养基培养. 将转染试剂lipo2000与质粒以2.5 μL:5 μg混合, 室温孵育, 15 min后均匀滴入培养板细胞, 6 h后换用完全培养基, 48 h收取细胞; (2)稳定转染: 将瞬时转染5 d后的6孔板细胞, 在每个孔加入终浓度为500 mg/L的G418进行筛选, 3 wk后得到稳定转染的细胞.
1.2.4 MTT分析: 将稳定转染GFP-CDK4后处于对数生长期的SMMC-7702细胞接种于96孔板作为实验组, 稳定转染PEGFP-C1的SMMC-7702作为对照组, 未经处理的SMMC-7702作为空白对照组. 平均每孔2×103个细胞, 每组细胞均重复作3个孔. 于种板后的24、48、72、96 h分别加入20 μL MTT溶液, 4 h后小心吸出培养基及MTT, 每孔加150 μL DMSO, 混匀后用酶标仪检测490 nm处各孔的吸光度(A)值, 绘制生长曲线.
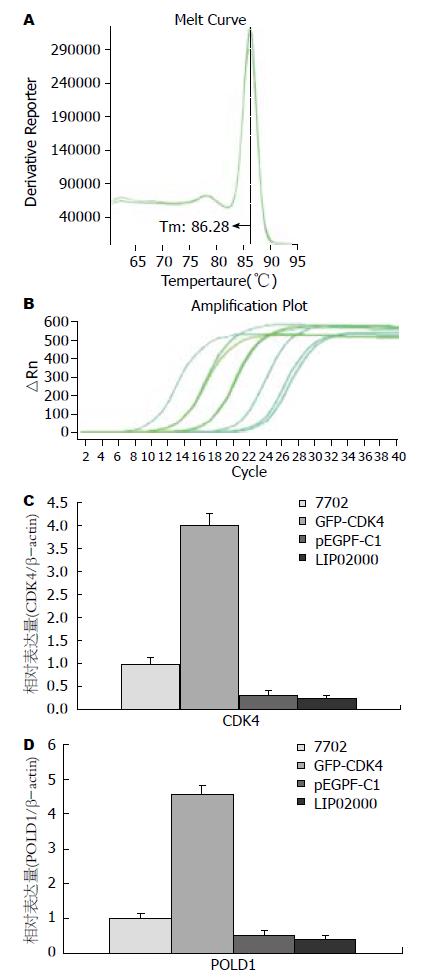
1.2.5 实时荧光定量PCR(qRT-PCR)检测: 通过primer primier 5.0软件设计特异性引物(表1); 将瞬时转染的细胞用TRIzol、氯仿法提取总RNA, 各取1 μg进行逆转录得到cDNA, 以此为模板在ABI7500实时荧光定量仪上进行荧光定量聚合酶链反应, 反应体系为: 9 μL PCR Mix、9 μL去离子水、1 μL引物、1 μL cDNA. PCR条件为: 95 ℃预变性2 min; 95 ℃变性20 s、60 ℃退火 30 s, 72 ℃延伸30 s, 40个循环, 采用比较△△Ct法, 设置β-actin为内参, 结果用7500 Software v2.0.5分析数据.
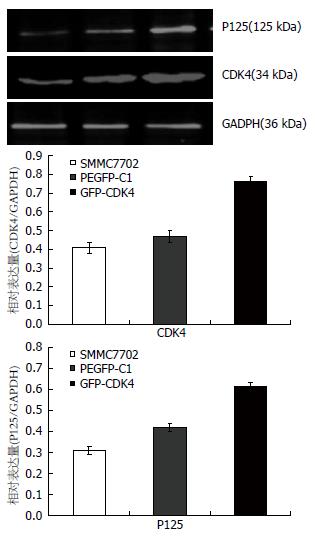
1.2.6 蛋白质印迹(Western blot)分析: 将稳定转染后的细胞用RIPA裂解液裂解后提取细胞总蛋白, BCA法测定蛋白浓度后, 取70 μg总蛋白用梯度SDS-PAGE胶分离后转移到PVDF膜上. 杂交膜先用5%脱脂奶粉的PBST溶液封闭2 h后4 ℃摇床孵育一抗(CDK4、P125一抗稀释度分别为1:5 000、1:3 000)过夜, PBST洗膜3次, 每次10 min, 室温下孵育二抗1 h(兔抗小鼠、兔抗山羊二抗稀释度为1:3 000), PBST洗膜3次, 每次10 min; 将漂洗过的PVDF膜用LI-COR Odyssey 红外荧光扫描成像系统扫描, Odyssey V3.0软件分析图像及数据.
统计学处理 运用SPSS13.0统计软件进行ANOVA单因素方差分析, LSD法进行两两比较, 结果用mean±SD表示, 检验水准α = 0.05, P<0.05有统计学意义.
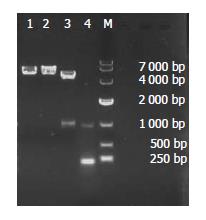
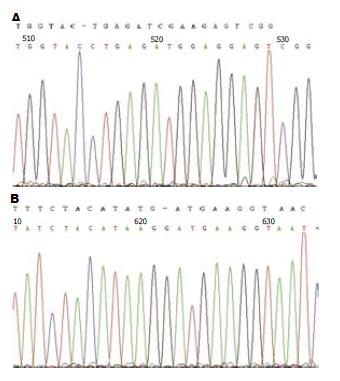
将PCR产物进行凝胶电泳在977 bp处有明亮特异条带, 与预期结果一致. 单酶切及双酶切鉴定结果行凝胶电泳, 在约5 700 bp处、4 700 bp处及1 000 bp处分别有明亮条带(图1), 表明CDK4基因已连接入pEGFP-C1载体. DNA测序结果与UCSC库中查找的CDK4序列与测序序列SEQ进行BLAST比对后得出, Expect = 0.0, Identities = 619/630(98%), Gaps = 5/630(1%), 5个碱基突变, 4个碱基插入, 2个碱基缺失(表2, 图2). 这导致突变型CDK4编码的蛋白CDK4对比野生型CDK4编码的CDK4蛋白有了5个氨基酸的改变.
| 突变位点 | 原碱基 | 突变后碱基 | 氨基酸变化 |
| 470 | G_A | GGA | - |
| 516 | C_T | CCT | - |
| 522 | TCG | TGG | Ser→Try |
| 524 | GAA | GA_缺失 | - |
| 583 | CCT | C_T缺失 | - |
| 605 | GCT | GCA | Ala→Glu |
| 606 | _TT | CTT | - |
| 610 | TTT | TAT | Phe→Tyr |
| 620 | ATG | AAG | Met→Lys |
| 622 | _AT | GAT | - |
| 633 | AAC | AAT | Asp→Asp |
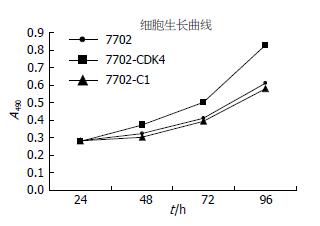
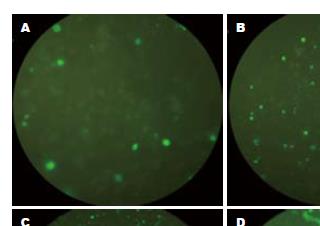
转染GFP-CDK4的实验组SMMC-7702细胞与转染PEGFP-C1对照组细胞SMMC-7702和空白对照组SMMC-7702细胞相比, 吸光度值A490在种板后的24、48、72 h差异无统计学意义分别是(0.279±0.040 vs 0.283±0.030, 0.282±0.030, F = 0.010, 均P>0.05), (0.372±0.030 vs 0.310±0.040, 0.325±0.010, F = 3.145, 均P>0.05)、(0.502±0.110 vs 0.405±0.030, 0.410±0.060, F = 1.603, 均P>0.05), 但与96 h差异具有统计学意义(0.826±0.080 vs 0.596±0.060, 0.609±0.100, F = 7.033, 均P<0.05), 实验组细胞增殖速度高于对照组和空白对照组(图3), 这与实验组细胞荧光出现的数量和强度趋势一致(图4).
实验组细胞在转染后48 h检测CDK4基因和POLD1基因的相对表达量, 结果显示实验组细胞明显高于对照组, 阴性对照组和空白对照组(1.94±0.11 vs 1.01±0.00, 1.05±0.12, F = 54.046, P<0.01), (0.54±0.04 vs 0.30±0.07, 0.25±0.06, F = 11.788, 均P<0.05, 图5). 说明重组质粒在正常肝细胞内高表达CDK4基因, 而且高表达的CDK4基因可以促进POLD1基因的高表达.
实验组CDK4蛋白相对于对照组和空白对照组高表达(0.65±0.03 vs 0.41±0.03, 0.39±0.05, F = 14.665, 均P<0.05), 对应的P125蛋白的表达增高, 与对照组和空白对照组差异明显(0.54±0.04 vs 0.30±0.07, 0.25±0.06, F = 11.788, 均P<0.05), 对照组和空白对照组间则没有明显差异(P>0.05), 结果具有统计学意义. 即CDK4蛋白高表达可以促进P125蛋白的高表达, 结论与mRNA水平趋势一致(图6).
HCC以及其他的恶性肿瘤的生长和转移都是以细胞恶性增殖为基础的[11], 细胞的恶性增殖则必须依赖POLD1编码的P125参与合成复制DNA, 且这个过程与细胞周期调控密不可分. 调控细胞周期的核心因子是细胞周期蛋白依赖性激酶, 他与不同的细胞周期蛋白形成多种复合物, 作用于细胞周期的不同时相, 决定着细胞周期的进程[12]. 其中CDK4/cyclinD的复合物就是调控G1/S期的关键蛋白复合物, 他可以使Rb蛋白的丝氨酸或苏氨酸残基发生磷酸化[13]. 在通常情况下Rb蛋白处于低磷酸化状态, 并与转录因子E2F结合[14]. 磷酸化后的Rb蛋白可导致E2F的释放, 释放出的E2F可以诱导cyclinE的表达, cyclinE与CDK2蛋白形成复合物后又可以使Rb蛋白发生磷酸化, 使E2F与cyclinE的活性在G1/S期交界点处迅速增高, 引起一系列与G1/S期行进有关的靶分子的表达, 促使细胞完成DNA复制[15-17].
到目前为止, 科学家们在多种癌细胞中检测到CDK4基因发生了突变, Pilotti等[18]首先发现遗传性家族性黑色素瘤病人CDK4基因存在的较高突变率, Plan等[19]在乳腺癌和胰腺癌中也发现了突变的CDK4. Miliani de Marval等[20]在研究CDK4在肿瘤形成中的作用的发现, 在CDK4缺失的小鼠体内, 即使其他抑癌基因如P53或Ink4a/Arf失活的情况下, 小鼠仍然不会形成肿瘤, 这说明CDK4是肿瘤形成所不可缺少的基因. 我们的研究证实在肝细胞癌细胞系SMMC-7721中存在碱基缺失和突变, 并推测出相应氨基酸的改变. 但是, 研究人员一直未能证实CDK4的突变和恶性肿瘤之间的直接因果关系.
朱晓宇等的运用染色体免疫共沉淀(chromatin immunoprecipitation, ChIP)和荧光素酶报告基因实验证实了P53以及一些细胞周期调控因子可以在细胞内(in vivo)能与POLD1启动子结合并影响POLD1启动子活性[21,22]. Greeve等[23]的研究证实了MCF-7癌细胞增殖的阻断可能与CDK2和CDK4活性降低引起p21与CDK2和CDK4复合物结合的改变有关. 然而至今没有进一步的研究解释这些细胞周期因子是如何对癌细胞增殖阻断起作用, 是否最终是通过抑制POLD1基因表达或P125活性达到的. 因此, 研究关键的细胞周期调控因子对于POLD1基因和其编码蛋白P125表达影响就显得非常必要, 特别是对存在着高突变率的恶性肿瘤中的CDK4对POLD1的调控通路和机制的研究, 将有可能为阻止肿瘤发生提供新的思路.
本文探讨了肝癌细胞SMMC-7721中突变型CDK4对肝细胞SMMC-7702增殖和迁移能力的影响. 构建的突变型CDK4重组真核表达质粒GFP-CDK4经过DNA测序比对, 发现SMMC-7721中突变型的CDK4存在有碱基突变和缺失, 改变引起相应氨基酸序列的替换, 证实了肝细胞癌SMMC-7721中的CDK4在结构功能发生了异常. 而氨基酸的替换引起的CDK4空间构象的改变, 以及这些改变对细胞周期中细胞周期因子调控复合物结构和功能的机制尚不明确, 需要进一步深入研究. 有意义的是, 我们将GFP-CDK4转染到肝细胞SMMC-7702中, MTT结果证实, 突变型CDK4基因的高表达促进了正常肝细胞SMMC-7702的增殖. 转染突变型CDK4后细胞生物学行为的改变与其他研究者对于CDK4基因促进细胞增殖和分裂的功能一致.
作为DNA复制中负主要责任的聚合酶, 我们推断CDK4对细胞增殖和迁移的促进作用是通过调控POLD1基因和其编码的P125催化亚基实现的, 这种调控方式可以是直接的也可以是间接的. 实时荧光定量PCR的结果证实了这一推论, CDK4促进了POLD1的表达, 且POLD1的表达滞后于CDK4, 这一方面说明POLD1作为CDK4的下游基因受到CDK4调控, 另一方面也验证了CDK4和POLD1作用于不同细胞周期, 共同承担细胞DNA复制的任务. Western blot的结果在蛋白质水平上也说明了CDK4对P125的存在正向调控作用.
现有研究[24,25]证实cyclinD-CDK4复合物在细胞G1期中期和晚期磷酸化RB蛋白释放E2f-Dp1, E2f靶基因的表达使细胞通过R点(restriction point)完成DNA复制的准备, 进入下一细胞周期S期. 这时, DNA聚合酶δ(DNA polymerase δ, polδ)的催化亚基P125在增殖细胞核抗(proliferation cell nuclear antigen, PCNA)和复制因子C(replication factor C, RFC)的参与下形成复合物定位于复制叉, 以前导链和后续链为模板两种不同形式的DNA复制[26], 为细胞的增殖提供物质基础. 但是, 目前仍没有足够的证据证实CDK4蛋白是否直接参与了构成调控POLD1基因启动子的转录调控蛋白复合物, 这种转录调控复合物的空间结构与CDK4基因的突变是否有关系也没有实验验证. 这些都需更加深入的研究.
另外, 作为细胞核蛋白复合物的CDK4/cyclinD本应在细胞核表达, 但在多种癌症的免疫病理的研究观察中发现, CDK4/cyclinD均可在胞浆中表达, 且表达强弱与癌恶性程度有关[27]. 研究CDK4/cyclinD在不同细胞周期的定位对解释细胞周期依赖相关疾病的发生和发展有重要的意义. 而在研究细胞蛋白定位方面, 荧光蛋白和依赖荧光蛋白的荧光共振能量转移(fluorescence resonance energy transfer, FRET)等新技术的使用将成为研究细胞周期蛋白的有力工具[28-30].
总之, 我们目前的实验结果证实了突变型CDK4促进了肝细胞SMMC-7702的增殖能力, 其机制是通过调控POLD1基因和P125蛋白的高表达实现的. 进一步研究恶性肿瘤细胞中CDK4对POLD1调控通路和作用模式对从基因和蛋白水平上抑制肿瘤细胞增殖的提供新的思路, 对指导临床上肿瘤的治疗有重要意义.
POLD1基因编码的P125蛋白是细胞S期中负责DNA复制调控的关键蛋白, 与其他细胞周期调控因子关系密切.
王钦红, 副教授, 美国杜克大学医学院肿瘤生物系
研究癌细胞和正常细胞中DNA与蛋白复合物, 或蛋白与蛋白复合物空间结构和作用位点的改变能够解释细胞恶变的机制, 从而为新的诊疗方法提供理论依据.
CDK4是细胞G1期关键调控蛋白, 但是CDK4与POLD1/P125的调控关系研究鲜有报道, 本文首先发现肝癌细胞系内CDK4为突变型, 转染到肝细胞系后能使其增殖能力显著增加, 这与CDK4参与调控POLD1/P125有关.
肝细胞癌中突变型CDK4对POLD1调控机制的研究将为阻断肝癌的发生和发展提供新的思路和理论依据.
本研究在肝癌细胞中成功克隆了CDK4基因并对此基因的突变进行了分析, 为进一步在肝癌中研究此基因提供了有力的工具.
编辑: 曹丽鸥 电编:闫晋利
| 1. | 娄 国强. 加强HBV相关肝细胞肝癌的基础及临床研究. 中华实验和临床病毒学杂志. 2011;25:321-321. |
| 2. | Aladjem MI, Pasa S, Parodi S, Weinstein JN, Pommier Y, Kohn KW. Molecular interaction maps--a diagrammatic graphical language for bioregulatory networks. Sci STKE. 2004;2004:pe8. [PubMed] |
| 3. | Xu H, Zhang P, Liu L, Lee MY. A novel PCNA-binding motif identified by the panning of a random peptide display library. Biochemistry. 2001;40:4512-4520. [PubMed] [DOI] |
| 4. | Burgers PM, Gerik KJ. Structure and processivity of two forms of Saccharomyces cerevisiae DNA polymerase delta. J Biol Chem. 1998;273:19756-19762. [PubMed] [DOI] |
| 5. | Blain SW. Switching cyclin D-Cdk4 kinase activity on and off. Cell Cycle. 2008;7:892-898. [PubMed] [DOI] |
| 6. | Altirriba J, García A, Sánchez B, Haba L, Altekruse S, Stratmann T, Bombí JA, Mezquita C, Gomis R, Mora C. The sole presence of CDK4 is not a solid criterion for discriminating between tumor and healthy pancreatic tissues. Int J Cancer. 2012;130:2743-2745. [PubMed] [DOI] |
| 7. | Molenaar JJ, Ebus ME, Koster J, van Sluis P, van Noesel CJ, Versteeg R, Caron HN. Cyclin D1 and CDK4 activity contribute to the undifferentiated phenotype in neuroblastoma. Cancer Res. 2008;68:2599-2609. [PubMed] [DOI] |
| 8. | Chow YH, Zhu XD, Liu L, Schwartz BR, Huang XZ, Harlan JM, Schnapp LM. Role of Cdk4 in lymphocyte function and allergen response. Cell Cycle. 2010;9:4922-4930. [PubMed] [DOI] |
| 10. | Yu Q, Sicinska E, Geng Y, Ahnström M, Zagozdzon A, Kong Y, Gardner H, Kiyokawa H, Harris LN, Stål O. Requirement for CDK4 kinase function in breast cancer. Cancer Cell. 2006;9:23-32. [PubMed] [DOI] |
| 13. | Schrage YM, Lam S, Jochemsen AG, Cleton-Jansen AM, Taminiau AH, Hogendoorn PC, Bovée JV. Central chondrosarcoma progression is associated with pRb pathway alterations: CDK4 down-regulation and p16 overexpression inhibit cell growth in vitro. J Cell Mol Med. 2009;13:2843-2852. [PubMed] [DOI] |
| 14. | Lange C, Huttner WB, Calegari F. Cdk4/cyclinD1 overexpression in neural stem cells shortens G1, delays neurogenesis, and promotes the generation and expansion of basal progenitors. Cell Stem Cell. 2009;5:320-331. [PubMed] [DOI] |
| 15. | Annicotte JS, Blanchet E, Chavey C, Iankova I, Costes S, Assou S, Teyssier J, Dalle S, Sardet C, Fajas L. The CDK4-pRB-E2F1 pathway controls insulin secretion. Nat Cell Biol. 2009;11:1017-1023. [PubMed] [DOI] |
| 16. | Johnson SM, Torrice CD, Bell JF, Monahan KB, Jiang Q, Wang Y, Ramsey MR, Jin J, Wong KK, Su L. Mitigation of hematologic radiation toxicity in mice through pharmacological quiescence induced by CDK4/6 inhibition. J Clin Invest. 2010;120:2528-2536. [PubMed] [DOI] |
| 17. | Li W, Kotoshiba S, Berthet C, Hilton MB, Kaldis P. Rb/Cdk2/Cdk4 triple mutant mice elicit an alternative mechanism for regulation of the G1/S transition. Proc Natl Acad Sci U S A. 2009;106:486-491. [PubMed] [DOI] |
| 18. | Pilotti S, Della Torre G, Mezzelani A, Tamborini E, Azzarelli A, Sozzi G, Pierotti MA. The expression of MDM2/CDK4 gene product in the differential diagnosis of well differentiated liposarcoma and large deep-seated lipoma. Br J Cancer. 2000;82:1271-1275. [PubMed] |
| 19. | Plna K, Hemminki K. Re: High frequency of multiple melanomas and breast and pancreas carcinomas in CDKN2A mutation-positive melanoma families. J Natl Cancer Inst. 2001;93:323-325. [PubMed] [DOI] |
| 20. | Miliani de Marval PL, Macias E, Rounbehler R, Sicinski P, Kiyokawa H, Johnson DG, Conti CJ, Rodriguez-Puebla ML. Lack of cyclin-dependent kinase 4 inhibits c-myc tumorigenic activities in epithelial tissues. Mol Cell Biol. 2004;24:7538-7547. [PubMed] [DOI] |
| 23. | Greeve MA, Allan RK, Harvey JM, Bentel JM. Inhibition of MCF-7 breast cancer cell proliferation by 5alpha-dihydrotestosterone; a role for p21(Cip1/Waf1). J Mol Endocrinol. 2004;32:793-810. [PubMed] [DOI] |
| 24. | 阮 细玲, 李 永继, 廖柳凤 黄文涛, 吴 琼, 徐 恒. P21对胃癌细胞MGC-803的增殖抑制及对POLD1基因表达的调控. 世界华人消化杂志. 2011;19:1990-1995. [DOI] |
| 25. | Prall OW, Sarcevic B, Musgrove EA, Watts CK, Sutherland RL. Estrogen-induced activation of Cdk4 and Cdk2 during G1-S phase progression is accompanied by increased cyclin D1 expression and decreased cyclin-dependent kinase inhibitor association with cyclin E-Cdk2. J Biol Chem. 1997;272:10882-10894. [PubMed] [DOI] |
| 26. | Hindges R, Hübscher U. DNA polymerase delta, an essential enzyme for DNA transactions. Biol Chem. 1997;378:345-362. [PubMed] |
| 28. | Hu CD, Chinenov Y, Kerppola TK. Visualization of interactions among bZIP and Rel family proteins in living cells using bimolecular fluorescence complementation. Mol Cell. 2002;9:789-798. [PubMed] [DOI] |
| 29. | Zhang H, Rudkevich DM. A FRET approach to phosgene detection. Chem Commun (Camb). 2007;1238-1239. [PubMed] [DOI] |
| 30. | Silvius JR, Nabi IR. Fluorescence-quenching and resonance energy transfer studies of lipid microdomains in model and biological membranes. Mol Membr Biol. 2006;23:5-16. [PubMed] [DOI] |