修回日期: 2012-04-20
接受日期: 2012-05-18
在线出版日期: 2012-06-28
目的: 系统评价超声内镜引导下细针穿刺活检(EUS-FNA)在胰腺实性占位定性诊断中的价值.
方法: 计算机检索MEDLINE、Cochrane Libr-ary、中国生物医学文献数据库、万方数据库、中国学术期刊全文等数据库, 检索时间均为建库至2011-10. 全面查找有关EUS-FNA诊断胰腺实性占位的文献, 按照诊断试验的纳入标准筛选文献, 提取纳入文献的特征信息(研究背景、设计信息和诊断参数信息), 根据QUADAS质量评价标准纳入文献的质量. 采用Meta-Disc1.4软件进行Meta分析, 检验异质性, 并根据异质性结果选择相应的效应模型. 对纳入文献予以加权定量合并, 计算汇总敏感度、特异度、阳性似然比、阴性似然比和诊断优势比及其95%CI, 绘制汇总受试者工作特征(SROC)曲线, 并计算曲线下面积(AUC).
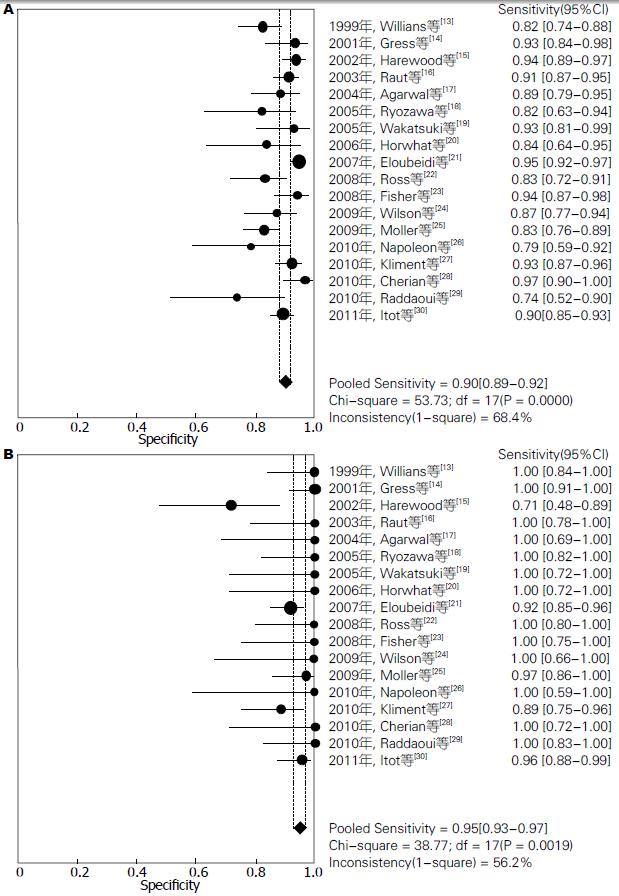
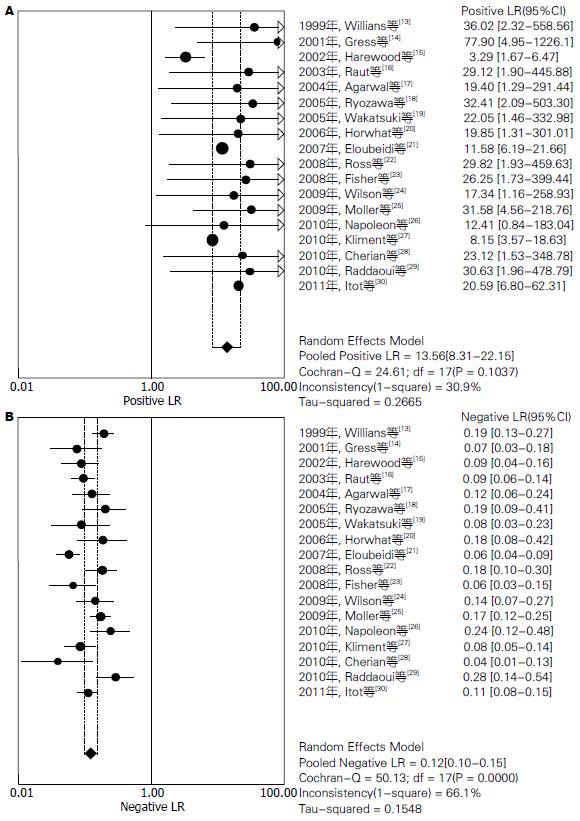
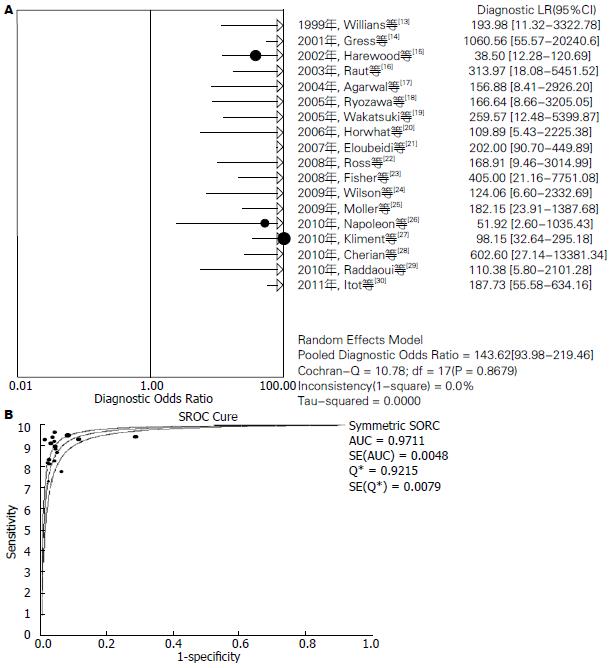
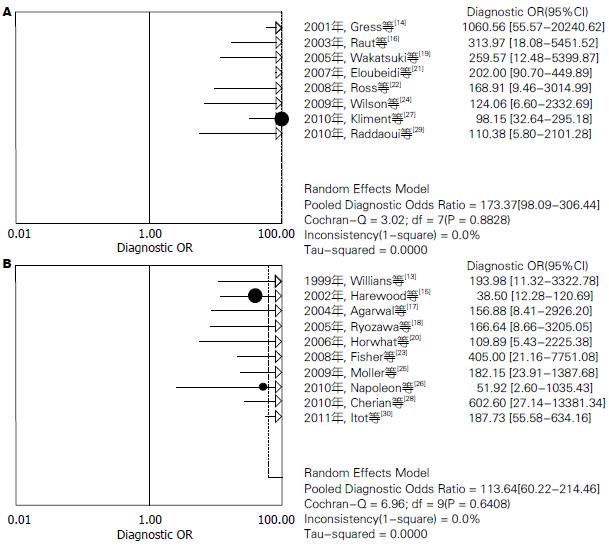
结果: 共检索出相关文献280篇, 按照文献纳入标准, 最终纳入18篇文献(均为英文文献). EUS-FNA对胰腺实性占位定性诊断价值分别为: 汇总敏感度为0.90[95%CI(0.89-0.92)], 汇总特异度为0.95[95%CI(0.93-0.97)], 汇总阳性似然比为13.56[95%CI(8.31-22.15)], 汇总阴性似然比为0.12[95%CI(0.10-0.15)], 汇总诊断优势比为143.62[95%CI(93.98-219.46)], SROC曲线下面积AUC为0.9711, Q* = 0.9215. 另外, 本研究还对有无病理医生在场指导进行了亚组分析, 发现有病理医生在场的AUC为0.9757, Q* = 0.9295. 且汇总诊断优势比173.37[95%CI(98.09-306.44)], 明显较无病理医生在场的113.64[95%CI(60.22-214.46)]高.
结论: 经SROC曲线证实, EUS-FNA活检在胰腺实性占位定性诊断中具有较高的灵敏度和特异度, 尤其是有病理医生在场指导的情况下, 可作为临床上胰腺实性占位定性诊断的重要检查手段.
引文著录: 朱成林, 黄强, 刘臣海, 谢放, 姚谦. 超声内镜引导下细针穿刺活检对胰腺实性占位定性诊断价值的Meta分析. 世界华人消化杂志 2012; 20(18): 1667-1676
Revised: April 20, 2012
Accepted: May 18, 2012
Published online: June 28, 2012
AIM: To establish the overall diagnostic accuracy of endoscopic ultrasound-guided fine-needle aspiration (EUS-FNA) for solid pancreatic masses.
METHODS: We searched PubMed (1966/2011-10), Cochrane Library (from establishment to 2011-10), CNKI (1994/2011-10), CBM (1978/2011-10) and Wanfang (2000/2011-10) databases to find all diagnostic tests about EUS-FNA for solid pancreatic masses. After collecting studies according to inclusion criteria of diagnostic tests, data (study background, design information and diagnostic parameters) were extracted. QUADAS items were used to evaluate the qualities of the included studies. Meta-disc software was used to handle data of included studies and to examine heterogeneity. The effect-model was selected according to outcomes of heterogeneity. After all included studies were weighted and combined, sensitivity, specificity, positive likelihood ratio (PLR), negative likelihood ratio (NLR), diagnostic odds ratio (DOR) and their 95%CI were calculated, and SROC curve was drawn.
RESULTS: A total of 280 potentially relevant studies were retrieved. According to eligibility criteria, 18 studies were included (all in English). The meta-analysis results are as follows: pooled sensitivity 0.90 (95%CI, 0.89-0.92), pooled specificity 0.95 (95%CI, 0.93-0.97), PLR 13.56 (95%CI, 8.31-22.15), NLR 0.12 (95%CI, 0.10-0.15), DOR 143.62 (95%CI, 93.98-219.46) and SROC AUC 0.9711 (Q* = 0.9215). Moreover, subgroup analysis was performed to identify the sources of heterogeneity according to the presence or absence of an on-site cytopathologist. The SROC AUC was 0.9757 (Q* = 0.9295) in the presence of an on-site cytopathologist. The DOR in the presence of an on-site cytopathologist was higher that in the absence of an on-site cytopathologist [173.37 (95%CI, 98.09-306.44) vs 113.64 (95%CI, 60.22-214.46)].
CONCLUSION: EUS-FNA has a high sensitivity and specificity in the diagnosis of solid pancreatic masses, especially in the presence of an on-site cytopathologist.
- Citation: Zhu CL, Huang Q, Liu CH, Xie F, Yao Q. Diagnostic value of endoscopic ultrasound-guided fine-needle aspiration for solid pancreatic masses: A meta-analysis. Shijie Huaren Xiaohua Zazhi 2012; 20(18): 1667-1676
- URL: https://www.wjgnet.com/1009-3079/full/v20/i18/1667.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i18.1667
近年来, 胰腺恶性肿瘤的发病率国内外报道均呈明显上升趋势, 特别是胰腺实性肿瘤, 缺乏有效的早期诊断方法是其主要原因之一. 胰腺实性肿瘤主要包括导管腺癌、神经内分泌瘤、胃泌素瘤、胰岛细胞瘤、胰高血糖素瘤及生长抑素瘤. 由于患者早期没有明显的症状, 且胰腺位于腹膜后, 早期各种检查和肿瘤指标缺乏特异性, 故其早期定性诊断非常困难. 随着内镜技术的快速发展, 自90年代首次报道超声内镜引导下细针穿刺(endoscopic ultrasound-guided fine-needle aspiration, EUS-FNA)以来, 因其具有安全、有效且能早期获得病理性诊断等传统检查所不具备的优势, 已成为对各种消化系统、恶性疾病进行鉴别或分期的一种重要检查手段. 虽然EUS-FNA有较高的诊断率, 但其结果存在一定假阴性率, 加上仪器设备和检查费用昂贵, 使其在临床的诊断价值受到争议和广泛推广受到限制. 目前, 国内外关于EUS-FNA对胰腺实性占位的定性诊断研究较多. 本研究旨在采用循证医学的方法, 汇总分析国内外EUS-FNA诊断胰腺实性占位的价值, 为其在临床上的使用提供证据.
数据库查找有关EUS-FNA诊断胰腺实性占位的文献, 按照诊断试验的纳入标准筛选文献, 提取纳入文献的特征信息(研究背景、设计信息和诊断参数信息), 进行系统性评价分析.
1.2.1 文献纳入和排除标准: 同时符合以下条件的文献被纳入: (1)中文和英文文献; (2)研究目的为评价EUS-FNA对胰腺实性占位定性诊断的临床价值; (3)前瞻性或回顾性研究; (4)研究对象大于30例; (5)所有纳入的研究对象均进行EUS-FNA和金标准检查; (6)以手术切除的病理或长期随访的结果为金标准; (7)若数据重复发表, 选择其中最详尽的数据或最近发表的文章; (8)文章能直接或间接提供数据, 可分别计算真阳性值(TP)、假阳性值(FP)、真阴性值(TN)、假阴性值(FN). 文献排除标准: (1)研究对象不足30例; (2)无法获得诊断结果的数据; (3)数据重叠, 小样本, 早期或低质量文献; (4)无法获得全文者.
1.2.2 文献检索: (1)数据库: 英文数据库包括MEDLINE和Cochrane图书馆, 中文数据库包括中国生物医学文献数据库、万方数据库、中国学术期刊全文数据库. 检索时间均从建库至2011-10. 此外使用Google Scholar和Medical Matix等搜索引擎检索互联网上的相关文献, 追查纳入文献的参考文献; (2)检索策略: 英文检索词: EUS-FNA, endoscopic ultrasound-guided fine needle aspiration, solid pancreatic mass, solid pancreatic lesion, pancreatic cancer, pancreatic tumor, sensitivity and specificity, diagnosis, false negative, false positive. 中文检索词: 超声内镜, 细针穿刺, 胰腺实性占位, 胰腺占位, 胰腺癌, 胰腺肿瘤. 参考"The Bayes library of diagnostic studies and reviews"[1]制定的检索策略, 检索词分目标疾病、目标人群、诊断方法和诊断准确性指标部分, 并且根据具体数据库调整, 采取主题词和自由词检索结合的方式, 所有检索策略都通过多次预检索后确定, 检索语种不限.
1.2.3 纳入和排除文献方法: 由朱成林和姚谦医生按照制定的纳入和排除标准同时单独纳入和排除文献, 如遇分歧讨论决定.
1.2.4 文献资料提取: 按照预先设计的资料提取表, 由朱成林医生提取和录入资料, 姚谦医生核对, 如遇分歧讨论解决或由谢放医生判定, 缺乏的资料通过电话或电子邮件与作者联系予以补充. (1)研究背景或设计信息的提取: 包括作者、国家、发表时间、EUS-FNA检查方法、样本量、偏倚和研究设计(前瞻性或回顾性)及其他信息; (2)诊断参数信息的提取: 包括TP、FP、TN、FN、敏感度、特异度、阳性似然比(PLR)、阴性似然比(NLR)和诊断优势比(DOR).
1.2.5 文献质量评价方法: 依据Whiting等[2]制定的QUADAS(quality assessment of diagnostic accuracy studies)14条标准评价文献质量, 分别对14个条目按"是"(满足此标准)、"否"(不满足或未提及)、"不清楚"(部分满足或者从文献中无法得到足够信息)3个判断标准进行评价. 由刘臣海和黄强医生独立评价文献质量, 如遇分歧讨论决定.
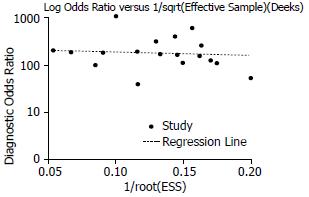
1.2.6 发表偏倚分析: 对诊断优势比对数与有效样本大小平方根的倒数进行分析, 绘制漏斗图.
统计学处理 采用Meta-Disc1.4软件进行Meta分析. 根据χ2检验, 若P<0.05, 且I2>50%, 说明纳入研究间具有异质性, 选择随机效应模型进行Meta分析; 反之, P>0.05, 且I2<50%, 说明纳入研究间具有同质性, 选择固定效应模型进行Meta分析. 绘制汇总受试者工作特征(SROC)曲线, 并计算曲线下面积(AUC)和Q*指数, Q*指数为SROC曲线与直线(敏感度 = 特异度)相交处的敏感度, Q*指数越大, 表示诊断试验的准确性越大; AUC越接近1, 表示诊断试验的准确性越高, 说明该项检查的诊断价值越高.
初检出相关文献280篇. 朱成林与姚谦医生通过阅读文献及摘要, 排除综述, 动物实验, 非诊断性试验252篇, 初步纳入文献28篇; 进一步阅读全文并与谢放医生讨论后排除不满足纳入标准及无法提取诊断参数信息的10篇(穿刺针大小不同对胰腺实性占位诊断的比较1篇[3], 有无病理医生在场对胰腺实性占位诊断的比较2篇[4,5], 但无法获取总体资料, 与纳入资料有重复数据1篇[6], 病例中包括胰腺囊性病变或病例数<30的5篇[7-11], 无法获取4个表资料的1篇[12]). 最终纳入18篇文献[13-30], 均为英文文献, 共纳入研究对象2 592例, 一般情况及纳入文献的诊断参数信息具体见表1.
| 年份 作者 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 1999年 Willians等[13] | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 否 | 是 | 是 | 是 |
| 2001年 Gress等[14] | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 否 | 是 | 是 | 是 |
| 2002年 Harewood等[15] | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 否 | 是 | 是 | 是 |
| 2003年 Raut等[16] | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 否 | 是 | 是 | 是 |
| 2004年 Agarwal等[17] | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 否 | 是 | 否 | 是 |
| 2005年 Ryozawa等[18] | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 否 | 是 | 否 | 是 |
| 2005年 Wakatsuki等[19] | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 否 | 是 | 是 | 是 |
| 2006年 Horwhat等[20] | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 否 | 是 | 是 | 否 |
| 2007年 Eloubeidi等[21] | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 否 | 是 | 是 | 不清楚 |
| 2008年 Ross等[22] | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 否 | 是 | 否 | 是 |
| 2008年 Fisher等[23] | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 否 | 是 | 是 | 否 |
| 2009年 Wilson等[24] | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 否 | 是 | 否 | 不清楚 |
| 2009年 Moller等[25] | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 否 | 是 | 是 | 是 |
| 2010年 Napoleon等[26] | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 否 | 是 | 是 | 是 |
| 2010年 Kliment等[27] | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 否 | 是 | 是 | 是 |
| 2010年 Cherian等[28] | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 否 | 是 | 是 | 是 |
| 2010年 Raddaoui等[29] | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 否 | 是 | 是 | 是 |
| 2011年 Itot等[30] | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 否 | 是 | 否 | 是 |
18篇均符合QUADAS标准中的11项条目, 即疾病谱组成, 选择标准, 金标准, 疾病进展偏倚, 部分参照偏倚, 多重参照偏倚, 混合偏倚, 待评价试验的实施, 金标准的实施, 试验解读偏倚, 临床解读偏倚. 另3个条目描述如下, 所有文献均是在知晓待评价试验的结果的情况下进行金标准试验. 5篇[17,18,22,24,30]未解释报告中难以解释的中间试验结果, 2篇[20,23]对退出的病例没有做出解释, 2篇[21,24]对退出病例无法从文献中得到足够信息. 具体见表2.
| 年份 作者 | n | 国家 | 真阳性(n) | 假阳性(n) | 假阴性(n) | 真阴性(n) | 穿刺针大小 | 肿块大小(mm) | 病理医生(是/否) |
| 1999年 Willians等[13] | 144 | 美国 | 101 | 0 | 22 | 21 | 22, 23 | 35 | 否 |
| 2001年 Gress等[14] | 102 | 美国 | 57 | 0 | 4 | 41 | 22, 23 | 35±32.7 | 是 |
| 2002年 Harewood等[15] | 185 | 美国 | 154 | 6 | 10 | 15 | 22 | 30±13 | 否 |
| 2003年 Raut等[16] | 233 | 美国 | 197 | 0 | 19 | 15 | 22 | none | 是 |
| 2004年 Agarwal等[17] | 81 | 美国 | 63 | 0 | 8 | 10 | 不清楚 | 不清楚 | 否 |
| 2005年 Ryozawa等[18] | 47 | 日本 | 23 | 0 | 5 | 19 | 22 | 33 | 否 |
| 2005年 Wakatsuki等[19] | 53 | 美国 | 39 | 0 | 3 | 11 | 22 | 34.2±13.7 | 是 |
| 2006年 Horwhat等[20] | 36 | 美国 | 21 | 0 | 4 | 11 | 20-22 | 28.7±10.1 | 否 |
| 2007年 Eloubeidi等[21] | 547 | 美国 | 414 | 9 | 23 | 101 | 22 | 36 | 是 |
| 2008年 Ross等[22] | 83 | 美国 | 55 | 0 | 11 | 17 | 22 | 不清楚 | 是 |
| 2008年 Fisher等[23] | 100 | 澳大利亚 | 82 | 0 | 5 | 13 | 22 | 35.1±12.9 | 否 |
| 2009年 Wilson等[24] | 72 | 澳大利亚 | 55 | 0 | 8 | 9 | 19/22 | 不清楚 | 是 |
| 2009年 Moller等[25] | 192 | 希腊 | 128 | 1 | 26 | 37 | 22 | 不清楚 | 否 |
| 2010年 Napoleon等[26] | 35 | 法国 | 22 | 0 | 6 | 7 | 22 | 30±12 | 否 |
| 2010年 Kliment等[27] | 207 | 捷克 | 151 | 5 | 12 | 39 | 22 | 31.5±9.7 | 是 |
| 2010年 Cherian等[28] | 78 | 英国 | 65 | 0 | 2 | 11 | 22 | 不清楚 | 否 |
| 2010年 Raddaoui等[29] | 42 | 沙特阿拉伯 | 17 | 0 | 6 | 20 | 22 | 不清楚 | 是 |
| 2011年 Itot等[30] | 355 | 日本 | 256 | 3 | 30 | 66 | 19/22/25 | 不清楚 | 否 |
2.3.1 Meta分析异质性检验: 阈值效应的异质性检验: 计算敏感度对数与(1-特异度)对数的Spearman相关系数 = 0.394, P = 0.106. 表明纳入研究不存在阈值效应导致的异质性. 非阈值效应检验: PLR(χ2 = 24.61, P = 0.1037), DOR(χ2 = 10.78, P = 0.8679), 敏感度(χ2 = 53.73, P = 0.0000), 特异度(χ2 = 38.77, P = 0.0019)及NLR(χ2 = 50.13, P = 0.0000), 说明研究间存在由非阈值效应导致的异质性.
2.3.2 Meta分析: 由于研究之间存在异质性, 采用随机效应模型进行Meta分析. 结果显示: 汇总敏感度为0.90[95%CI(0.89-0.92)] (图1A), 汇总特异度为0.95[95%CI(0.93-0.97)] (图1B), 汇总阳性似然比为13.56[95%CI(8.31-22.15)] (图2A), 汇总阴性似然比为0.12[95%CI(0.10-0.15)] (图2B), 汇总诊断优势比为143.62[95%CI(93.98-219.46)] (图3A), SROC曲线下面积AUC为0.9711,Q* = 0.9215(图3B).
2.3.3 亚组分析: 由于受研究数量及质量限制, 本研究只对有无病理医生在场进行亚组分析. 有病理医生在场敏感度(χ2 = 19.14, P = 0.0078, I2 = 63.4%)和无病理医生在场敏感度(χ2 = 27.65, P = 0.0011, I2 = 67.5%), 有明显异质性, 采用随机效应模型进行Meta分析. 结果显示有病理医生在场AUC为0.9757, Q* = 0.9295, 且汇总诊断优势比173.37[95%CI(98.09-306.44)](图4A), 明显比无病理医生在场的113.64[95%CI(60.22-214.46)] (图4B)高.
2.3.4 敏感性分析: 将每个研究逐一排除后的分析显示汇总敏感度和特异度未见明显改变, 这说明纳入文献的稳定性好.
2.3.5 发表偏倚分析: 漏斗图分析显示, 发表偏倚系数(Z) = -10.226,P = 0.765, 说明纳入的研究发表偏倚不明显(图5).
胰腺实性肿瘤在临床上能够做到早期良恶性定性诊断非常困难, 尤其是对胰腺癌与肿块性胰腺炎. EUS-FNA作为一种新兴高灵敏的检查手段, 由于仍具有一定的假阴性, 导致许多临床医生认为, 既然最后确诊仍有赖于手术病理或长期跟踪随访, 不如直接手术或保守治疗观察; 另外因检查设备昂贵, 重视操作者水平, 穿刺标本易失败以及可能出现并发症等, 使其诊断价值广受争议. 临床上对其定性价值的报道均是各中心小样本的病例分析, 缺乏系统的分析, 针对其争议, 本研究采用诊断试验的系统评价方法对EUS-FNA在胰腺实性占位定性诊断中的价值进行分析.
Meta分析纳入了18篇以手术病理和长期病例跟踪随访为金标准的EUS-FNA的诊断性研究. 结果显示, EUS-FNA定性诊断胰腺实性占位的汇总敏感度为90%, 汇总特异度为95%, 提示漏诊率为10%, 误诊率为5%, 说明该试验检验效能高; 汇总PLR为13.56, 提示EUS-FNA试验结果为阳性时, 疑似病例可基本确诊为恶性肿瘤; 汇总NLR为0.12, 提示诊断试验结果为阴性时, 疑似病例可基本排除为恶性肿瘤; 诊断汇总DOR为143.62, 提示诊断试验的判断效果较好, SROC AUC为0.9711, 提示诊断试验的诊断准确性较高. 以上结果表明, EUS-FNA对于胰腺实性占位的定性诊断具有较高的敏感度和特异度, 诊断准确性较好, 可以作为重要的检测手段.
结合QUADAS质量评价结果, 分析异质性可能主要来自以下几个方面: (1)试验设计缺陷: 纳入研究的大部分均为回顾性研究, 设计理念不符合高质量诊断试验的要求, 而且所有病例都是在知道诊断试验的结果下行金标准试验, 且是根据诊断试验的结果决定性金标准试验, 金标准试验不仅是手术病理还包括对诊断试验良性的进行长期跟踪随访, 虽然最后都得到确诊, 但随访的资料可能存在误差不能排除; (2)由于不同医疗单位的诊疗技术、设备的差异, 可能导致异质性. 目前对EUS-FNA诊断影响较大的因素[31]主要是操作者的经验、穿刺针的选择、负压的选择、试验时细胞病理诊断和穿刺次数的选择及有无病理医生现场指导和病变的部位、大小和种类. 本研究准备对肿瘤大小、穿刺针大小及有无病理医生现场指导进行Meta回归和亚组分析, 但因文献质量有限, 只对有无病例医生在场指导进行了亚组分析, 研究显示有病理医生在场的DOR173.37[95%CI(98.09-306.44), 比无病理医生在场指导DOR113.64[95%CI(60.22-214.46)]要高的多, 有趣的是本研究将有无病理医生在场和设计资料类型纳入Meta回归(结果未给出), 二者均与诊断结果的差异无显著统计学意义, 其主要原因可能与纳入的病例不够, 或与自变量过少有关, 但据国内外最新报道, 二者之间确实有关. 国内金震东等[12]研究报道的EUS-FNA敏感性67.6%, 加用病理医师现场快速染色观片后敏感性上升至93.1%, 国外Iglesias-Garcia等[5]也报道了有无病理医生在场的诊断灵敏度分别为96.2% vs 78.2%, 并能够显著降低并发症; (3)人种、地域不同, 可能存在差异. 检索策略、发表偏倚及灰色文献也是产生异质性的重要来源.
从方法学质量评价及异质性分析结果来看, 本文纳入研究的质量较高. 另外, 在对待选择偏倚及数据摘录方面, 经漏斗图分析显示, 发表偏倚系数(Z) = -10.226, P = 0.765, 说明纳入的研究发表偏倚不明显. 但仍有改进的地方: (1)尽量采用诊断性试验报告标准, 提高诊断性试验的报告质量; (2)诊断性试验和对照试验应尽量同步进行. 在进行诊断时应做到"盲法"评估; (3)应尽可能采用前瞻性研究方法, 以避免回顾性偏倚的影响; (4)对此方法用于诊断胰腺实性占位的定性诊断评价, 除评价诊断准确性外, 还应关注安全性和成本-效果等问题.
总之, EUS-FNA是一种具有高敏感性和特异度的检查方法, 同时作为一种简单、安全、有效的方法, 对于可能切除的病例有利于术前诊断并决定手术方案; 对于晚期的胰腺肿瘤可避免不必要的剖腹探查, 并能指导合理的使用化疗, 可以作为胰腺实性占位定性诊断的重要检查方法, 但还需要高质量的前瞻性研究, 以进一步证实其在胰腺实性占位定性诊断中的价值.
胰腺实性肿瘤能够做到早期良恶性定性诊断非常困难, 随着内镜技术的快速发展, 超声内镜引导下细针穿刺(EUS-FNA)作为一种新兴高灵敏的检查手段, 临床上正逐渐被采用与推广, 但对其在胰腺实性占位定性诊断中的价值尚未有系统性评价.
徐辉雄, 教授, 主任医师, 博士生导师, 同济大学附属第十人民医院暨上海市第十人民医院超声科
虽然EUS-FNA有较高的诊断率, 但其结果存在一定假阴性率, 加上仪器设备和检查费用昂贵, 使其在临床的诊断价值受到争议和广泛推广受到限制.
自90年代首次报道EUS-FNA以来, 因其具有安全、有效且能早期获得病理性诊断等传统检查所不具备的优势, 已成为对各种消化系统、恶性疾病进行鉴别或分期的一种重要检查手段.
本研究采用循证医学的方法, 汇总分析国内外EUS-FNA诊断胰腺实性占位的价值, 减少了因各中心小样本的病例分析而出现的差异, 更准确地评价EUS-FNA的临床价值.
本研究显示EUS-FNA作为一种具有高敏感性和特异度的检查方法, 对于可能切除的病例有利于术前诊断并决定手术方案, 对于晚期的胰腺肿瘤可避免不必要的剖腹探查, 并能指导合理的使用化疗, 可以作为胰腺实性占位定性诊断的重要检查方法, 临床上值得应用与推广.
本研究目的合理, 有可行性及临床意义, 收集的文献较全面, 制定了严格的纳入排除标准, Meta分析步骤正确, 明确了EUS-FNA的诊断价值.
编辑: 张姗姗 电编:闫晋利
| 1. | Main C, Moxham T, Wyatt JC, Kay J, Anderson R, Stein K. Computerised decision support systems in order communication for diagnostic, screening or monitoring test ordering: systematic reviews of the effects and cost-effectiveness of systems. Health Technol Assess. 2010;14:1-227. [PubMed] |
| 2. | Whiting P, Rutjes AW, Reitsma JB, Bossuyt PM, Kleijnen J. The development of QUADAS: a tool for the quality assessment of studies of diagnostic accuracy included in systematic reviews. BMC Med Res Methodol. 2003;3:25. [PubMed] [DOI] |
| 3. | Fabbri C, Polifemo AM, Luigiano C, Cennamo V, Baccarini P, Collina G, Fornelli A, Macchia S, Zanini N, Jovine E. Endoscopic ultrasound-guided fine needle aspiration with 22- and 25-gauge needles in solid pancreatic masses: a prospective comparative study with randomisation of needle sequence. Dig Liver Dis. 2011;43:647-652. [PubMed] [DOI] |
| 4. | Hikichi T, Irisawa A, Bhutani MS, Takagi T, Shibukawa G, Yamamoto G, Wakatsuki T, Imamura H, Takahashi Y, Sato A. Endoscopic ultrasound-guided fine-needle aspiration of solid pancreatic masses with rapid on-site cytological evaluation by endosonographers without attendance of cytopathologists. J Gastroenterol. 2009;44:322-328. [PubMed] [DOI] |
| 5. | Iglesias-Garcia J, Dominguez-Munoz JE, Abdulkader I, Larino-Noia J, Eugenyeva E, Lozano-Leon A, Forteza-Vila J. Influence of on-site cytopathology evaluation on the diagnostic accuracy of endoscopic ultrasound-guided fine needle aspiration (EUS-FNA) of solid pancreatic masses. Am J Gastroenterol. 2011;106:1705-1710. [PubMed] [DOI] |
| 6. | Eloubeidi MA, Chen VK, Eltoum IA, Jhala D, Chhieng DC, Jhala N, Vickers SM, Wilcox CM. Endoscopic ultrasound-guided fine needle aspiration biopsy of patients with suspected pancreatic cancer: diagnostic accuracy and acute and 30-day complications. Am J Gastroenterol. 2003;98:2663-2668. [PubMed] |
| 7. | 郑 孔林, 陈 涛, 居 峰, 王 含芬, 王 辉, 范 苑丹, 杜 虎, 唐 良, 陆 国民, 蒋 丽莎. 内镜超声引导下细针穿刺活检诊断胰腺占位性病变28例. 中华消化内镜杂志. 2010;27:657-658. |
| 8. | 郭 文, 雷 姗, 程 天明, 朱 微, 姚 永莉, 周 丹, 智 发朝, 姜 泊. 超声内镜引导细针穿刺活检对胰腺占位性病变的诊断价值. 现代消化及介入诊疗. 2010;15:223-226. |
| 13. | Williams DB, Sahai AV, Aabakken L, Penman ID, van Velse A, Webb J, Wilson M, Hoffman BJ, Hawes RH. Endoscopic ultrasound guided fine needle aspiration biopsy: a large single centre experience. Gut. 1999;44:720-726. [PubMed] [DOI] |
| 14. | Gress F, Gottlieb K, Sherman S, Lehman G. Endoscopic ultrasonography-guided fine-needle aspiration biopsy of suspected pancreatic cancer. Ann Intern Med. 2001;134:459-464. [PubMed] |
| 15. | Harewood GC, Wiersema MJ. Endosonography-guided fine needle aspiration biopsy in the evaluation of pancreatic masses. Am J Gastroenterol. 2002;97:1386-1391. [PubMed] [DOI] |
| 16. | Raut CP, Grau AM, Staerkel GA, Kaw M, Tamm EP, Wolff RA, Vauthey JN, Lee JE, Pisters PW, Evans DB. Diagnostic accuracy of endoscopic ultrasound-guided fine-needle aspiration in patients with presumed pancreatic cancer. J Gastrointest Surg. 2003;7:118-126; discussion 127-128. [PubMed] [DOI] |
| 17. | Agarwal B, Abu-Hamda E, Molke KL, Correa AM, Ho L. Endoscopic ultrasound-guided fine needle aspiration and multidetector spiral CT in the diagnosis of pancreatic cancer. Am J Gastroenterol. 2004;99:844-850. [PubMed] [DOI] |
| 18. | Ryozawa S, Kitoh H, Gondo T, Urayama N, Yamashita H, Ozawa H, Yanai H, Okita K. Usefulness of endoscopic ultrasound-guided fine-needle aspiration biopsy for the diagnosis of pancreatic cancer. J Gastroenterol. 2005;40:907-911. [PubMed] [DOI] |
| 19. | Wakatsuki T, Irisawa A, Bhutani MS, Hikichi T, Shibukawa G, Takagi T, Yamamoto G, Takahashi Y, Yamada Y, Watanabe K. Comparative study of diagnostic value of cytologic sampling by endoscopic ultrasonography-guided fine-needle aspiration and that by endoscopic retrograde pancreatography for the management of pancreatic mass without biliary stricture. J Gastroenterol Hepatol. 2005;20:1707-1711. [PubMed] [DOI] |
| 20. | Horwhat JD, Paulson EK, McGrath K, Branch MS, Baillie J, Tyler D, Pappas T, Enns R, Robuck G, Stiffler H. A randomized comparison of EUS-guided FNA versus CT or US-guided FNA for the evaluation of pancreatic mass lesions. Gastrointest Endosc. 2006;63:966-975. [PubMed] [DOI] |
| 21. | Eloubeidi MA, Varadarajulu S, Desai S, Shirley R, Heslin MJ, Mehra M, Arnoletti JP, Eltoum I, Wilcox CM, Vickers SM. A prospective evaluation of an algorithm incorporating routine preoperative endoscopic ultrasound-guided fine needle aspiration in suspected pancreatic cancer. J Gastrointest Surg. 2007;11:813-819. [PubMed] [DOI] |
| 22. | Ross WA, Wasan SM, Evans DB, Wolff RA, Trapani LV, Staerkel GA, Prindiville T, Lee JH. Combined EUS with FNA and ERCP for the evaluation of patients with obstructive jaundice from presumed pancreatic malignancy. Gastrointest Endosc. 2008;68:461-466. [PubMed] [DOI] |
| 23. | Fisher L, Segarajasingam DS, Stewart C, Deboer WB, Yusoff IF. Endoscopic ultrasound guided fine needle aspiration of solid pancreatic lesions: Performance and outcomes. J Gastroenterol Hepatol. 2009;24:90-96. [PubMed] [DOI] |
| 24. | Wilson JL, Kalade A, Prasad S, Cade R, Thomson B, Banting S, Mackay S, Desmond PV, Chen RY. Diagnosis of solid pancreatic masses by endoscopic ultrasound-guided fine-needle aspiration. Intern Med J. 2009;39:32-37. [PubMed] [DOI] |
| 25. | Möller K, Papanikolaou IS, Toermer T, Delicha EM, Sarbia M, Schenck U, Koch M, Al-Abadi H, Meining A, Schmidt H. EUS-guided FNA of solid pancreatic masses: high yield of 2 passes with combined histologic-cytologic analysis. Gastrointest Endosc. 2009;70:60-69. [PubMed] [DOI] |
| 26. | Napoleon B, Alvarez-Sanchez MV, Gincoul R, Pujol B, Lefort C, Lepilliez V, Labadie M, Souquet JC, Queneau PE, Scoazec JY. Contrast-enhanced harmonic endoscopic ultrasound in solid lesions of the pancreas: results of a pilot study. Endoscopy. 2010;42:564-570. [PubMed] [DOI] |
| 27. | Kliment M, Urban O, Cegan M, Fojtik P, Falt P, Dvorackova J, Lovecek M, Straka M, Jaluvka F. Endoscopic ultrasound-guided fine needle aspiration of pancreatic masses: the utility and impact on management of patients. Scand J Gastroenterol. 2010;45:1372-1379. [PubMed] [DOI] |
| 28. | Cherian PT, Mohan P, Douiri A, Taniere P, Hejmadi RK, Mahon BS. Role of endoscopic ultrasound-guided fine-needle aspiration in the diagnosis of solid pancreatic and peripancreatic lesions: is onsite cytopathology necessary? HPB (Oxford). 2010;12:389-395. [PubMed] [DOI] |
| 29. | Raddaoui E. Clinical utility and diagnostic accuracy of endoscopic ultrasound-guided fine needle aspiration of pancreatic lesions: Saudi Arabian experience. Acta Cytol. 2011;55:26-29. [PubMed] [DOI] |
| 30. | Itoi T, Tsuchiya T, Itokawa F, Sofuni A, Kurihara T, Tsuji S, Ikeuchi N. Histological diagnosis by EUS-guided fine-needle aspiration biopsy in pancreatic solid masses without on-site cytopathologist: a single-center experience. Dig Endosc. 2011;23 Suppl 1:34-38. [PubMed] [DOI] |