修回日期: 2012-03-15
接受日期: 2012-04-17
在线出版日期: 2012-06-08
目的: 探讨表皮生长因子(epidermal growth factor, EGF)对人食管腺癌SEG-1细胞尿激酶型纤溶酶原激活物(urokinase-type plasminogen activator, u-PA)mRNA和蛋白表达的影响及p38MAPK信号转导通路在其中的作用.
方法: 以相同浓度的EGF(100 μg/L)按时间梯度刺激SEG-1细胞, 应用Western blot法测定各时间点总p38MAPK蛋白、磷酸化p38MAPK蛋白、u-PA蛋白表达, 并应用RT-PCR方法检测各时间点u-PA mRNA表达. 用p38MAPK特异抑制剂SB203580预处理细胞后, 观察上述指标变化.
结果: EGF可明显增强SEG-1细胞(u-PA)mRNA和蛋白的表达, 并可激活p38MAPK蛋白的磷酸化, 具有时间依赖性. SB203580能明显抑制EGF诱导的p38MAPK蛋白的磷酸化, 用其阻断p38MAPK信号转导通路后, EGF对u-PA mRNA和蛋白表达的诱导作用受到显著抑制, 并且具有剂量依赖性.
结论: EGF可通过p38MAPK信号转导通路诱导SEG-1细胞表达u-PA.
引文著录: 李宁, 陈娟, 白研, 白文元. p38MAPK信号转导通路在EGF诱导食管腺癌SEG-1细胞表达u-PA中的作用. 世界华人消化杂志 2012; 20(16): 1458-1462
Revised: March 15, 2012
Accepted: April 17, 2012
Published online: June 8, 2012
AIM: To study the effect of epidermal growth factor (EGF) on the mRNA and protein expression of urokinase-type plasminogen activator (u-PA) in esophageal adenocarcinoma SEG-1 cells and to detect the role of the p38MAPK signaling pathway in this process.
METHODS: After SEG-1 cells non-pre-incubated or pre-incubated with SB203580 (a p38MAPK inhibitor) for two hours were treated with EGF (100 μg/L) for different durations, the protein expression of total p38MAPK, phosphorylated p38MAPK and u-PA was determined by Western blot, and the expression of u-PA mRNA was examined by reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: Treatment with EGF significantly increased the mRNA and protein expressions of u-PA and induced p38 kinase phosphorylation in SEG-1 cells in a time-dependent manner. SB203580 could sufficiently suppress EGF-induced p38MAPK phosphorylation and significantly attenuate EGF-induced u-PA mRNA and protein expression in SEG-1 cells in a dose-dependent manner.
CONCLUSION: EGF can significantly induce u-PA in SEG-1 cells by activating the p38MAPK signaling pathway.
- Citation: Li N, Chen J, Bai Y, Bai WY. Role of the p38MAPK signaling pathway in EGF-induced u-PA expression in esophageal adenocarcinoma SEG-1 cells. Shijie Huaren Xiaohua Zazhi 2012; 20(16): 1458-1462
- URL: https://www.wjgnet.com/1009-3079/full/v20/i16/1458.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i16.1458
食管腺癌的主要临床特征之一是早期转移. 腺癌细胞是通过何种机制侵入正常组织、进入到远处组织器官发生转移机制的还不清楚. 尿激酶型纤溶酶原激活(urokinase-type plasminogen activator, u-PA)作用系统被认为在细胞外基质和基底膜的降解, 促进肿瘤侵袭和转移中起核心作用. 现已证实体内多种因子如肿瘤生长因子(tumor growth factor, TGF)、胰岛素生长因子(insulin like growth factor, IGF)、表皮生长因子(epidermal growth factor, EGF)、KGF、白介素1(interleukin 1, IL-1)等均能调控u-PA表达. 丝裂原活化蛋白激酶(mitogen activated protein kinase, MAPK)的磷酸化级联反应, 是EGF诱导的重要反应[1-3]. 其中p38MAPK激活后在肿瘤细胞的侵袭转移方面具有重要的调控功能.
我们旨在通过观察EGF与其受体结合后对食管腺癌细胞u-PA和p38MAPK表达的影响以及p38MAPK在EGF诱导食管腺癌SEG-1细胞表达u-PA中的作用, 进一步了解EGF在引起食管腺癌细胞发生侵袭、转移中的作用及其机制.
人食管腺癌SEG-1细胞株由美国北卡罗来纳州中央大学陈教授友好惠赠; EGF购自Sigma公司; p38MAPK、磷酸化p38MAPK(p-p38MAPK)单克隆抗体购自Cell Signaling公司; 抗u-PA抗体购自Thermo Fish Scientific公司; p38MAPK活化抑制剂SB203580购自美国ALEXIS公司; HRP标记的山羊抗小鼠IgG购自Santa Cruz公司; u-PA和β-actin引物由北京赛百盛基因技术有限公司合成, 其中u-PA上游: 5'-TCACCACCAAAATGCTGTGT-3', 下游: 5'-AGGCCATTCTCTTCCTTGGT-3', 扩增长度为502 bp; 内参β-actin上游: 5'-AGAGCTACGAGCTGCCTGAC-3', 下游: 5'-GTCACCTTCACCGTTCCAGT-3', 扩增长度为190 bp.
1.2.1 细胞培养: 复苏冷冻保存于液氮中的SEG-1后, 接种于含100 mL/L胎牛血清的DMEM(Gibco)培养液中, 37 ℃、50 mL/L CO2条件下培养. 当细胞生长至单层致密状时, 用0.25%胰蛋白酶消化后1:3传代, 24 h换液, 72 h再次传代.
1.2.2 实验分组: 每次实验均在细胞对数生长期进行, 接种2×105-3×105个细胞于50 mL的新玻璃培养瓶. 培养箱中孵育至50%-80%细胞汇合时, 弃培养液. 按下列分组进行处理: (1)对照组; (2)EGF组; (3)EGF+SB203580. (2)、(3)组中EGF浓度均为100 μg/L.
1.2.3 RT-PCR: 按照TRIzol试剂(赛百盛公司)一步法提取细胞总RNA, 按逆转录试剂盒(Promega公司)说明书先逆转录合成第1条cDNA、再以等量的cDNA为模板进行PCR反应, 反应条件如下: 94 ℃预变性2 min; 94 ℃变性1 min, 53 ℃退火1 min, 72 ℃延伸2 min, 35个循环; 72 ℃延伸5 min. 等量的PCR产物经1.5%琼脂糖凝胶电泳分离.
1.2.4 Western blot: 取100 μg细胞总蛋白样品进行SDS-PAGE电泳, 并转移至硝酸纤维素膜(Millipore公司)上; 室温封闭2 h后, 用TBST缓冲液漂洗3次, 加入鼠抗人u-PA单克隆抗体(1:2 000)、鼠抗人磷酸化p38MAPK多克隆抗体(1:000), 4 ℃孵育过夜. TBST漂洗3次后, 加入辣根过氧化物酶标记的二抗(1:2 000), 室温摇床孵育2 h, ECL化学发光试剂盒(Santa Cruz公司)自显影后, 暗室内X光底片感光成像.
统计学处理 各组实验重复3次. 计量资料以mean±SD表示, 细胞磷酸化率以百分率表示, 应用SPSS13.0软件进行统计分析; 多组间比较采用单因素方差分析(one-way ANOVA); 组间比较采用LSD检验. P<0.05即认为有统计学意义.
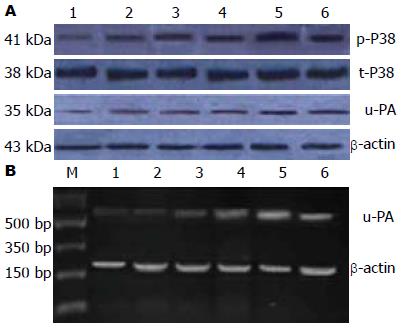
100 μg/L EGF作用1、6、12、24 h后, SEG-1的p38MAPK磷酸化程度不断增高, 而从24 h-48 h, p38MAPK磷酸化程度降低, 但EGF作用对p38MAPK总蛋白表达水平无影响. 采用凝胶定量软件分析p38MAPK磷酸化和总p38MAPK的蛋白条带灰度并计算p-p38MAPK磷酸化/p38MAPK的比值, 对照组1、6、12、24、48 h的p38MAPK磷酸化的百分比分别为5.62%、11.21%、26.42%、37.63%、55.27%、41.18%. 因此认为24 h的p38MAPK磷酸化水平最高(图1).
正常食管腺癌细胞(即对照组)中有u-PA基因表达, 随着EGF作用时间的延长, u-PA mRNA的表达水平逐渐上升, EGF作用于SEG-1细胞6 h, u-PA mRNA表达为0.31±0.06, 与正常对照组表达0.26±0.06相比, u-PA mRNA表达升高, 有统计学意义(P<0.05); EGF作用于SEG-1细胞12、24、48 h后, u-PA mRNA表达分别为: 0.64±0.05, 0.89±0.05, 0.73±0.05, 与正常对照组表达量0.26±0.06相比, u-PA mRNA表达明显升高, 差异有统计学意义(P<0.01). 可见与正常对照组相比, u-PA mRNA表达于24 h达高峰, 之后逐渐下降, 表达呈明显的时间依赖性(图1, 表1).
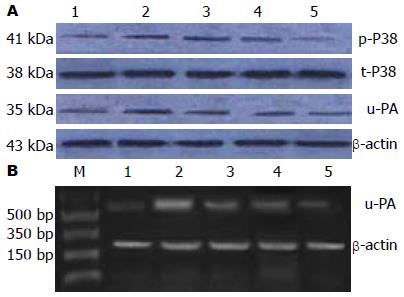
5、10、20 μmol/L SB203580与EGF同时作用于SEG-1细胞后p38MAPK蛋白磷酸化的百分比分别为36.25%、19.36%、7.18%, 明显低于EGF组p38MAPK蛋白磷酸化的百分比(51.40%), 可见SB203580可明显抑制SEG-1细胞p38MAPK蛋白的磷酸化, 呈明显的浓度依赖性. SB203580对EGF诱导的SEG-1细胞内u-PA mRNA和蛋白的表达亦有明显的抑制作用, 而且随着SB203580浓度的升高, 抑制作用更加明显, 呈明显的浓度依赖性(图2, 表2).
食管腺癌是一种恶性度较高的消化系肿瘤, 其侵袭力和转移率较高, 许多患者在就诊时已处于肿瘤晚期, 5年生存率很低. 近年来, 研究发现生长因子不仅促进细胞增生而且还诱导其恶性转化. EGF是由单核巨噬细胞产生的一种多肽, 在肿瘤的发生、发展中起主要作用. EGF通常通过自分泌和旁分泌途径, 刺激EGF受体(EGFR)自磷酸化, 激活受体酪氨酸蛋白激酶活性, 导致其下游的信号通路活化, 催化多种底物蛋白酪氨酸残基(Tyr)磷酸化. u-PA是一种丝氨酸蛋白水解酶, 具有水解蛋白和信号传导等多种功能, 其中最重要的作用是激活纤溶酶原转变为纤溶酶, 后者可催化降解多种底物, 如细胞外基质(extracellular matrix, ECM)的重要组成部分(纤维蛋白、纤维结合素和层粘连蛋白等)[4], 另外, 活性纤溶酶还能激活MMP-3、MMP-9、MMP-12和MMP-13等基质金属蛋白酶的前体, 活化的MMPs可进一步降解ECM[5], 特别是降解其中的基质和Ⅳ型胶原, 对细胞迁移和肿瘤侵袭转移过程中细胞外基质的降解有重要作用[6].
u-PA作用系统被认为在细胞外基质和基底膜的降解、促进肿瘤侵袭转移过程中起核心作用[7]. 高水平的u-PA已经被证实代表了快速增殖和低分化胰腺癌的高侵袭性的临床特征, 而关于其他恶性肿瘤(包括肺癌、胰腺癌、胃癌、直结肠癌、前列腺癌等)研究中也发现u-PA的激活与侵袭力有关[8-10]. 现已证实体内多种因子如TGF、IGF、EGF、KGF、IL-1等均能调控u-PA表达, 但具体机制尚不明确[11]. 我们在研究EGF对食管腺癌细胞SEG-1细胞u-PA表达影响的过程中发现, EGF可引起SEG-1细胞u-PA mRNA和蛋白表达增加, 并呈明显的时间依赖性, u-PA表达在6 h时开始升高, 24 h达到高峰, 然后下降, 反映出EGF受体饱和性的特点.
EGF与其受体结合后诱导MAPK的磷酸化级联反应, p38MAPK是EGF激发的多条信号传导通路之一. p38是MAPK家族中的一员, 是一组细胞内信号转导分子, 参与调控炎症、细胞生长、细胞分化、细胞周期及细胞死亡、侵袭表型等. p38MAPK可被多种细胞外的刺激因素激活, 包括炎性细胞因子、生长因子、血管内皮生长因子等. p38MAPK上游的MAPKK通过磷酸化p38MAPK的Thr-Gly-Tyr位点中的苏氨酸和酪氨酸使其活化, 活化的p38MAPK进一步调控下游多种基因的表达. SB203580是其活化的特异性抑制剂, 可通过与ATP结合位点的结合来抑制p38MAPK的蛋白激酶活性[12]. 本研究结果显示, EGF呈时间依赖性地激活SEG-1细胞中的p38MAPK, 在24 h达高峰, 然后开始下降. p38MAPK特异抑制剂SB203580呈浓度依赖的方式可部分抑制EGF诱导p38MAPK激酶的活化.
研究发现[13], 内源性p38MAPK的活性与乳癌细胞的侵袭能力相关, 用p38MAPK特异性抑制剂可明显减少u-PA/u-PAR基因和蛋白的表达, 抑制BT45细胞的侵袭能力; Ke等[14]报道了p38MAPK特异性抑制剂SB203580可抑制PMA诱导的UM-SCC-1细胞MMP-9的表达, 并能阻止其体外侵入作用; Yu等[15]进一步证明, p38MAPK信号转导通路通过调节u-PA的表达参与了内皮细胞的运动和侵袭; p38MAPK特异性抑制剂SB203580可降低u-PA启动子的活性及u-PA mRNA表达水平[16]; 转染突变型p38MAPK则导致胃癌SNU-638细胞u-PA启动子活性的降低; 最近国内研究提示AngⅡ可诱导自发性高血压大鼠血管外膜成纤维细胞迁移活性增强, 该过程涉及p38MAPK信号途径, p38MAPK特异性抑制剂SB202190几乎能够完全阻断AngⅡ诱导的血管外膜成纤维细胞的迁移.
近年来研究发现, p38MAPK信号转导通路参与胃癌、肺癌、淋巴瘤及乳腺癌等细胞u-PA的表达调控. 但目前尚未见关于EGF、p38MAPK和u-PA与食管腺癌SEG-1细胞侵袭转移关系的相关报道. 本实验我们采用SB203580抑制SEG-1细胞p38MAPK活性后, 再用EGF诱导SEG-1细胞u-PA的表达, 发现u-PA mRNA以及蛋白的表达均显著下降, 并呈剂量依赖性, 此结果证实在EGF引起SEG-1细胞u-PA表达增加的过程中, p38MAPK信号转导通路参与了u-PA的表达调控, 并且是在mRNA水平调控u-PA的表达. 有研究报道u-PA基因启动子区有AP-1、SP-1、ETS等转录因子结合位点, p38MAPK活化后可磷酸化增强多种转录因子(ATF-2、ETS及NF-KB等)活性, ATF-2可引起AP-1活化. 推测p38MAPK可能通过活化转录因子AP-1和ETS, 引起u-PA基因转录增强, u-PA产生增多[17]. 另有报道, u-PA mRNA的不稳定性是由3端非翻译区富含AU序列元件(ARE)介导的, SB203580以ARE依赖方式增强u-PA mRNA的不稳定性, p38MAPK通过调节u-PA mRNA的稳定性来调控其表达. 同时我们也发现u-PA mRNA以及蛋白的表达并未被SB203580完全抑制, 这提示EGF激活u-PA增强细胞的侵袭力一部分是通过p38MAPK信号传导通路实现的, 可能还有其他通路参与该过程.
总之, EGF可刺激食管腺癌SEG-1细胞p38MAPK磷酸化, 诱导SEG-1细胞表达u-PA, 应用p38MAPK特异抑制剂SB203580可明显下调u-PA的表达, 从而提示EGF诱导SEG-1细胞表达u-PA可能是通过p38MAPK信号转导通路实现的.
EGF通过激发p38MAPK等多条信号传导通路, 调控下游多种基因的表达, 在细胞的侵袭、转移中起重要作用; u-PA主要参与细胞外的蛋白溶解和基底膜的降解, 利于肿瘤的侵袭和转移, 两者在肿瘤的侵袭转移中发挥重要作用.
曹秀峰, 教授, 南京医科大学附属南京第一医院肿瘤中心
肿瘤细胞转移机制是目前肿瘤学研究的热点, u-PA是PA家族中重要成员, 在多种肿瘤细胞的转移机制中扮演重要的角色, 但是目前u-PA在食管腺癌细胞转移中的具体分子机制尚未明确.
研究表明EGF在食管腺癌组织中表达明显增高, 并与肿瘤的发展和预后密切相关; u-PA表达与肿瘤浸润深度、肿瘤侵袭转移等生物学行为密切相关, 能在一定程度上促进肿瘤的侵袭和转移.
本文研究了EGF对食管癌细胞侵袭p38MAPK、u-PA表达的影响, 探讨EGF促进食管癌侵袭的相关机制, 研究目的明确, 思路清晰, 方法设计合理, 结论可靠.
编辑: 张姗姗 电编:鲁亚静
| 1. | Van den Eynde M, Baurain JF, Mazzeo F, Machiels JP. Epidermal growth factor receptor targeted therapies for solid tumours. Acta Clin Belg. 2011;66:10-17. [PubMed] |
| 2. | Hatanpaa KJ, Burma S, Zhao D, Habib AA. Epidermal growth factor receptor in glioma: signal transduction, neuropathology, imaging, and radioresistance. Neoplasia. 2010;12:675-684. [PubMed] |
| 3. | Ronellenfitsch MW, Steinbach JP, Wick W. Epidermal growth factor receptor and mammalian target of rapamycin as therapeutic targets in malignant glioma: current clinical status and perspectives. Target Oncol. 2010;5:183-191. [PubMed] [DOI] |
| 4. | Zhang H, Liu XF, Li YJ, Zhou JP, Kong FM, Dong M. [Epidermal growth factor-mediated NF-kappaB activation promotes uPA expression and invasiveness in pancreatic cancer cells]. Zhonghua Zhongliu Zazhi. 2007;29:909-912. [PubMed] |
| 5. | Pappot H, Pedersen AN, Brünner N, Christensen IJ. The complex between urokinase (uPA) and its type-1 inhibitor (PAI-1) in pulmonary adenocarcinoma: relation to prognosis. Lung Cancer. 2006;51:193-200. [PubMed] [DOI] |
| 6. | Okamoto T, Valacchi G, Gohil K, Akaike T, van der Vliet A. S-nitrosothiols inhibit cytokine-mediated induction of matrix metalloproteinase-9 in airway epithelial cells. Am J Respir Cell Mol Biol. 2002;27:463-473. [PubMed] |
| 7. | Tan X, Egami H, Nozawa F, Abe M, Baba H. Analysis of the invasion-metastasis mechanism in pancreatic cancer: involvement of plasmin(ogen) cascade proteins in the invasion of pancreatic cancer cells. Int J Oncol. 2006;28:369-374. [PubMed] |
| 8. | Yoon JH, Gwak GY, Lee HS, Bronk SF, Werneburg NW, Gores GJ. Enhanced epidermal growth factor receptor activation in human cholangiocarcinoma cells. J Hepatol. 2004;41:808-814. [PubMed] [DOI] |
| 9. | Mimeault M, Pommery N, Hénichart JP. New advances on prostate carcinogenesis and therapies: involvement of EGF-EGFR transduction system. Growth Factors. 2003;21:1-14. [PubMed] [DOI] |
| 10. | Harper ME, Goddard L, Glynne-Jones E, Assender J, Dutkowski CM, Barrow D, Dewhurst OL, Wakeling AE, Nicholson RI. Multiple responses to EGF receptor activation and their abrogation by a specific EGF receptor tyrosine kinase inhibitor. Prostate. 2002;52:59-68. [PubMed] [DOI] |
| 11. | Schoppmeyer K, Frühauf N, Oldhafer K, Seeber S, Kasimir-Bauer S. Tumor cell dissemination in colon cancer does not predict extrahepatic recurrence in patients undergoing surgery for hepatic metastases. Oncol Rep. 2006;15:449-454. [PubMed] |
| 12. | Behren A, Binder K, Vucelic G, Herberhold S, Hirt B, Loewenheim H, Preyer S, Zenner HP, Simon C. The p38 SAPK pathway is required for Ha-ras induced in vitro invasion of NIH3T3 cells. Exp Cell Res. 2005;303:321-330. [PubMed] [DOI] |
| 13. | Jo M, Thomas KS, Takimoto S, Gaultier A, Hsieh EH, Lester RD, Gonias SL. Urokinase receptor primes cells to proliferate in response to epidermal growth factor. Oncogene. 2007;26:2585-2594. [PubMed] [DOI] |
| 14. | Ke Z, Lin H, Fan Z, Cai TQ, Kaplan RA, Ma C, Bower KA, Shi X, Luo J. MMP-2 mediates ethanol-induced invasion of mammary epithelial cells over-expressing ErbB2. Int J Cancer. 2006;119:8-16. [PubMed] [DOI] |
| 15. | Yu J, Bian D, Mahanivong C, Cheng RK, Zhou W, Huang S. p38 Mitogen-activated protein kinase regulation of endothelial cell migration depends on urokinase plasminogen activator expression. J Biol Chem. 2004;279:50446-50454. [PubMed] [DOI] |