修回日期: 2012-04-20
接受日期: 2012-04-25
在线出版日期: 2012-05-28
目的: 观察FAS、Ki-67在结肠腺瘤、异常隐窝病灶(aberrant crypt foci, ACF)中的表达, 探讨脂肪酸合成酶(fatty acid synthase, FAS)、增殖细胞核抗原(Ki-67)的异常表达在结直肠癌癌前病变形成中的意义.
方法: 对34例结肠镜确诊为腺瘤性息肉患者, 常规内镜检查结束时, 用0.2%的亚甲蓝溶液染色直肠黏膜, 然后使用放大结肠镜观察直肠寻找ACF. 对结肠腺瘤性息肉、ACF及正常黏膜活检标本进行免疫组织化学分析其FAS和Ki-67的表达.
结果: 34例结肠腺瘤性息肉患者, 其中31例直肠发现ACF, 共发现并活检ACF 166处(其中伴异型增生14处, 不伴异型增生152处). FAS、Ki-67在结肠腺瘤、ACF中呈异常高表达(P<0.01). 伴异型增生ACF中FAS、Ki-67表达较不伴异型增生ACF无明显上调.
结论: FAS、Ki-67在结直肠癌的癌前病变(腺瘤、ACF)呈异常高表达. 结直肠癌的癌前病变存在细胞能量代谢异常及异常增殖, 在ACF阶段就已经异常增殖明显, 抑制FAS有望成为结直肠癌预防、治疗的靶点.
引文著录: 张伟, 王芳军, 钱建忠, 徐洪明, 刘鹏飞, 徐娟. 转染重组质粒pBudCE4.1-CYP 3A4-GST A1的肝细胞系的建立及功能评价. 世界华人消化杂志 2012; 20(15): 1371-1375
Revised: April 20, 2012
Accepted: April 25, 2012
Published online: May 28, 2012
AIM: To detect the expression of fatty acid synthase (FAS) and Ki-67 in colonic adenoma and aberrant crypt foci to explore their significance in the formation of precancerous lesions.
METHODS: Aberrant crypt foci (ACF) in the rectum of 34 patients with adenoma were identified by magnification chromoendoscopy (MCE) after staining with 0.2% methylene blue solution. Specimens with ACF were biopsied to detect the expression of FAS and Ki-67 by immunohistochemistry.
RESULTS: A total of 166 ACF were found in 31 patients, of which 14 had atypical hyperplasia and 152 had no atypical hyperplasia. The expression of FAS and Ki-67 in colonic adenoma and ACF were significantly higher than that in normal tissue (all P < 0.01). There was no significant difference in the expression of FAS and Ki-67 between ACF with and without dysplasia.
CONCLUSION: The expression of FAS and Ki-67 is higher in colorectal precancerous lesions. FAS may be used as a target for preventing and treating colorectal cancer.
- Citation: Zhang W, Wang FJ, Qian JZ, Xu HM, Liu PF, Xu J. Overexpression of FAS and Ki-67 in aberrant crypt foci from patients with adenoma. Shijie Huaren Xiaohua Zazhi 2012; 20(15): 1371-1375
- URL: https://www.wjgnet.com/1009-3079/full/v20/i15/1371.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i15.1371
既往结直肠癌癌前病变主要包括结直肠腺瘤、腺瘤病和炎性肠病相关异型增生, 现在普遍认为结直肠异常隐窝病灶(aberrant crypt foci, ACF)是结直肠癌癌前病变. ACF是目前结直肠癌发生过程中可在光镜下观察到的最小最早期的结直肠黏膜病变[1], ACF在组织病理学、分子遗传学、生物化学及免疫组织化学方面与结直肠癌存在类似的改变[2-4], 在临床及抗肿瘤药物筛选等方面具有重要意义. 2000年WHO为便于临床医师操作, 根据是否伴有异型增生将ACF分为: 具有增生性息肉形态特征的ACF和伴有异型增生的ACF[5]. FAS与Ki-67是肿瘤相关基因, 与肿瘤异常增殖密切相关, 多项研究发现他们在结肠癌的发生、发展过程中起着重要的作用[6-8], 结直肠ACF中FAS、Ki-67表达的相关研究较少, 或为动物实验研究[9,10]. 本研究采用免疫组织化学的方法, 通过检测结肠腺瘤患者腺瘤、ACF中FAS、Ki-67表达, 了解结直肠癌癌前病变的分子生物学改变, 以探索结直肠癌早期预防、治疗的靶点.
2010-09/2011-03, 在本科室行肠镜检查患者, 对34例常规肠镜检查发现息肉并经病理证实为腺瘤性息肉患者, 常规内镜检查结束后, 先用清水大力充分冲洗直肠黏膜, 再用10%乙酰半胱氨酸溶液冲洗直肠黏膜以清除黏液, 然后用新鲜配制的0.2%亚甲蓝溶液通过喷洒导管染色直肠黏膜, 然后使用放大结肠镜观察直肠寻找ACF, 所用内窥镜型号为Olympus CF-H260AZI. 20例结肠镜检查正常者直肠黏膜为对照. 对结肠腺瘤性息肉、ACF及正常黏膜活检标本进行免疫组织化学分析其FAS和Ki-67的表达.
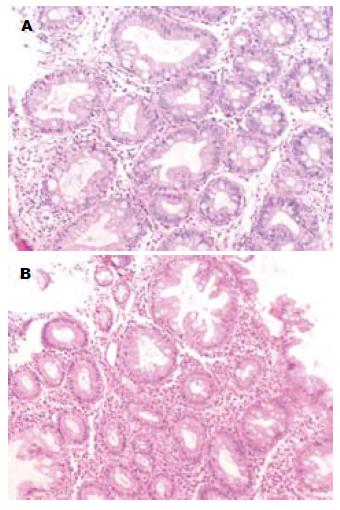
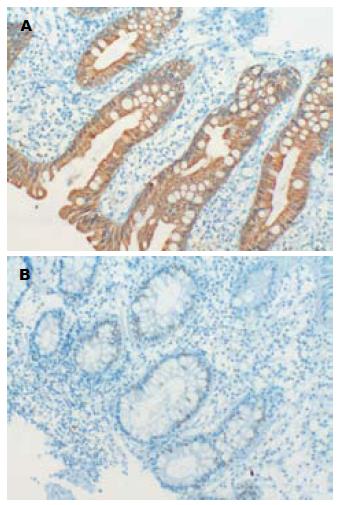
1.2.1 免疫组织化学染色: 标本采用石蜡组织切片脱蜡、水化等处理后, 分别用兔抗人FAS蛋白抗体、Ki-67蛋白抗体处理, 试剂盒均为北京博奥森生物技术有限公司产品, DAB-H2O2显微镜控制下显色, 苏木素复染细胞核, 常规脱水中性树胶封片, 观察目标蛋白的表达强度和分布. 省去一抗作空白对照.
1.2.2 免疫组织化学结果判断标准: FAS表达阳性细胞的标准是胞浆出现棕色染色, Ki-67阳性是细胞核内出现棕黄色颗粒. 随机计数每例切片10个高倍视野细胞中染色阳性的细胞百分率. (1)阴性为FAS或Ki-67无任何阳性细胞表达; (2)每张切片阳性细胞<25%为(+); (3)阳性细胞25%-50%为(++); (4)阳性细胞>50%为(+++). (+)-(+++)均视为阳性. 所有病理切片均经2位高年资病理医师独立诊断, 如意见不一致, 则交由第3位高年资病理医师诊断, 以多数人意见为准.
统计学处理 应用SPSS13.0统计学软件进行数据分析, 率的比较采用χ2检验, 相关分析采用Spearman等级相关, P<0.05为有统计学意义.
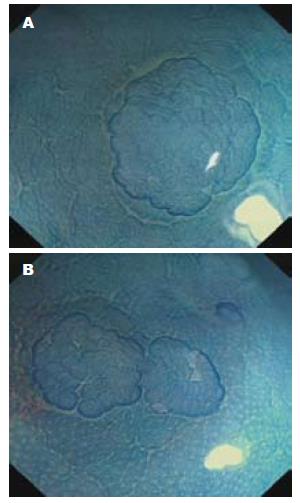
34例结肠腺瘤患者, 其中31例直肠发现ACF, 其中男21例, 平均年龄58岁±17岁, 女13例, 平均年龄65岁±10岁, 共发现ACF 166处, 伴异型增生ACF 14处, 不伴异型增生ACF 152处(图1,2).
与正常对照组相比, FAS、Ki-67在结肠腺瘤、ACF中均呈异常高表达(P<0.05, 表1), 且常常同一病例同时存在FAS、Ki-67阳性, FAS的表达与Ki-67呈正相关(P<0.05, r = 0.72). FAS、Ki-67在结肠腺瘤与ACF的表达未见统计学差异.
与正常对照组相比ACF的Ki-67、FAS呈高表达(表2, 图3). 伴异型增生ACF中Ki-67表达较不伴异型增生ACF比例增高, 但差异无统计学意义, 但不伴异型增生的ACF Ki-67染色阳性细胞多位于隐窝的下1/3至中1/3, 伴异型增生ACF Ki-67呈弥漫性表达. 而FAS在不同类型ACF中则表达类似, 从隐窝底部到隐窝的顶部显示一个由高到低的渐变的表达, 与ACF是否伴有异型增生无明显关系.
从正常结直肠上皮细胞到结直肠癌细胞的演变是多步骤、多基因改变的结果, 因此, 寻找结直肠癌的早期发现、早期治疗的靶点一直是研究的重点. ACF作为结直肠上皮性肿瘤的最早期形态学改变, 是目前结直肠癌发生过程中可在光镜下观察到的最小最早期的结直肠黏膜病变. 了解ACF的特征性变化及其与结直肠癌发生的关系, 对进一步认识和预防结直肠癌有重要意义. 现在普遍认为ACF是癌前病变, 并认为经ACF有两条途径发展为结直肠癌: (1)正常黏膜-ACF-腺瘤-癌途径; (2)正常上皮-ACF-癌变途径. 本研究重点观测正常黏膜-ACF-腺瘤-癌途径中, 由正常黏膜到ACF、腺瘤阶段的分子生物学改变.
依据文献报道的对手术标本的研究和内镜研究, ACF较常发现在左半结肠和直肠中[11,12]. 同时我们认为, 对大量患者进行结直肠大范围染色及放大结肠镜检查ACF, 在许多病例检查时间的延长会令人无法接受, 考虑到患者的耐受情况, 我们选择直肠的ACF为研究对象.
FAS是内源性脂肪酸合成的关键酶, 是哺乳动物唯一的能将较小的碳水化合物基质合成长链脂肪酸的酶. 其位于细胞浆内, 以小分子碳源为底物, 合成内源性的脂肪酸. 但是在大多数正常组织中由于细胞优先利用日常饮食中的循环脂肪酸而使FAS表现为低水平. 在正常情况下除肝、胎儿肺脏及分泌期乳腺以外, 在其他正常组织FAS, 呈低表达状态[13-15]. FAS表达上升是对内源性脂肪酸合成和细胞增殖的适应. FAS的主要产物软脂酸既是细胞膜结构的主要成分, 也是细胞能量代谢的重要底物. Kusakabe等[16]的研究表明, FAS较高表达基本上集中分布于脂质代谢, 对激素敏感, 处于增殖状态的细胞. 在多种人类癌症中FAS高度表达, 包括前列腺癌、结肠癌、子宫内膜癌、卵巢癌、胃癌、肺癌和乳房癌. 这些癌症中的许多FAS的高表达水平与临床肿瘤侵袭性的增加相关[17]. 恶性肿瘤中FAS过度表达提示细胞内酶转录加快, 内源性脂肪酸合成活跃表明对能量物质和成膜脂质的需求旺盛. 本研究检测20例正常结肠黏膜FAS呈低水平表达, 与Rashid等[10]的研究结果一致. ACF中FAS呈异常高表达, 提示ACF的发生伴随细胞能量代谢和细胞增殖异常, 结肠腺瘤中存在类似表现, 另外伴异型增生ACF较不伴异型增生的ACF中FAS表达无显著的差异, 提示FAS在结直肠癌发生前很早期就发挥了重要作用.
Ki-67是常用的反应细胞增殖水平的指标, 其阳性表达部位在胞核. 在正常组织向肿瘤组织的演变过程中其表达逐渐增加, 处于增殖状态的细胞比例显著升高, Ki-67阳性表达的细胞比例也随之升高. 本研究检测20例正常对照中Ki-67呈低水平表达, 与郭学良等[18]的研究结果一致; ACF中Ki-67呈弥漫性高表达, 表明ACF的增殖水平明显升高, 与张耀朋等[19]的动物实验结果一致. 结肠腺瘤中Ki-67呈弥漫性过表达, 阳性表达比例及强度与ACF相比有升高, 但未见统计学意义. Ki-67的表达与FAS存在正相关关系, 进一步提示在ACF、腺瘤等结肠癌癌前病变的发生中, FAS在细胞异常增殖中起重要作用, 抑制FAS活性, 抑制细胞异常增殖有望成为结肠癌预防、治疗的靶点.
FAS在过去的15年中已成为治疗肿瘤的一个有吸引力的目标. RNAi技术敲除实验表明, 乳腺癌、前列腺癌、卵巢癌等多种肿瘤细胞株的增殖和生存依赖FAS. FAS抑制剂如浅蓝菌素、C75和奥利司特已被证实可诱导多种肿瘤细胞凋亡, 并诱导多种异种移植肿瘤模型的肿瘤生长延迟. 但发现浅蓝菌素和C75会造成试验小鼠食物摄入量减少和体质量下降[20]. 奥利司特存在细胞通透性低、溶解度低、缺乏选择性[21]以及口服生物利用度和代谢稳定性差等问题[22], 这些阻碍了他们在临床的使用. 新近有默克、阿斯利康、葛兰素史克等公司关于新的FAS抑制剂研发的专利文献报道, 希望在不久的将来能充分发挥FAS作为癌症治疗靶点的潜力. 绿茶儿茶素、大豆蛋白等已被证明能够抑制FAS[23,24], 这或许将调整饮食来降低ACF的形成, 成为预防结肠癌可能的手段.
总之, FAS、Ki-67在ACF、结肠腺瘤异常高表达, ACF作为一种癌前病变, 存在细胞能量代谢异常及异常增殖, FAS在ACF等形成中起着重要作用, 抑制FAS活性, 抑制细胞异常增殖有望成为结直肠癌预防、治疗的靶点.
自从1986年Bird在动物模型中发现异常隐窝病(ACF)后, 他成为了研究热点之一, 人们对他的组织学、基因的改变, 染色体的变化, 细胞动力学, 信号转导途径, 化学诱导及抑制剂, 流行病学特点以及内镜下的形态等做了一系列的探讨.
陆伦根, 教授, 上海交通大学医学院附属仁济医院消化内科, 上海市消化疾病研究所
结直肠ACF是目前结直肠癌发生过程中可在光镜下观察到的最小最早期的结直肠黏膜病变, 现在普遍认为是结直肠癌癌前病变, 了解结直肠癌癌前病变的分子生物学改变, 以探索结直肠癌早期预防、治疗的靶点.
本实验将对结直肠癌前病变的关注由通常的腺瘤提早到通过放大色素结肠镜在人体活体观察到的ACF, 应用免疫组织化学探索结直肠癌前病变的分子生物学改变的规律.
明确ACF形成中的各种变化, 尤其是与结直肠癌变相关联的特征改变, 不仅有助于进一步认识结直肠癌发生的机制, 同时也为预防治疗结直肠癌提供新思路.
本文探讨了FAS, Ki-67的异常表达在结直肠癌癌前病变形成中的意义, 具有一定的科研价值.
编辑: 曹丽鸥 电编:鲁亚静
| 1. | Siu IM, Robinson DR, Schwartz S, Kung HJ, Pretlow TG, Petersen RB, Pretlow TP. The identification of monoclonality in human aberrant crypt foci. Cancer Res. 1999;59:63-66. [PubMed] |
| 2. | Paulsen JE, Løberg EM, Olstørn HB, Knutsen H, Steffensen IL, Alexander J. Flat dysplastic aberrant crypt foci are related to tumorigenesis in the colon of azoxymethane-treated rat. Cancer Res. 2005;65:121-129. [PubMed] |
| 3. | Seike K, Koda K, Oda K, Kosugi C, Shimizu K, Nishimura M, Shioiri M, Takano S, Ishikura H, Miyazaki M. Assessment of rectal aberrant crypt foci by standard chromoscopy and its predictive value for colonic advanced neoplasms. Am J Gastroenterol. 2006;101:1362-1369. [PubMed] [DOI] |
| 4. | Luo L, Shen GQ, Stiffler KA, Wang QK, Pretlow TG, Pretlow TP. Loss of heterozygosity in human aberrant crypt foci (ACF), a putative precursor of colon cancer. Carcinogenesis. 2006;27:1153-1159. [PubMed] [DOI] |
| 5. | Hamilton SR, Aaltonen LA eds. World Health Organization Classification of Tumours. Pathology and Genetics of Tumours of the Digestive System. Lyon: IARC Press 2000; . |
| 7. | Suzuki H, Matsumoto K, Terabe M. Ki-67 antibody labeling index in colorectal carcinoma. J Clin Gastroenterol. 1992;15:317-320. [PubMed] [DOI] |
| 8. | Kikuchi Y, Dinjens WN, Bosman FT. Proliferation and apoptosis in proliferative lesions of the colon and rectum. Virchows Arch. 1997;431:111-117. [PubMed] [DOI] |
| 9. | Lau DS, Archer MC. Fatty acid synthase is over-expressed in large aberrant crypt foci in rats treated with azoxymethane. Int J Cancer. 2009;124:2750-2753. [PubMed] [DOI] |
| 10. | Rashid A, Pizer ES, Moga M, Milgraum LZ, Zahurak M, Pasternack GR, Kuhajda FP, Hamilton SR. Elevated expression of fatty acid synthase and fatty acid synthetic activity in colorectal neoplasia. Am J Pathol. 1997;150:201-208. [PubMed] |
| 11. | Takayama T, Katsuki S, Takahashi Y, Ohi M, Nojiri S, Sakamaki S, Kato J, Kogawa K, Miyake H, Niitsu Y. Aberrant crypt foci of the colon as precursors of adenoma and cancer. N Engl J Med. 1998;339:1277-1284. [PubMed] [DOI] |
| 12. | Adler DG, Gostout CJ, Sorbi D, Burgart LJ, Wang L, Harmsen WS. Endoscopic identification and quantification of aberrant crypt foci in the human colon. Gastrointest Endosc. 2002;56:657-662. [PubMed] [DOI] |
| 13. | Kawamura T, Kanno R, Fujii H, Suzuki T. Expression of liver-type fatty-acid-binding protein, fatty acid synthase and vascular endothelial growth factor in human lung carcinoma. Pathobiology. 2005;72:233-240. [PubMed] [DOI] |
| 14. | Menendez JA, Lupu R. Oncogenic properties of the endogenous fatty acid metabolism: molecular pathology of fatty acid synthase in cancer cells. Curr Opin Clin Nutr Metab Care. 2006;9:346-357. [PubMed] [DOI] |
| 15. | Weiss L, Hoffmann GE, Schreiber R, Andres H, Fuchs E, Körber E, Kolb HJ. Fatty-acid biosynthesis in man, a pathway of minor importance. Purification, optimal assay conditions, and organ distribution of fatty-acid synthase. Biol Chem Hoppe Seyler. 1986;367:905-912. [PubMed] [DOI] |
| 16. | Kusakabe T, Maeda M, Hoshi N, Sugino T, Watanabe K, Fukuda T, Suzuki T. Fatty acid synthase is expressed mainly in adult hormone-sensitive cells or cells with high lipid metabolism and in proliferating fetal cells. J Histochem Cytochem. 2000;48:613-622. [PubMed] [DOI] |
| 17. | Kuhajda FP. Fatty-acid synthase and human cancer: new perspectives on its role in tumor biology. Nutrition. 2000;16:202-208. [PubMed] [DOI] |
| 20. | Loftus TM, Jaworsky DE, Frehywot GL, Townsend CA, Ronnett GV, Daniel Lane M, Kuhajda FP. Reduced food intake and bodyweight in mice treated with fatty acid synthase inhibitors. Science. 2000;288:2379-2381. [PubMed] [DOI] |
| 21. | Hoover HS, Blankman JL, Niessen S, Cravatt BF. Selectivity of inhibitors of endocannabinoid biosynthesis evaluated by activity-based protein profiling. Bioorg Med Chem Lett. 2008;18:5838-5841. [PubMed] [DOI] |
| 22. | Zhi J, Melia AT, Funk C, Viger-Chougnet A, Hopfgartner G, Lausecker B, Wang K, Fulton JS, Gabriel L, Mulligan TE. Metabolic profiles of minimally absorbed orlistat in obese/overweight volunteers. J Clin Pharmacol. 1996;36:1006-1011. [PubMed] [DOI] |
| 23. | Puig T, Relat J, Marrero PF, Haro D, Brunet J, Colomer R. Green tea catechin inhibits fatty acid synthase without stimulating carnitine palmitoyltransferase-1 or inducing weight loss in experimental animals. Anticancer Res. 2008;28:3671-3676. [PubMed] |
| 24. | Xiao R, Su Y, Simmen RC, Simmen FA. Dietary soy protein inhibits DNA damage and cell survival of colon epithelial cells through attenuated expression of fatty acid synthase. Am J Physiol Gastrointest Liver Physiol. 2008;294:G868-G876. [PubMed] [DOI] |