修回日期: 2012-03-23
接受日期: 2012-04-19
在线出版日期: 2012-05-28
目的: 研究肝脏病理形态学、肝功能、氧化应激因子的变化, 探讨氢盐水(hydrogen-rich saline, HS)对大鼠酒精性肝损伤的的保护作用.
方法: 将40只SD大鼠随机分为空白对照组、模型组、低剂量HS治疗组、高剂量HS治疗组; 采用梯度酒精灌胃方法建立大鼠慢性酒精性肝损伤模型, 模型组及治疗组给予酒精灌胃12 wk, 低剂量HS治疗组和高剂量HS治疗组同时分别给予HS 5 g/kg、10 g/kg体质量, 腹腔注射; 空白对照组给予等热量、等体积的糖水灌胃. 12 wk后检测大鼠血清谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、总胆红素(total bilirubin, TBIL)、甘油三酯(triglyceride, TG)、肝组织匀浆丙二醛(malonyldialdehyde, MDA)、还原型谷胱甘肽(reduced glulathione hormone, GSH)、超氧化物歧化酶(superoxide dismutase, SOD)的含量, 肝组织HE染色观察肝组织形态学变化.
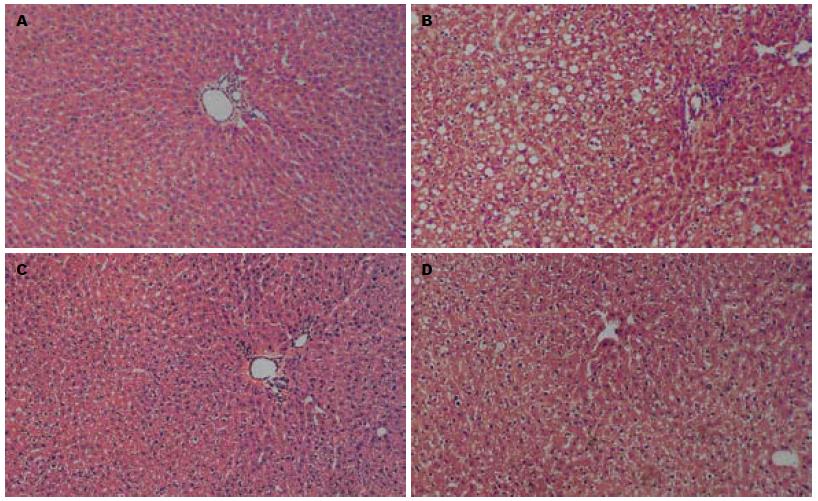
结果: 灌酒12 wk后模型组大鼠血清ALT、AST、TG、TBIL水平均明显上升(65.82±16.14 vs 36.43±4.92, 180.45±35.51 vs 110.53±18.43, 0.92±0.13 vs 0.35±0.07, 1.92±0.34 vs 0.74±0.12, P<0.01); 肝脏GSH含量、SOD活性下降(78.56±16.45 vs 135.43±19.81, 93.14±21.05 vs 181.53±30.13, P<0.01), 而MDA含量增加显著 (8.04±1.12 vs 3.25±0.83, P<0.01); HS低剂量组和高剂量组大鼠血清ALT、AST、TG、TBIL下降显著(43.26±8.81, 41.15±8.89 vs 65.82±16.14; 130.42±11.64, 125.81±10.84 vs 180.45±35.51; 0.44±0.09, 0.38±0.08 vs 0.92±0.13; 1.03±0.21, 0.89±0.15 vs 1.92±0.34; P<0.01); SOD、GSH活性明显增加(162.51±28.56, 164.24±30.07 vs 93.14±21.05; 105.42±17.32, 110.67±20.51 vs 78.56±16.45; P<0.01), MDA含量明显上升(4.56±0.98, 4.21±1.05 vs 8.04±1.12; P<0.01). HE染色结果显示, 模型组大鼠肝组织可见中重度肝细胞变性, 胞质内见大小不一的脂滴空泡, 窦内皮细胞肿胀, 汇管区炎细胞浸润; HS低、高剂量组肝组织脂肪变性、炎细胞浸润程度减轻.
结论: HS可有效地抗氧化应激和脂质过氧化, 改善肝功能, 减轻酒精诱导的大鼠慢性肝损伤.
引文著录: 齐慧慧, 宋佳, 陈岳祥. 氢盐水对大鼠酒精性肝损伤的保护作用. 世界华人消化杂志 2012; 20(15): 1328-1332
Revised: March 23, 2012
Accepted: April 19, 2012
Published online: May 28, 2012
AIM: To investigate whether hydrogen-rich saline has a protective effect on alcohol-induced liver injury in rats.
METHODS: Male Sprague-Dawley rats (n = 40) were divided randomly into four groups: control group, model group, low-dose (5 mL/kg, i.p.) and high-dose (10 mL/kg, i.p.) hydrogen-rich saline treatment groups. Rats received intragastric administration of ethanol or isocaloric/isovolumetric maltose-dextrin solution. After 12 wk, these rats were sacrificed to take serum samples for biochemical measurements and liver samples for HE staining.
RESULTS: At week 12, serum levels of ALT, AST, TG, TBIL (65.82 ± 16.14 vs 36.43 ± 4.92, 180.45 ± 35.51 vs 110.53 ± 18.43, 0.92 ± 0.13 vs 0.35 ± 0.07, 1.92 ± 0.34 vs 0.74 ± 0.12, all P < 0.01) and MDA content (8.04 ± 1.12 vs 3.25 ± 0.83, P < 0.01) significantly increased, and liver GSH content and SOD activity significantly decreased (78.56 ± 16.45 vs 135.43 ± 19.81, 93.14 ± 21.05 vs 181.53 ± 30.13, both P < 0.01) in the model group compared to the control group. In low and high-dose hydrogen-rich saline treatment groups, serum levels of ALT, AST, TG, TBIL decreased significantly (43.26 ± 8.81, 41.15 ± 8.89 vs 65.82 ± 16.14; 130.42 ± 11.64, 125.81 ± 10.84 vs 180.45 ± 35.51; 0.44 ± 0.09, 0.38 ± 0.08 vs 0.92 ± 0.13; 1.03 ± 0.21, 0.89 ± 0.15 vs 1.92 ± 0.34; all P < 0.01), and SOD and GSH activity (162.51 ± 28.56, 164.24 ± 30.07 vs 93.14 ± 21.05; 105.42 ± 17.32, 110.67 ± 20.51 vs 78.56±16.45; P < 0.01) and MDA content (4.56 ± 0.98, 4.21 ± 1.05 vs 8.04 ± 1.12; both P < 0.01) increased significantly compared to the model group. Moderate to severe liver cell degeneration, presence of large and small lipid droplets in the cytoplasm, swelling of the sinus endothelial cells, and portal area inflammatory cell infiltration were seen in the model group. In the two treatment groups, steatosis and inflammatory cell infiltration lessened.
CONCLUSION: Hydrogen-rich saline can resist oxidative stress and lipid peroxidation, improve liver function, and thereby reduce alcohol-induced chronic liver injury.
- Citation: Qi HH, Song J, Chen YX. Protective effect of hydrogen-rich saline on alcohol-induced liver injury in rats. Shijie Huaren Xiaohua Zazhi 2012; 20(15): 1328-1332
- URL: https://www.wjgnet.com/1009-3079/full/v20/i15/1328.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i15.1328
在西方国家, 酒精性肝病(alcoholic liver disease, ALD)及其并发症是导致死亡的重要病因之一[1]. 在欧美国家的嗜酒人群中, ALD的患病率高达84%, 其中20%-30%可进展为肝硬化[2]. 但关于ALD的发病机制尚不十分清楚, 目前认为氧化应激、脂质过氧化在ALD早期发挥重要作用. 研究表明氢分子可选择性清除羟自由基和亚硝酸阴离子, 有较强的抗氧化作用. 但氢盐水(hydrogen-rich saline, HS)对慢性酒精性肝损伤是否有保护作用尚不清楚. 本文旨在通过建立大鼠慢性酒精性肝损伤模型, 并给予HS干预, 探讨HS的保护作用及相关机制.
40只SPF级♂SD大鼠, 体质量220-250 g, 购自上海斯莱克实验动物有限公司. 实验动物饲养于中国人民解放军第二军医大学清洁级动物房, 12 h光照和黑夜循环, 标准饲料, 自由饮水, 温度22 ℃±2 ℃, 湿度50%-60%. HS由上海中国人民解放军第二军医大学潜水教研室制备; 大鼠SOD、MDA、GSH试剂盒购自南京建成公司; HE染色相关试剂购自美国Sigma公司.
1.2.1 分组及处置: 40只SD大鼠适应性喂养1 wk后, 随机分为空白对照组、模型组、低剂量HS治疗组、高剂量HS治疗组; 采用梯度酒精灌胃方法建立大鼠慢性酒精性肝损伤模型. 模型组和治疗组给予500 mL/L的乙醇8 mL/(kg•d) 2 wk, 10 mL/(kg•d) 2 wk, 12 mL/(kg•d) 8 wk, 低剂量HS治疗组和高剂量HS治疗组同时分别给予HS 5 g/kg、10 g/kg体质量, 腹腔注射; 空白对照组给予等热量、等体积的糖水灌胃, 普通饲料、自由饮水. 12 wk后, 禁食12 h, 称重后麻醉, 留取血液标本, 肝脏称重后部分液氮冻存, 部分4%多聚甲醛固定, 进行生化、病理形态学等测定.
1.2.2 生化指标检测: 取血后静置30 min, 离心3 000 r/min×10 min, 常规分离血清, 运用自动生化分析仪检测血清谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、总胆红素(total bilirubin, TBIL)、甘油三酯 (triglyceride, TG). 取一定量的肝组织, 加10倍重量预冷现配的生理盐水, 在电动匀浆机内匀浆, 制成10%肝匀浆, 所有操作均在冰浴中进行. 3 000 r/min离心10-15 min, 取上清液-20 ℃待检, 肝匀浆每次操作前新鲜配置. 严格按照按试剂盒说明用TBA法检测肝组织匀浆中肝脏丙二醛(malonyldialdehyde, MDA)、还原型谷胱甘肽(reduced glulathione hormone, GSH)的含量; 用黄嘌呤氧化酶法检测肝组织匀浆中超氧化物歧化酶(superoxide dismutase, SOD)含量.
1.2.3 肝组织病理形态学: 肝组织石蜡切片行常规HE染色, 光镜下观察组织切片的变化.
统计学处理 统计软件采用SPSS18.0统计软件包分析, 统计结果用mean±SD表示. 两组间比较先采用方差分析F检验进行方差齐性检验, 方差齐的采用非配对t检验, 不齐的采用非参方差分析. P<0.05有统计学意义.
空白组大鼠进食正常, 生长良好; 模型组大鼠造模后期进食较差; 但各组体质量变化无统计学差异.
与空白组相比, 模型组大鼠血清ALT、AST、TG、TBIL水平均明显上升(P<0.01); 与模型组相比, 低剂量HS治疗组、高剂量HS治疗组大鼠血清ALT、AST、TG、TBIL均下降(P<0.01), 而高剂量组下降幅度稍大, 两治疗组间无明显差异(表1).
模型组大鼠于灌酒12 wk后肝脏GSH含量、SOD活性下降, 与空白组比有显著统计学意义(P<0.01), 而MDA含量增加显著(P<0.01); HS低剂量组和高剂量组GSH含量、SOD活性均增加, MDA含量下降明显, 与模型组相比均具有统计学意义(P<0.01), 两治疗组间差异不明显(表2).
HE染色结果显示: 空白组大鼠肝组织形态结构均正常; 模型组大鼠肝组织可见中重度肝细胞变性, 胞质内见大小不一的脂滴空泡, 窦内皮细胞肿胀, 汇管区炎细胞浸润(图1). HS低、高剂量组脂肪变性、炎细胞浸润程度减轻.
ALD的发病机制目前尚不明确, 但氧化应激和脂质过氧化被认为与ALD的发生发展密切相关. 乙醇进入体内后主要经肝细胞中乙醇脱氢酶(alcohol dehydrogenase, ADH)、乙醛脱氢酶(aldehyde dehydrogenase, ALDH)最终代谢为乙酸. 乙醇在被氧化的过程中产生大量的活性氧(reactive oxygen species, ROS), 而ROS是造成氧化损伤的主要原因, 可导致细胞膜脂质过氧化、细胞器功能异常、炎症反应、核氧化, 从而加重肝损伤. 而肝脏是合成多种抗氧化酶的主要器官, 当肝细胞受损后, 抗氧化酶合成减少, 进一步加重机体的氧化应激. SOD可催化超氧阴离子歧化反应的酶类, 保护细胞、对抗氧自由基的侵害; 谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)以GSH为底物, 与SOD、过氧化氢酶(catalase, CAT)共同清除机体ROS, 从而减轻和阻止氧化损伤. 同时肝库普弗细胞合成酶产生的一氧化氮(NO)、肝脏铁质沉积可加重酒精诱导的肝损伤[3,4]. MDA是多不饱和脂肪酸发生脂质过氧化反应的最终产物. 本实验进一步证实酒精诱导的肝损伤SOD、GSH活性明显下降, MDA含量升高明显. 肝功能受损后表现为大鼠血清ALT、AST、TG、TBIL值较空白对照组明显上升.
实验证明动物呼吸2%的氢可有效清除自由基, 显著改善脑缺血再灌注损伤[3]. 随后有研究表明呼吸2%的氢可治疗动物心肌及肝脏缺血再灌注损伤、小肠移植引起的炎症损伤和新生儿脑缺血缺氧损伤[4,5]. 采用饮用饱和氢气水可治疗应激引起的神经损伤、2型糖尿病, 化疗药顺铂引起的肾损伤、帕金森病、小鼠基因缺陷慢性氧化应激损伤. HS是将氢气通过高压溶解于生理盐水中, 研究表明腹腔注射HS能明显提高大鼠腹部脏器肝、肾组织内的氢浓度, 腹腔注射HS对脑、肠缺血再灌注损伤动物模型、结扎胆管造成的肝损伤及Galn/LPS、CCl4、DEN肝损伤小鼠模型中和CCl4导致的肝纤维化都有很好的保护作用[4-20].
本研究发现HS治疗组大鼠血清ALT、AST、TG、TBIL显著下降; SOD、GSH活性明显增加, 脂质过氧化产物MDA含量明显上升. ALD早期损伤多为可逆的, 如能及时有针对性的治疗可防止疾病向肝硬化、肝癌等不可逆病变发展. 目前除戒酒和支持性治疗外, 尚无令人满意的治疗药物. 因此, 寻找治疗ALD的药物具有重要的临床意义. 目前临床上应用的药物包括: 皮质激素、秋水仙碱、胰岛素、胰高血糖素、丙基硫氧嘧啶、抗氧化剂、抗内毒素剂等, 但对疗效的报道不一. HS可有效清除多余自由基, 抗氧化作用显著, 并被证实在很多肝损伤方面有治疗作用. 本研究发现HS可明显改善肝功能, 拮抗氧化应激和脂质过氧化, 提高肝脏抗氧化能力, 从而有效保护肝脏. 下一步我们将深入研究HS对酒精性肝损伤对肝组织白介素-1β(interleukin 1β, IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)的影响.
酒精性肝病的发病日益引起了人们的重视. 但其发病机制尚不清楚. 实验研究表明抑制自由基的产生或清除过多的自由基可减轻肝损伤. 氢可有效清除自由基, 而氢盐水(HS)对酒精性肝损伤是否有保护作用尚未报道.
迟宝荣, 教授, 吉林大学第一医院消化内科
研究表明呼吸2%的氢可治疗动物心肌及肝脏缺血再灌注损伤、小肠移植引起的炎症损伤和新生儿脑缺血缺氧损伤.
研究证实注射HS对脑、肠缺血再灌注损伤动物模型、结扎胆管造成的急性肝损伤及Galn/LPS、CCl4、DEN急性肝损伤小鼠模型中和CCl4导致的肝纤维化都有很好的保护作用.
该文通过研究肝脏病理形态学、肝功能、氧化应激因子的变化, 探讨HS对大鼠酒精性肝损伤的保护作用.
本研究设计科学合理, 文章结构清晰, 结果、结论较明确. 文章的科学性、创新性和可读性能较好地反映我国该领域研究的先进水平.
编辑: 张姗姗 电编:闫晋利
| 1. | Tome S, Lucey MR. Review article: current management of alcoholic liver disease. Aliment Pharmacol Ther. 2004;19:707-714. [PubMed] [DOI] |
| 2. | Tilg H, Day CP. Management strategies in alcoholic liver disease. Nat Clin Pract Gastroenterol Hepatol. 2007;4:24-34. [PubMed] [DOI] |
| 3. | Day CP. Treatment of alcoholic liver disease. Liver Transpl. 2007;13:S69-S75. [PubMed] [DOI] |
| 4. | Dey A, Cederbaum AI. Alcohol and oxidative liver injury. Hepatology. 2006;43:S63-S74. [PubMed] [DOI] |
| 5. | Betteridge DJ. What is oxidative stress? Metabolism. 2000;49:3-8. [PubMed] [DOI] |
| 6. | Ohsawa I, Ishikawa M, Takahashi K, Watanabe M, Nishimaki K, Yamagata K, Katsura K, Katayama Y, Asoh S, Ohta S. Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals. Nat Med. 2007;13:688-694. [PubMed] [DOI] |
| 7. | Fukuda K, Asoh S, Ishikawa M, Yamamoto Y, Ohsawa I, Ohta S. Inhalation of hydrogen gas suppresses hepatic injury caused by ischemia/reperfusion through reducing oxidative stress. Biochem Biophys Res Commun. 2007;361:670-674. [PubMed] [DOI] |
| 8. | Hayashida K, Sano M, Ohsawa I, Shinmura K, Tamaki K, Kimura K, Endo J, Katayama T, Kawamura A, Kohsaka S. Inhalation of hydrogen gas reduces infarct size in the rat model of myocardial ischemia-reperfusion injury. Biochem Biophys Res Commun. 2008;373:30-35. [PubMed] [DOI] |
| 9. | Ohsawa I, Nishimaki K, Yamagata K, Ishikawa M, Ohta S. Consumption of hydrogen water prevents atherosclerosis in apolipoprotein E knockout mice. Biochem Biophys Res Commun. 2008;377:1195-1198. [PubMed] [DOI] |
| 10. | Kajiyama S, Hasegawa G, Asano M, Hosoda H, Fukui M, Nakamura N, Kitawaki J, Imai S, Nakano K, Ohta M. Supplementation of hydrogen-rich water improves lipid and glucose metabolism in patients with type 2 diabetes or impaired glucose tolerance. Nutr Res. 2008;28:137-143. [PubMed] [DOI] |
| 11. | Zheng X, Mao Y, Cai J, Li Y, Liu W, Sun P, Zhang JH, Sun X, Yuan H. Hydrogen-rich saline protects against intestinal ischemia/reperfusion injury in rats. Free Radic Res. 2009;43:478-484. [PubMed] [DOI] |
| 12. | Sato Y, Kajiyama S, Amano A, Kondo Y, Sasaki T, Handa S, Takahashi R, Fukui M, Hasegawa G, Nakamura N. Hydrogen-rich pure water prevents superoxide formation in brain slices of vitamin C-depleted SMP30/GNL knockout mice. Biochem Biophys Res Commun. 2008;375:346-350. [PubMed] [DOI] |
| 13. | Nagata K, Nakashima-Kamimura N, Mikami T, Ohsawa I, Ohta S. Consumption of molecular hydrogen prevents the stress-induced impairments in hippocampus-dependent learning tasks during chronic physical restraint in mice. Neuropsychopharmacology. 2009;34:501-508. [PubMed] [DOI] |
| 14. | Nakashima-Kamimura N, Mori T, Ohsawa I, Asoh S, Ohta S. Molecular hydrogen alleviates nephrotoxicity induced by an anti-cancer drug cisplatin without compromising anti-tumor activity in mice. Cancer Chemother Pharmacol. 2009;64:753-761. [PubMed] [DOI] |
| 15. | Fu Y, Ito M, Fujita Y, Ito M, Ichihara M, Masuda A, Suzuki Y, Maesawa S, Kajita Y, Hirayama M. Molecular hydrogen is protective against 6-hydroxydopamine-induced nigrostriatal degeneration in a rat model of Parkinson's disease. Neurosci Lett. 2009;453:81-85. [PubMed] [DOI] |
| 16. | Buchholz BM, Kaczorowski DJ, Sugimoto R, Yang R, Wang Y, Billiar TR, McCurry KR, Bauer AJ, Nakao A. Hydrogen inhalation ameliorates oxidative stress in transplantation induced intestinal graft injury. Am J Transplant. 2008;8:2015-2024. [PubMed] [DOI] |
| 17. | Cai J, Kang Z, Liu WW, Luo X, Qiang S, Zhang JH, Ohta S, Sun X, Xu W, Tao H. Hydrogen therapy reduces apoptosis in neonatal hypoxia-ischemia rat model. Neurosci Lett. 2008;441:167-172. [PubMed] [DOI] |
| 18. | Cai J, Kang Z, Liu K, Liu W, Li R, Zhang JH, Luo X, Sun X. Neuroprotective effects of hydrogen saline in neonatal hypoxia-ischemia rat model. Brain Res. 2009;1256:129-137. [PubMed] [DOI] |
| 19. | Mao YF, Zheng XF, Cai JM, You XM, Deng XM, Zhang JH, Jiang L, Sun XJ. Hydrogen-rich saline reduces lung injury induced by intestinal ischemia/reperfusion in rats. Biochem Biophys Res Commun. 2009;381:602-605. [PubMed] [DOI] |