修回日期: 2011-03-08
接受日期: 2011-03-16
在线出版日期: 2011-03-28
目的: 研究微生物产物对树突状细胞(dendritic cell, DC)和TIM4的作用, 探讨在微生物产物参与的食物过敏(food allergy, FA)中TIM4对CD4+ T淋巴细胞分化的影响.
方法: 培养Balb/c小鼠骨髓来源的树突状细胞(bone marrow-derived DC, BMDC), 培养的DC分为两组: 金黄色葡萄球菌肠毒素B(SEB)刺激组和空白对照组, RT-PCR检测不同组DC的TIM4 mRNA表达; 流式细胞仪检测DC表面CD11c、MHC-Ⅱ、CD86的表达. 在DC和CD4+ T淋巴细胞共同培养中将培养的DC分为5组: 空白对照组、SEB+卵清蛋白(OVA)组、SEB组、OVA组及TIM4组, 同时取过敏模型小鼠脾脏CD4+ T淋巴细胞, 不同组的DC与CD4+ T淋巴细胞共同培养, ELISA法测定混合培养细胞上清液IL-4与IFN-γ的表达.
结果: 与空白对照组相比, SEB组DC TIM4 mRNA表达明显增高(0.941±0.018 vs 0.422±0.083, P<0.05), 并具有剂量依从性. SEB组DC表面分子MHC-Ⅱ、CD86表达明显高于空白对照组(MHC-Ⅱ: 76.684%±3.1803% vs 52.984%±3.6026%; CD86: 89.746%±2.113% vs 67.558%±0.4341%, 均P = 0.000). DC和CD4+ T淋巴细胞共同培养中, 相比空白对照组, SEB+OVA组IL-4表达显著增高(295.834±20.408 vs 78.335±13.109, P<0.05), 而IFN-γ的表达明显减少(362.109±92.271 vs 761.897±102.967, P<0.05); 单独的SEB组或OVA组IL-4和IFN-γ与空白对照组无明显差异; TIM4组中IL-4的表达水平较SEB+OVA组明显降低, 而IFN-γ的表达明显增高(90.511±15.500 vs 295.834±20.408; 807.734±95.436 vs 362.109±92.271, 均P<0.05).
结论: 微生物产物和食物抗原共同作用导致FA, TIM4参与FA的发生. 消除TIM4的表达可明显抑制Th2细胞分化, 有效纠正Th1/Th2细胞失衡, 可阻止过敏性免疫反应.
引文著录: 杨慧敏, 郑鹏远, 刘志强, 李付广, 王新亭. TIM4对小鼠食物过敏模型中抗原特异性Th2细胞分化的影响. 世界华人消化杂志 2011; 19(9): 940-945
Revised: March 8, 2011
Accepted: March 16, 2011
Published online: March 28, 2011
AIM: To evaluate the modulatory effect of microbial products on the expression of T cell immunoglobulin and mucin domain 4 (TIM4) in dendritic cells (DCs) and to determine the role of TIM4 in modulating CD4+ T cell activation in allergic response induced by exposure to microbial products.
METHODS: Bone marrow-derived DCs were isolated from Balb/c mice and cultured in vitro. Cultured DCs were divided into control group and Staphylococcal enterotoxin B (SEB)-stimulated group. The expression of TIM4 mRNA in different groups of DCs was measured by reverse transcription-polymerase chain reaction (RT-PCR). The expression of CD11c, MHC-II and CD86 on DCs were measured by flow cytometry. DCs co-cultured with CD4+ T cells in vitro were divided into five groups: control group, SEB group, OVA group, SEB plus ovalbumin (OVA) group, and anti-TIM4 antibody plus SEB and OVA group. Different sets of DCs were co-cultured for 48 h with CD4+ T cells that were obtained from the spleen of allergic mice. Levels of interleukin-4 (IL-4) and interferon-γ (IFN-γ) in culture medium were evaluated by enzyme-linked immunosorbent assay (ELISA).
RESULTS: Compared with the control group, the expression of TIM4 mRNA in DCs was increased significantly in the SEB-stimulated group (0.941 ± 0.018 vs 0.422 ± 0.083, P < 0.05), and SEB up-regulated the expression of TIM-4 in a dose-dependent manner. SEB stimulation also significantly increased the expression of MHC-II and the costimulatory molecule CD86 on DCs compared with control cells (MHC-II: 76.684% ± 3.1803% vs 52.984% ± 3.6026%, P = 0.000; CD86: 89.746% ± 2.113% vs 67.558% ± 0.4341%, P = 0.000). Compared with control DCs co-cultured with CD4+ T cells, the level of IL-4 in culture medium increased significantly (295.834 ± 20.408 vs 78.335 ± 13.109, P < 0.05) and that of IFN-γ decreased significantly (362.109 ± 92.271 vs 761.897 ± 102.967, P < 0.05) in the SEB plus OVA group. The levels of IL-4 and IFN-γ in the SEB group and OVA group showed no significant differences with those in the control group. In contrast, the expression level of IL-4 was significantly lower and that of IFN-γ was significantly higher in the anti-TIM4 antibody group than in the SEB plus OVA group (P < 0.05). The levels of IL-4 and IFN-γ in the anti-TIM4 antibody group showed no significant differences with those in the control group, SEB group and OVA group (90.511 ± 15.500 vs 295.834 ± 20.408; 807.734 ± 95.436 vs 362.109 ± 92.271, both P < 0.05).
CONCLUSION: TIM4 is involved in the pathogenesis of food allergy induced by concurrent exposure to microbial products and food antigen. Inhibition of TIM4 expression can significantly inhibit Th2 cell polarization, effectively correct Th1/Th2 imbalance and thereby prevent the development of allergic reaction.
- Citation: Yang HM, Zheng PY, Liu ZQ, Li FG, Wang XT. TIM4 modulates antigen-specific Th2 cell differentiation in mice with food allergy. Shijie Huaren Xiaohua Zazhi 2011; 19(9): 940-945
- URL: https://www.wjgnet.com/1009-3079/full/v19/i9/940.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i9.940
随着新型抗生素和疫苗的发展及其在临床上的应用, 治疗感染性疾病已取得巨大成功, 但在过去的几十年中, 过敏性疾病却呈现出明显上升趋势[1], 大约15%-20%的人对外源抗原产生IgE介导的过敏反应[2]. 近年虽然过敏性疾病成为研究热点且已有较多的研究[3], 但是过敏性疾病的发病机制及病因学仍不清楚, 其治疗方法有限且效果不佳. 一般认为树突状细胞(dendritic cell, DC)和Th2细胞是过敏免疫反应中的关键细胞. DC是机体内功能最强的抗原提呈细胞(antigen presenting cell, APC), 也是唯一能激活初始T淋巴细胞的APC, DC捕获和加工外源性抗原, 并递呈抗原信息给T淋巴细胞[4], 激活T淋巴细胞介导的免疫反应[5,6]. 不成熟的DC刺激初始T淋巴细胞增殖、分化的能力弱, 成熟的DC高表达MHC-Ⅰ/Ⅱ类分子, 共刺激分子如CD80和CD86等协助抗原信息递呈过程, 有效活化T淋巴细胞[7]. 初始CD4+ T淋巴细胞被激活后分化为Th1、Th2或Treg细胞, Th1细胞释放1型细胞因子如IFN-γ、Th2细胞主要释放IL-4、IL-5和IL-13. 而IL-4和IL-13可诱导B淋巴细胞产生抗原特异性IgE, 产生一系列致敏反应[8,9], 再暴露于特异性抗原后, IgE激活肥大细胞释放致敏物质促发超敏反应和产生过敏临床症状. 最近发现的T淋巴细胞免疫球蛋白与黏蛋白域蛋白(T cell immunoglobulin and mucin domains, TIMs)基因家族是一组新的细胞表面蛋白家族. 已发现TIMs基因家族在小鼠中包括8个成员(TIMs 1-8)和在人类中3个成员(TIM1、3、4)[10-12]. 最近密切关注他们在过敏性疾病和自身免疫性疾病中重要的调节作用[13]. 其中TIM4表达于APC, 尤其是成熟的DC, TIM1表达于T淋巴细胞, 特别是Th2细胞, 近来发现他们是Th2细胞重要的调节因子[13,14]. 体外研究[15]显示DC中TIM4蛋白的表达与自身免疫性疾病的严重程度正相关, TIM4结合TIM1共同促进T淋巴细胞的扩增, 且提示TIM4可能作为一个新的分子机制来调节T淋巴细胞反应. 我们前期研究[16]显示, 在过敏小鼠中存在Treg细胞功能不全, TIM4与TIM1的相互作用可降低Treg细胞的功能及状态, 破坏免疫耐受平衡. 但是TIM4对食物抗原特异性Th2细胞分化的影响性研究甚少, 体外实验证据不多, 其机制仍需进一步研究. 我们推测微生物产物和食物抗原共同作用导致食物过敏(food allergy, FA), 其中TIM4与TIM1的相互作用可能导致Th1/Th2细胞失衡和免疫耐受的打破, 是引起FA的关键. 本研究是通过体外培养骨髓来源的DC(bone marrow-derived DC, BMDC), 与CD4+ T淋巴细胞共同培养来研究微生物产物和食物抗原对CD4+ T淋巴细胞的影响, 并应用TIM4抗体干预, 探讨TIM4在FA中的作用, 从而进一步了解食物过敏发生的分子机制, 并为临床治疗提供理论依据.
Balb/c小鼠购于河南省实验动物中心. 卵清蛋白(ovalbumin, OVA, Sigma公司). 黄色葡萄球菌肠毒素B(staphylococcus aureus enterotoxin B, SEB)(郑州大学生物工程系). RPMI 1640完全培养基由: RPMI 1640培养液(Gibco公司), HEPES 2×10-2 mol/L、L-谷氨酰胺 2×10-3 mol/L、青霉素100 kU/L、链霉素0.1 g/L和100 mL/L胎牛血清(Gibco公司)构成. 重组小鼠GM-CSF(rmGM-CSF)、重组小鼠IL-4(rm IL-4)(Peprotech公司产品). FITC-抗小鼠CD11c、PE-抗小鼠CD86、PE-抗小鼠MHC-Ⅱ(均购自美国BioLegend公司). CD4+ T Cell Isolation Kit(Miltenyi Biotec). TIM4抗体(美国RD公司). 小鼠IL-4、IFN-γ ELISA定量试剂盒(武汉博士德生物科技有限公司).
1.2.1 小鼠BMDC细胞的分离培养: 取Balb/c小鼠, 颈椎脱臼法处死, 浸入750 mL/L乙醇中3-5 min, 无菌取出股骨和胫骨, 用灭菌注射器抽取Hanks液, 将针头从两端插入骨髓腔, 反复冲洗出骨髓, 收入离心管中, 以1 800 r/min离心10 min, 弃上清, 加入37 ℃预温的红细胞裂解液, 室温2-3 min, 离心洗涤后, 用RPMI 1640完全培养液调整细胞浓度为2×108/L, 接种于6 孔培养板, 每孔4 mL, 加入细胞因子rmGM-CSF、rmIL-4各10 μg/L, 置于37 ℃、50 mL/L CO2培养箱中培养, 48 h后全量换液, 之后隔天半量换液.
1.2.2 小鼠过敏模型的制造: 按照文献[17]方法进行造模, 第0天、第3天、第9天使用10 μg SEB及20 μg OVA无菌生理盐水溶液0.2 mL腹腔注射进行基础致敏, 第7天、第14天使用10 μg SEB及20 μg OVA无菌生理盐水溶液0.2 mL对小鼠进行灌胃激发.
1.2.3 DC细胞和CD4+ T淋巴细胞的共培养: 培养第5天的DC分为5组: SEB组(加入SEB 200 μg/L)、OVA组(加入OVA 20 mg/L)、SEB+OVA组(加入SEB 200 μg/L和OVA 20 mg/L)、TIM4组(加入SEB+OVA+TIM4抗体 5 mg/L)、空白对照组(不加任何刺激物质), 培养48 h后, 收集悬浮及半贴壁细胞离心, RPMI 1640洗3次, 调整细胞浓度为2×108/L备用. 致敏Balb/c小鼠无菌开腹取脾脏, 清洗、剪碎、研磨, 红细胞裂解液去红细胞, 制成细胞悬液, 用小鼠CD4+ T淋巴细胞磁珠纯化试剂盒收集CD4+ T淋巴细胞, 调整细胞浓度至2×109/L备用, 取不同组DC和CD4+ T淋巴细胞各0.1 mL混合培养48 h, 收集上清液冻存待测.
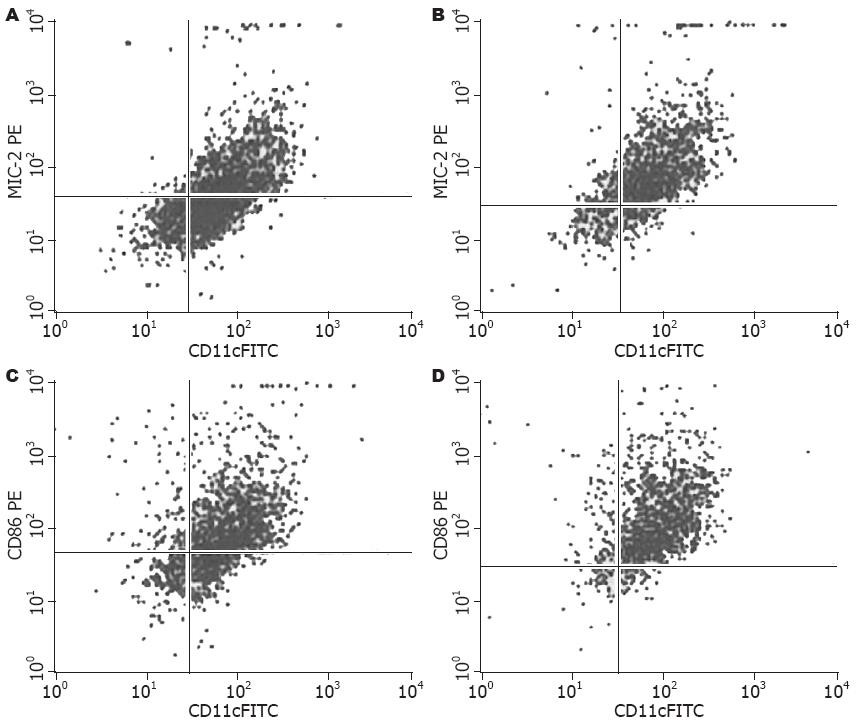
1.2.4 流式细胞仪测定DC表面分子: 培养的DC第5天加入SEB 200 μg/L, 收集第7天的DC, 分为两组: 空白对照组和SEB刺激组, 经PBS洗涤2次, 调整细胞浓度至1×109/L. 将FITC-抗鼠CD11c 0.2 μL、PE-抗鼠CD86 0.25 μL、PE-抗鼠MHC-Ⅱ 0.25 μL, 加入流式样管底部, 加入500 μL细胞悬液混匀, 避光静置30 min后, 1 mL PBS洗涤2次, 500 μL PBS重悬细胞上机检测.
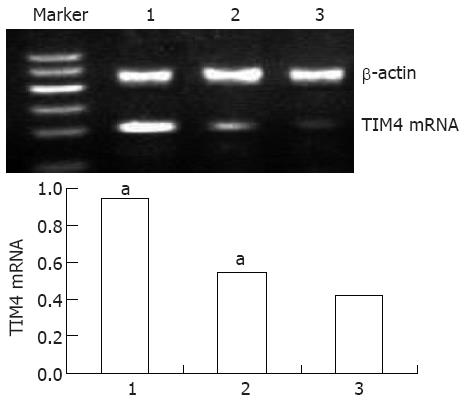
1.2.5 RT-PCR检测TIM4 mRNA表达: 收集第7天的DC, 分为3组: SEB刺激组(SEB 200 μg/L培养48 h)、小剂量SEB刺激组(SEB 50 μg/L培养48 h)及空白对照组. 按TRIzol法提取总RNA, 按试剂盒说明进行cDNA合成和PCR扩增, TIM4引物(上游: 5'-GGGAGGGATGATGAAGACG-3', 下游: 5'-TAAGGCACGAGGCAGGGA-3', 63 ℃, 扩增产物217 bp)、β-actin(上游: 5'-CCGTAAAGACCTCTATGCCAACA-3', 下游: 5'-GTCGCCTTCACCGTTCCA-3', 58 ℃, 扩增产物475 bp), PCR产物以1.5%琼脂糖凝胶电泳, 以DNA Marker标记确定条带大小. 凝胶扫描成像分析系统进行摄像后, 并对凝胶条带灰度信号强度半定量分析.
1.2.6 CD4+ T淋巴细胞分泌Th细胞因子的检测: 使用ELISA试剂盒按操作说明检测各组DC和CD4+ T淋巴细胞混合培养上清液中的IL-4、IFN-γ表达水平.
统计学处理 结果以mean±SD表示, 实验结果采用SPSS13.0统计软件包分析, 组间均数比较选用单因素方差分析, 采用α = 0.05为假设检验标准.
BMDC未受刺激时仅能微量表达TIM4 mRNA, 与空白对照组相比, SEB刺激组TIM4 mRNA表达显著增加(0.941±0.018 vs 0.422±0.083, P<0.05), 为进一步研究SEB对TIM4的刺激作用, 我们另设一组小剂量SEB(50 μg/L), 结果提示SEB刺激TIM4表达增加具有剂量依从性(图1).
培养的DC表面特异性分子CD11c在各检测组都达80%以上, SEB刺激组DC表面分子MHC-Ⅱ、CD86表达明显高于空白对照组(MHC-Ⅱ: 76.684%±3.1803% vs 52.984%±3.6026%, P = 0.000; CD86: 89.746%±2.113% vs 67.558%±0.4341%, P = 0.000, 图2).
SEB+OVA组的平均IL-4与空白对照组、SEB组和OVA组比较明显增加, 差异具有统计学意义(均P<0.05), 而SEB+OVA组的平均IFN-γ水平较空白对照组、SEB组和OVA组明显减少, 差异具有统计学意义(均P<0.05); SEB组或OVA组IL-4和IFN-γ与空白对照组均无明显差异; TIM4组中IL-4的表达水平较SEB+OVA组明显降低(P<0.05), 而IFN-γ的表达明显增高(P<0.05), 与空白对照组、SEB组和OVA组相比, IL-4和IFN-γ的表达无统计学差异(表1).
FA和相关疾病在世界上广泛存在, 但其发病机制仍不清楚. 一般认为Th2细胞的极化、DC的激活、调节性T淋巴细胞、微生物产物及食物蛋白等参与FA的发生发展[17,18]. 表达于免疫细胞的TIMs基因家族在调节Th1和Th2细胞介导的免疫应答中展现了重要的作用, 为我们提供一个崭新的研究视角. 最近研究[19]证实在变应性鼻炎患者(allergic rhinitis, AR)外周血中存在Th2细胞的极化和TIM1的表达增加, 体外培养Th2细胞出现TIM1表达快速的衰变, 而加入TIM4能稳定TIM1的表达, 说明DC来源的TIM4能结合TIM1维持TIM1在一个稳定的状态, 然后共同作用促进Th2细胞的极化. 另外有研究显示表达于APC的TIM4特异性识别表达于凋亡细胞的磷脂酰丝氨酸, 在清除凋亡细胞过程中发挥作用[20,21], 且发现肝脏中表达于巨噬细胞的TIM4过量表达, 抑制伴刀豆球蛋白A介导的肝炎[22]. 可见, TIM4的作用和产生机制比较复杂, 尚需大量的研究阐明.
越来越多的临床证据证实, 致病性微生物的感染及其毒素参与过敏性疾病的发生, 许多文献[23]提示, SEB与过敏性疾病的发病有关, 我们前期研究也发现, SEB在小鼠FA反应中发挥重要作用[24], 因而SEB被用作有代表性的微生物产物, 作为佐剂应用于FA动物模型中, 但是其参与FA的分子机制知之甚少. DC作为最强的APC, 在固有免疫尤其是适应性免疫反应中发挥关键作用, 因此暴露于微生物产物, 如SEB的DC自身会产生什么反应是我们的研究内容之一. 一般认为启动CD4+ T淋巴细胞免疫反应, 需要DC上MHC-Ⅱ和共刺激分子如CD80、CD86等, 作为不同信号通路协同促进免疫应答[25]. 本研究显示SEB刺激DC导致其表面MHC-Ⅱ和CD86表达增高, 促进DC的成熟.
有研究[26]报道, 应用霍乱毒素(cholera toxin, CT)刺激DC能导致TIM4表达增加, CT和花生萃取物(peanut extract, PE)刺激培养的DC, 过继转移到正常小鼠体内, 口服PE抗原激发后能引起肠道Th2细胞的极化和过敏反应. 本研究显示体外培养的BMDC微量表达TIM4, SEB刺激后, TIM4的表达显著增加, 且具有剂量依从性. 另外研究显示仅在SEB或OVA单独条件下DC和CD4+ T淋巴细胞共同培养均不能导致Th2细胞的极化, 而只有同时存在SEB和OVA条件下, 才导致OVA特异性Th2细胞的极化, 表现为与空白对照组相比, IL-4分泌显著增高. 而IFN-γ分泌减少, 应用TIM4抗体共同培养能阻止Th2细胞的极化, 说明TIM4在Th2 细胞极化反应中发挥重要作用. 当然微生物及微生物产物种类很多, 除了SEB的其他微生物产物是否也有这样的作用, 值得进一步探讨.
总之, 本实验中证实在SEB和OVA共存条件下, DC与CD4+ T淋巴细胞共同培养, 导致CD4+ T向Th2方向分化增殖, 单独的SEB或OVA不能导致Th2细胞分化, TIM4作为重要的分子参与这一过程, 应用相应抗体可抑制SEB和OVA对CD4+ T向Th2分化的作用. 表明在FA中, TIM4对Th2细胞的分化起着重要作用, TIM4表达增加能促进Th2型细胞因子的分泌, 进而在体内产生一系列的过敏反应和临床症状. 阻断TIM4信号传导, 可以有效纠正Th1/Th2细胞失衡, 阻止过敏性免疫反应, 改善相应过敏症状.
过敏性疾病尤其是食物过敏在世界上广泛存在, 最近几十年其发病率在全球范围内显著增高, 然而食物过敏的病因和发病机制尚不清楚.
刘占举, 教授, 同济大学附属第十人民医院胃肠内科
最近研究发现TIM4在Th2极化和过敏疾病中具有重要的作用, 成为研究热点.
Yang等研究表明在小鼠肠道TIM4与TIM1相互作用能促进Th2细胞分化, 在食物过敏中发挥重要作用, 应用相应抗体干预则能改善肠道症状. Rodriguez-Manzanet等体外研究显示, 外周DC中TIM4蛋白的表达与自身免疫性疾病的严重程度相关, TIM4结合TIM1导致TIM1磷酸化, 同时促进细胞分裂和诱导信号使细胞避免凋亡性死亡来导致T淋巴细胞的扩增, 提示TIM4能调节T淋巴细胞免疫反应.
本文通过体外培养系统研究微生物产物对DC及其表面跨膜蛋白TIM4的作用, 明确TIM4对CD4+ T淋巴细胞分化的作用, 探讨食物过敏发生的病因学和分子机制.
本研究结果显示, 微生物产物和食物抗原共同导致食物过敏(FA)的产生, 其中TIM4能促进Th2细胞分化, TIM4的激活对FA的发生至关重要. 应用TIM4抗体, 可以维持Th1/Th2细胞平衡. 提示我们阻断TIM4的免疫学作用, 可预防和阻止FA的发生, 为临床治疗提供理论依据.
本文设计合理, 数据可靠, 具有较高的理论价值和潜在的临床意义.
编辑: 曹丽鸥 电编:何基才
| 1. | Herz U, Petschow B. Perinatal events affecting the onset of allergic diseases. Curr Drug Targets Inflamm Allergy. 2005;4:523-529. [PubMed] [DOI] |
| 2. | Eder W, Ege MJ, von Mutius E. The asthma epidemic. N Engl J Med. 2006;355:2226-2235. [PubMed] [DOI] |
| 3. | Tournoy KG, Provoost S, Van Hove C, Joos G. The role of immune tolerance in asthma pathogenesis. Curr Allergy Asthma Rep. 2006;6:437-443. [PubMed] [DOI] |
| 4. | Meraner P, Horejsí V, Wolpl A, Fischer GF, Stingl G, Maurer D. Dendritic cells sensitize TCRs through self-MHC-mediated Src family kinase activation. J Immunol. 2007;178:2262-2271. [PubMed] |
| 5. | Gatti E, Pierre P. Understanding the cell biology of antigen presentation: the dendritic cell contribution. Curr Opin Cell Biol. 2003;15:468-473. [PubMed] [DOI] |
| 6. | Banchereau J, Steinman RM. Dendritic cells and the control of immunity. Nature. 1998;392:245-252. [PubMed] [DOI] |
| 7. | Inaba K, Inaba M. Antigen recognition and presentation by dendritic cells. Int J Hematol. 2005;81:181-187. [PubMed] [DOI] |
| 8. | Webb RA, Hoque T, Dimas S. Expulsion of the gastrointestinal cestode, Hymenolepis diminuta by tolerant rats: evidence for mediation by a Th2 type immune enhanced goblet cell hyperplasia, increased mucin production and secretion. Parasite Immunol. 2007;29:11-21. [PubMed] [DOI] |
| 9. | Verdú EF, Bercík P, Bergonzelli GE, Huang XX, Blennerhasset P, Rochat F, Fiaux M, Mansourian R, Corthésy-Theulaz I, Collins SM. Lactobacillus paracasei normalizes muscle hypercontractility in a murine model of postinfective gut dysfunction. Gastroenterology. 2004;127:826-837. [PubMed] [DOI] |
| 10. | Kuchroo VK, Umetsu DT, DeKruyff RH, Freeman GJ. The TIM gene family: emerging roles in immunity and disease. Nat Rev Immunol. 2003;3:454-462. [PubMed] [DOI] |
| 11. | McIntire JJ, Umetsu DT, DeKruyff RH. TIM-1, a novel allergy and asthma susceptibility gene. Springer Semin Immunopathol. 2004;25:335-348. [PubMed] [DOI] |
| 12. | Kuchroo VK, Meyers JH, Umetsu DT, DeKruyff RH. TIM family of genes in immunity and tolerance. Adv Immunol. 2006;91:227-249. [PubMed] [DOI] |
| 13. | Meyers JH, Chakravarti S, Schlesinger D, Illes Z, Waldner H, Umetsu SE, Kenny J, Zheng XX, Umetsu DT, DeKruyff RH. TIM-4 is the ligand for TIM-1, and the TIM-1-TIM-4 interaction regulates T cell proliferation. Nat Immunol. 2005;6:455-464. [PubMed] [DOI] |
| 14. | Umetsu SE, Lee WL, McIntire JJ, Downey L, Sanjanwala B, Akbari O, Berry GJ, Nagumo H, Freeman GJ, Umetsu DT. TIM-1 induces T cell activation and inhibits the development of peripheral tolerance. Nat Immunol. 2005;6:447-454. [PubMed] [DOI] |
| 15. | Rodriguez-Manzanet R, Meyers JH, Balasubramanian S, Slavik J, Kassam N, Dardalhon V, Greenfield EA, Anderson AC, Sobel RA, Hafler DA. TIM-4 expressed on APCs induces T cell expansion and survival. J Immunol. 2008;180:4706-4713. [PubMed] |
| 16. | 王 新亭, 郑 鹏远, 罗 予, 刘 志强, 张 利利. TIM1与TIM4对小鼠食物过敏模型中CD4+CD25+调节性T淋巴细胞功能的影响. 世界华人消化杂志. 2009;17:3507-3513. [DOI] |
| 17. | Yang PC, Xing Z, Berin CM, Soderholm JD, Feng BS, Wu L, Yeh C. TIM-4 expressed by mucosal dendritic cells plays a critical role in food antigen-specific Th2 differentiation and intestinal allergy. Gastroenterology. 2007;133:1522-1533. [PubMed] [DOI] |
| 18. | Mandron M, Ariès MF, Brehm RD, Tranter HS, Acharya KR, Charveron M, Davrinche C. Human dendritic cells conditioned with Staphylococcus aureus enterotoxin B promote TH2 cell polarization. J Allergy Clin Immunol. 2006;117:1141-1147. [PubMed] [DOI] |
| 19. | Zhao CQ, Li TL, He SH, Chen X, An YF, Wu WK, Zhou XH, Li P, Yang PC. Specific immunotherapy suppresses Th2 responses via modulating TIM1/TIM4 interaction on dendritic cells. Allergy. 2010;65:986-995. [PubMed] [DOI] |
| 20. | Miyanishi M, Tada K, Koike M, Uchiyama Y, Kitamura T, Nagata S. Identification of Tim4 as a phosphatidylserine receptor. Nature. 2007;450:435-439. [PubMed] [DOI] |
| 21. | Kobayashi N, Karisola P, Peña-Cruz V, Dorfman DM, Jinushi M, Umetsu SE, Butte MJ, Nagumo H, Chernova I, Zhu B. TIM-1 and TIM-4 glycoproteins bind phosphatidylserine and mediate uptake of apoptotic cells. Immunity. 2007;27:927-940. [PubMed] [DOI] |
| 22. | Xu L, Qi J, Zhao P, Liang X, Ju Y, Liu P, Liu B, Guo C, Zhang L, Ma C. T cell immunoglobulin- and mucin-domain-containing molecule-4 attenuates concanavalin A-induced hepatitis by regulating macrophage. J Leukoc Biol. 2010;88:329-336. [PubMed] [DOI] |
| 23. | Kedzierska A, Kaszuba-Zwoińska J, Słodowska-Hajduk Z, Kapińska-Mrowiecka M, Czubak M, Thor P, Wójcik K, Pryjma J. SEB-induced T cell apoptosis in atopic patients--correlation to clinical status and skin colonization by Staphylococcus aureus. Arch Immunol Ther Exp (Warsz). 2005;53:63-70. [PubMed] |
| 24. | Liu T, Wang BQ, Zheng PY, He SH, Yang PC. Rhinosinusitis derived Staphylococcal enterotoxin B plays a possible role in pathogenesis of food allergy. BMC Gastroenterol. 2006;6:24. [PubMed] [DOI] |
| 25. | Dai SY, Nakagawa R, Itoh A, Murakami H, Kashio Y, Abe H, Katoh S, Kontani K, Kihara M, Zhang SL. Galectin-9 induces maturation of human monocyte-derived dendritic cells. J Immunol. 2005;175:2974-2981. [PubMed] |
| 26. | Feng BS, Chen X, He SH, Zheng PY, Foster J, Xing Z, Bienenstock J, Yang PC. Disruption of T-cell immunoglobulin and mucin domain molecule (TIM)-1/TIM4 interaction as a therapeutic strategy in a dendritic cell-induced peanut allergy model. J Allergy Clin Immunol. 2008;122:55-61, 61.e1-e7. [PubMed] |