修回日期: 2011-02-18
接受日期: 2011-02-22
在线出版日期: 2011-03-18
目的: 探讨RNA干扰技术沉默p21基因对肝癌细胞SMMC-7721增殖及恶性表型变化的影响.
方法: 通过慢病毒载体将p21小干扰RNA片段稳定转染入SMMC-7721细胞, 通过RT-PCR、Western blot分别检测p21 mRNA和蛋白表达变化, 流式细胞仪检测7721-p21 RNAi组(感染p21 siRNA慢病毒载体组)、7721-NC组(感染阴性对照慢病毒载体组)、7721组(未转染组)细胞生长周期, MTT法检测转染后SMMC-7721细胞生长情况, 细胞克隆形成实验检测单细胞锚定依赖性成克隆能力.
结果: 慢病毒载体可有效介导p21小干扰RNA片段进入SMMC-7721细胞, 经RT-PCR及Western blot检测, p21小干扰RNA可以明显降低SMMC-7721细胞p21 mRNA和蛋白的表达. 流式细胞仪检测细胞周期发现, 各组G0/G1期比例分别为32.82%±3.27%、61.25%±0.76%、57.77%±4.08%, S期比例分别为42.56%±5.62%, 22.91%±1.53%, 25.13%±5.11%. 经统计学分析, 7721-p21 RNAi组G0/G1期比例较其余两组下降(P<0.05), S期比例较其余两组升高(P<0.05), 而7721-NC组与7721组相比差异无显著性. MTT法检测细胞生长速度发现, 与7721-NC和7721组细胞相比, 7721-p21 RNAi组细胞的生长速度较快, 每天的活细胞数目均多于另外两种细胞系(P<0.05). 细胞克隆形成实验发现7721-p21 RNAi组、7721-NC组及7721组克隆形成数分别为81.24±1.5、51.67±2.08、52.73±1.53个. 7721-p21 RNAi组克隆形成数明显多于7721-NC组、7721组(P<0.05), 7721-NC组克隆形成数与7721组无明显差异. 表明p21表达下降可加速SMMC-7721细胞从G1期进入S期, 细胞生长速度加快, 单细胞锚定依赖性成克隆能力增强.
结论: 本研究通过RNA干扰技术反向验证了p21具有抑制肝癌细胞生长及细胞周期进程的作用, 为下一步深入研究p21抑制细胞增殖的机制及在肝癌发生发展中所起的作用打下了基础.
引文著录: 谭晓虹, 徐恒, 韦长元, 曹骥, 崔凌飞, 刘斐. RNA干扰p21对肝癌细胞SMMC-7721增殖的影响. 世界华人消化杂志 2011; 19(8): 827-831
Revised: February 18, 2011
Accepted: February 22, 2011
Published online: March 18, 2011
AIM: To investigate the effect of RNA interference (RNAi)-mediated knockdown of p21 on cell proliferation in human hepatocellular carcinoma cell line SMMC-7721.
METHODS: p21 knockdown was achieved in SMMC-7721 cells by lentivirus-mediated tranfection of small interfering RNA (siRNA) targeting the p21 gene. The expression of p21 mRNA and protein was detected by RT-PCR and Western blot, respectively. Cell cycle of 7721-p21 RNAi group (those transfected with p21 siRNA), 7721-NC group (those transfected with empty vecter) and 7721 group (those non-transfected) was determined by flow cytometry (FCM). Cell proliferation was measured by MTT assay and colony formation assay.
RESULTS: The expression of p21 mRNA and protein was obviously reduced in cells transfected with siRNA targeting the p21 gene. The percentage of cells in G0/G1 phase was significantly lower in 7721-p21 RNAi group than in 7721-NC group and 7721 group (32.82% ± 3.27% vs 61.25% ± 0.76%, 57.77% ± 4.08%, both P < 0.05). The growth of cells in 7721-p21 RNAi group was faster than that in 7721-NC group and 7721 group. The number of cell colonies formed in 7721-p21 RNAi group was significantly higher than those in 7721-NC group and 7721 group (81.24 ± 1.5 vs 51.67 ± 2.08, 52.73 ± 1.53, both P < 0.05).
CONCLUSION: p21 can inhibit the proliferation of SMMC-7721 cells.
- Citation: Tan XH, Xu H, Wei CY, Cao J, Cui LF, Liu F. RNA interference-mediated knockdown of p21 promotes cell proliferation in human hepatocellular carcinoma cell line SMMC-7721. Shijie Huaren Xiaohua Zazhi 2011; 19(8): 827-831
- URL: https://www.wjgnet.com/1009-3079/full/v19/i8/827.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i8.827
肝细胞癌(hepatocellular carcinoma, HCC)是全世界最常见的恶性肿瘤之一, 发病率在恶性肿瘤中位居世界第5位, 死亡率位居第3位[1]. 我国是肝癌的高发地区之一, 每年新发HCC病例占全世界新发病例的42.5%, 高居各种肿瘤发病率的第2位, 在我国城市居民中肝癌的死亡率居所有癌症死亡率的第2位, 而在农村居民中肝癌的死亡率则居各种癌症之首[2]. 肝癌的发生和发展是一个多因素、多步骤、多基因作用的复杂过程, 研究表明, p21可能通过不同的途径参与了肝癌的发生和发展[3,4]. 本研究通过慢病毒载体将p21小干扰RNA片段(small interference RNA, siRNA)稳定转染入肝癌细胞株SMMC-7721, 探讨p21对肝癌细胞生长及恶性表型变化的影响.
人肝癌细胞株SMMC-7721购自中国科学院细胞库. 胎牛血清、RPMI 1640完全培养基为Hyclone公司产品. RNA提取液TRIzol、RIPA细胞裂解液购于Invitrogen公司. 逆转录试剂盒购于Fermentas公司, Taq酶购于TaKaRa公司. p21抗体购于Santa Cruz公司, 小鼠抗人GAPDH单克隆抗体为上海康成生物工程有限公司产品, 碱性磷酸酶标记的二抗购自中杉金桥生物技术有限公司. 凋亡试剂盒购于南京凯基生物科技发展有限公司. 四甲基偶氮唑蓝(MTT)购于Sigma公司. p21 siRNA和阴性对照片段由上海吉凯基因化学技术有限公司负责设计、合成.
1.2.1 细胞培养及稳定转染: SMMC-7721细胞常规培养于含100 mL/L胎牛血清的RPMI 1640完全培养基中, 在37 ℃、50 mL/L CO2培养箱中培养. 取生长活跃的细胞转种于96孔培养板培养24 h, 使细胞生长稳定并达到30%-50%的细胞贴壁融合时, 用完全培养基将慢病毒稀释至感染复数(multiplicity of infection, MOI)值为10, 每孔加入慢病毒及完全培养基混合液100 μL. 24 h后去除慢病毒及完全培养基混合液, 继续用完全培养基培养至48-72 h后, 倒置显微镜下观察可见细胞出现绿色荧光, 证明感染成功. 胰酶消化吹打每孔细胞制备细胞悬液, 按梯度稀释每孔细胞, 直至孔中含一个有绿色荧光的细胞扩大培养后得到稳定细胞系. 实验设置7721-p21 RNAi组(感染p21 siRNA慢病毒载体组)、7721-NC组(感染阴性对照慢病毒载体组)、7721组(未转染组).
1.2.2 RT-PCR检测p21 mRNA表达水平: 胰酶消化收集各组细胞, 用TRIzol提取各组细胞总RNA, 紫外分光光度计测定总RNA浓度. 按照逆转录试剂盒说明书操作合成cDNA后进行PCR反应. 检测p21的上游引物序列为5'-ATTAGCAGCGGAACAAGGAGTCAGACAT-3', 下游引物序列为5'-CTGTGAAAGACACAGAACAGTACAGGGT-3', 扩增片段长度为318 bp; 内参GADPH基因的上游引物序列为5'-AACGGATTTGGTCGTATTG-3', 下游引物序列为5'-CTGGAAGATGGTGATGGG-3', 扩增片段长度为210 bp. 扩增条件: 94℃预变性5 min; 94℃变性30 s, 57 ℃退火1 min, 72 ℃延伸30 s 35个循环; 72 ℃再延伸10 min. PCR产物行1.5%琼脂糖凝胶电泳, Bio-Rad凝胶图像分析系统采集图像.
1.2.3 Western blot检测p21蛋白表达水平: RIPA细胞裂解液抽提各组细胞总蛋白, BCA法定量. 作SDS-PAGE电泳, 分离胶浓度为10%, 电压120 V, 电泳90 min. 用电转仪将产物转移到PVDF膜上, 分别加入p21抗体(1:2 000)及单克隆抗体GADPH(1:5 000), 室温孵育2 h, PBS充分洗膜后加入碱性磷酸酶标记的二抗(1:2 000), 室温孵育1 h, PBS洗膜后加入发光底物Super ECL Plus, 在暗房内曝光显影固定.
1.2.4 FCM检测细胞生长周期及凋亡: 细胞转染后48 h, 胰酶消化收集各组细胞, PBS洗涤并1 000 r/min, 离心5 min共3次, 收集细胞沉淀, 加入750 mL/L冰乙醇固定过夜, 流式细胞仪检测细胞生长周期.
1.2.5 MTT法检测细胞增殖活性: 将细胞以1×104/孔密度接种于96孔培养板, 每组12孔, 于37 ℃、50 mL/L CO2培养箱培养. 到达观测时段时, 分别加入新鲜含100 mL/L血清培养基100 μL/孔、5 g/L的MTT 10 μL/孔. 37 ℃、50 mL/L CO2培养箱中继续培养4 h后, 小心吸弃培养基, 加入DMSO 150 μL, 用酶标仪在490 nm波长下检测每孔的吸光度(A)值, 记录结果, 绘制生长曲线.
统计学处理 用SPSS13.0软件进行统计学分析, 各组率的比较采用χ2检验, 均数比较采用t检验, P<0.05为差异具有显著性.
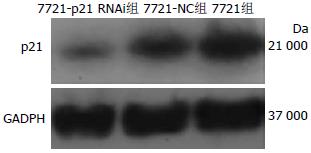
本实验中RT-PCR检测转染后各组细胞p21 mRNA水平情况显示, 7721-p21 RNAi组p21 mRNA表达水平明显低于7721-NC组及7721组, 而各组内参GADPH表达水平一致.
经Western blot检测, 在各组内参GADPH蛋白表达水平一致的同时, 7721-p21 RNAi组p21蛋白表达水平较7721-NC组及7721组明显减弱(图1).
细胞生长曲线可以反映细胞生长速率, 在不同细胞系中观察和比较生长曲线的变化, 可以直观的反映某基因表达水平改变后对细胞生长的影响. 绘制7721-p21 RNAi组、7721-NC组、7721组细胞在含10%血清培养基中的生长曲线发现, 与7721-NC和7721细胞相比7721-p21 RNAi细胞的生长速度较快, 每天的活细胞数目均多于另外两种细胞系(P<0.05), 表明p21表达下降可以使细胞生长速度加快.
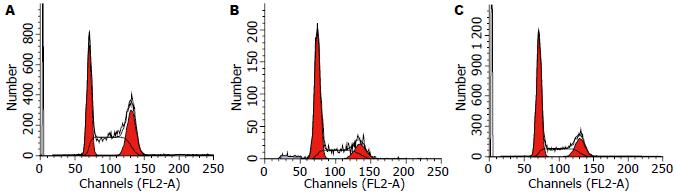
流式细胞仪检测7721-p21 RNAi组、7721-NC组及7721组细胞周期发现(图2), 各组G0/G1期比例分别为32.82%±3.27%、61.25%±0.76%、57.77%±4.08%, S期比例分别为42.56%±5.62%、22.91%±1.53%、25.13%±5.11%. 经统计学分析, 7721-p21 RNAi组G0/G1期比例较其余两组下降(P<0.05), S期比例较其余两组升高(P<0.05), 而7721-NC组与7721组相比差异无显著性, 说明p21表达下降后可加速SMMC-7721细胞从G1期进入S期.
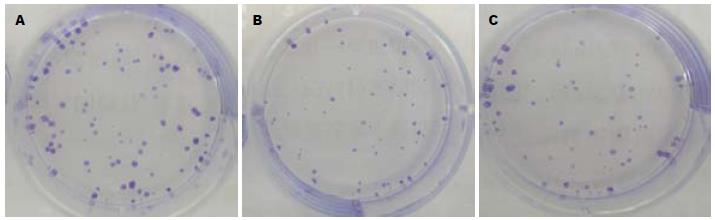
7721-p21 RNAi组、7721-NC组及7721组克隆形成数(个)分别为81.24±1.5、51.67±2.08、52.73±1.53. 7721-p21 RNAi组克隆形成数明显多于7721-NC组、7721组(P<0.05), 7721-NC组克隆形成数与7721组无明显差异(图3).
在肝癌组织中, p21表达各家报道很不一致. Kobayashi等[5]、李锡锋等[6]研究显示肝癌组织中p21表达较癌旁组织明显降低, 而Wagayama等[7]、林源等[8]研究则显示肝癌组织中p21表达较癌旁组织明显升高. 为什么在肝癌组织中p21的表达情况如此矛盾, 目前并没有很好的解释, 而p21在肝癌发生发展中所起的作用目前依然还是没有完全明了, 因此有必要深入系统的研究p21对肝癌细胞生长的影响.
RNAi技术作为一种新的反向遗传学手段, 被广泛地应用于基因功能分析、信号转导通路研究和基因治疗. 慢病毒载体是一种复制缺陷型逆转录病毒载体, 能够转染非分裂期细胞和分裂期细胞, 慢病毒载体RNAi作用持久, 同时扩大了载体感染细胞的范围. 2004年Gerolami等[9]首次将慢病毒载体应用于HCC的基因治疗研究中, 结果发现慢病毒对HCC细胞具有较高的转导效率.
细胞周期依赖性蛋白激酶抑制因子p21属于细胞周期抑制因子中的Cip/Kip家族, 是最早被发现的细胞周期抑制因子, 在DNA复制修复和损失修复, 细胞分化、衰老、凋亡及肿瘤形成等过程中均有重要作用[10]. 通过改变p21基因的表达可以起到调节肿瘤细胞生长的作用, 如张学彦等[11,12]将p21基因分别转染入食管鳞癌细胞系EC109及胰腺癌细胞系BxPC-3发现, p21表达增高可以抑制食管鳞癌细胞及胰腺癌细胞的生长. Qin等[13]将p21基因转染入肝癌Hep3B细胞中发现, p21表达增高可以抑制Hep3B细胞的生长, 表现为细胞生长速率下降, 克隆形成数减少, G0/G1期细胞比例升高, S期比例降低, 导致G1/S期阻滞.
本研究通过慢病毒载体将p21 siRNA片段稳定转染入肝癌细胞株SMMC-7721, 通过RT-PCR及Western blot检测, 发现SMMC-7721细胞p21 mRNA及蛋白表达水平明显降低. 随着p21表达水平降低, G0/G1期细胞减少, 进入S期的细胞增多, 细胞生长速率加快, 细胞克隆形成增多. 这种生长改变, 目前的研究认为与p21具有抑制细胞周期进程和DNA合成的作用是分不开的.
p21具有N端结构域可以与cyclin E-CDK2复合物结合, 抑制该复合物磷酸化活性使Rb去磷酸化不能释放E2F, 从而使DNA合成受到抑制, 细胞不能进入S期, 进而抑制细胞周期进程[14]. 其C端结构域可以与细胞增殖核抗原(proliferating cell nuclear antigen, PCNA)直接结合, 在G1/S转换过程中抑制DNA聚合酶δ与PCNA结合, 从而抑制细胞周期中DNA的合成过程[15,16]. 因此, p21表达下调后有可能通过改变p21与cyclin E-CDK2复合物及PCNA的结合能力, 解除p21对细胞周期的G1/S期阻滞作用, 从而使SMMC-7721细胞生长能力及恶性度增高, 但具体机制尚待进一步研究.
本研究通过慢病毒载体介导的RNAi技术反向验证了p21具有抑制肝癌细胞生长及细胞周期进程的作用, 为下一步深入研究p21抑制细胞增殖的机制及在肝癌发生发展中所起的作用打下了基础.
细胞周期依赖性蛋白激酶抑制因子p21属于细胞周期抑制因子(CKIs)中的Cip/Kip家族, 是最早被发现的细胞周期抑制因子. p21作为目前已知的具有最广泛激酶活性的细胞周期依赖性蛋白激酶抑制因子, 在细胞周期调控中无疑具有重要地位. 研究表明, p21可能通过不同的途径参与了肝癌的发生和发展.
田字彬, 教授, 青岛大学医学院附属医院消化内科
Qin等将p21基因转染入肝癌Hep3B细胞中发现, p21表达增高可以抑制Hep3B细胞的生长, 表现为细胞生长速率下降, 克隆形成数减少导致G1/S期阻滞.
本研究通过慢病毒载体介导的RNA干扰技术下调肝癌细胞SMMC-7721 p21表达, 反向验证了p21具有抑制肝癌细胞生长及细胞周期进程的作用.
本文为研究p21抑制细胞增殖的机制提供了理论基础, 有一定潜在的应用价值.
编辑: 曹丽鸥 电编:何基才
| 1. | Farazi PA, DePinho RA. Hepatocellular carcinoma pathogenesis: from genes to environment. Nat Rev Cancer. 2006;6:674-687. [PubMed] [DOI] |
| 2. | Yang L, Parkin DM, Li L, Chen Y. Time trends in cancer mortality in China: 1987-1999. Int J Cancer. 2003;106:771-783. [PubMed] [DOI] |
| 3. | Ozturk M, Arslan-Ergul A, Bagislar S, Senturk S, Yuzugullu H. Senescence and immortality in hepatocellular carcinoma. Cancer Lett. 2009;286:103-113. [PubMed] [DOI] |
| 4. | Pang R, Tse E, Poon RT. Molecular pathways in hepatocellular carcinoma. Cancer Lett. 2006;240:157-169. [PubMed] [DOI] |
| 5. | Kobayashi S, Matsushita K, Saigo K, Urashima T, Asano T, Hayashi H, Ochiai T. P21WAF1/CIP1 messenger RNA expression in hepatitis B, C virus-infected human hepatocellular carcinoma tissues. Cancer. 2001;91:2096-2103. [PubMed] [DOI] |
| 7. | Wagayama H, Shiraki K, Sugimoto K, Ito T, Fujikawa K, Yamanaka T, Takase K, Nakano T. High expression of p21WAF1/CIP1 is correlated with human hepatocellular carcinoma in patients with hepatitis C virus-associated chronic liver diseases. Hum Pathol. 2002;33:429-434. [PubMed] [DOI] |
| 9. | Gerolami R, Uch R, Faivre J, Garcia S, Hardwigsen J, Cardoso J, Mathieu S, Bagnis C, Brechot C, Mannoni P. Herpes simplex virus thymidine kinase-mediated suicide gene therapy for hepatocellular carcinoma using HIV-1-derived lentiviral vectors. J Hepatol. 2004;40:291-297. [PubMed] [DOI] |
| 10. | Coqueret O. New roles for p21 and p27 cell-cycle inhibitors: a function for each cell compartment? Trends Cell Biol. 2003;13:65-70. [PubMed] [DOI] |
| 12. | 张 学彦, 姜 仪增, 刘 志强, 景 德怀, 关 景明, 刘 伟. P21 WAF1基因对人胰腺癌细胞系BxPC-3增殖的抑制作用. 世界华人消化杂志. 2009;17:1614-1620. [DOI] |
| 13. | Qin LF, Ng IO. Exogenous expression of p21 (WAF1/CIP1) exerts cell growth inhibition and enhances sensitivity to cisplatin in hepatoma cells. Cancer Lett. 2001;172:7-15. [PubMed] [DOI] |
| 14. | Gartel AL. p21(WAF1/CIP1) and cancer: a shifting paradigm? Biofactors. 2009;35:161-164. [PubMed] [DOI] |
| 15. | Cazzalini O, Perucca P, Riva F, Stivala LA, Bianchi L, Vannini V, Ducommun B, Prosperi E. p21CDKN1A does not interfere with loading of PCNA at DNA replication sites, but inhibits subsequent binding of DNA polymerase delta at the G1/S phase transition. Cell Cycle. 2003;2:596-603. [PubMed] |