修回日期: 2011-01-05
接受日期: 2011-01-11
在线出版日期: 2011-02-18
目的: 研究2型糖尿病中国地鼠脂肪肝相关胰岛素抵抗的形成机制.
方法: 采用高脂饮食及结合小剂量链脲菌素(STZ)的方法建立肥胖胰岛素抵抗地鼠和2型糖尿病中国地鼠模型. 应用基因表达芯片技术检测模型地鼠肝脏中基因表达谱的变化, 并应用实时定量PCR进行验证.
结果: 基因芯片结果显示在胰岛素抵抗地鼠和糖尿病地鼠脂肪变的肝脏中, 代谢相关差异表达的基因主要与肝脏糖脂代谢及相关信号通路和转录因子/核因子相关. PCR证实肝脏固醇调节元件结合蛋白(SREBPs)和过氧化物酶体增殖体激活受体(PPAR)γ表达升高(均P<0.05), 肝X受体(LXR)α, PPARα和PPARβ/δ表达降低(均P<0.05), 而LXRβ的表达无改变. 肝脏LXRα, SREBPs和PPARs及其靶基因的表达在两模型地鼠间存在显著差异(均P<0.05).
结论: 表达改变的LXRα, SREBPs和PPARs参与2型糖尿病地鼠脂肪肝相关胰岛素抵抗形成.
引文著录: 李国生, 刘栩晗, 黄澜, 朱华, 刘亚莉, 马春梅. 2型糖尿病中国地鼠脂肪肝相关胰岛素抵抗的形成机制. 世界华人消化杂志 2011; 19(5): 457-466
Revised: January 5, 2011
Accepted: January 11, 2011
Published online: February 18, 2011
AIM: To investigate the mechanisms underlying the development of hepatic steatosis-related insulin resistance in Chinese hamsters with type 2 diabetes.
METHODS: Insulin-resistant obese Chinese hamsters and Chinese hamsters with type 2 diabetes were generated by feeding a high-fat diet with or without low-dose streptozotocin. Then we investigated the alterations in hepatic gene expression profiles by microarray analysis followed by real-time RT-PCR confirmation.
RESULTS: Microarray analysis indicated that, in insulin-resistant obese Chinese hamsters and those with type 2 diabetes, differentially expressed metabolism-related genes were mainly associated with hepatic glycolipid metabolism and related signaling pathways. Real-time RT-PCR analysis verified that the expression of hepatic sterol regulatory element-binding proteins (SREBPs) and peroxisome proliferator-activated receptors (PPAR) γ was increased (all P < 0.05), the expression of liver X receptor α (LXRα), PPARα, and PPARβ/δ was decreased (all P < 0.05), and the expression of LXR β was unchanged in the liver of hamster models. The expression of hepatic LXR α, SREBPs, PPARs and their target genes in insulin-resistant hamsters significantly differed from that in type 2 diabetic hamsters (all P < 0.05).
CONCLUSION: Altered expression of LXR α, SREBPs and PPARs may be involved in the development of hepatic steatosis-related insulin resistance in type 2 diabetic Chinese hamsters.
- Citation: Li GS, Liu XH, Huang L, Zhu H, Liu YL, Ma CM. Mechanisms underlying the development of hepatic steatosis-related insulin resistance in Chinese hamsters with type 2 diabetes. Shijie Huaren Xiaohua Zazhi 2011; 19(5): 457-466
- URL: https://www.wjgnet.com/1009-3079/full/v19/i5/457.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i5.457
在2型糖尿病的发生发展过程中胰岛素抵抗发挥重要作用. 然而, 其形成机制尚未阐明. 由高脂和高胆固醇饮食诱导的肥胖是2型糖尿病胰岛素抵抗常见而重要的环境因素之一[1,2]. 糖尿病脂毒性理论提出高脂和高胆固醇饮食性肥胖发生2型糖尿病的潜在机制是在胰岛素敏感组织内由异常糖脂代谢形成的异位脂沉积并造成功能异常, 即诱发脂诱性胰岛素抵抗[3,4]. 肝脏作为胰岛素敏感组织, 在调控糖、脂和能量代谢维持正常的血糖脂浓度方面发挥独特的作用. 因而, 肝脏胰岛素抵抗将有助于高血糖、异常脂血症、肝脂肪变和系统性胰岛素抵抗的发生[5,6]. 因此, 肝脏胰岛素抵抗, 尤其是脂诱性肝脏胰岛素抵抗的形成机制是了解肥胖相关2型糖尿病病因的前提. 中国地鼠具有糖尿病的遗传易感性并且在脂代谢方面与人类有很多相似的特征[7]. 因此, 我们选择中国地鼠建立肥胖胰岛素抵抗和2型糖尿病模型来模拟患者病理生理特征和发病过程. 基因表达芯片技术是一种解码疾病相关复杂基因表达谱改变的有力工具. 在本研究中, 我们将应用基因芯片技术来确定胰岛素抵抗和2型糖尿病地鼠脂肪肝相关胰岛素抵抗的基因表达改变和探究相应的分子机制.
中国地鼠, 雌雄各半, 40只, 清洁级, 血糖4.65 mmol/L±0.68 mmol/L, 周龄26 wk, 体质量125 g±11.2 g, 购自四川省医学科学院实验动物研究所, 单笼饲养, 自由摄食摄水, 造模和观察. 高脂饲料购自军事医学科学院实验动物中心, 高能量高脂饲料的配方为: 1%胆固醇, 0.02%牛胆酸钠, 10%猪油, 10%蛋黄粉及78.98%基础饲料. 诱导剂STZ购自Sigma公司. 应用稳豪血糖仪监测血糖. 鼠胰岛素ELISA试剂盒(Linco公司)购自吉泰公司. 血三酰甘油(triglycerides, TG)试剂盒、血游离脂肪酸(free fatty acids, FFAs)试剂盒、血低密度脂蛋白(low density lipoprotein, LDL)试剂盒、血高密度脂蛋白(high density lipoprotein, HDL)试剂盒、血总胆固醇(total cholesterol, TC)试剂盒(Randox公司)均购自北京九强生物技术有限公司. NucLeospin® Extract Ⅱ和Nucleospin® RNA Clean-up购自德国Macherey-Nagel公司, Reverse Transcription System, T7 RiboMAXTM Express Large Scale RNA Production System, dNTP Mix和dNTP购自Promega公司, Cy3-dCTP和Cy5-dCTP购自Amersham公司. RNA提取试剂盒(Qiagen公司)和逆转录试剂盒(Qiagen公司)购自基因有限公司. HotStarTaqTMDNA聚合酶(TaKaRa公司)购自百灵克公司, Mg2+及缓冲液为Taq酶自带. RNase inhibitor, Oligo-dT(Promega公司)和实时荧光定量PCR反应试剂盒(Bio-rad公司)购自东胜创新公司. 其余常用试剂购自北京鼎国生物技术公司.
1.2.1 造模及分组: 参照相关的造模方法[8-10]建立肥胖胰岛素抵抗和2型糖尿病地鼠模型并加以改进. 现简述如下: 健康中国地鼠40只, 雌雄各半, 随机分为普食正常对照组和高脂饮食组, 前者10只, 饲以普通饲料; 后者30只, 饲以高脂饮食. 饲养4 wk后, 高脂饮食喂养的地鼠自发形成肥胖性胰岛素抵抗, 将这些肥胖性胰岛素抵抗地鼠随机分成2组, 一组(20只)禁食12 h后, 按40 mg/kg的剂量间隔2 d 2次腹腔注射STZ(将STZ用0.1 mmol/L, pH4.2的无菌柠檬酸缓冲液配制成1% STZ溶液, 0.2 mm微孔过滤灭菌), 注射后继续禁食12 h建立2型糖尿病模型. 另一组(10只)及普食正常对照组(10只)注射等量的0.1 mmol/L, pH4.2的无菌柠檬酸缓冲液(注射方式和剂量同前). 处理后, 各组地鼠继续维持原饮食2 wk. 2型糖尿病和胰岛素抵抗地鼠模型依据空腹血糖(糖尿病地鼠≥9 mmol/L)和口服葡萄糖耐量试验(oral glucose tolerance test, OGTT)确定. 造模结束时共得到2型糖尿病地鼠15只. 造模结束后, 地鼠分为3组: 正常对照组、胰岛素抵抗组和2型糖尿病组, 每组10只. 实验结束时, 各组地鼠禁食12 h, 乙醚麻醉, 眼内眦静脉取血并处死, 剖开腹腔, 迅速取出肝脏, 称质量, 大部分肝脏液氮速冻并保存于-80 ℃备用, 少部分肝脏固定于40 g/L中性甲醛溶液. 4 ℃ 3 000 g 20 min离心分离血浆并保存于-80℃备用.
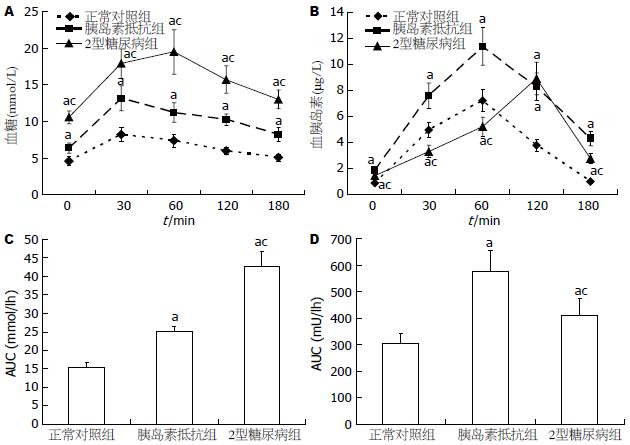
1.2.2 OGTT和糖耐量试验曲线下面积: 地鼠禁食12 h后, 给予葡萄糖2 g/kg灌胃, 乙醚麻醉后, 在设定的时间点(0, 30, 60, 120和180 min)眼内眦静脉取血测血糖. 糖耐量曲线下面积 = 1/2空腹测定值+60 min 测定值+120 min测定值+1/2 180 min测定值.
1.2.3 血生化检测: 血浆FFAs, TC, LDL, HDL和TG的浓度采用Randox公司试剂盒, 应用日立8060全自动生化分析仪进行检测. 应用稳豪血糖仪检测血糖. 应用Linco公司鼠胰岛素ELISA试剂盒检测血浆胰岛素浓度.
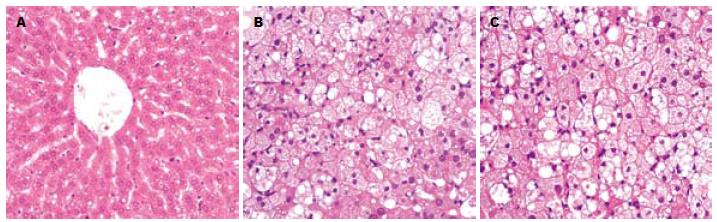
1.2.4 组织形态学观察: 肝组织固定于10%中性甲醛溶液, 逐级脱水, 石蜡包埋, 切片, HE染色, 光镜观察.
1.2.5 基因表达芯片检测: 应用Qiagen公司RNeasy试剂盒提取肝脏总RNA. 纯化后, 用分光光度计定量, 甲醛变性凝胶电泳质检. 5 μg总RNA用cDNA Synthesis Kit逆转录成cDNA, 经过纯化, 用T7 RiboMAX Express Large Scale RNA Production System将双链cDNA进行体外转录合成cRNA, 然后, 取2 μg cRNA逆转录成cDNA, 2 μg cDNA用40 μmol/L Cy5-dCTP或Cy3-dCTP标记. 36k Mouse Genome(Mouse Genome Version 4.0 of Operon Co.) 代表大约25 000个基因, 被点样列阵于75×25的玻片上. 依据生产者提供的小鼠和地鼠基因组序列的高度保守性和交叉反应的高度可能性, 我们使用小鼠的基因芯片杂交地鼠的cDNA. 0.9 μg标记的cDNA溶于30 μL杂交液(3×SSC, 0.2% SDS, 5×Denhart's和25%甲酰胺)中, 加样于基因芯片的玻片上于42 ℃杂交过夜, 杂交结束后, 先在42 ℃含0.2% SDS和2×SSC的溶液中洗5 min, 而后在0.2×SSC溶液中室温洗5 min. 玻片甩干后即可用于扫描. 每组随机选取3只地鼠用于基因芯片分析. 基因芯片用LuxScan 10KA双通道激光扫描仪(CapitalBio公司)进行扫描. 采用GenePix Pro 4.0图像分析软件(Axon Instruments公司)对芯片图像进行分析, 把图像信号转化为数字信号, 然后对芯片数据用Lowess方法进行归一化, 计算Ratio值, 最后以差异为1.5倍的标准来确定差异表达基因并对差异表达的基因进行GO(gene ontology)分析.
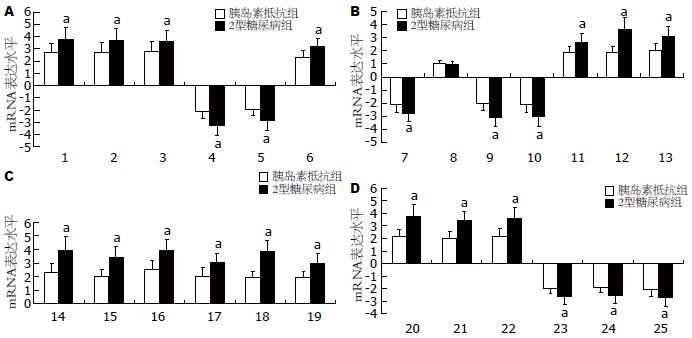
1.2.6 实时定量PCR检测: 使用Qiagen公司的RNeasy Mini Kit提取总RNA. 分光光度计测定A260/A280光吸收值, 计算总RNA浓度, 并用1%琼脂糖凝胶电泳鉴定完整性. 取1 μg总RNA应用cDNA合成试剂盒合成cDNA. 每个基因的特异引物对序列应用软件设计或来自已发表的文献. 在实时定量PCR扩增之前对引物进行普通PCR扩增以得到最适反应条件. 50 ng总RNA的逆转录产物使用iQ Syber Green Supermix和 iCycler iQ Real-Time PCR Detection System按iQ SYBR Green Mix Kit说明书扩增. 反应条件是: 95 ℃ 3 min, 95 ℃ 10 s 59 ℃ 45 s 45个循环. 扩增之后, 做溶解曲线, 反应从59 ℃开始, 每个循环10 s上升0.5 ℃共80个循环. 每个反应均重复3次. 设立阴性对照. 扩增之前测定每对引物的扩增效率, 经检测所用引物的扩增效率均接近于1. 样本目标基因相对含量的计算使用 2-ΔΔCT方法[11]. β-actin作为内参基因. 引物序列见表1.
| 引物名称 | 序列号 | 引物序列 |
| SREBP-1a | NM_011480 | 5'-ATGGACGAGCTGGCCTTCGGTGAGGCGGC-3' |
| 5'-CAGGAAGGCTTCCAGAGAGGA-3' | ||
| SREBP-1c | NM_011480 | 5'-GCTGTTGGCATCCTGCTATC-3' |
| 5'-TAGCTGGAAGTGACGGTGGT-3' | ||
| SREBP-2 | U12330 | 5'-AGCTGGCAAATCAGAAAAACAAG-3' |
| 5'-GATTAAAGTCTTCAATCTTCAAGTCCAC-3' | ||
| LXRα | AJ132601 | 5'-TCAGCATCTTCTCTGCAGACCGG-3' |
| 5'-TCATTAGCATCCGTGGGAACA-3' | ||
| LXRβ | NM_009473 | 5'-AAGCAGGTGCCAGGGTTCT-3' |
| 5'-TGCATTCTGTCTCGTGGTTGT-3' | ||
| PPARα | NM_011144 | 5'-TGAGGAAGCCGTTCTGTGAC-3' |
| 5'-GGTGTCATCTGGATGGTTGC-3' | ||
| PPARβ/δ | NM_011145 | 5'-GCCTCGGGCTTCCACTAC-3' |
| 5'-AGATCCGATCGCACTTCTCA-3' | ||
| PPARγ | NM_011146 | 5'-CCCCTGCTCCAGGAGATCTAC-3' |
| 5'-GCAATCAATAGAAGGAACACGTTGT-3' | ||
| HMG-CoA reductase | X00494 | 5'-AGATACTGGAGAGTGCCGAGAAA-3' |
| 5'-TTTGTAGGCTGGGATGTGCTT-3' | ||
| HMG-CoA synthase | L00326 | 5'-CCTGGGTCACTTCCTTTGAATG-3' |
| 5'-GATCTCAAGGGCAACGATTCC-3' | ||
| LDLR | NM_010700 | 5'-CCAACCTGAAGAATGTGGTG-3' |
| 5'-CAGGTCCTCACTGATGATGG-3' | ||
| FAS | NM007988 | 5'-CACAGATGATGACAGGAGATGG-3' |
| 5'-TCGGAGTGAGGCTGGGTTGAT-3' | ||
| SCD-1 | NM009127 | 5'-TGGGTTGGCTGCTTGTG-3' |
| 5'-GCGTGGGCAGGATGAAG-3' | ||
| ACC | AF356089 | 5'-ACACTGGCTGGCTGGACAG-3' |
| 5'-CACACAACTCCCAACATGGTG-3' | ||
| PEPCK | NM_011044 | 5'-GAGTTCCTGCCTCTCTCCAC-3' |
| 5'-TTCCACGAACTTCCTCACTG-3' | ||
| G-6-pase | U00445 | 5'-CATCAATCTCCTCTGGGTGGC-3' |
| 5'-TGTTGCTGTAGTAGTCGGTGTCC-3' | ||
| PGC-1α | BC066868 | 5'-TCTGGAACTGCAGGCCTAACTC-3' |
| 5'-GCAAGAGGGCTTCAGCTTTG-3' | ||
| CYP7A1 | NM_007824 | 5'-AGCAACTAAACAACCTGCCAGTACTA-3' |
| 5'-GTCCGGATATTCAAGGATGCA-3' | ||
| Gck | NM_010292 | 5'-AGAGCAGATCCTGGCAGAGT-3' |
| 5'-TGGTTCCTCCCAGGTCTAAG-3' | ||
| Acox | NM_053115 | 5'-CCAGGACAGAGGTTCTTGGT-3' |
| 5'-TCTCAGGAAGGACTTGGCTT-3' | ||
| Cpt1 | NM_013495 | 5'-CTCAGTGGGAGCGACTCTTCA-3' |
| 5'-GGCCTCTGTGGTACACGACAA-3' | ||
| Acadm | NM_007382 | 5'-TGACGGAGCAGCCAATGA-3' |
| 5'-ATGGCCGCCACATCAGA-3' | ||
| LPL | NM_008509 | 5'-GCCCAGCAACATTATCCAGT-3' |
| 5'-GGTCAGACTTCCTGCTACGC-3' | ||
| FAT / CD36 | NM_007643 | 5'-GCCAAGCTATTGCGACATGA-3' |
| 5'-GATAGACCTGCAAATGTCAGAGGAA-3' | ||
| aP2 | NM_024406 | 5'-AACACCGAGATTTCCTT-3' |
| 5'-ACACATTCCACCACCAG-3' | ||
| β-actin | AY618569 | 5'-AGAGGGAAATCGTGCGTGAC-3' |
| 5'-CAATAGTGATGACCTGGCCGT-3' |
统计学处理 数据以mean±SD表示. 统计学差异使用SPSS13.0进行t检验和单因素方差分析检验. P≤0.05为差异有统计学意义.
胰岛素抵抗地鼠和2型糖尿病地鼠的表型和代谢特征见表2. 实验结束时, 与正常对照组相比, 胰岛素抵抗地鼠和2型糖尿病地鼠的体质量显著增加(P<0.05), 表现肥胖, 但两者的体质量无显著性差异(P>0.05). 胰岛素抵抗地鼠和2型糖尿病地鼠的肝脏重量明显增加(P<0.05), 肝质量/体质量的比值显著高于对照组(P<0.05), 肝脏呈肿大状态. 与正常对照组相比, 除了HDL水平降低以外, 胰岛素抵抗地鼠和2型糖尿病地鼠的血脂(包括FFAs, TC, LDL和TG)水平显著升高(P<0.05). 胰岛素抵抗地鼠的血糖虽然有所升高, 但尚未达到糖尿病的血糖标准, 而是处于正常与糖尿病间的过渡状态. 与正常地鼠和胰岛素抵抗地鼠相比, 2型糖尿病地鼠的血糖显著升高(P<0.05). 与正常对照组相比, 胰岛素抵抗地鼠表现明显的高胰岛素血症, 而2型糖尿病地鼠表现相对的高胰岛素血症. 与对照组地鼠相比, 胰岛素抵抗地鼠和2型糖尿病地鼠OGTT各指定点的血糖值增高(P<0.05), 血浆胰岛素的水平异常, OGTT的糖曲线下面积增大(P<0.05), 胰岛素曲线下面积增大(P<0.05, 图1). 胰岛素抵抗地鼠和2型糖尿病地鼠的胰岛素敏感指数降低(P<0.05), 而胰岛素抵抗指数升高(P<0.05). 2型糖尿病地鼠的胰岛素抵抗程度显著高于胰岛素抵抗地鼠(P<0.05, 表2).
| 正常对照组 | 胰岛素抵抗组 | 2型糖尿病组 | |
| 体质量(g) | 123.6±9.9 | 144.3±8.7a | 143.4±8.3a |
| 肝质量(g) | 3.57±0.66 | 5.55±0.95a | 6.10±0.62a |
| 肝质量/体质量(%) | 2.7±0.3 | 3.7±0.4a | 4.1±0.1ac |
| 血糖(mmol/L) | 4.33±0.61 | 6.56±0.90a | 11.00±1.22ac |
| 血胰岛素(μg/L) | 0.91±0.14 | 1.95±0.28a | 1.52±0.25ac |
| TG(mmol/L) | 1.91±0.33 | 7.38±0.81a | 7.83±0.75a |
| FFAs(mmol/L) | 1.23±0.31 | 6.27±0.96a | 6.41±0.89a |
| LDL(mmol/L) | 1.89±0.25 | 10.20±0.82a | 11.95±1.58ac |
| HDL(mmol/L) | 1.60±0.14 | 1.18±0.28a | 1.13±0.21a |
| TC(mmol/L) | 6.22±0.65 | 14.66±1.97a | 15.76±1.82a |
| G0×I0 | 105.02±14.62 | 240.80±58.07a | 310.60±70.00ac |
| IRHOMA | 4.48±0.54 | 10.70±2.58a | 14.40±3.10ac |
| QUICKI | 0.3061±0.007 | 0.2752±0.007a | 0.2621±0.006a |
组织形态学研究(图2)显示对照组地鼠肝组织结构和细胞形态正常. 胰岛素抵抗地鼠和2型糖尿病地鼠均出现肝脏脂沉积(肝脂肪变性). 胰岛素抵抗地鼠的肝细胞内出现细小的和中等大小的脂滴并呈现轻中度的肝脏脂肪变性. 2型糖尿病地鼠的肝细胞内出现中等大小的脂滴并且含有中等大小脂滴的肝细胞数目稍增多, 但亦呈现轻中度的肝脏脂肪变性. 总体看来, 胰岛素抵抗地鼠和2型糖尿病地鼠肝脏的脂沉积状况相近似, 并无本质差异.
基因芯片分析显示在胰岛素抵抗地鼠和2型糖尿病地鼠肝脏中, 分别大约有7.2%(1 800)和12%(3 000)个基因至少上调或下调1.5倍. 在胰岛素抵抗地鼠肝脏中, 1 800个差异表达的基因中大约1 025(4.1%)个基因上调, 775(3.1%)个基因下调. 而在2型糖尿病地鼠肝脏中, 3 000个差异表达的基因中1 700(6.8%)个基因上调, 1 300(5.2%)个基因下调. 这些差异表达的基因主要与代谢、转录、信号转导、细胞通讯、转运、刺激反应、细胞生长和维持、应激、细胞周期、凋亡及调节、细胞增殖和分化、发育、细胞黏附、蛋白修饰、防御反应、翻译和细胞结构等相关. G0分析结果显示在代谢相关差异表达的基因中, 胰岛素抵抗地鼠有199个基因, 2型糖尿病地鼠有247个基因与糖尿病相关. 这些基因主要与肝脏糖代谢、脂代谢、信号通路和转录因子/核因子相关. 在这199和247个差异表达的基因中有143个(包括67个上调和76个下调基因)基因共同表达于胰岛素抵抗地鼠和2型糖尿病地鼠, 其中部分被列于表3. 而在其余的差异表达的基因中, 24个基因只在胰岛素抵抗地鼠上调; 49个基因只在2型糖尿病地鼠上调, 32个基因只在胰岛素抵抗地鼠下调; 55个基因只在2型糖尿病地鼠下调.
| 序列号 | 基因名称 | 胰岛素抵抗组(倍数变化) | 2型糖尿病组(倍数变化) | 调解者1 |
| NM_007988 | fatty acid synthase (Fasn) | 2.26 | 3.99 | SREBP-1 |
| BE865030 | acetyl-Coenzyme A carboxylase (ACC) | 2.04 | 3.33 | SREBP-1 |
| NM_009127 | Stearoyl CoA desaturase 1(Scd1) | 2.57 | 4.27 | SREBP-1 |
| NM_053115 | acyl-Coenzyme A oxidase | -1.99 | -2.66 | PPARα |
| NM_013495 | carnitine palmitoyltransferase 1, liver (Cpt1) | -1.90 | -2.60 | PPARα |
| NM_007382 | acetyl-Coenzyme A dehydrogenase, medium chain (Acadm) | -2.09 | -2.75 | PPARα |
| NM_007824 | cytochrome P450, family 7, subfamily a, polypeptide 1 (Cyp7a1) | -2.00 | -3.02 | LXRα |
| BM937289 | 3-hydroxy-3-methylglutaryl-coenzyme A reductase(Hmgcr) | 2.03 | 3.02 | SREBP-2 |
| NM_145942 | 3-hydroxy-3-methylglutaryl-Coenzyme A synthase (Hmgcs) | 1.72 | 3.83 | SREBP-2 |
| NM_010700 | low density lipoprotein receptor (Ldlr) | 1.97 | 2.87 | SREBP-2 |
| NM_007643 | CD36 antigen (Cd36) CD36/ FAT | 2.02 | 3.31 | PPARγ |
| NM_010292 | glucokinase (Gck) | -2.05 | -2.99 | LXRα |
| NM_008061 | glucose-6-phosphatase, catalytic (G6pc) | 1.89 | 2.37 | LXRα |
| NM_011044 | phosphoenolpyruvate carboxykinase 1, cytosolic (Pck1) | 1.90 | 3.61 | LXRα |
| NM_011480 | sterol regulatory element binding factor 1 (Srebf1) | 2.76 | 3.72 | LXRα |
| XM_127995 | sterol regulatory element binding factor 2 (Srebf2) | 2.65 | 3.38 | |
| NM_013839 | nuclear receptor subfamily 1, group H, member 3 (Nr1h3) | -2.07 | -2.80 | LXRα |
| NM_009473 | nuclear receptor subfamily 1, group H, member 2 (Nr1h2) | NC | NC | |
| NM_011144 | peroxisome proliferator activated receptor alpha (Ppara) | -2.13 | -3.14 | |
| NM_011145 | peroxisome proliferator activator receptor delta (Ppard) | -2.03 | -2.82 | |
| NM_011146 | peroxisome proliferator activated receptor gamma (Pparg) | 2.18 | 2.91 | |
| NM_008509 | lipoprotein lipase (Lpl) | 2.06 | 3.79 | PPARγ |
| NM_024406 | fatty acid binding protein 4, adipocyte (Fabp4), aP2 | 2.17 | 3.87 | PPARγ |
| NM_008904 | peroxisome proliferative activated receptor, gamma, coactivator 1 alpha (Ppargc1a) | 2.20 | 3.21 | LXRα |
表3显示与正常对照组相比, 胰岛素抵抗地鼠和2型糖尿病地鼠肝脏中SREBPs基因的表达增加. SREBP-1c调节的脂肪酸合成相关靶基因, 如脂肪酸合成酶(FAS)、乙酰辅酶A羧化酶(ACC)和硬脂酰辅酶A去饱和酶-1(SCD-1)的表达升高; SREBP-2调节的胆固醇代谢相关靶基因, 如羟甲戊二酰辅酶A合成酶(HMG CoA synthase)、羟甲戊二酰辅酶A还原酶(HMG CoA reductase)和高密度脂蛋白受体(LDLR)的表达也增加; 由LXRα调节的磷酸烯醇式丙酮酸羧激酶(PEPCK)、葡萄糖-6-磷酸酶(G-6-Pase)和过氧化物酶体增殖体激活的受体γ共激活因子-1α(PGC-1α)基因的表达升高; PPARγ及其靶基因脂蛋白脂酶(LPL)、脂肪酸转运者(FAT/CD36)和脂肪酸结合蛋白(ap2)的表达也升高. 在2型糖尿病地鼠的肝脏中上述升高表达的基因高于其在胰岛素抵抗地鼠肝脏中的表达(表3). 与正常对照组相比较, 在胰岛素抵抗地鼠和2型糖尿病地鼠肝脏中LXRα, PPARα和PPARβ/δ基因表达降低, 而LXRβ基因表达未发生改变. PPARα调节的靶基因如酰基辅酶A氧化酶(Acox)、肉碱棕榈酰转移酶1(Cpt1)和中链酰基辅酶A脱氢酶(Acadm)的表达降低, 而由LXRα 调节的靶基因如胆固醇7α羟化酶1(CYP7A1)和葡萄糖激酶(Gck)的表达也降低. 在2型糖尿病地鼠肝脏中上述降低的基因表达低于其在胰岛素抵抗地鼠肝脏中的表达(表3).
为了验证胰岛素抵抗地鼠和2型糖尿病地鼠肝脏中LXRs, SREBPs和PPARs及其靶基因表达的改变, 我们选择了包括LXRs, SREBPs和PPARs在内的25个基因来进一步应用实时定量RT-PCR来研究其表达状况并与基因芯片的结果相比较. 上述被检基因的实时定量RT-PCR的结果与基因芯片的结果相似. 与正常对照组相比, 胰岛素抵抗地鼠和2型糖尿病地鼠肝脏中SREBPs(SREBP-1a, SREBP-1c和SREBP-2)和PPARγ的表达升高, LXRα, PPARα和PPARβ/δ的表达降低, 而LXRβ的表达未发生改变. 另外, PEPCK, G-6-Pase, PGC-1α, FAS, ACC, SCD1, LDLR, HMG CoA synthase, HMG CoA reductase, LPL, FAT/CD36和ap2的表达增加而CYP7A1, Gck, Acox, Cpt1和Acadm的表达降低. 同时, 在胰岛素抵抗地鼠肝脏和2型糖尿病地鼠肝脏中LXRα, SREBPs和PPARs及其靶基因表达改变存在统计学差异(P<0.05, 图3).
糖尿病脂毒性学说提出异常的脂代谢可造成胰岛素敏感组织中异常的脂沉积并导致胰岛素敏感组织功能的异常(胰岛素抵抗), 即导致脂毒性. 造成肥胖的高脂饮食增加肝脏脂代谢产物的含量, 形成形态学上的肝脂肪变性, 同时在分子水平激活了包括蛋白激酶Cε的丝氨酸激酶级联反应, 导致降低胰岛素受体、胰岛素受体底物1和2、磷酸肌醇激酶3和蛋白激酶B的激酶活性而诱发肝脏胰岛素抵抗[12,13]. 尽管脂肪肝相关胰岛素抵抗的分子机制正被广泛研究, 但参与脂肪肝相关胰岛素抵抗的肝脏基因表达改变尚未完全清楚. 我们的结果显示异常的LXRs, SREBPs和PPARs表达参与胰岛素抵抗地鼠和2型糖尿病地鼠脂肪肝相关胰岛素抵抗的形成.
LXRs包括LXRα和LXRβ两个异构体, 是核受体家族成员, 被认为是炎症性细胞因子、胆固醇代谢、脂的生物合成、糖稳态和胆汁酸代谢的关键调解者[14]. 本研究结果显示在胰岛素抵抗地鼠和2型糖尿病地鼠肝脏中LXRα, CYP7A1和Gck的表达降低而PEPCK, G6Pase和PGC-1α的表达增加. 这些基因表达改变提示降低表达的LXRα不能有效的抑制肝脏糖异生基因PEPCK, G6Pase和PGC-1α的表达而抑制肝脏的糖异生, 因而有助于肝糖的产生和外输. 降低表达的LXRα不能有效的诱导肝脏Gck基因的表达而增加肝脏对糖的利用. 因此, 降低表达的LXRα有助于形成高血糖. 同时, 增加表达的肝脏PEPCK, G6Pase和PGC-1α有助于胰岛素抵抗、糖耐量异常和肥胖相关2型糖尿病的发生[15-17]. 另外, 降低表达的LXRα和增加表达的SREBP-1c降低CYP7A1的表达[18], 这将降低胆汁酸的合成而有助于肝脏胆固醇的沉积和脂肪肝相关胰岛素抵抗的形成. 在胰岛素抵抗地鼠和2型糖尿病地鼠的肝脏中LXRβ的表达未发生改变, 似乎不参与脂肪肝相关胰岛素抵抗的形成. 因此, 降低表达的肝脏LXRα及其相应靶基因表达的改变有助于胰岛素抵抗地鼠和2型糖尿病地鼠异常的肝脏糖脂代谢、脂肪肝相关胰岛素抵抗的形成和肥胖相关2型糖尿病的发生.
SREBPs属于膜结合转录因子家族, 主要参与脂的合成代谢和胰岛素诱导的葡萄糖代谢. 哺乳动物细胞基因组编码3个SREBP异构体, 分别为SREBP-1a, SREBP-1c和SREBP-2. 本研究结果显示在胰岛素抵抗地鼠和2型糖尿病地鼠肝脏中SREBPs(SREBP-1a, SREBP-1c和SREBP-2), FAS, ACC, SCD1, LDLR, HMG CoA synthase和HMG CoA reductase的表达增加. 肝脏增加表达的SREBPs可能主要由高脂饮食[15]或增高的血糖[19]诱导形成. 这或许可解释为什么当肝脏LXRα表达降低时SREBPs表达增加的原因. 增强表达的SREBP-1c将诱导脂合成基因, 如FAS, ACC和SCD1的表达, 增加肝脏TG的沉积[20], 有助于脂肪肝相关胰岛素抵抗的形成. 另外, 增强表达的SREBP-1c也可以通过直接抑制胰岛素受体底物2基因转录而抑制胰岛素信号通路, 从而引起或加重胰岛素抵抗[21]. 增强表达的SREBP-2将诱导LDLR, HMG CoA synthase和HMG CoA reductase的表达而增加胆固醇的摄取和合成[22]. 增强表达的SREBP-1a似乎可以同时参与脂和胆固醇的合成[23]. 因此, 增强表达的SREBPs及其靶基因将导致肝脏脂代谢异常和脂沉积, 这将有助于胰岛素抵抗地鼠和2型糖尿病地鼠脂肪肝相关胰岛素抵抗的形成.
PPARs是配体激活的转录因子, 在脂肪酸的分解代谢中发挥重要作用. PPARs家族包括3个具有组织特异性表达的异构体(α、δ/β、γ)[24]. 我们的结果显示胰岛素抵抗地鼠和2型糖尿病地鼠肝脏中PPARα, PPARβ/δ, Acox, Cpt1和Acadm的表达降低而PPARγ, LPL, FAT/CD36和ap2的表达增加. 这些基因表达改变提示降低表达的PPARα不能有效地诱导参与过氧化物酶体和线粒体脂肪酸氧化基因, 如Acox, Cpt1和Acadm的转录而有利于肝脂沉积. 有研究显示在2型糖尿病动物模型降低表达的PPARα及其与脂肪酸氧化相关的靶基因发生在脂沉积形成之前[25-27]. 同时, 降低表达的PPARα诱导肝脏脂沉积和胰岛素抵抗[28,29]. 因此, 降低表达的PPARα及其靶基因导致降低肝脏脂肪酸氧化, 有助于肝脏脂沉积而导致或恶化脂肪肝相关胰岛素抵抗. 降低表达的PPARβ/δ不能有效地抑制SREBPs及成脂基因的表达, 而有助于肝脏脂沉积和胰岛素抵抗的形成[30]. 增加表达的PPARγ及其靶基因LPL, FAT/CD36和ap2, 有助于肝脏脂生成和沉积从而导致或恶化脂肪肝相关胰岛素抵抗[31].
我们的结果显示肝脏LXRα, SREBPs和PPARs表达的改变与高脂饮食(高脂状态)和STZ处理(高糖状态)相关. 这些基因表达改变显示高脂饮食诱导的肥胖通过肝脏LXRα, SREBPs和PPARs表达的改变导致异常的肝脏糖脂代谢和脂沉积(肝脂肪变), 而有助于脂肪肝相关胰岛素抵抗的形成和2型糖尿病的发生.
感谢寿克让和高红在技术方面的支持及帮助, 感谢本研究的所有参与者.
胰岛素抵抗是2型糖尿病重要的发病机制之一. 脂毒性理论提出高脂饮食性肥胖发生2型糖尿病的潜在机制是异位脂沉积诱发的胰岛素敏感组织的脂肪变相关胰岛素抵抗. 肝脏(胰岛素敏感组织)脂肪变相关胰岛素抵抗在2型糖尿病的形成和发展过程中发挥重要作用.
徐庆, 教授, 桂林医学院药理教研室
目前, 2型糖尿病脂肪肝相关胰岛素抵抗形成机制的研究主要集中在受体后缺陷方面. 在激素调节的信号通路和转录因子/核因子(受体)系统及其信号通路方面的研究有助于理解其分子机制, 但其机制仍需深入的研究.
近期研究显示肝内脂代谢产物的沉积激活了丝氨酸激酶级联反应, 导致降低胰岛素受体激酶活性和胰岛素信号通路代谢缺陷, 形成胰岛素抵抗. 但诱导上述脂及脂代谢产物沉积的相关分子和信号通路及分子机制尚未完全阐明.
本实验选择具有糖尿病易感性和脂代谢类人性的中国地鼠建立疾病模型, 应用基因芯片技术, 一种解码疾病相关复杂基因表达谱改变的有力工具, 发现了新的有助于2型糖尿病脂肪肝相关胰岛素抵抗形成的基因表达改变模式和相关机制.
研究肝脏胰岛素抵抗, 尤其是脂肪肝相关胰岛素抵抗形成的分子机制是了解肥胖相关2型糖尿病发生的前提. 同时为肥胖相关2型糖尿病及相关疾病的饮食和药物防治提供分子靶点.
本文内容新颖, 方法可靠, 对了解脂肪肝与糖尿病的关系有一定意义.
编辑: 李薇 电编:何基才
| 1. | de Fourmestraux V, Neubauer H, Poussin C, Farmer P, Falquet L, Burcelin R, Delorenzi M, Thorens B. Transcript profiling suggests that differential metabolic adaptation of mice to a high fat diet is associated with changes in liver to muscle lipid fluxes. J Biol Chem. 2004;279:50743-50753. [PubMed] [DOI] |
| 2. | Jeon JR, Kim JY. Effects of pine needle extract on differentiation of 3T3-L1 preadipocytes and obesity in high-fat diet fed rats. Biol Pharm Bull. 2006;29:2111-2115. [PubMed] [DOI] |
| 3. | McGarry JD. Banting lecture 2001: dysregulation of fatty acid metabolism in the etiology of type 2 diabetes. Diabetes. 2002;51:7-18. [PubMed] [DOI] |
| 4. | Unger RH, Orci L. Lipotoxic diseases of nonadipose tissues in obesity. Int J Obes Relat Metab Disord. 2000;24 Suppl 4:S28-S32. [PubMed] |
| 5. | Matsumoto M, Han S, Kitamura T, Accili D. Dual role of transcription factor FoxO1 in controlling hepatic insulin sensitivity and lipid metabolism. J Clin Invest. 2006;116:2464-2472. [PubMed] |
| 6. | Shimomura I, Matsuda M, Hammer RE, Bashmakov Y, Brown MS, Goldstein JL. Decreased IRS-2 and increased SREBP-1c lead to mixed insulin resistance and sensitivity in livers of lipodystrophic and ob/ob mice. Mol Cell. 2000;6:77-86. [PubMed] [DOI] |
| 7. | Wu Q, Ortegon AM, Tsang B, Doege H, Feingold KR, Stahl A. FATP1 is an insulin-sensitive fatty acid transporter involved in diet-induced obesity. Mol Cell Biol. 2006;26:3455-3467. [PubMed] [DOI] |
| 8. | Luo J, Quan J, Tsai J, Hobensack CK, Sullivan C, Hector R, Reaven GM. Nongenetic mouse models of non-insulin-dependent diabetes mellitus. Metabolism. 1998;47:663-668. [PubMed] [DOI] |
| 9. | Danda RS, Habiba NM, Rincon-Choles H, Bhandari BK, Barnes JL, Abboud HE, Pergola PE. Kidney involvement in a nongenetic rat model of type 2 diabetes. Kidney Int. 2005;68:2562-2571. [PubMed] [DOI] |
| 10. | Mu J, Woods J, Zhou YP, Roy RS, Li Z, Zycband E, Feng Y, Zhu L, Li C, Howard AD. Chronic inhibition of dipeptidyl peptidase-4 with a sitagliptin analog preserves pancreatic beta-cell mass and function in a rodent model of type 2 diabetes. Diabetes. 2006;55:1695-1704. [PubMed] [DOI] |
| 11. | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 2001;25:402-408. [PubMed] |
| 12. | Samuel VT, Liu ZX, Qu X, Elder BD, Bilz S, Befroy D, Romanelli AJ, Shulman GI. Mechanism of hepatic insulin resistance in non-alcoholic fatty liver disease. J Biol Chem. 2004;279:32345-3253. [PubMed] [DOI] |
| 14. | Steffensen KR, Gustafsson JA. Putative metabolic effects of the liver X receptor (LXR). Diabetes. 2004;53 Suppl 1:S36-S42. [PubMed] [DOI] |
| 15. | Finck BN, Kelly DP. PGC-1 coactivators: inducible regulators of energy metabolism in health and disease. J Clin Invest. 2006;116:615-622. [PubMed] [DOI] |
| 16. | Sun Y, Liu S, Ferguson S, Wang L, Klepcyk P, Yun JS, Friedman JE. Phosphoenolpyruvate carboxykinase overexpression selectively attenuates insulin signaling and hepatic insulin sensitivity in transgenic mice. J Biol Chem. 2002;277:23301-23307. [PubMed] [DOI] |
| 17. | Trinh KY, O'Doherty RM, Anderson P, Lange AJ, Newgard CB. Perturbation of fuel homeostasis caused by overexpression of the glucose-6-phosphatase catalytic subunit in liver of normal rats. J Biol Chem. 1998;273:31615-31620. [PubMed] [DOI] |
| 18. | Ponugoti B, Fang S, Kemper JK. Functional interaction of hepatic nuclear factor-4 and peroxisome proliferator-activated receptor-gamma coactivator 1alpha in CYP7A1 regulation is inhibited by a key lipogenic activator, sterol regulatory element-binding protein-1c. Mol Endocrinol. 2007;21:2698-2712. [PubMed] [DOI] |
| 19. | Hasty AH, Shimano H, Yahagi N, Amemiya-Kudo M, Perrey S, Yoshikawa T, Osuga J, Okazaki H, Tamura Y, Iizuka Y. Sterol regulatory element-binding protein-1 is regulated by glucose at the transcriptional level. J Biol Chem. 2000;275:31069-31077. [PubMed] [DOI] |
| 20. | Yahagi N, Shimano H, Hasty AH, Matsuzaka T, Ide T, Yoshikawa T, Amemiya-Kudo M, Tomita S, Okazaki H, Tamura Y. Absence of sterol regulatory element-binding protein-1 (SREBP-1) ameliorates fatty livers but not obesity or insulin resistance in Lep(ob)/Lep(ob) mice. J Biol Chem. 2002;277:19353-19357. [PubMed] [DOI] |
| 21. | Ide T, Shimano H, Yahagi N, Matsuzaka T, Nakakuki M, Yamamoto T, Nakagawa Y, Takahashi A, Suzuki H, Sone H. SREBPs suppress IRS-2-mediated insulin signalling in the liver. Nat Cell Biol. 2004;6:351-357. [PubMed] [DOI] |
| 22. | Miserez AR, Muller PY, Barella L, Barella S, Staehelin HB, Leitersdorf E, Kark JD, Friedlander Y. Sterol-regulatory element-binding protein (SREBP)-2 contributes to polygenic hypercholesterolaemia. Atherosclerosis. 2002;164:15-26. [PubMed] [DOI] |
| 23. | Liang G, Yang J, Horton JD, Hammer RE, Goldstein JL, Brown MS. Diminished hepatic response to fasting/refeeding and liver X receptor agonists in mice with selective deficiency of sterol regulatory element-binding protein-1c. J Biol Chem. 2002;277:9520-9528. [PubMed] [DOI] |
| 25. | Ip E, Farrell G, Hall P, Robertson G, Leclercq I. Administration of the potent PPARalpha agonist, Wy-14,643, reverses nutritional fibrosis and steatohepatitis in mice. Hepatology. 2004;39:1286-1296. [PubMed] [DOI] |
| 26. | Yeon JE, Choi KM, Baik SH, Kim KO, Lim HJ, Park KH, Kim JY, Park JJ, Kim JS, Bak YT. Reduced expression of peroxisome proliferator-activated receptor-alpha may have an important role in the development of non-alcoholic fatty liver disease. J Gastroenterol Hepatol. 2004;19:799-804. [PubMed] [DOI] |
| 27. | Wan YJ, Morimoto M, Thurman RG, Bojes HK, French SW. Expression of the peroxisome proliferator-activated receptor gene is decreased in experimental alcoholic liver disease. Life Sci. 1995;56:307-317. [PubMed] [DOI] |
| 28. | Svegliati-Baroni G, Candelaresi C, Saccomanno S, Ferretti G, Bachetti T, Marzioni M, De Minicis S, Nobili L, Salzano R, Omenetti A. A model of insulin resistance and nonalcoholic steatohepatitis in rats: role of peroxisome proliferator-activated receptor-alpha and n-3 polyunsaturated fatty acid treatment on liver injury. Am J Pathol. 2006;169:846-860. [PubMed] [DOI] |
| 29. | 朱 金玲, 张 虎, 张 淑红, 姚 海涛, 张 金波, 祝 丽玲. 非酒精性脂肪肝大鼠L-FABP和PPAR-α mRNA的动态表达. 世界华人消化杂志. 2010;18:1525-1530. [DOI] |
| 30. | Qin X, Xie X, Fan Y, Tian J, Guan Y, Wang X, Zhu Y, Wang N. Peroxisome proliferator-activated receptor-delta induces insulin-induced gene-1 and suppresses hepatic lipogenesis in obese diabetic mice. Hepatology. 2008;48:432-441. [PubMed] [DOI] |
| 31. | Yu S, Matsusue K, Kashireddy P, Cao WQ, Yeldandi V, Yeldandi AV, Rao MS, Gonzalez FJ, Reddy JK. Adipocyte-specific gene expression and adipogenic steatosis in the mouse liver due to peroxisome proliferator-activated receptor gamma1 (PPARgamma1) overexpression. J Biol Chem. 2003;278:498-505. [PubMed] [DOI] |