修回日期: 2010-12-27
接受日期: 2011-01-06
在线出版日期: 2011-02-08
目的: 研究白花丹醌对瘦素(Leptin)刺激体外培养人肝星状细胞株HSC-LX2凋亡及相关蛋白表达的影响, 以探讨其抗肝纤维化作用的机制.
方法: 体外培养HSC-LX2, 将其分为以下几组: 空白对照组、Leptin对照组、秋水仙碱组、2 、8、16 μmol/L 白花丹醌组. 瘦素刺激24 h, 药物与细胞共孵育24 h后, 应用流式细胞仪Annexin/PI双染方法检测细胞凋亡, 透射电镜观察HSC-LX2凋亡形态学变化, 免疫组织化学法检测HSC-LX2凋亡基因p53、Bax、Bcl-2的蛋白表达.
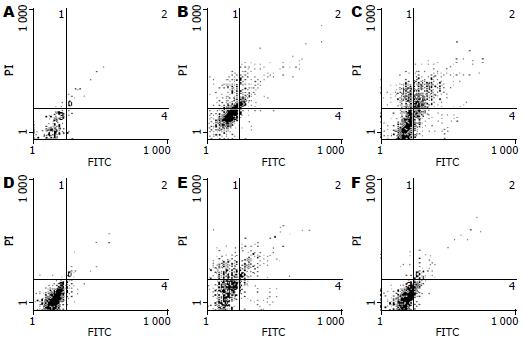
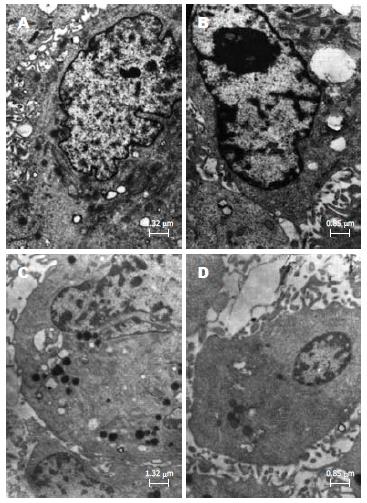
结果: 细胞流式术结果显示, 白花丹醌作用HSC-LX2 24 h, HSC凋亡率明显增加, 白花丹醌8、16 μmol/L组和秋水仙碱组HSC凋亡率均显著高于空白对照组和Leptin对照组(5.21%±0.41%, 8.10%±0.63%, 10.1%±1.08% vs 1.40%±0.13%, 2.85%±0.21%, 均P<0.01). 透射电镜结果, 空白对照组细胞形态清晰, 细胞膜、核膜完整, 胞质内细胞器清晰, 染色质均匀, 细胞表面微绒毛; 药物组可见少量坏死细胞和许多不同程度的凋亡细胞, 体积变小, 核膜消失, 胞质浓缩, 胞质内出现大量空泡, 细胞核染色质固缩, 可见核碎裂, 细胞表面微绒毛消失. 免疫组织化学结果显示, 受Leptin刺激后HSC-LX2胞质内表达少量的Bax、Bcl-2、P53, 可见少量的棕黄色颗粒, 经白花丹醌2、8、16 μmol/L干预后, HSC-LX2促凋亡基因Bax、P53蛋白表达明显升高, 抗凋亡基因Bcl-2蛋白表达显著降低, 与Leptin刺激组相比, 差异均有统计学意义(Bax: 85.24±1.08, 86.35±1.12, 91.13±1.13 vs 56.63±0.94; P53: 25.32±0.6, 38.14±0.71, 41.19±0.72 vs 19.25±0.46; Bcl-2: 32.12±0.43, 27.71±0.38, 21.46±0.46 vs 44.51±0.56, P<0.05或0.01).
结论: 白花丹醌能够促进活化的HSC-LX2凋亡, 其促HSC-LX2凋亡机制可能与上调P53、Bax蛋白表达和下调Bcl-2蛋白有关.
引文著录: 韦燕飞, 钟振国, 黄仁彬, 彭岳, 谢海源, 段雪琳, 赵铁建. 白花丹醌对人肝星状细胞凋亡及相关蛋白表达的影响. 世界华人消化杂志 2011; 19(4): 349-354
Revised: December 27, 2010
Accepted: January 6, 2011
Published online: February 8, 2011
AIM: To investigate the effects of plumbagin on leptin-induced apoptosis and expression of apoptosis-related protein in human hepatic satellite cells (HSC-LX2) and to explore the anti-fibrotic mechanism of plumbagin.
METHODS: After HSC-LX2 cells were cultured in vitro, stimulated with leptin for 24 h, and treated with different concentrations of plumbagin for 24 h, cell apoptosis was detected by flow cytometry; cell ultrastructure was observed by transmission electron microscopy; and the protein expression of P53, Bax, and Bcl-2 was determined by immunocytochemistry.
RESULTS: HSC-LX2 cells were divided into 6 groups: untreated cells (blank control group), those treated with 100 μg/L leptin (leptin control group), those treated with both leptin and colchicin (colchicin group), those treated with both leptin and 2, 8 or 16 μmol/L plumbagin (2, 8, 16 μmol/L plumbagin group). The apoptosis rate of HSC-LX2 cells was significantly increased in plumbagin groups. The apoptosis rates of cells treated with 8 or 16 µmol/L plumbagin or colchicine were significantly higher than those of the blank control group and leptin group (5.21% ± 0.41%, 8.10% ± 0.63%, 10.1% ± 1.08% vs 1.40% ± 0.13%, 2.85% ± 0.21%, all P < 0.01). Transmission electron microscopy revealed varying degrees of apoptosis in the leptin group or plumbagin groups. Immunocytochemistry analysis showed that the protein expression levels of P53 and Bax were higher and that of Bcl-2 was lower in plumbagin groups than in the leptin group (Bax: 85.24 ± 1.08, 86.35 ± 1.12, 91.13 ± 1.13 vs 56.63 ± 0.94; P53: 25.32 ± 0.6, 38.14 ± 0.71, 41.19 ± 0.72 vs 19.25 ± 0.46; Bcl-2: 32.12 ± 0.43, 27.71 ± 0.38, 21.46 ± 0.46 vs 44.51 ± 0.56, all P < 0.05 or 0.01).
CONCLUSION: Plumbagin can significantly accelerate leptin-induced apoptosis of HSC-LX2 cells possibly by up-regulating P53 and Bax expression and down-regulating Bcl-2 expression.
- Citation: Wei YF, Zhong ZG, Huang RB, Peng Y, Xie HY, Duan XL, Zhao TJ. Effects of plumbagin on apoptosis and expression of apoptosis-related proteins in human hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2011; 19(4): 349-354
- URL: https://www.wjgnet.com/1009-3079/full/v19/i4/349.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i4.349
肝纤维化是肝病研究领域的一大热点, 肝星状细胞(hepatic stellate cell, HSC)是参与肝纤维化过程的重要细胞, 其活化增殖是肝纤维化发生机制的中心环节, 抑制HSC增殖, 诱导其凋亡是抗纤维化的重要策略[1-3]. 大量研究[4,5]已证明HSC凋亡受多种凋亡基因调控, 例如死亡受体, Fas/FasL, P53, caspases和Bax/Bcl-2家族. 其中Bcl-2家族成员在细胞凋亡的基因调控过程中起着至关重要的作用, 尤其这一家族的两个代表性成员Bcl-2和Bax, 分别是凋亡抑制和促进因子. 白花丹醌(plumbagin)是白花丹的主要活性成分, 是从植物白花丹中提取的一种小分子萘醌化合物, 具有广泛的药理活性, 包括抗菌消炎、抗生殖、抗凝等作用[6]. 本课题前期研究发现白花丹对CCl4所致大鼠急慢性肝损伤有抑制作用[7,8], 白花丹醌体外明显抑制HSC-T6细胞的增殖, 抑制转化生长因子-β1和α-平滑肌动蛋白表达[9,10]. 本研究以HSC-LX2细胞为体外模型, 初步探讨白花丹提取物白花丹醌对HSC-LX2细胞凋亡的影响, 从HSC-LX2凋亡相关蛋白表达角度来研究白花丹醌抗肝纤维化的机制.
人肝星状细胞株(HSC-LX2), 由湖南湘雅医学院医学实验中心提供. 白花丹醌(lot: 20071028)购自Sigma公司, 用二甲基亚砜(DMSO)溶解, 配成0.1 mol/L储备液, 于-20 ℃保存; 重组瘦素(Leptin, Protech公司, 批号: 8110060R); DMEM(Gibco, Cat No. 12800-056); 胎牛血清(Hyclone, 批号: NTM0136); 秋水仙碱(西双版纳药业公司, 批号: 070205); Annexin V-PE细胞凋亡检测试剂盒为美国BD公司生产; 鼠抗P53、Bax单克隆抗体和兔抗-Bcl-2多克隆抗体, 均为Santa Cruz公司产品; 免疫组织化学SP试剂盒, DAB显色试剂盒等, 购自武汉博士德有限公司. CO2培养箱(美国Thermo, Model 311); 高速冷冻离心机(上海安亭科学仪器厂, TGL-16G-A); 相差倒置显微镜(德国Zeiss, XD-101型); 酶标仪(美国Thermo, Model 450).
1.2.1 细胞培养: 人肝星状细胞株(HSC-LX2), 置于含100 mL/L胎牛血清的高糖DMEM培养液, 37 ℃, 50 mL/L CO2条件下培养, 隔天换液, 当细胞呈单层致密状时, 用2.5 g/L胰蛋白酶消化, 每3-4 d传代1次, 按1:2传代, 每次实验均在呈指数生长的细胞中进行.
1.2.2 分组及处理: 空白对照组: 加入含100 mL/L胎牛血清的高糖DMEM培养液; Leptin对照组: 在含100 mL/L胎牛血清的高糖DMEM培养液中加Leptin(1 000 μg/L), 终浓度为100 μg/L; Leptin与药物不同质量浓度联用组, 秋水仙碱组: Leptin与秋水仙碱, 终浓度为6.25 mg/L; 药物组: 在Leptin刺激组基础上加入白花丹醌, 低、中、高剂量组终浓度分别为2、8、16 μmol/L.
1.2.3 流式细胞仪Annexin V-PE/7-AAD双染色法检测HSC-LX2的凋亡情况: 各组细胞依Annexin V-FITC凋亡检测试剂盒说明操作, 各组以PBS洗涤1次, 胰酶消化后, 加入培养液中, 混匀, 离心后, 加入195 μL Annexin V-FITC结合液重悬细胞, 再加入5 μL Annexin V-FITC, 混匀. 加入190 μL Annexin V-FITC结合液重悬细胞, 再加入10 μL PI混匀, 随即用流式细胞仪检测凋亡率, 使用Flow max 2.4软件进行数据处理.
1.2.4 透射电镜观察HSC超微结构: 选用空白对照组、药物中剂量组, 处理同前, 共孵育24 h, 消化离心去上清. 加入100 mL/L牛血清白蛋白100 μL重悬, 离心后吸去多余牛血清白蛋白, 向附着1 mm3左右大小细胞团的离心管中加入适量4 ℃预冷的2.5%戊二醛固定, 经1%四氧化锇预固定和后固定后, 酒精及丙酮逐级脱水, 环氧树脂包埋, 作0.5 μm的薄切片, 醋酸双氧铀及构椽酸铅染色, JEM-1200EX型透射电镜观察、拍照.
1.2.5 免疫细胞化学法检测P53、Bax、Bcl-2的蛋白表达: 将传代培养的HSC-LX2用含100 mL/L胎牛血清的DMEM接种于放有盖玻片的6孔培养板, 24 h后待细胞贴壁伸展后, 分组、干预同前. 药物与细胞共孵育24 h后取出盖玻片置于载玻片上, 用4%多聚甲醛固定, 3% H2O2过氧化氢灭活, 抗原修复, 血清封闭后, 依次滴加P53、Bax、Bcl-2一抗、二抗试剂孵育后进行脱水、封片, 镜下观察. 检测方法严格按照试剂盒说明书进行操作, 胞质或胞膜被染成棕褐色为P53、Bax、Bcl-2表达阳性细胞. 结果判定标准: 阳性信号为棕黄色或棕褐色, 位于胞质内、胞膜和核膜上, 运用HPIAS-1000高清晰度彩色病理图文分析系统细胞测定程序, 对各组HSC P53、Bax、Bcl-2阳性细胞进行显微图像分析, 每组随机检测4个视野细胞的吸光度, 计算其平均吸光度.
统计学处理 应用SPSS10.0软件进行统计学处理, 计量资料均采用mean±SD表示, 采用单因素方差分析.
与对照组比较, Leptin组HSC凋亡率升高(P>0.05), 白花丹醌作用HSC-LX2 24 h, HSC凋亡率明显增加, 中、高剂量组和阳性药组HSC-LX2细胞凋亡率均明显增高, 差异均有显著性(P<0.05, 图1, 表1).
电镜下, 空白对照组细胞形态清晰, 细胞膜、核膜完整, 胞质内细胞器清晰, 染色质均匀, 细胞表面微绒毛(图2A, B); 白花丹醌8 μmol/L组可见少量坏死细胞和许多不同程度的凋亡细胞, 其细胞体积变小, 核膜消失, 胞质浓缩, 胞质内出现大量空泡, 细胞核染色质固缩, 可见核碎裂, 细胞表面微绒毛消失(图2C, D).
受Leptin刺激后, HSC胞内表达少量的Bax、Bcl-2、P53, 可见少量的棕黄色颗粒, 经白花丹醌2、8、16 μmol/L干预后, HSC-LX2促凋亡基因Bax、P53蛋白表达明显升高, 抗凋亡基因Bcl-2蛋白表达显著降低, 与Leptin组相比, 差异均有统计学意义(P<0.01, 表2).
HSC在肝纤维化进程中起关键作用, 是肝纤维化时细胞外基质(extracellular matrix, ECM)合成的主要来源细胞[11]. 近来研究表明[12], 逆转肝纤维化关键在于减少激活的HSC数量, 凋亡是减少活化型HSC数量的最主要途径. 在各种病因的刺激下, 静止的HSC可以活化、增殖, 合成并分泌大量的ECM, 活化增生后的HSC有两种命运: 一是回到静止状态, 二是可能通过凋亡途经等死亡. 最近的研究表明[13-15], 肝纤维化恢复期, 活化的HSC减少主要通过凋亡途经, 而非表型的改变, 凋亡引起的HSC减少具有重要的意义: 一方面, HSC的减少使细胞基质的分泌减少, 还不引起溶酶体等细胞器的破坏, 凋亡的细胞可在数小时内被周围的细胞所吞噬, 很少引起微环境的炎症损伤, 是一种理想的清除活化HSC的方式; 另一方面, 由激活的HSC分泌的金属蛋白酶抑制物1(tissue inhibitors of matrix metalloproteinase-1, TIMP-1)明显下降, 解除了对胶原酶活性的抑制, 胶原酶活性增强, 胶原降解增加. 因此, 诱导活化的HSC凋亡是肝纤维化治疗的重要靶向, 凋亡是有核细胞通过启动自身内部的遗传机制激活内源性DNA内切酶而发生的一种主动细胞死亡过程[16]. 透射电镜是观察凋亡细胞形态的最好方法, 他可以同时反映细胞膜的完整性, 细胞质中细胞器的改变, 细胞核及染色质的改变, 凋亡小体的形成等.
细胞凋亡受多种基因调控, 这一过程受多种促凋亡和抗凋亡的蛋白调节, 其中促凋亡基因Bax和凋亡抑制基因Bc1-2被认为与细胞凋亡关系密切[17,18]. P53是一种核内的磷酸蛋白, 他在细胞凋亡中的作用: (1)降低内源性Bcl-2蛋白表达和抑制其功能; (2)激动Bax基因转录, 提高细胞内Bax蛋白的表达, 使Bcl-2/Bax蛋白比例改变而促进细胞凋亡; (3)增强Fas、FasL基因表达, 从而激活敏感的Fas/FasL信号传递途径. Aprigliano等[14]在随后的实验中发现, 在HSC激活后Fas/FasL表达增加, Bcl-2和Bcl-xL的表达下降及p53基因的上调共同促进HSC凋亡.
白花丹来源于蓝雪科蓝雪属, 主要分布于我国西南省份, 民间用于散疮、消肿、通经活络, 治疗蛇伤、风湿乳腺炎以及慢性气管炎等症[19]. 现代药理学研究表明[20,21], 白花丹具有抗肝纤维化作用, 白花丹醌是植物白花丹的主要活性成分, 具有很强的活血化瘀作用, 据测定白花丹根中的白花丹醌的含量多少与其活血化瘀功效的强弱相一致. 白花丹醌是一种小分子萘醌化合物, 为棕黄色结晶, 其分子式为C11H8O3, 相对分子质量为188.18, 化学结构式是5-羟基-2-甲基-1, 4萘醌(5-hydroxy-2-methyl-1, 4-naphthoquinone). 研究发现[6], 白花丹醌具有抗肿瘤、抗炎、抗细菌、抗真菌等多种作用. 目前大量研究表明[22-25]其对多种肿瘤细胞系有抗肿瘤作用, Sugie等[26]通过动物实验研究, 表明白花丹醌可显著抑制氧化偶氮甲烷诱发的小肠肿瘤; Sandur等[27]研究表明其可能通过抑制NF-κB通路达到抗肿瘤作用. Srinivas等[28]研究了白花丹素诱导子宫癌细胞ME-180凋亡, 其可能机制与白花丹醌增加细胞内活性氧产生、损伤线粒体, 使其膜电位下降, 引起ME-180细胞凋亡, 而且ME-180细胞凋亡率与白花丹素浓度呈正相关性. 本课题前期研究发现白花丹对CCl4所致大鼠急慢性肝损伤有抑制作用[7,8], 白花丹醌体外可以明显抑制HSC-T6细胞的增殖[29]. 本实验研究发现实验中可见白花丹醌(8、16 μmol/L)作用HSC 24 h后HSC核膜消失, 染色质边集, 细胞核染色质固缩, 核碎裂, 呈明显的凋亡改变. 流式细胞仪能对细胞凋亡进行定量分析, 实验中白花丹醌作用24 h后, 凋亡的HSC显著增加. 表明白花丹醌促进活化的HSC凋亡, 使HSC数量明显减少, 这可能是该药抗肝纤维化的有效途径之一. 在进一步探讨白花丹醌诱导HSC凋亡具体机制的研究中发现白花丹醌可以上调活化的HSC中P53、Bax蛋白表达, 下调Bcl-2蛋白表达, 提示白花丹醌与通过促进P53、Bax蛋白表达有关. Jaiswal等[30]在小鼠胚胎纤维母细胞研究中发现, 白花丹醌通过诱导周期蛋白依赖蛋白激酶抑制剂(CD KI)-P21的产生, 调节细胞周期阻滞于S-G2/M期.
细胞凋亡的机制相当复杂, 目前对白花丹醌调控HSC增殖及凋亡确切机制尚未完全明了, 深入研究白花丹醌对HSC的影响, 将有助于进一步了解白花丹醌调控HSC增殖及凋亡的分子机制, 并为抗肝纤维化治疗提供新的思路.
感谢广西医科大学实验中心李佳荃老师在本实验中给予的大力帮助.
肝星状细胞(HSC)在肝纤维化进程中起关键作用, 是肝纤维化时细胞外基质合成的主要来源细胞, 其活化增殖是肝纤维化发生机制的中心环节, 逆转肝纤维化关键在于减少激活的HSC数量, 凋亡是减少活化型HSC数量的最主要途径.
黄昆, 教授, 华中科技大学同济药学院
白花丹醌是白花丹的主要活性成分, 是从植物白花丹中提取的一种小分子萘醌化合物, 具有广泛的药理活性, 包括抗菌消炎、抗生殖、抗凝等作用. 研究发现白花丹对四氯化碳所致大鼠急慢性肝损伤有抑制作用, 白花丹醌体外明显抑制HSC-T6细胞的增殖, 然而, 白花丹醌是如何实现抑制HSC增殖活力, 加速HSC凋亡, 这是亟待解决的问题.
Sugie等通过动物实验研究, 表明白花丹醌可显著抑制氧化偶氮甲烷诱发的小肠肿瘤; Sandur等研究表明其可能通过抑制NF-κB通路达到抗肿瘤作用.
白花丹醌是否能通过细胞凋亡通路阻断肝纤维化, 目前未见报道. 本实验研究白花丹醌对瘦素刺激体外培养HSC-LX2凋亡及凋亡相关蛋白表达的影响, 以探讨其抗肝纤维化作用机制.
本文创新性较好, 对于治疗肝纤维化具有一定的临床参考价值.
编辑: 李薇 电编:何基才
| 4. | Panasiuk A, Dzieciol J, Panasiuk B, Prokopowicz D. Expression of p53, Bax and Bcl-2 proteins in hepatocytes in non-alcoholic fatty liver disease. World J Gastroenterol. 2006;12:6198-6202. [PubMed] |
| 5. | 席 文娜, 孙 水林, 李 方春, 罗 杰, 肖 影群, 章 萍, 张 伟. α-2a干扰素对大鼠肝组织bcl-2基因表达的影响及意义. 世界华人消化杂志. 2009;17:3237-3240. [DOI] |
| 6. | Krishnaswamy M, Purushothaman KK. Plumbagin: A study of its anticancer, antibacterial & antifungal properties. Indian J Exp Biol. 1980;18:876-877. [PubMed] |
| 7. | 赵 铁建, 钟 振国, 方 卓, 付 杰军, 覃 玉智, 段 雪琳, 廖 丹. 白花丹水煎液对四氯化碳慢性肝损伤小鼠肝组织脂质过氧化的影响. 广西医科大学学报. 2006;23:725-726. |
| 10. | 刘 雪梅, 韦 燕飞, 彭 岳, 谢 海源, 方 卓, 段 雪琳, 赵 铁建. 白花丹醌对瘦素诱导人肝星状细胞增殖与α-SMA表达的影响. 中国药理学通报. 2010;26:1154-1157. |
| 11. | Bataller R, Brenner DA. Hepatic stellate cells as a target for the treatment of liver fibrosis. Semin Liver Dis. 2001;21:437-451. [PubMed] [DOI] |
| 14. | Aprigliano I, Dudas J, Ramadori G, Saile B. Atorvastatin induces apoptosis by a caspase-9-dependent pathway: an in vitro study on activated rat hepatic stellate cells. Liver Int. 2008;28:546-557. [PubMed] [DOI] |
| 15. | de Villiers WJ, Song Z, Nasser MS, Deaciuc IV, McClain CJ. 4-Hydroxynonenal-induced apoptosis in rat hepatic stellate cells: mechanistic approach. J Gastroenterol Hepatol. 2007;22:414-422. [PubMed] [DOI] |
| 18. | Ermak N, Lacour B, Drüeke TB, Vicca S. Role of reactive oxygen species and Bax in oxidized low density lipoprotein-induced apoptosis of human monocytes. Atherosclerosis. 2008;200:247-256. [PubMed] [DOI] |
| 22. | Ahmad A, Banerjee S, Wang Z, Kong D, Sarkar FH. Plumbagin-induced apoptosis of human breast cancer cells is mediated by inactivation of NF-kappaB and Bcl-2. J Cell Biochem. 2008;105:1461-1471. [PubMed] [DOI] |
| 26. | Sugie S, Okamoto K, Rahman KM, Tanaka T, Kawai K, Yamahara J, Mori H. Inhibitory effects of plumbagin and juglone on azoxymethane-induced intestinal carcinogenesis in rats. Cancer Lett. 1998;127:177-183. [PubMed] [DOI] |
| 27. | Sandur SK, Ichikawa H, Sethi G, Ahn KS, Aggarwal BB. Plumbagin (5-hydroxy-2-methyl-1,4-naphthoquinone) suppresses NF-kappaB activation and NF-kappaB-regulated gene products through modulation of p65 and IkappaBalpha kinase activation, leading to potentiation of apoptosis induced by cytokine and chemotherapeutic agents. J Biol Chem. 2006;281:17023-17033. [PubMed] [DOI] |
| 28. | Srinivas P, Gopinath G, Banerji A, Dinakar A, Srinivas G. Plumbagin induces reactive oxygen species, which mediate apoptosis in human cervical cancer cells. Mol Carcinog. 2004;40:201-211. [PubMed] [DOI] |