修回日期: 2011-10-28
接受日期: 2011-11-04
在线出版日期: 2011-12-28
目的: 探讨RNA 干扰技术沉默Bmi-1基因表达后, 对人肝癌细胞株MHCC97-H侵袭迁移能力的影响.
方法: 设计并合成针对Bmi-1基因序列特异性的双链小干扰RNA(Bmi-1-siRNA), 转染高转移性人肝癌细胞株MHCC97-H, 用流式细胞仪观察转染效率, 荧光实时定量PCR 和Western blot 检测Bmi-1基因的mRNA和蛋白表达水平; 通过体外Transwell小室基质侵袭和迁移实验, 观察 Bmi-1表达沉默后对人肝癌细胞株 MHCC97-H侵袭和迁移能力的影响.
结果: 将针对Bmi-1基因序列特异性的小干扰RNA(Bmi-1-siRNA)转染高转移性人肝癌细胞株MHCC97-H后, 流式细胞仪显示, 转染效率可达到91%. 与空白组、对照siRNA组相比, 实验组Bmi-1-siRNA能有效抑制MHCC97-H细胞中Bmi-1基因的mRNA(F = 56.199, P<0.05)和蛋白表达水平. 通过Transwell小室基质侵袭和迁移实验, 我们分析了不同组细胞的侵袭迁移能力. 结果发现, 与空白组、对照siRNA组相比, Bmi-1-siRNA转染的MHCC97-H细胞穿透能力明显降低(F = 186.66, 12.746, P<0.05).
结论: 沉默Bmi-1基因表达可抑制肝癌细胞株MHCC97-H的侵袭迁移力.
引文著录: 李小磊, 宋文杰, 陈战, 陈亚峰, 李霄, 周亮, 张福琴, 窦科峰. siRNA沉默Bmi-1基因对人肝癌细胞株MHCC97-H侵袭迁移能力的影响. 世界华人消化杂志 2011; 19(36): 3643-3648
Revised: October 28, 2011
Accepted: November 4, 2011
Published online: December 28, 2011
AIM: To investigate the effect of small interference RNA (siRNA)-mediated silencing of the Bmi-1gene on cell invasion and metastasis in human hepatocellular carcinoma cell line MHCC97-H.
METHODS: Chemically synthesized siRNA duplex targeting the Bmi-1 gene (Bmi-1-siRNA) was transiently transfected into MHCC97-H cells, which have high metastatic potential, using Lipofectamine 2000. Transfection efficiency was evaluated by flow cytometry (FCM). Bmi-1 mRNA and protein expression was detected by real-time RT-PCR and Western blot, respectively. The effect of Bmi-1 knockdown on cell invasion and migration was analyzed by Transwell chamber assays.
RESULTS: The transfection efficiency achieved using Bmi-1-siRNA was 91%. Compared to the blank group and control siRNA group, transfection with Bmi-1-siRNA effectively down-regulated the expression of Bmi-1mRNA (F = 56.199, P < 0.05) and protein. Bmi-1-siRNA-transfected MHCC97-H cells had lower levels of invasion and migration capacity than cells in the blank group and control-siRNA group (F = 186.66, 12.746, both P < 0.05).
CONCLUSION: SiRNA-mediated silencing of the Bmi-1 gene could significantly inhibit cell invasion and metastasis in human hepatocellular carcinoma cell line MHCC97-H.
- Citation: Li XL, Song WJ, Chen Z, Chen YF, Li X, Zhou L, Zhang FQ, Dou KF. SiRNA-mediated silencing of the Bmi-1gene inhibits cell invasion and metastasis in human hepatocellular carcinoma cell line MHCC97-H. Shijie Huaren Xiaohua Zazhi 2011; 19(36): 3643-3648
- URL: https://www.wjgnet.com/1009-3079/full/v19/i36/3643.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i36.3643
Bmi-1基因(B lymphoma Mo-MLV insertion region 1 homolog, Bmi-1)是荷兰癌症中心1991年发现的原癌基因, 他与c-myc基因协同导致小鼠淋巴瘤的发生[1]. 他是一种广泛表达的核蛋白, 直接参与细胞生长、增殖和衰老的调节, 其适量表达也是胚胎正常发育和多种成体干细胞自我更新所必需的[2,3]. 近来, 大量研究证实Bmi-1的高表达与多种肿瘤的发生发展关系密切, 如乳腺癌[4]、肺癌[5]、胰腺癌[6]等. 一些研究也表明Bmi-1在原发性肝细胞癌(hepatocellular carcinoma, HCC)中高表达[7-9], 但其在肝癌发生发展中的作用却有较大的争议. Effendi等[10]的研究表明Bmi-1主要表达在早期和高分化肝癌中, Bmi-1的表达与肝癌的恶性进展无关. 而Sasaki等[11]的研究表明Bmi-1主要表达在低分化肝癌中, Bmi-1的表达与肝癌的病理分级和肿瘤细胞增殖、血管侵犯行为密切相关. 两者的研究结果相互矛盾. 为了研究Bmi-1是否与肝癌的侵袭迁移行为相关, 本研究采用RNA干扰技术抑制高转移性肝癌细胞株MHCC97-H中Bmi-1的表达, 观察下调Bmi-1表达后, MHCC97-H细胞侵袭和迁移能力的变化, 来探讨Bmi-1在肝癌侵袭迁移中的作用.
人肝癌细胞株MHCC97-H由本实验室保存. DMEM高糖培养基购自Gibco公司. TRIzol、脂质体转染试剂LipofectamineTM2000购自美国Invitrogen公司. 逆转录试剂盒及RealTime PCR扩增试剂盒购自TaKaRa公司. Negative control、FAM-siRNA购自上海吉玛生物有限公司. Bmi-1和GAPDH引物由生工生物(上海)有限公司合成. 小鼠抗人Bmi-1抗体购自Abcam公司, 小鼠抗人GAPDH抗体购自Santa Cruz公司. Transwell小室购自Millipore公司, Matrigel胶购自美国BD公司.
1.2.1 siRNA的合成: 上海吉玛生物有限公司化学合成3条针对Bmi-1序列的siRNA, 我们从中筛选出一条有效的siRNA序列, 正义链: 5'-CCAGACCACUACUGAAUAUTT-3', 反义链: 5'-AUAUUCAGUAGUGGUCUGGTT-3'. 干粉siRNA用Free-Rnase水稀释, 浓度为20 μmol/L.
1.2.2 细胞培养及siRNA瞬时转染: 肝癌细胞株MHCC97-H在含100 mL/L胎牛血清的高糖DMEM培养基(含青霉素100 U/mL, 链霉素100 μg/mL); 37 ℃、50 mL/L CO2、饱和湿度环境的条件下连续培养. 转染前24 h, 取对数生长期的细胞胰酶消化、计数, 接种于6孔板, 每孔细胞数为1.5×105个, 使细胞密度达到60%. 转染方法按照LipofectamineTM2000说明书进行操作. 将细胞分3组: (1)空白组(只加LipofectamineTM2000); (2)阴性对照组(转染时加入非特异性siRNA/LipofectamineTM2000复合物); (3)实验组(转染时加入Bmi-1特异性siRNA/Lipofectamine 2000复合物).
1.2.3 荧光实时定量PCR: 细胞转染24 h后收集细胞, 按TRIzol说明书操作提取细胞总RNA, 按逆转录试剂盒说明书进行逆转录反应, 用于扩增人Bmi-1cDNA的引物序列上游为: 5'-GCTTCAAGATGGCCGCTTG-3', 下游引物序列: 5'-TTCTCGTTGTTCGATGCATTTC-3', 扩增片段长度144 bp; 以人GAPDH为内参照, 上游引物序列为: 5'-GCACCGTCAAGGCTGAGAAC-3', 下游引物序列为: 5'-TGGTGAAGACGCCAGTGGA-3', 扩增片段长度138 bp. 扩增条件为: 95 ℃预变性3 min, 然后40个循环(95 ℃变性10 s, 59 ℃退火30 s, 72 ℃延伸30 s), 40个循环结束后建立熔解曲线. 实验结果采用公式2-∆∆CT计算.
1.2.4 Western blot: 转染后72 h, 用RIPA和蛋白酶抑制剂PMSF 提取各组细胞总蛋白. BCA法检测蛋白浓度. 取40 μg/道蛋白质样品上样, 经10% SDS-PAGE电泳后, 蛋白从凝胶中转移到PVDF膜上, 含5%脱脂奶粉的TBST 封闭1 h. 加入小鼠抗人Bmi-1单克隆抗体(1:500稀释)和小鼠抗人GAPDH单克隆抗体(1:500稀释), 4 ℃孵育过夜, TBST漂洗3次, 每次10 min, 加入HRP标记的羊抗鼠二抗(1:5 000稀释)室温孵育2 h, ECL显影检测.
1.2.5 细胞侵袭实验: 采用孔径为8 μm的24孔millicell小室进行试验. 用无血清DMEM培养基稀释Matrigel胶(稀释比例8:1), 按50 μL/孔均匀地铺在millicell小室膜上. 37 ℃孵育1 h. 收集转染48 h后的各组细胞, 用无血清DMEM培养液调整密度为1×105/mL, 取其中200 μL接种到上室中, 将小室置于加有600 μL含20%胎牛血清DMEM培养液的24孔板内, 37 ℃、50 mL/L CO2, 孵育36 h后取出小室, 小心擦掉上室细胞, PBS 洗3次, 950 mL/L乙醇固定, 结晶紫染色, 显微镜下计数5个视野穿过微孔的细胞数, 取其均值, 每组3个小室.
1.2.6 细胞迁移实验: 迁移实验不铺Matrigel胶, 孵育12 h后取出小室, 其余步骤同侵袭实验.
统计学处理 采用SPSS13.0统计软件分析, 计量资料以mean±SD表示, 两组均数比较采用t检验, 多组均数比较采用单因素方差分析. 取P<0.05为差异有统计学意义.
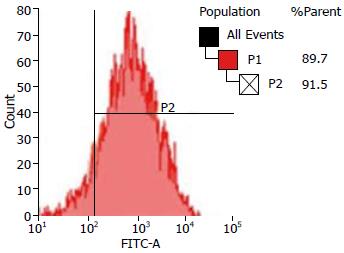
用FAM-siRNA转染MHCC97-H细胞, 在6孔板中选取细胞密度为40%-70%, siRNA浓度为100-200 pmol/L为初步预实验条件. 结果发现, 在细胞融合度达到60%, siRNA浓度为200 pmol/L时有最佳的转染效率. 流式细胞仪显示, 有绿色荧光的细胞达91%以上(图1).
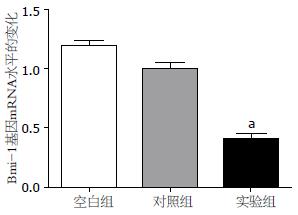
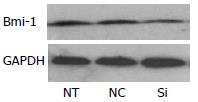
与空白组、阴性对照组相比, 实验组Bmi-1基因的mRNA(F = 56.199, P<0.05)和蛋白明显下调, 而空白组、阴性对照组无明显差异(P = 0.055, 图2, 3). 说明Bmi-1基因被沉默.
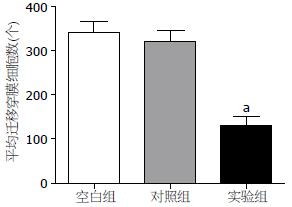
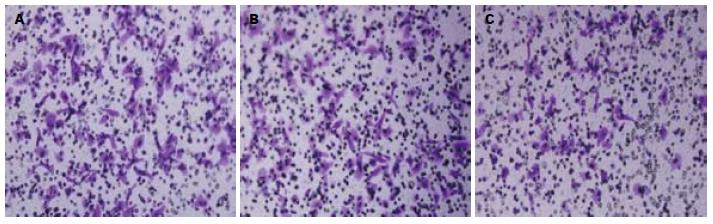
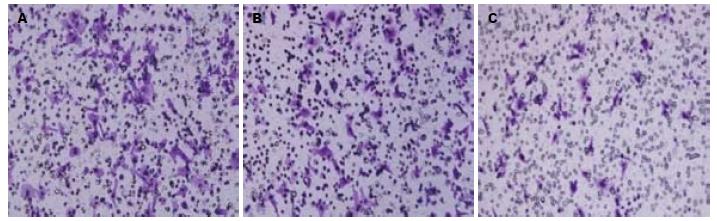
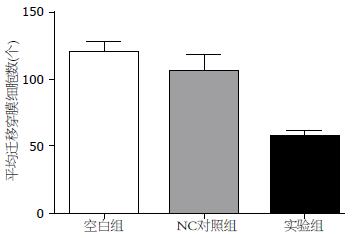
转染48 h后, 计数实验组、阴性对照组、空白对照组穿过Transwell小室的细胞数, 并进行方差分析. 结果显示, 与空白组、阴性对照组性比, 实验组穿过Transwell小室的细胞数明 显减少(F = 186.66, P<0.05), 而空白组、阴性对照组无明显差异(P = 0.47). 说明Bmi-1基因被抑制后, 细胞运动迁移能力下降(图4, 5).
转染48 h后, 计数实验组、阴性对照组、空白对照组穿过人工基底膜的细胞数, 并进行方差分析. 结果显示, 与空白组、阴性对照组性比, 实验组穿过的细胞数明显减少(F = 12.746, P<0.05), 而空白组、阴性对照组无明显差异(P = 0.124). 说明Bmi-1基因被抑制后, 细胞运动侵袭能力下降(图6, 7).
肝癌是世界范围内发病率最高的恶性肿瘤之一, 每年新发病例约有100万人[12]. 目前以手术切除为主的综合治疗是治疗原发性肝癌的主要方法, 但术后的5年复发率高达60%, 严重影响患者的长期生存. 虽然目前对肝癌的治疗有了很大的进步, 但对肝癌的复发转移的预防和治疗效果仍十分有限, 原因在于我们对肝癌复发转移的分子机制不完全清楚, 因此研究肝癌复发转移的分子机制并采取有效的预防和治疗措施是目前医学界亟待解决的重大问题.
Bmi-1基因属于转录抑制因子多梳基因家族(polycomb group, PcG)成员之一, 位于染色体10p12的位置上, 通过形成多梳抑制复合体1(polycomb repressive complex 1, PRC1)对染色质进行修饰而抑制靶基因的表达. 正常情况下在胚胎和多种成体干细胞中均有表达, 在维持正常神经干细胞、造血干细胞、肠干细胞和乳腺干细胞的自我更新中具有决定性作用[2,3], 其适量表达是个体发育所必需的.
研究证实, Bmi-1在多种肿瘤的恶性进展中发挥着重要作用, 如膀胱癌[13]、前列腺癌[14]、脑肿瘤[15,16]、乳腺癌[4]、肺癌[5]和胰腺癌[6]等是影响预后的重要因素. 众所周知, 肿瘤恶性进展是一个多因素、多步骤、多基因共同作用的综合病变结果, 涉及肿瘤细胞增殖、新生血管形成、细胞黏附、迁徙运动和凋亡等一系列过程. Bmi-1作为一个广泛表达的原癌基因是如何介导肿瘤的恶性进展? 目前研究表明: (1)Bmi-1直接或间接激活端粒末端转移酶活性, 使染色体端粒稳定维持在一定长度, 从而使细胞获得凋亡抵抗并永生化, 导致细胞恶性转化[17,18]; (2)通过甲基化或乙酰化修饰染色质组蛋白H3上的9、27位赖氨酸, 稳定抑制抑癌基因CDKN2A (编码p16INK4a和p14ARF)转录, 促进细胞周期进展, 导致肿瘤细胞无限扩增[19]; (3)介导多种肿瘤干细胞自我更新和扩增, 促进肿瘤的恶性进展[3,20-22]; (4)诱导上皮细胞发生间皮样表型转化(epithelial-mesenchymal transition, EMT), 而EMT 是恶性转化和肿瘤侵袭转移的早期重要标志[23]; (5)可以通过p16INK4a/p14ARF非依赖性途径, 如Akt、NF-κB及Bcl-2等多个通路或分子, 直接或间接促进细胞恶性转化、凋亡抵抗、运动和新生血供生成, 利于肿瘤细胞的播散及在远端靶器官的增殖和生存[24-28]. 因此, Bmi-1通过直接或间接调控作用, 参与了细胞的永生、增殖、血管生成、运动及侵袭转移等和肿瘤恶性进展相关的诸多环节, 是阻断肿瘤恶性进展极具发展前景的重要分子靶点.
目前, 关于Bmi-1和肝癌发生发展关系的研究还不是很多, 但这些研究结果却存在较大的争议. Effendi等[10]通过免疫组织化学方法检测Bmi-1蛋白在122例肝癌标本中的表达情况, 结果发现: Bmi-1蛋白在早期和高分化肝癌中高表达, 在晚期和低分化肝癌中低表达, 在癌旁组织中不表达. Bmi-1的表达与临床病理分级(包括肿瘤大小、门静脉侵犯、肝外转移)无关. 对肝癌标本的实时定量PCR检测结果和上述结果相似. 通过对5种肝癌细胞株进行实时定量PCR和Western blot分析发现, Bmi-1在这5种肝癌细胞株中高表达, 在分化程度最高的细胞株中表达最高. 这些结果说明Bmi-1在早期肝癌发生中发挥着重要作用, 与肝癌恶性进展无关. 而这些结果与Sasaki等[11]的研究结果相矛盾. Sasaki等也采用免疫组织化学方法检测了Bmi-1蛋白在27例肝癌和14例癌前病变中表达情况, 结果发现, Bmi-1在低分化肝癌中高表达, 在高分化肝癌中低表达, 在癌前病变中未见表达. Bmi-1在伴有血管侵犯的肝癌中的表达明显高于无血管侵犯的肝癌中的表达. 通过对肝癌标本中细胞周期蛋白A检测发现, Bmi-1与癌细胞的增殖能力相关. 下调肝癌细胞株中Bmi-1的表达, 细胞的增殖能力下降. 这些结果说明Bmi-1参与了癌前病变的恶性进展及肝癌细胞的增殖、血管侵犯等生物学行为. Glinsky等[29]的研究表明Bmi-1的高表达与明显的转移倾向明显相关.
那么, Bmi-1是否与肝癌的侵袭转移等恶性生物学行为相关呢? 为探讨这个问题, 本实验设计并合成了针对Bmi-1基因的siRNA, 将其转染入高转移能力的肝癌细胞株MHCC97-H中, 来研究下调Bmi-1的表达后是否可以减弱高转移性MHCC97-H的侵袭迁移能力. Transwell小室模型是研究肿瘤细胞侵袭迁移的经典体外实验方法, 他可以模拟肿瘤细胞降解局部细胞外基质和穿过基膜的侵袭迁移过程. 荧光实时定量PCR和Western blot检测结果显示, Bmi-1在mRNA水平及蛋白水平被抑制, 说明通过siRNA转染可成功沉默Bmi-1. 然后, 通过Transwell小室侵袭、迁移模型检验沉默Bmi-1后MHCC97-H细胞侵袭、迁移能力的变化, 结果发现, 与对照组相比, 下调Bmi-1基因后高转移的MHCC97-H细胞侵袭、迁移能力明显下降, 说明Bmi-1与肝癌的恶性生物学行为有关.
总之, 我们的研究说明Bmi-1在肝癌的侵袭迁移恶性生物学行为中有重要作用. 下调Bmi-1的表达, 可以明显抑制肝癌细胞系MHCC97-H细胞的侵袭、迁移能力. 但是, Bmi-1基因在肝癌中发生发展中的作用, 及其在侵袭迁移中的作用机制及调控网络尚需进一步的研究. 我们相信这些研究将为临床治疗肝癌提供新的依据.
肝癌的侵袭转移是肝癌患者术后死亡的重要原因之一. 阐明肝癌侵袭转移的分子机制并发现重要的防治靶点具有重要的理论和实践意义. RNA干扰(RNAi)技术能针对目的基因表达进行高效、特异性的阻断, 因其简便、快速、经济, 目前已成为探寻肿瘤相关基因功能的一个重要方法.
李淑德, 主任医师, 教授, 中国人民解放军第二军医大学长海医院消化内科
RNAi最直接的应用就是利用其特异性降解靶基因mRNA的特点, 从而进行基因表达缺失的功能研究. Bmi-1 的高表达与乳腺癌、肺癌、胰腺癌等多种肿瘤的发生发展关系密切.
Effendi等的研究表明Bmi-1主要表达在早期和高分化肝癌中, Bmi-1的表达与肝癌的恶性进展无关. 而Sasaki等的研究表明Bmi-1主要表达在低分化肝癌中, Bmi-1的表达与肝癌的病理分级和肿瘤细胞增殖、血管侵犯行为密切相关.
本研究发现体外合成的siRNA可以有效降解肝癌细胞MHCC97-H中Bmi-1 mRNA和蛋白水平上的表达, 为进一步研究Bmi-1在肝癌发生发展过程中的作用奠定了基础.
本研究发现体外合成的siRNA可以有效降解肝癌细胞MHCC97-H中Bmi-1 mRNA和蛋白水平上的表达, 可以降低肝癌细胞侵袭转移能力, 这为今后肝癌侵袭转移的治疗提供了新的靶点.
本文研究siRNA转染沉默Bmi-1基因对肝癌细胞侵袭转移能力的影响, 立题新颖, 所采用技术先进, 方法得当, 数据可信, 为肝癌的治疗提供了理论基础和指导意义.
编辑: 曹丽鸥 电编:闫晋利
| 1. | Haupt Y, Alexander WS, Barri G, Klinken SP, Adams JM. Novel zinc finger gene implicated as myc collaborator by retrovirally accelerated lymphomagenesis in E mu-myc transgenic mice. Cell. 1991;65:753-763. [PubMed] [DOI] |
| 2. | Park IK, Morrison SJ, Clarke MF. Bmi1, stem cells, and senescence regulation. J Clin Invest. 2004;113:175-179. [PubMed] |
| 3. | Jiang L, Li J, Song L. Bmi-1, stem cells and cancer. Acta Biochim Biophys Sin (Shanghai). 2009;41:527-534. [PubMed] [DOI] |
| 4. | Arnes JB, Collett K, Akslen LA. Independent prognostic value of the basal-like phenotype of breast cancer and associations with EGFR and candidate stem cell marker BMI-1. Histopathology. 2008;52:370-380. [PubMed] [DOI] |
| 5. | Vrzalikova K, Skarda J, Ehrmann J, Murray PG, Fridman E, Kopolovic J, Knizetova P, Hajduch M, Klein J, Kolek V. Prognostic value of Bmi-1oncoprotein expression in NSCLC patients: a tissue microarray study. J Cancer Res Clin Oncol. 2008;134:1037-1042. [PubMed] [DOI] |
| 6. | Song W, Tao K, Li H, Jin C, Song Z, Li J, Shi H, Li X, Dang Z, Dou K. Bmi-1is related to proliferation, survival and poor prognosis in pancreatic cancer. Cancer Sci. 2010;101:1754-1760. [PubMed] [DOI] |
| 7. | Neo SY, Leow CK, Vega VB, Long PM, Islam AF, Lai PB, Liu ET, Ren EC. Identification of discriminators of hepatoma by gene expression profiling using a minimal dataset approach. Hepatology. 2004;39:944-953. [PubMed] [DOI] |
| 8. | Ma S, Chan KW, Hu L, Lee TK, Wo JY, Ng IO, Zheng BJ, Guan XY. Identification and characterization of tumorigenic liver cancer stem/progenitor cells. Gastroenterology. 2007;132:2542-2556. [PubMed] [DOI] |
| 9. | Wang H, Pan K, Zhang HK, Weng DS, Zhou J, Li JJ, Huang W, Song HF, Chen MS, Xia JC. Increased polycomb-group oncogene Bmi-1expression correlates with poor prognosis in hepatocellular carcinoma. J Cancer Res Clin Oncol. 2008;134:535-541. [PubMed] [DOI] |
| 10. | Effendi K, Mori T, Komuta M, Masugi Y, Du W, Sakamoto M. Bmi-1gene is upregulated in early-stage hepatocellular carcinoma and correlates with ATP-binding cassette transporter B1 expression. Cancer Sci. 2010;101:666-672. [PubMed] [DOI] |
| 11. | Sasaki M, Ikeda H, Itatsu K, Yamaguchi J, Sawada S, Minato H, Ohta T, Nakanuma Y. The overexpression of polycomb group proteins Bmi1 and EZH2 is associated with the progression and aggressive biological behavior of hepatocellular carcinoma. Lab Invest. 2008;88:873-882. [PubMed] [DOI] |
| 12. | Ye QH, Qin LX, Forgues M, He P, Kim JW, Peng AC, Simon R, Li Y, Robles AI, Chen Y. Predicting hepatitis B virus-positive metastatic hepatocellular carcinomas using gene expression profiling and supervised machine learning. Nat Med. 2003;9:416-423. [PubMed] [DOI] |
| 13. | Qin ZK, Yang JA, Ye YL, Zhang X, Xu LH, Zhou FJ, Han H, Liu ZW, Song LB, Zeng MS. Expression of Bmi-1is a prognostic marker in bladder cancer. BMC Cancer. 2009;9:61. [PubMed] [DOI] |
| 14. | Cooper CS, Foster CS. Concepts of epigenetics in prostate cancer development. Br J Cancer. 2009;100:240-245. [PubMed] [DOI] |
| 15. | Häyry V, Tynninen O, Haapasalo HK, Wölfer J, Paulus W, Hasselblatt M, Sariola H, Paetau A, Sarna S, Niemelä M. Stem cell protein Bmi-1is an independent marker for poor prognosis in oligodendroglial tumours. Neuropathol Appl Neurobiol. 2008;34:555-563. [PubMed] [DOI] |
| 16. | Tirabosco R, De Maglio G, Skrap M, Falconieri G, Pizzolitto S. Expression of the Polycomb-Group protein BMI1 and correlation with p16 in astrocytomas an immunohistochemical study on 80 cases. Pathol Res Pract. 2008;204:625-631. [PubMed] [DOI] |
| 17. | Dimri GP, Martinez JL, Jacobs JJ, Keblusek P, Itahana K, Van Lohuizen M, Campisi J, Wazer DE, Band V. The Bmi-1 oncogene induces telomerase activity and immortalizes human mammary epithelial cells. Cancer Res. 2002;62:4736-4745. [PubMed] |
| 18. | Song LB, Zeng MS, Liao WT, Zhang L, Mo HY, Liu WL, Shao JY, Wu QL, Li MZ, Xia YF. Bmi-1 is a novel molecular marker of nasopharyngeal carcinoma progression and immortalizes primary human nasopharyngeal epithelial cells. Cancer Res. 2006;66:6225-6232. [PubMed] [DOI] |
| 19. | Sparmann A, van Lohuizen M. Polycomb silencers control cell fate, development and cancer. Nat Rev Cancer. 2006;6:846-856. [PubMed] [DOI] |
| 20. | Liu S, Dontu G, Mantle ID, Patel S, Ahn NS, Jackson KW, Suri P, Wicha MS. Hedgehog signaling and Bmi-1 regulate self-renewal of normal and malignant human mammary stem cells. Cancer Res. 2006;66:6063-6071. [PubMed] [DOI] |
| 21. | Chiba T, Zheng YW, Kita K, Yokosuka O, Saisho H, Onodera M, Miyoshi H, Nakano M, Zen Y, Nakanuma Y. Enhanced self-renewal capability in hepatic stem/progenitor cells drives cancer initiation. Gastroenterology. 2007;133:937-950. [PubMed] [DOI] |
| 22. | Chiba T, Miyagi S, Saraya A, Aoki R, Seki A, Morita Y, Yonemitsu Y, Yokosuka O, Taniguchi H, Nakauchi H. The polycomb gene product BMI1 contributes to the maintenance of tumor-initiating side population cells in hepatocellular carcinoma. Cancer Res. 2008;68:7742-7749. [PubMed] [DOI] |
| 23. | Song LB, Li J, Liao WT, Feng Y, Yu CP, Hu LJ, Kong QL, Xu LH, Zhang X, Liu WL. The polycomb group protein Bmi-1 represses the tumor suppressor PTEN and induces epithelial-mesenchymal transition in human nasopharyngeal epithelial cells. J Clin Invest. 2009;119:3626-3636. [PubMed] [DOI] |
| 24. | Xiao J, Deng C. Knockdown of Bmi-1 impairs growth and invasiveness of human gastric carcinoma cells. Oncol Res. 2009;17:613-620. [PubMed] [DOI] |
| 25. | Hoenerhoff MJ, Chu I, Barkan D, Liu ZY, Datta S, Dimri GP, Green JE. BMI1 cooperates with H-RAS to induce an aggressive breast cancer phenotype with brain metastases. Oncogene. 2009;28:3022-3032. [PubMed] [DOI] |
| 26. | Liu J, Cao L, Chen J, Song S, Lee IH, Quijano C, Liu H, Keyvanfar K, Chen H, Cao LY. Bmi1 regulates mitochondrial function and the DNA damage response pathway. Nature. 2009;459:387-392. [PubMed] [DOI] |
| 27. | Qin L, Zhang X, Zhang L, Feng Y, Weng GX, Li MZ, Kong QL, Qian CN, Zeng YX, Zeng MS. Downregulation of BMI-1 enhances 5-fluorouracil-induced apoptosis in nasopharyngeal carcinoma cells. Biochem Biophys Res Commun. 2008;371:531-535. [PubMed] [DOI] |
| 28. | Wang Q, Li WL, You P, Su J, Zhu MH, Xie DF, Zhu HY, He ZY, Li JX, Ding XY. Oncoprotein BMI-1 induces the malignant transformation of HaCaT cells. J Cell Biochem. 2009;106:16-24. [PubMed] [DOI] |
| 29. | Glinsky GV, Berezovska O, Glinskii AB. Microarray analysis identifies a death-from-cancer signature predicting therapy failure in patients with multiple types of cancer. J Clin Invest. 2005;115:1503-1521. [PubMed] [DOI] |