修回日期: 2011-10-30
接受日期: 2011-11-04
在线出版日期: 2011-11-28
目的: 探讨NF-κB、HMGB1在SAP大鼠肠黏膜损伤发生发展过程中的时点表达规律及其意义.
方法: 将70只SD大鼠随机分为A组(n = 40)和S组(n = 30), 再分别按3、6、12、24、36 h时点随机均等分成5个亚组. A组大鼠行逆行胰胆管匀速泵入5%牛磺胆酸钠建立SAP模型, S组大鼠开腹仅翻动十二指肠. 两组大鼠均在建模后按时点开腹, 门静脉取血检测AMY、DAO浓度, ELISA法和免疫组化法检测小肠黏膜NF-κB和HMGB1的表达.
结果: (1)A组大鼠血DAO浓度随时点延迟逐渐增加; (2)肠黏膜NF-κB表达在3 h最高, 随时点延迟逐渐下降, 24 h、36 h降至正常水平; (3)肠黏膜HMGB1表达6 h开始明显升高, 且随时点延迟逐渐增高, 在24 h最高, 一直持续到36 h仍然保持在较高水平.
结论: (1)SAP大鼠早期即出现肠黏膜损伤; (2)SAP肠黏膜早期的损伤可能与小肠组织NF-κB的表达增加有关; (3)HMGB1作为"晚期"炎症介质可能介导了SAP肠黏膜损伤的发生发展; (4)HMGB1的调控可能受到了NF-κB的调节.
引文著录: 卿伯华, 曾之耀, 王湘英, 骆永富, 李振华, 张兴文, 卢义展. NF-κB、HMGB1在重症急性胰腺炎肠黏膜损伤中的时点表达及其意义. 世界华人消化杂志 2011; 19(33): 3390-3396
Revised: October 30, 2011
Accepted: November 4, 2011
Published online: November 28, 2011
AIM: To evaluate the significance of temporal expression of NF-κB and HMGB1 in intestinal mucosal injury in rats with severe acute pancreatitis (SAP).
METHODS: Seventy SD rats were randomly divided into two groups: A (n = 40) and S (n = 30). The two groups were divided into five subgroups for testing at 3, 6, 12, 24, and 36 h. Group A was used to induce SAP by retrograde injection of 5% sodium taurocholate into the biliopancreatic duct, while group S underwent a sham operation. At various time points, serum and intestinal samples were taken to measure serum concentrations of AMY and DAO by ELISA and to detect the expression of NF-κB and HMGB1 in the intestine by immunohistochemistry.
RESULTS: Serum concentrations of DAO increased with the aggravation of SAP. The expression of NF-κB in intestine mucosal injury reached the peak at 3 h, gradually decreased over time, and returned to normal level at 24 h and 36 h. The expression of HMGB1 in intestinal mucosal injury significantly increased at 6 h, gradually increased over time, reached the highest level at 24 h, and remained at a high level at 36 h.
CONCLUSION: Intestinal mucosal injury occurs in the early stage of SAP. Intestinal mucosal injury in SAP may be related with the high expression of NF-κB in the small intestinal. HMGB1 as a "late" inflammatory mediator may be involved in the development of SAP-associated intestinal mucosal injury.
- Citation: Qing BH, Zeng ZY, Wang XY, Luo YF, Li ZH, Zhang XW, Lu YZ. Significance of temporal expression of NF-κB and HMGB1 in intestinal mucosal injury in rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2011; 19(33): 3390-3396
- URL: https://www.wjgnet.com/1009-3079/full/v19/i33/3390.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i33.3390
重症急性胰腺炎(severe acute pancreatitis, SAP)是一种发病率高、病情重、发病机制复杂的急腹症, 死亡率达20%-30%[1,2]. 肠道是SAP发生应激反应的中心器官之一[3]. SAP容易发生肠黏膜损伤(intestinal mucosal damage), 使SAP并发肠源性感染, 诱发和加重全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)、多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS), 且病死率居高不下的症结所在[4]. 目前, 对于SAP时并发肠黏膜损伤的发生机制尚不明确, 控制SAP肠黏膜损伤的发生发展, 对改善SAP预后至关重要.
研究报道[5], 核因子-κB(nuclear factor-kappa B, NF-κB)属于前炎性转录因子, 在SAP发病的早期即被激活, 在SAP的发生、发展以及由此引起的SIRS、MODS中起着关键性作用, 他可能是作为SAP中细胞因子级联瀑布反应的上游靶点, 进而在SAP整个复杂的细胞因子调控网络中起枢纽性作用. 进一步研究发现[6], 高迁移率族蛋白1(high mobility group box protein 1, HMGB1)由于产生明显晚于TNF-α, IL-1等"早期"炎性介质, 且持续时间较长, 因而被称为"晚期"炎症介质, 参与SAP全身炎症反应综合征和脓毒症的病理过程. 然而, 目前NF-κB、HMGB1在SAP肠黏膜损伤病程中的作用机制尚不明确, 若同时检测NF-κB和HMGB1的动态变化, 将为SAP肠黏膜损伤的研究提供新的思路和方法, 有助于全面了解NF-κB和HMGB1在SAP肠黏膜损伤发生、发展过程中的作用, 为临床进一步研究SAP肠黏膜损伤的防治提供理论依据和实验基础.
健康SD大鼠70只, 清洁级, 雌雄不拘, 体质量250-300 g, 湖南农业大学动物实验中心提供, 许可证编号SCXK(湘)2006-0001. Rabbit Anti-HMGB1、Rabbit Anti-NF-κB、Rat DAO ELISA KiT、Rat HMGB1 ELISA KiT、Rat NF-κB ELISA KiT均购自武汉博士德生物工程有限公司.
1.2.1 分组: 70只SD大鼠, 随机(抽签法)分成A组(实验组, SAP组, n = 40)和S组(假手术组, SO组, n = 30). A组和S组再分别按3、6、12、24、36 h时点随机均等分成5个时点组, A组和S组各时点组大鼠数量分别为8只、6只.
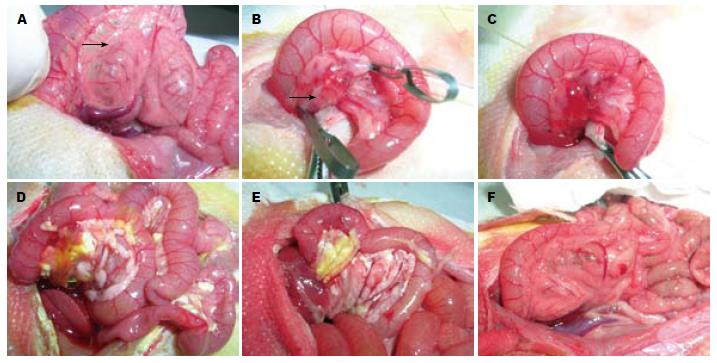
1.2.2 造模: (1)SAP组模型建立: 建模前禁食12 h, 禁饮4 h, 采用10%水合氯醛腹腔注射(0.3 mL/100 g)麻醉, 腹部手术视野剪毛, 2%络合碘消毒, 铺无菌孔巾, 取上腹正中线切口, 长约3 cm, 依次切开进入腹腔. 入腹后沿胰胆管向十二指肠方向找到十二指肠乳头开口, 1号注射器针头于乳头对侧十二指肠壁无血管区刺一小孔, 将处理消毒后的硬膜外导管沿十二指肠刺孔经乳头开口置入胰胆管内约0.5 cm, 显微血管夹2枚分别夹闭肝门部胆管与胰胆管末端, 匀速泵入5%的牛磺胆酸钠, 0.1 mL/100 g, 速度0.2 mL/min, 3 min后可见胰腺区弥漫性充血肿胀, 观察8 min后松开血管夹并拔管, 8-0无损伤缝线缝合十二指肠穿刺孔, 关腹(图1A-E). (2)SO组模型建立: 假手术组大鼠开腹仅翻动十二指肠, 关腹(图1F).
1.2.3 标本采集: A、S两组大鼠均在建模后按3 h、6 h、12 h、24 h、36 h时点剖腹, 观察腹腔及胰腺大体情况; 门静脉收集血液, 切取胰腺组织和距回盲部约5 cm处小肠一段.
1.2.4 指标检测: (1)全自动生化检测仪检测血AMY; (2)酶联免疫吸附法(ELISA法)检测血DAO; (3)酶联免疫吸附法(ELISA法)检测小肠组织NF-κB和HMGB1浓度. 取距回盲瓣5 cm处的一段小肠组织, 纵型剪开, 用冰生理盐水漂洗干净, 用滤纸吸干, 准确称取0.1 g小肠组织, 用组织剪将其剪成碎片, 加入1 mL冰生理盐水, 在冰水浴中用玻璃匀浆器充分研磨6-8 min, 制成10%匀浆液, 于4 ℃离心机中, 4 000 r/min离心10 min, 提取上清液分别置入2个EP管中(0.25 mL/管), -20 ℃低温冰箱保存; (4)免疫组化法(SP法)检测小肠黏膜NF-κB、HMGB的表达. 石蜡切片经脱蜡, 80 ℃恒温箱中烘烤, 二甲苯中浸泡, 梯度酒精水化, 3%H2O2室温孵育10 min, 0.01 mol/L枸橼酸钠缓冲溶液(pH6.0)抗原修复, 加入正常血清封闭液孵育30 min后, 再滴加一抗(1:100)兔抗大鼠50 μL, 室温静置2 h, 再加入生物素标记山羊抗兔IgG二抗50 μL, 再滴加辣根酶标记链霉卵白素工作液覆盖, DAB显色, 苏木精复染, 1%盐酸酒精分化, 95%酒精脱水, 恒温箱烘干, 镜检. 用PBS代替一抗为阴性对照.
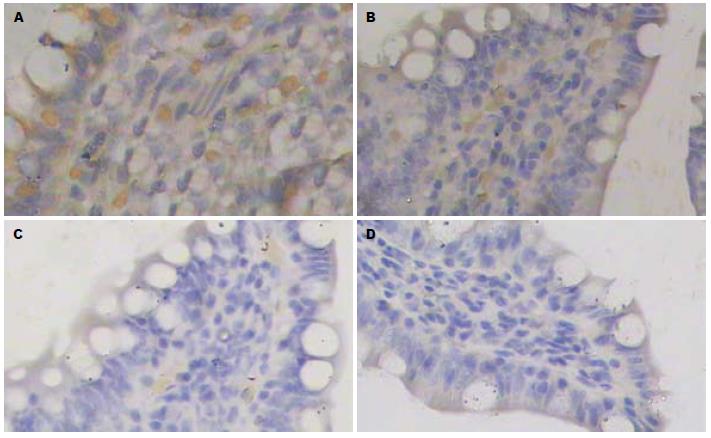
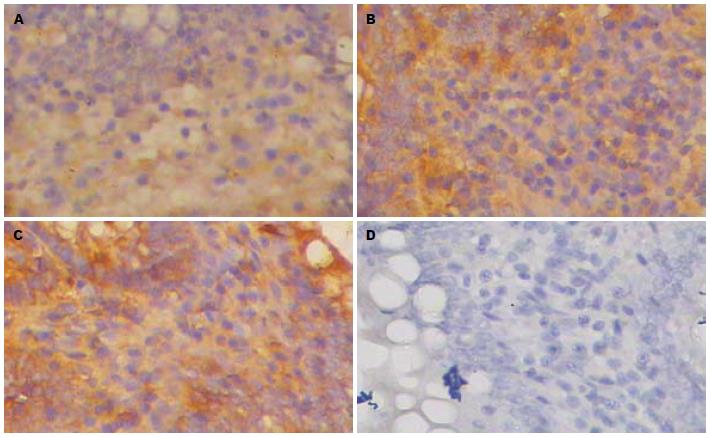
之后, NF-κB显微镜观察, 若为阳性, 棕黄色表达于细胞核内, 少量表达在细胞质; 若为阴性, 细胞核和细胞质均为蓝色(图2). HMGB1显微镜观察, 若为阳性, 棕黄色表达于胞浆, 少量表达细胞核内; 若为阴性, 细胞核和细胞质均为蓝色(图3).
使用美国Image proplus 6.0专业图像分析软件进行分析, 每个时点组各张切片高倍镜下(400倍)随机取5个视野, 按照双盲法原则由病理医师指导在光镜下观察阳性表达的情况, 取平均值作为结果做半定量分析. 小肠黏膜细胞NF-κBp65的阳性表达采用测定阳性细胞数(N); 小肠黏膜细胞HMGB1的阳性表达采用测定阳性染色部位的累积吸光度(IA), 即将图片上每个阳性染色部位的像素点的强度值全部累加起来得到的值.
统计学处理 实验数据以mean±SD表示, 采用SPSS13.0统计软件对各组数据进行统计学处理. 随机设计资料的多个样本均数比较及样本均数间多重比较采用One-Way ANOVA分析, 两因素相关分析采用Person法; P<0.05表示统计学差异.
A组大鼠各时点组血AMY浓度均高于相应的S组各时点组. 血AMY浓度, 有统计学差异(P<0.05), 且浓度在3 h时点开始升高, 24 h时点达到最高, 36 h时点仍在较高水平(表1).
| 时间点 | 分组 | 血淀粉酶(U/L) | DAO(U/mL) | NF-κB | HMGB1 |
| 3 h | A组 | 4102.06±1513.98a | 0.14±0.02 | 8.88±0.29a | 0.42±0.026 |
| S 组 | 1617.10±320.82 | 0.14±0.011 | 3.36±0.23 | 0.42±0.06 | |
| 6 h | A组 | 7610.88±4068.27a | 0.245±0.05a | 6.01±0.52a | 0.58±0.04a |
| S 组 | 1782.96±433.34 | 0.14±0.021 | 3.26±0.22 | 0.40±0.03 | |
| 12 h | A组 | 8005.88±2089.58a | 0.32±0.05a | 4.26±0.26a | 0.62±0.05a |
| S 组 | 1886.26±463.62 | 0.15±0.03 | 3.27±0.16 | 0.42±0.04 | |
| 24 h | A组 | 10525.15±3000.21a | 0.63±0.14a | 3.39±0.16 | 0.76±0.06a |
| S 组 | 1613.90±99.44 | 0.14±0.01 | 3.22±0.17 | 0.41±0.03 | |
| 36 h | A组 | 7290.46±1231.47a | 0.58±0.09a | 3.35±0.24 | 0.70±0.07a |
| S 组 | 1608.71±349.33 | 0.14±0.02 | 3.19±0.15 | 0.39±0.01 |
A组大鼠3 h时点血浆DAO浓度与相应的S组同时点血浆DAO浓度比较, 无统计学差异(P>0.05), 其余各时点血浆DAO浓度均高于相应的S组同时点血浆DAO浓度, 有统计学差异(P<0.05). A组大鼠血浆DAO浓度在6 h时点开始升高, 随时点延迟逐渐升高, 36 h时点仍处于较高水平(表1).
正常肠黏膜屏障包括机械屏障、化学屏障、生物屏障和免疫屏障[7]. 肠道是人体最大的"贮菌库", 正常肠道内细菌种类达500种以上, 主要为需氧菌和兼性菌, 95%以厌氧菌为主, 末端回肠和结肠细菌较多. 肠黏膜不仅是人体营养物质消化、吸收的重要场所, 同时也是致病微生物和毒素侵入的主要门户. 肠黏膜屏障功能障碍(intestinal mucosal barrier dysfunction, IBD)是指各种原因引起的肠黏膜损伤、肠通透性增加, 使肠道防止肠腔内有害物质进入体内其他组织器官和血液循环的功能被破坏, 从而导致细菌和(或)内毒素移位[8]. Banks等[9]利用糖分子探针对SAP患者肠通透性进行研究, 表明SAP肠通透性明显增加, 存在肠屏障功能障碍. SAP时肠黏膜屏障功能障碍的直接危害是肠道细菌移位导致胰腺坏死组织及其他远隔脏器感染, 而间接危害是肠道细菌、内毒素进入体循环导致肠源性内毒素血症, 刺激已经活化的单核和巨噬细胞释放过量的细胞因子和炎性介质, 促使SIRS的发生, 对胰腺等脏器构成严重的"第二次打击", 甚至诱发和加重MODS, 导致较高死亡率[10].
血浆二胺氧化酶(diamine oxidase, DAO)是特异性存在于哺乳动物肠黏膜上皮细胞的细胞质中, 具有高度活性的细胞内酶, 在小肠黏膜上皮层绒毛中含量高、活性强. 正常情况下DAO不会出现在血浆中, 只有当肠黏膜上皮细胞受损, 细胞内的DAO释放进入组织间隙、淋巴管和血循环, 使血中DAO含量升高. 因此, 外周血的DAO活性稳定, 血液DAO含量可客观反映肠黏膜结构完整性, 而肠黏膜结构的破坏是发生肠黏膜屏障功能障碍的基础, 故检测血液DAO也可间接反映肠黏膜屏障功能. 动物实验证实[11], 血浆DAO活性的升高和降低, 与病理检查证实的肠黏膜结构的破坏与恢复是一致的. 黄晓曦等[12]临床研究53例危重病患者中, 提示存在肠黏膜屏障功能障碍的患者血浆DAO增高. 这与我们前期的研究结果相吻合[13]. 动态监测血中DAO活性的改变,可准确了解早期肠黏膜屏障功能的变化, 有望应用于临床[14]. 本实验研究中A组大鼠血DAO浓度6 h时点与S组同时点比较, 有统计学差异, 随时点的延迟逐渐升高, 提示SAP模型建立后6 h时点即开始出现明显的肠黏膜受损, 且随时点的延迟, 逐渐加重.
NF-κB是Sen等[15]1986年首次在成熟B细胞、浆细胞中发现的能与免疫球蛋白K轻链启动子KB序列特异结合的一种高度保守的免疫反应性蛋白. 现已发现5种蛋白属于NF-κB/Rel家族, 根据C末端序列的不同可分为2大类, 一类包括cRel A(P65)、cRel B和c-Rel; 另一类包括P50(NF-κBl)和P65(NF-κB2). 我们通常所说的NF-κB通常指NF-κB P65, 他在细胞内含量最多, 是其活性的主要形式. NF-κB是具有基因转录调节作用的蛋白质因子, 参与许多炎性因子的调控. 在未受刺激时, 细胞质中的NF-κB与抑制因子I-κB结合处于非活化状态, 受到刺激时, I-κB与NF-κB解离, NF-κB进入细胞核与特异的启动子结合, 调节基因表达. 而NF-κB的不适当激活是引起过度炎症反应及炎症损伤的关键因素, 从而可加重急性炎症反应, NF-κB激活后,可刺激TNF-α、IL-1的产生, 这些蛋白的增多又促进NF-κB 的活化. 在SAP中, 无论是胰腺组织还是胰外脏器, NF-κB均明显被激活, 这说明NF-κB在其中起着至关重要的作用. 但目前NF-κB对于SAP肠黏膜屏障功能障碍损伤的具体机制尚不明确.
Wang等[16]证实, SAP时大鼠肠黏膜细胞的NF-κB P65表达升高, 给予NF-κB激活的抑制剂, 代表肠黏膜屏障功能的指标血DAO降低, 肠黏膜屏障功能障碍损害减轻, 提示NF-κB介导了SAP肠黏膜屏障功能障碍的发生发展. 本组资料从定量和半定量检测SAP大鼠小肠组织NF-κB的表达, 显示SAP大鼠小肠组织NF-κB的表达3 h时点达到高峰, 6 h时点开始降低, 12 h时点降至较低水平, 24 h、36 h时点降至正常水平. 结合我们血DAO检测结果: A组大鼠6 h时点才开始出现明显的肠黏膜功能受损, 随着时点的延迟, 其肠黏膜的受损程度逐渐增加. 基于以上事实, 提示: (1)SAP大鼠肠黏膜NF-κB表达的增加早于肠黏膜屏障功能的明显损伤; (2)SAP肠黏膜屏障功能早期的损伤可能与小肠肠黏膜NF-κB的表达增加有关.
1973年, Goodwin等[17]在牛胸腺中首次提取鉴定了一种含量丰富的非组蛋白核蛋白, 该蛋白分子量30 kDa左右, 富含电荷, 并因其在聚丙烯酰胺凝胶电泳中迁移率快的特性而命名为高迁移率族蛋白(high mobility group, HMG). 随后研究发现HMG是一个大家族, HMG包括HMGA、HMGB、HMGN家族, HMGB又可分为HMGB1及HMGB2. HMGB1作为HMGB家族的一个亚族, 是含量最丰富的HMG蛋白, 平均10-15个核小体中含有一个HMGB1分子. HMGB1广泛存在于各种细胞中, 在一般环境条件下, HMGB1的表达量维持在基础水平, 而HMGB2一般只在胚胎期才大量表达, 部位也比较局限.
HMGB1曾经作为一种转录因子和促生长因子而被广泛研究. 然而, 近年来研究表明, HMGB1在感染性脓毒血症、败血症和烧伤等情况下, 作为"晚期"炎症介质在循环和组织中显示出延迟和高水平表达, 以一种时间-剂量依赖方式释放, 可明显影响肝、肺、肠等重要器官的功能, 并可与其他重要的炎性细胞因子如TNF-α和IL-1等相互诱生, 是内毒素血症致死效应的重要细胞介质, 参与了脓毒症、SIRS及MODS的发生、发展过程[18,19].
我们的实验研究, 采用定量和半定量检测SAP大鼠小肠组织HMGB1的表达, 显示A组大鼠3 h时点小肠组织HMGB1浓度与S组同时点比较(P>0.05), 随着病程延长, SAP大鼠小肠组织HMGB1的表达强度不断升高, 6 h时点即开始明显升高, 在24 h时点达到高峰, 一直持续到36 h时点. 由此认为, HMGB1可能作为"晚期"炎症介质呈时间-剂量依赖性地增加肠黏膜上皮的损伤, 参与了SAP肠黏屏障功能障碍的病理过程. 其机制可能为: HMGB1以及B box能以一种时间剂量方式, 通过增加Caco-2人肠上皮细胞诱生一氧化氮合成酶(iNOS)mRNA的表达以及NO的合成, 从而增加该细胞的通透性, 对野生型小鼠给予B盒可增加回肠黏膜的通透性, 并使肠道细菌移位至肠系膜淋巴结[20], 该效应在iNOS基因敲除的小鼠中则不能观察到, 表明HMGB1和HMGB1 B盒都能通过依赖于NO的生成, 引起肠屏障功能的变化. 结合我们实验中A组大鼠肠黏膜NF-κB表达3 h即达到高峰, 12 h时点降至正常水平, 而HMGB1表达在6 h时点才开始明显升高, 24 h时点达到高峰, 一直持续到36 h时点. 由此衍生开来: NF-κB可能作为重要的前炎性转录因子, 参与了HMGB1的调控, 可能是SAP肠黏膜屏障功能损伤的上游因子. 因此, 笔者认为, 如能"早期"及时选用特异性的NF-κB抑制剂抑制NF-κB的活化, 而"晚期"选用HMGB1抑制剂抑制HMGB1的活化, 则有可能可以阻断"早期"与"晚期"炎症介质的相互诱导, 必定可以减轻SAP的病情进展, 降低胰腺炎对机体所造成的损害, 从而改善SAP肠黏膜屏障功能, 进而阻止SIRS、MODS的发生, 这将为今后SAP临床治疗肠黏膜屏障功能障碍提供了一条新的途径.
总之, SAP早期可引起肠黏膜受损, 破坏肠黏膜屏障结构的完整性, 从而引发肠道细菌及内毒素的易位, 发生肠源性感染, 进而导致SIRS、MODS, 严重影响病人的预后. 但是, 目前对于其发生机制尚不明确, 本实验初步探讨了SAP肠黏膜屏障损伤NF-κB、HMGB1不同时点的表达及其意义, 显示在SAP发生发展的病程中, NF-κB、HMGB1分别作为"早期"炎症介质和"晚期"炎症介质在SAP肠黏膜受损的不同病理阶段中起到了很重要的作用. 所以, 针对NF-κB、HMGB1靶向治疗的研究为临床不同阶段救治SAP肠黏膜损伤提供了新的治疗思路, 因而具有重要意义.
重症急性胰腺炎(severe acute pancreatitis, SAP)容易发生肠黏膜损伤. 目前对于SAP时并发肠黏膜损伤的发生机制尚不明确, 控制SAP肠黏膜损伤的发生发展, 对改善SAP预后至关重要.
施晓雷, 副主任医师, 南京大学医学院附属鼓楼医院肝胆外科
本研究同时检测NF-κB和HMGB1的动态变化, 有助于全面了解NF-κB和HMGB1在SAP肠黏膜损伤发生、发展过程中的作用, 为临床进一步研究SAP肠黏膜损伤的防治提供理论依据和实验基础.
肠黏膜屏障功能障碍(IBD): 指各种原因引起的肠黏膜损伤、肠通透性增加, 使肠道防止肠腔内有害物质进入体内其他组织器官和血液循环的功能被破坏, 从而导致细菌和(或)内毒素移位.
本研究同时检测了NF-κB和HMGB1在SAP肠黏膜损伤中的动态变化, 为临床上这一疾病的防治提供了一定的理论依据和实验基础, 有较好的意义.
编辑: 曹丽鸥 电编:闫晋利
| 1. | Gaisano HY, Gorelick FS. New insights into the mechanisms of pancreatitis. Gastroenterology. 2009;136:2040-2044. [PubMed] [DOI] |
| 2. | Warshaw AL. Improving the treatment of necrotizing pancreatitis--a step up. N Engl J Med. 2010;362:1535-1537. [PubMed] [DOI] |
| 3. | van Minnen LP, Blom M, Timmerman HM, Visser MR, Gooszen HG, Akkermans LM. The use of animal models to study bacterial translocation during acute pancreatitis. J Gastrointest Surg. 2007;11:682-689. [PubMed] [DOI] |
| 4. | Dervenis C, Smailis D, Hatzitheoklitos E. Bacterial translocation and its prevention in acute pancreatitis. J Hepatobiliary Pancreat Surg. 2003;10:415-418. [PubMed] [DOI] |
| 5. | Neurath MF, Becker C, Barbulescu K. Role of NF-kappaB in immune and inflammatory responses in the gut. Gut. 1998;43:856-860. [PubMed] [DOI] |
| 6. | Wang H, Bloom O, Zhang M, Vishnubhakat JM, Ombrellino M, Che J, Frazier A, Yang H, Ivanova S, Borovikova L. HMG-1 as a late mediator of endotoxin lethality in mice. Science. 1999;285:248-251. [PubMed] [DOI] |
| 8. | Balzan S, de Almeida Quadros C, de Cleva R, Zilberstein B, Cecconello I. Bacterial translocation: overview of mechanisms and clinical impact. J Gastroenterol Hepatol. 2007;22:464-471. [PubMed] [DOI] |
| 9. | Banks PA, Freeman ML. Practice guidelines in acute pancreatitis. Am J Gastroenterol. 2006;101:2379-2400. [PubMed] [DOI] |
| 14. | Kamei H, Hachisuka T, Nakao M, Takagi K. Quick recovery of serum diamine oxidase activity in patients undergoing total gastrectomy by oral enteral nutrition. Am J Surg. 2005;189:38-43. [PubMed] [DOI] |
| 15. | Sen R, Baltimore D. Multiple nuclear factors interact with the immunoglobulin enhancer sequences. Cell 1986. 46: 705-716. J Immunol. 2006;177:7485-7496. [PubMed] |
| 16. | Wang YL, Zheng YJ, Zhang ZP, Su JY, Lei RQ, Tang YQ, Zhang SD. Effects of gut barrier dysfunction and NF-kappaB activation on aggravating mechanism of severe acute pancreatitis. J Dig Dis. 2009;10:30-40. [PubMed] [DOI] |
| 17. | Goodwin GH, Sanders C, Johns EW. A new group of chromatin-associated proteins with a high content of acidic and basic amino acids. Eur J Biochem. 1973;38:14-19. [PubMed] [DOI] |
| 18. | Scaffidi P, Misteli T, Bianchi ME. Release of chromatin protein HMGB1 by necrotic cells triggers inflammation. Nature. 2002;418:191-195. [PubMed] [DOI] |
| 19. | Angus DC, Yang L, Kong L, Kellum JA, Delude RL, Tracey KJ, Weissfeld L. Circulating high-mobility group box 1 (HMGB1) concentrations are elevated in both uncomplicated pneumonia and pneumonia with severe sepsis. Crit Care Med. 2007;35:1061-1067. [PubMed] [DOI] |
| 20. | Sappington PL, Yang R, Yang H, Tracey KJ, Delude RL, Fink MP. HMGB1 B box increases the permeability of Caco-2 enterocytic monolayers and impairs intestinal barrier function in mice. Gastroenterology. 2002;123:790-802. [PubMed] [DOI] |