修回日期: 2011-08-22
接受日期: 2011-08-28
在线出版日期: 2011-09-28
目的: 比较术前联合放化疗联合手术与单纯手术对可切除食管癌患者的影响.
方法: 使用计算机及手工检索两种方法在Pubmed和Embase中搜索相关随机对照实验, 以确保无文献遗漏.
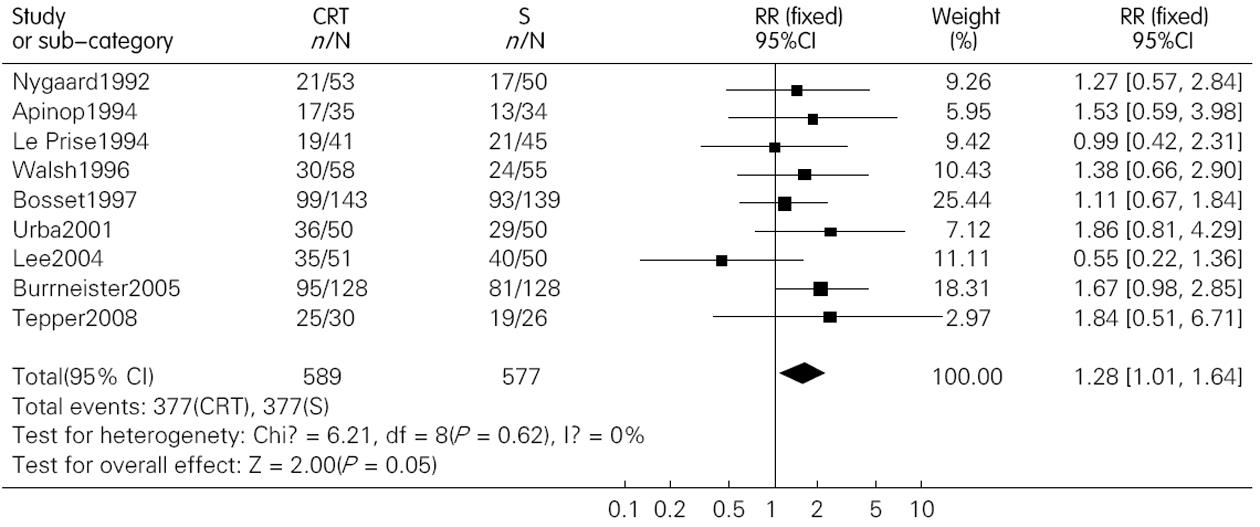
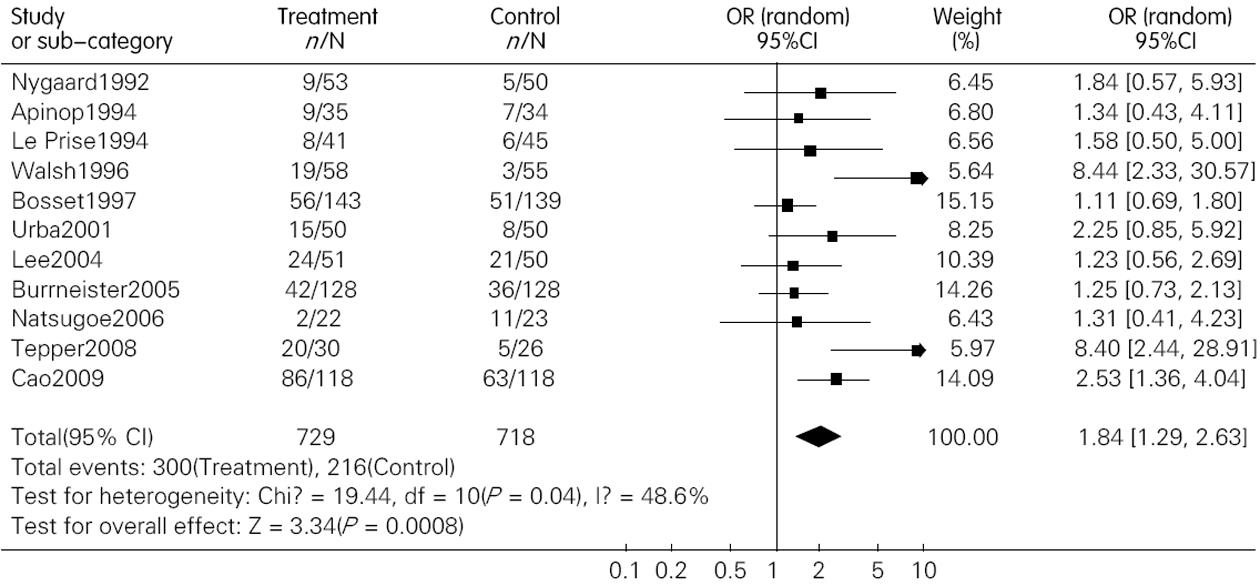
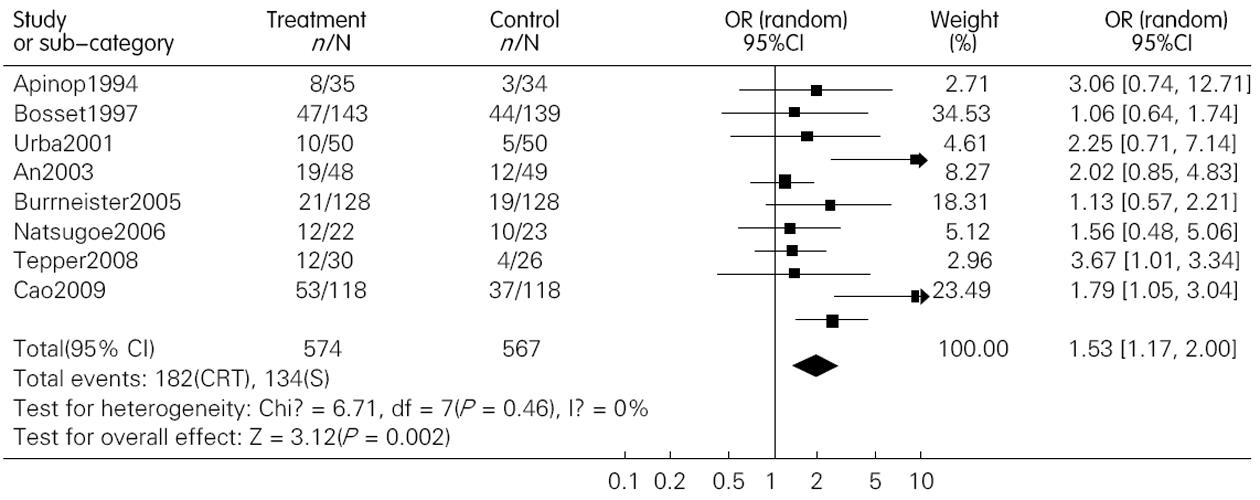
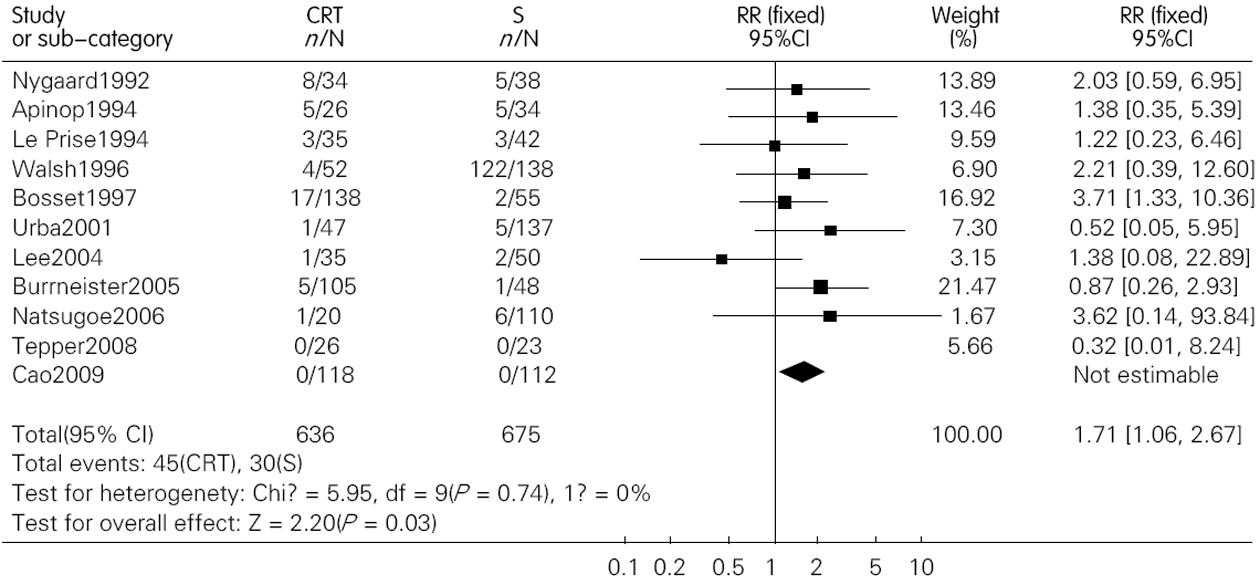
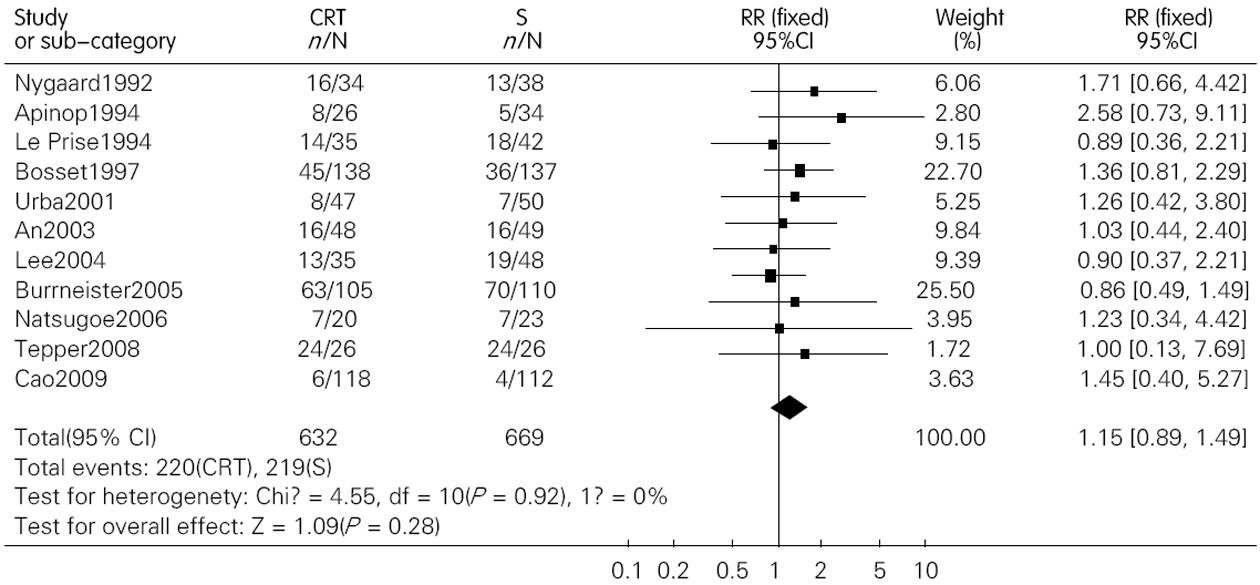
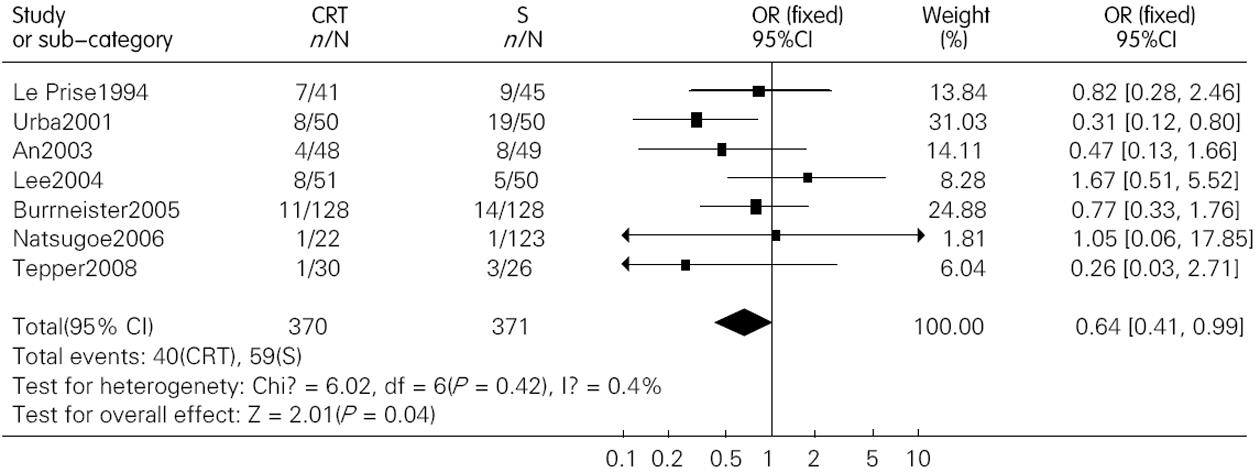
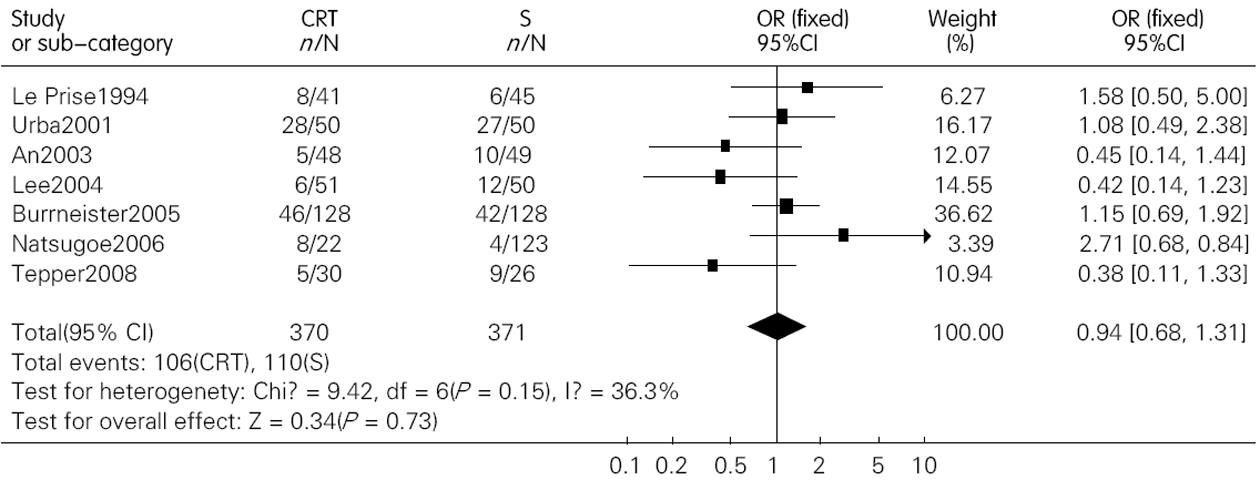
结果: 共纳入包含1 544名患者的12篇文献. 术前联合放化疗较单纯手术明显提高了患者的1年、3年和5年生存率, 其OR(95%CI, P值)分别为1.28(1.01-1.64, P = 0.05); 1.84(1.29-2.63, P = 0.00); 1.53(1.17-2.00, P = 0.00). 术前放化疗增加了术后死亡率, 但并不增加术后的并发症发生率, 其OR(95% CI; P值)分别为1.71(1.06-2.76, P = 0.03)和1.15(0.89-1.49, P = 0.28). 术前放化疗降低了肿瘤局部复发率, 但对远处转移无影响, 其对应的OR (95%CI, P值)分别为0.64(0.41-0.99, P = 0.04)和0.94(0.58-1.31, P = 0.73).
结论: 术前放化疗联合手术可显著改善食管癌患者的生存率, 值得临床应用推广.
引文著录: 金海林, 韩树堂, 李文杰, 吴大鹏. 术前联合放化疗与单纯手术治疗食管癌疗效的Meta分析. 世界华人消化杂志 2011; 19(27): 2869-2875
Revised: August 22, 2011
Accepted: August 28, 2011
Published online: September 28, 2011
AIM: To compare the efficacy of preoperative chemoradiotherapy plus surgery versus surgery alone for resectable esophageal carcinoma.
METHODS: We searched Pubmed and EMbase databases to identify eligible studies, and manual searches were done to ensure that no studies were missed.
RESULTS: Twelve randomized controlled trials that included 1 544 patients were included. Preoperative chemoradiotherapy plus surgery significantly improved 1-, 3- and 5-year survival rates [odds ratio (OR) = 1.28, 95% confidence interval (CI), 1.01-1.64, P = 0.05; OR = 1.84, 95% CI, 1.29-2.63, P = 0.00; OR = 1.53, 95% CI, 1.17-2.00, P = 0.00] compared to surgery alone. Postoperative mortality increased in patients treated by preoperative chemoradiotherapy (OR = 1.68, 95% CI, 1.03-2.73, P = 0.04), but the incidence of postoperative complications was similar between the two groups (OR = 1.15, 95% CI, 0.89-1.49, P = 0.28). Preoperative chemoradiotherapy reduced incidence of local -regional cancer recurrence (OR = 0.64, 95% CI, 0.41-0.99, P = 0.04), but incidence of distant cancer recurrence was similar between the two groups (OR = 0.94, 95% CI, 0.68-1.31, P = 0.73).
CONCLUSION: Preoperative chemoradiotherapy can remarkably improve the survival of patients with resectable esophageal carcinoma.
- Citation: Jin HL, Han ST, Li WJ, Wu DP. Efficacy of preoperative chemoradiotherapy plus surgery versus surgery alone for resectable esophageal carcinoma: a meta-analysis. Shijie Huaren Xiaohua Zazhi 2011; 19(27): 2869-2875
- URL: https://www.wjgnet.com/1009-3079/full/v19/i27/2869.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i27.2869
食管癌是消化系常见肿瘤, 在全球范围内它是引起肿瘤相关死亡的第六位原因[1]. 食管癌的治疗有多种方法, 如手术、化疗、放疗以及多种方法联合的综合治疗等. 临床上常常根据食管癌患者的疾病分期决定治疗方法. 外科手术一直被认为是治疗食管癌的基石, 但研究表明接受单纯手术治疗的食管癌患者的中位生存期不超过18 mo[2]. 术前放化疗联合手术(亦称为新辅助治疗)是目前食管癌治疗的研究热点. 然而, 食管癌患者究竟能否从术前放化疗中获益仍存在争议. 本研究旨在通过多个随机对照试验, 对术前放化疗联合手术以及单一手术治疗食管癌的疗效做一个荟萃分析.
行系统检索, 并获得全文, 截止日期为2011-06. 英文检索关键字包括esophageal neoplasm、surgery、radiotherapy、chemotherapy、chemoradiotherapy并以RCT(或 randomized, and clinical trial)限制. 中文检索关键字包括食管癌、放疗, 化疗、放化疗、新辅助.
1.2.1 纳入标准: 纳入荟萃分析的文献必须满足下列标准: (1)比较术前放化疗联合手术与单纯手术治疗食管癌疗效的前瞻性随机对照试验; (2)文献必须包含生存率相关的数据; (3)入组患者要求为无远处转移的可切除的经组织学证实的食管鳞癌或腺癌; (4)术前放化疗组与单纯手术组患者的信息必须经证实无统计学差异; (5)语种为英文和中文.
1.2.2 排除标准: 研究对象为曾接受单独化疗或单独放疗的食管癌患者; 剔除重复报道、信息太少以及数据描述不详的文献.
1.2.3 数据提取: 所有数据均由3位不同的研究者提取, 分歧通过协商解决.
统计学处理 本文分析了1年、3年、5年生存率以及术后死亡率, 术后并发症发生率, 术后首次治疗失败的局部复发率与远处转移率. 治疗效果(生存率和首次治疗失败的局部复发率与远处转移率)的评价是以入组患者的人数计算的. 而术后死亡率、并发症发生率按接受手术的实际人数计算. 应用RevMan4.2.8软件, 以Q检验分析文献异质性. Q检验P<0.05为各研究间存在异质性, 采用随机效应模型; 反之为无异质性, 采用固定效应模型. 计算OR值及其95%CI, P<0.05为差异有统计学意义.
共获得12篇相关文献[3-14], 均为已发表的文献, 不含摘要. 研究涉及9个国家, 中国、日本、韩国、泰国、美国、法国、挪威、爱尔兰、澳大利亚. 文章发表时间1992-2009, 各研究进行时间1983-2002. 其中8篇是以食管鳞癌患者为研究对象, 3篇研究包括鳞癌和腺癌, 仅1篇研究受试对象全部为腺癌. 入组患者的标准基本相同: 经病理证实的未治疗过的可切除的食管癌(鳞癌或腺癌), 而且对患者的肝肾心肺进行评估, 确认患者能耐受手术, 并且没有其他影响患者寿命的伴发疾病. 12篇文献中共有1 544人纳入了研究, 其中777例患者纳入了联合治疗组, 而767例患者纳入了单纯的手术治疗组. 单纯手术组几乎所有患者都接受了手术, 而联合治疗组却有部分因为各种原因未能完成预期的治疗计划. 入组时的肿瘤分期, 大部分患者都在II-III期(1987UICC), 而Natsugoe的研究中有更高病理分期(II-IV, 但所有M1均为远处淋巴结转移), 其中, Le Prise使用的AJC的标准(I-II), 而WALSH未说明病理分期. 联合治疗方案见表1.
| 国家 | 第一作者 | 发表时间 | 鳞癌或腺癌 | 放疗方案 | 化疗方案 | 同步或序贯 | 手术时间 |
| 挪威 | Nygaard | 1992 | SCC | 35 Gy1.75 Gy/d5 d/wk×4 wk | Cisplatin: 20 mg/m2 D1-5,D15-19Bleomycin: 10 mg/m2 D1-5,D15-19 | 序贯 | Not Report |
| 泰国 | Apinop | 1994 | SCC | 40 Gy2 Gy/d5 d/wk×4 wk | Cisplatin: 100 mg/m2 D1, 29FU: 1000 mg/m2 D1-4, D29-32 | 同步 | 化疗后4 wk |
| 法国 | Le Prise | 1994 | SCC | 20 Gy2 Gy/dD8-19 | Cisplatin:100 mg/m2 D1, 21FU: 600 mg/m2 D2-5, D22-25 | 序贯 | 第42d |
| 爱尔兰 | Walsh | 1996 | AC | 40 Gy2.67 Gy/dD1-5, 8-12, 15-19 | Cisplatin: 75 mg/m2 D7FU:15 mg/kg D1-5week1和week 6 | 同步 | 放化疗结束后8 wk |
| 法国 | Bosset | 1997 | SCC | 37 Gy3.7 Gy/d5 d/wk×2 wk | Cisplatin: 80 mg/m2 D0-2 | 序贯 | 放化疗结束后2-4 wk |
| 美国 | Urba | 2001 | SCC和AC | 45 Gy1.5 Gy bidD1-5, 8-12, 15-19 | Cisplatin: 20 mg/(m2·d) D1-5, 17-21FU: 300/(m2·d)D1-21Vinblastine: 1 mg/m2 D1-4, 17-20 | 同步 | 第42 d |
| 中国 | AN FS | 2003 | SCC | 36 Gy3 Gy/dD21-24, 28-31, 35-38 | Cisplatin: 25 mg/m2 D2-5 D22-25FU: 1000 mg/m2 D1-5 500 mg/m2 D21-25 | 序贯 | 放化疗结束后3 wk |
| 韩国 | Lee | 2004 | SCC | 45.6 Gy1.2 Gy bidD1-28 | Cisplatin: 60 mg/m2 D1, 21FU: 1000 mg/m2D2-5 | 同步 | 放疗后3-4 wk |
| 澳大利亚 | Burmeister | 2005 | SCC和AC | 35 Gy2.33 Gy/d5d/wk×3wk | Cisplatin 80 mg/m2 D1FU 800 mg/m2D2-5 | 同步 | 放疗后3-6 wk |
| 日本 | Natsugoe | 2006 | SCC | 40 Gy2 Gy/d5 d/wk×4wk | Cisplatin:7 mgFU;350 mg5 d/wk for 4-6 wk | 同步 | 放化疗结束后35-40 d |
| 美国 | Tepper | 2008 | SCC和AC | 50.4 Gy1.8 Gy/d5d/w*5.5w | Cisplatin: 100 mg/m2 D1,29FU: 1 000 mg/(m2·d) D1-4, D29-32 | 同步 | 放化疗结束后3-8 wk |
| 中国 | Cao XF | 2009 | SCC | 40 Gy2 Gy/dD1-5, 8-12, 15-19, 22-26 | Cisplatin20 mg/(m2·d)D1-5,8-12FU, 500 mg/(m2·d) D1-5,8-12MMC, 10 mg/(m2·d) D1 | 同步 | 放化疗结束后4-5 wk |
研究显示无论1年、3年还是5年生存率, 联合治疗组都显示出了优势(图1-3). 1年、3年和5年生存率的OR(95%CI, P值)分别为1.28 (1.01-1.64, P = 0.05)、1.84(1.29-2.63, P = 0.00)和1.53(1.17-2.00, P = 0.00). 因3年生存率的异质性检验P = 0.04, 故应用了随机效应模式, 而1年和5年生存率异质性检验的P值分别为0.62和0.46, 故应用固定效应模式.
术后死亡率在联合治疗组为0%-23.5%, 在单纯手术组为0%-14.7%, 联合治疗组术后死亡率最高的在Nygaard的研究中, 而单纯手术组死亡率最高在Apinop的研究中. 另外, 在2000年之前的研究中术后死亡率明显高于2000之后发表的文献. Meta分析的结果提示联合治疗组术后死亡率高于单纯手术组, OR(95%CI, P值)为1.71(1.06~2.76, P = 0.03)(图4). 敏感性分析分别去除Nygaard和Bosset的研究后, 2组死亡率无统计学差异, OR(95%CI, P值)分别为1.66(0.99-2.79, P = 0.06)和1.30(0.75-2.28, P = 0.35). 术后并发症在我们的研究中包括了普通并发症和致死性并发症, 而且是以实际接受手术的人数来计算的. 结果显示两组术后并发症并无统计学差异, 其OR(95%CI, P值)为1.15(0.89-1.49, P = 0.28)(图5).
我们对各个RCT进行Meta分析的结果显示, 术前放化疗联合手术治疗食管癌较单纯手术治疗在生存率上有优势, 无论1年、3年还是5年生存率. 但亚组分析提示食管鳞癌患者并无这种生存的获益. Fiorica等认为术前放化疗联合手术治疗食管癌较之单纯手术能降低患者的3年死亡率, 但若去除其中包含有食管腺癌的研究, 其结果亦无统计学差异. 另外, 在Val Gebski等人的研究中, 术前放化疗联合手术治疗食管鳞癌和腺癌较之单纯手术治疗均有统计学差异, 其OR(95%CI, P值)分别为0.84 (0.71-0.99, P = 0.04)和0.75 (0.59-0.95; P = 0.02). 因为前者P值接近0.05, 故下结论尚需谨慎. 因此, 目前尚无足够证据能支持术前放化疗联合手术治疗食管鳞癌较之单纯手术能提高患者的生存率. 明确的结论尚需更大样本含量的多中心随机对照试验来支持.
尽管在生存率上联合治疗组显示出了优势, 但术前放化疗组手术相关死亡率较单纯手术组升高, 而且有部分患者在术前就死亡了或是病情恶化而失去了手术机会. 这可能与术前放疗导致局部组织变化(质地变硬变脆, 解剖不清楚), 手术难度增加, 术后致死性并发症(如吻合口瘘, 肺部并发症)增多有关. 然而, 去除Nygaard的研究进行敏感性分析后, 两组死亡率无统计学差异. Nygaard的研究是所有研究中最早的(1983-1988), 或许限于当时的医疗水平, 对于术后严重并发症的治疗缺乏有效的措施. 因此, 在目前医疗水平下, 在改进手术方法和优化化放疗方案后, 联合治疗组手术相关死亡率或许有望下降到与单纯手术组无统计学差异的水平. 另外, 在各种并发症(包括致死性并发症)的发生率上, 术前放化疗组较单纯手术组无统计学差异.
有报道在肺癌治疗中序贯化放疗优于同步化放疗[15], 但如果不考虑食管癌的病理类型这一混杂因素, 那么新辅助治疗中化放疗同时进行时, 患者的生存率较单纯手术组高, 而当化放疗序贯进行时, 则两组患者生存率无统计学意义. 这可能与顺铂的放疗增敏作用有关, 具体机制尚需进一步研究.
有资料表明[16-18]即使临床或手术认定为局限性癌肿者(T1-3N0-1M0)也有40%~75%已发生亚临床转移或邻近器官受累. 因此, 我们要利用各种检查做好肿瘤的分期, 严格把握新辅助治疗联合手术治疗的适应证. 内镜下超声(endoscopic ultrasonography, EUS)是目前T分期和N分期最精确的方法[19], 而常规胸腹部对比增强CT对远处转移的敏感性超过了90%. 但由于食管癌黏膜及粘膜下有着丰富的淋巴管网络, 其有早期扩散和转移的倾向, 普通CT也可能会对一些微小转移灶不敏感. 超声内镜引导下细针穿刺抽吸术(endoscopic ultrasonography-guided fine-needle aspiration, EUS-FNA) 和FDG-PET可以弥补前者的缺憾[20]. 一些研究中的入组患者伴有远处淋巴结的转移, 这些患者TNM分期应属于IV期, 但有研究证明这些患者也能从手术治疗获益, 因为这些淋巴结可以手术清除, 而且放疗时可以纳入照射野.
另外, 本研究存在如下的不足: (1)一些研究样本含量较小, 降低了检验的功效, 增加了二型错误的几率; (2)少数研究中肿瘤的分期不明确(WALSH和Urba), 而且入组患者的TNM分期的评估所使用的方法不同. 由于条件的限制, 对T分期尤为重要的内镜下超声不能普遍的使用, 而Le Prise的研究中CT亦不能作为常规检查; (3)食管腺癌在美国及欧洲的发病率正在上升, 而本Meta分析纳入的研究中对腺癌的研究偏少; (4)纳入的RCTs时间跨度大, 最早的研究是Nygaard等在1983-1988完成的, 由于医学不断的进步, 对当年这些研究数据的参考价值要有中肯的评价.
总之, 本Meta分析的结果提示: ⑴术前放化疗联合手术治疗食管癌较单纯手术能改善患者的生存率, 但食管鳞癌患者似乎并不能从中获益, 更多以腺癌为研究对象的随机对照实验有待完成. 事实上, 在美国这样一个腺癌高发的国家, 术前放化疗已成为常规; ⑵术前放化疗联合手术与单纯手术, 两种方法的术后并发症无统计学差异, 甚至有可能前者并未增加患者的术后死亡率.
食管癌是中国发病率较高的消化系肿瘤之一, 国外文献报道食管癌的术后中位生存期不超过18 mo. 近年来, 术前放化疗联合手术治疗成为研究的热点, 对于该方法的治疗效果, 国内外报道一直未能达成一致意见
姜春萌, 教授, 大连医科大学附属第二医院消化科
术前放化疗联合手术治疗食管癌与单纯手术治疗相比, 是否会提高患者的生存率?其术后死亡率及并发症发生率是否高于单纯手术治疗?是本研究关注的中心问题.
Val Gebski等认为术前放化疗对食管鳞癌和腺癌患者均有益, 但目前尚无足够证据能支持术前放化疗联合手术治疗食管鳞癌较之单纯手术能提高患者的生存率. 明确的结论尚需完成更大样本含量的多中心随机对照试验.
本文提示术前放化疗可以提高食管癌患者的术后生存率, 并且随着技术的发展, 术前放化疗联合手术并不会增加食管癌患者的术后死亡率.
本尽管Meta分析提示术前放化疗可以提高食管癌患者的术后生存率, 但亚组分析提示食管鳞癌患者并不能从中获益, 间接提示食管腺癌患者可能为术前放化疗的真正受益者.
尽管Meta分析提示术前放化疗可以提高食管癌患者的术后生存率, 但亚组分析提示食管鳞癌患者并不能从中获益, 间接提示食管腺癌患者可能为术前放化疗的真正受益者.
编辑: 曹丽鸥 电编:闫晋利
| 1. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] [DOI] |
| 2. | Khushalani N. Cancer of the esophagus and stomach. Mayo Clin Proc. 2008;83:712-722. [PubMed] [DOI] |
| 3. | Lee JL, Park SI, Kim SB, Jung HY, Lee GH, Kim JH, Song HY, Cho KJ, Kim WK, Lee JS. A single institutional phase III trial of preoperative chemotherapy with hyperfractionation radiotherapy plus surgery versus surgery alone for resectable esophageal squamous cell carcinoma. Ann Oncol. 2004;15:947-954. [PubMed] [DOI] |
| 4. | Tepper J, Krasna MJ, Niedzwiecki D, Hollis D, Reed CE, Goldberg R, Kiel K, Willett C, Sugarbaker D, Mayer R. Phase III trial of trimodality therapy with cisplatin, fluorouracil, radiotherapy, and surgery compared with surgery alone for esophageal cancer: CALGB 9781. J Clin Oncol. 2008;26:1086-1092. [PubMed] [DOI] |
| 5. | Urba SG, Orringer MB, Turrisi A, Iannettoni M, Forastiere A, Strawderman M. Randomized trial of preoperative chemoradiation versus surgery alone in patients with locoregional esophageal carcinoma. J Clin Oncol. 2001;19:305-313. [PubMed] |
| 6. | Burmeister BH, Smithers BM, Gebski V, Fitzgerald L, Simes RJ, Devitt P, Ackland S, Gotley DC, Joseph D, Millar J. Surgery alone versus chemoradiotherapy followed by surgery for resectable cancer of the oesophagus: a randomised controlled phase III trial. Lancet Oncol. 2005;6:659-668. [PubMed] [DOI] |
| 7. | Natsugoe S, Okumura H, Matsumoto M, Uchikado Y, Setoyama T, Yokomakura N, Ishigami S, Owaki T, Aikou T. Randomized controlled study on preoperative chemoradiotherapy followed by surgery versus surgery alone for esophageal squamous cell cancer in a single institution. Dis Esophagus. 2006;19:468-472. [PubMed] [DOI] |
| 8. | An FS, Huang JQ, Xie YT, Chen SH, Rong TH. [A prospective study of combined chemoradiotherapy followed by surgery in the treatment of esophageal carcinoma]. Zhonghua Zhong Liu Za Zhi. 2003;25:376-379. [PubMed] |
| 9. | Nygaard K, Hagen S, Hansen HS, Hatlevoll R, Hultborn R, Jakobsen A, Mäntyla M, Modig H, Munck-Wikland E, Rosengren B. Pre-operative radiotherapy prolongs survival in operable esophageal carcinoma: a randomized, multicenter study of pre-operative radiotherapy and chemotherapy. The second Scandinavian trial in esophageal cancer. World J Surg. 1992;16:1104-119; discussion 1110. [PubMed] [DOI] |
| 10. | Apinop C, Puttisak P, Preecha N. A prospective study of combined therapy in esophageal cancer. Hepatogastroenterology. 1994;41:391-393. [PubMed] |
| 11. | Le Prise E, Etienne PL, Meunier B, Maddern G, Ben Hassel M, Gedouin D, Boutin D, Campion JP, Launois B. A randomized study of chemotherapy, radiation therapy, and surgery versus surgery for localized squamous cell carcinoma of the esophagus. Cancer. 1994;73:1779-1784. [PubMed] [DOI] |
| 12. | Walsh TN, Noonan N, Hollywood D, Kelly A, Keeling N, Hennessy TP. A comparison of multimodal therapy and surgery for esophageal adenocarcinoma. N Engl J Med. 1996;335:462-467. [PubMed] [DOI] |
| 13. | Bosset JF, Gignoux M, Triboulet JP, Tiret E, Mantion G, Elias D, Lozach P, Ollier JC, Pavy JJ, Mercier M. Chemoradiotherapy followed by surgery compared with surgery alone in squamous-cell cancer of the esophagus. N Engl J Med. 1997;337:161-167. [PubMed] [DOI] |
| 14. | Cao XF, He XT, Ji L, Xiao J, Lv J. Effects of neoadjuvant radiochemotherapy on pathological staging and prognosis for locally advanced esophageal squamous cell carcinoma. Dis Esophagus. 2009;22:477-481. [PubMed] [DOI] |
| 15. | Dillman RO, Herndon J, Seagren SL, Eaton WL, Green MR. Improved survival in stage III non-small-cell lung cancer: seven-year follow-up of cancer and leukemia group B (CALGB) 8433 trial. J Natl Cancer Inst. 1996;88:1210-1215. [PubMed] [DOI] |
| 16. | Diehl LF. Radiation and chemotherapy in the treatment of esophageal cancer. Gastroenterol Clin North Am. 1991;20:765-774. [PubMed] |
| 17. | Katlic MR, Wilkins EW, Grillo HC. Three decades of treatment of esophageal squamous carcinoma at the Massachusetts General Hospital. J Thorac Cardiovasc Surg. 1990;99:929-938. [PubMed] [DOI] |
| 18. | Kelsen D. Multimodality therapy for adenocarcinoma of the esophagus. Gastroenterol Clin North Am. 1997;26:635-645. [PubMed] [DOI] |
| 19. | Meyenberger C, Fantin AC. Esophageal carcinoma: current staging strategies. Recent Results Cancer Res. 2000;155:63-72. [PubMed] [DOI] |
| 20. | Romagnuolo J, Scott J, Hawes RH, Hoffman BJ, Reed CE, Aithal GP, Breslin NP, Chen RY, Gumustop B, Hennessey W. Helical CT versus EUS with fine needle aspiration for celiac nodal assessment in patients with esophageal cancer. Gastrointest Endosc. 2002;55:648-654. [PubMed] [DOI] |