修回日期: 2011-09-08
接受日期: 2011-09-26
在线出版日期: 2011-09-28
目的: 探讨急性胆道梗阻肠黏膜屏障破坏与肠上皮细胞氯离子通道-2(chloride channel-2, CLC-2)的关系.
方法: 建立急性胆道梗阻(阻塞性黄疸)大鼠动物模型, 术后7 d连续注射Lubiprostone(Lu组)、类高血糖素多肽-2(GLP-2组)、两者共同使用(Lu+GLP组), 以假手术组(Sham组)和阻塞性黄疸组(obstructive jaundice, OJ组)作为对照. 分别检测实验动物乳果糖/甘露醇(L/M)比值、血浆内毒素水平, 并用Western blots检测末端回肠紧密连接蛋白闭锁小带-1(zonula occludens-1, ZO-1)、CLC-2的表达, 并利用图像分析系统对Western blots图像进行定量分析.
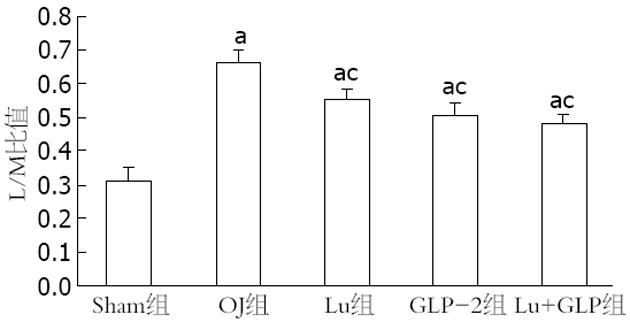
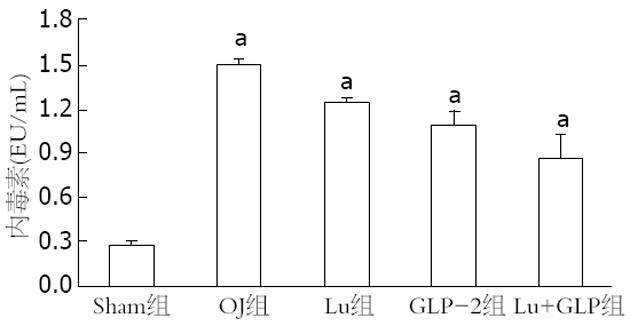
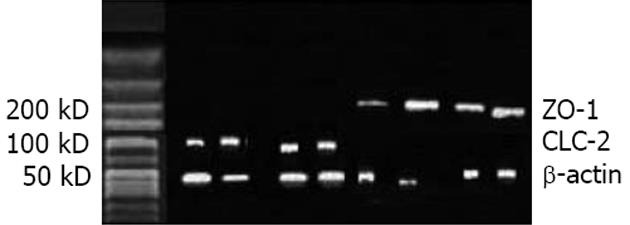
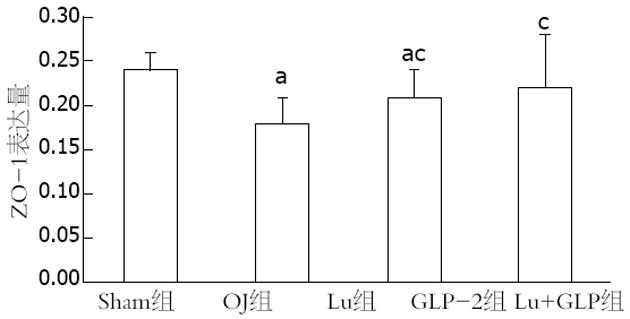
结果: 各实验组的L/M比值均高于Sham组(P = 0.00), Lu组(0.545±0.03)、GLP组(0.512±0.03)和Lu+GLP组(0.482±0.05)的数据均低于OJ组(0.656±0.04)(均P = 0.00). 手术后各组的血浆内毒素均升高, OJ组最高, Lu组、GLP组和Lu+GLP组均有所下降. 通过Western blots研究发现CLC-2蛋白的表达条带出现在90-100KD, ZO-1蛋白条带在200 kD左右. 定量研究显示OJ组的ZO-1相对表达量(0.178±0.03)明显下降, Lu组(0.209±0.03)高于OJ组而低于Sham组(P = 0.02), 而Lu+GLP组接近于Sham组. CLC-2蛋白的表达量Sham组为(0.267±0.04), OJ组(0.195±0.04)、GLP-2组(0.217±0.05)和Lu+GLP组(0.222±0.03)均下降明显(均P = 0.00).
结论: CLC-2和紧密连接蛋白共同参与肠黏膜屏障的维护, 急性胆道梗阻破坏肠黏膜屏障与肠上皮细胞的CLC-2有关, 促进或激活CLC-2后能活化紧密连接蛋白, 修复受损的肠黏膜屏障.
引文著录: 陈振勇, 王延刚, 杨鹏, 黄文广, 周有生, 冯贤松. 急性胆道梗阻肠黏膜屏障破坏与氯离子通道-2的关系. 世界华人消化杂志 2011; 19(27): 2829-2834
Revised: September 8, 2011
Accepted: September 26, 2011
Published online: September 28, 2011
AIM: To investigate the relationship between chloride channel-2 (CLC-2) and intestinal mucosal barrier in rats with obstructive jaundice (OJ).
METHODS: Rats were randomly divided into five groups: sham operation group, OJ group, lubiprostone (Lu) group, glucagon-like peptide-2 (GLP-2) group, and Lu + GLP group. Except for the sham operation group, OJ was induced by bile duct ligation in rats of other groups. The Lu group was subcutaneously injected with LU, and the GLP-2 group was injected with GLP-2. The Lu + GLP group was injected with both Lu and GLP-2. The animals were sacrificed 7 days after treatment. The ratio of lactulose to mannitol (L/M) and plasma endotoxin levels were measured. Western blot was used to examine the changes in the expression tight junction proteins zonula occludens-1 (ZO-1) and CLC-2 in epithelial cells in the terminal ileum.
RESULTS: The ratio of L/M was significantly higher in all the experiment groups than in the sham operation group (all P = 0.00), but was significantly lower in the Lu group, GLP-2 group and Lu + GLP group than in the OJ group (0.545 ± 0.03, 0.512 ± 0.03, 0.482 ± 0.05 vs 0.656 ± 0.04, all P = 0.00). Plasma endotoxin levels increased in all the experiment groups, highest in the OJ group and decreasing somewhat in the Lu group, GLP-2 group and Lu + GLP group. The relative expression of ZO-1 in the Lu group (0.209 ± 0.03) was higher than that in the OJ group (0.178 ± 0.03) but lower than that in the sham operation group (P = 0.02). The relative expression of ZO-1 in the Lu + GLP group was comparable to that in the sham operation group. The relative expression of CLC-2 descended more obviously in the OJ, GLP-2 and Lu + GLP groups than in the sham operation group (0.195 ± 0.04, 0.217 ± 0.05, 0.222 ± 0.03 vs 0.267 ± 0.04, all P = 0.00).
CONCLUSION: CLC-2 and tight junction protein participate in the maintenance of intestinal mucosal barrier. Acute biliary obstruction-induced destruction of intestinal mucosa barrier is associated with CLC-2 in enterocytes. CLC-2 activation could activate tight junction protein and repair impaired intestinal mucosa barrier.
- Citation: Chen ZY, Wang YG, Yang P, Huang WG, Zhou YS, Feng XS. Relationship between CLC-2 and intestinal mucosal barrier in rats with obstructive jaundice. Shijie Huaren Xiaohua Zazhi 2011; 19(27): 2829-2834
- URL: https://www.wjgnet.com/1009-3079/full/v19/i27/2829.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i27.2829
我们前期的研究发现急性胆道梗阻所致阻塞性黄疸(阻塞性黄疸)影响肠腔Cl-分泌, 降低血清Cl-浓度, 升高小肠上皮细胞内Cl-浓度, 缩小上皮细胞内外氯离子浓度差, 激活Cl-外向电流, 并且此作用与细胞膜上氯离子通道蛋白-2(chloride channel-2, CLC-2)的表达降低有关. 同时阻塞性黄疸也可以改变肠上皮细胞顶侧的紧密连接蛋白的数量和分布, 损伤肠黏膜屏障[1,2]. 而紧密连接与CLC-2具有共同的分布区域[3,4], 因此有理由推测阻塞性黄疸破坏肠黏膜屏障与CLC-2和紧密连接蛋白均有关系. 本项目的研究目的既是利用阻塞性黄疸动物模型, 研究阻塞性黄疸对肠黏膜屏障和肠上皮细胞CLC-2的影响, 以及紧密连接蛋白和CLC-2间的相互关系.
健康Wistar大鼠50只, 雌雄不限, 体质量250-330 g, 由同济医学院实验动物中心提供.
1.2.1 分组: 按随机数字表法平均分为5组, 每组10只. 假手术组(Sham组): 采用10%水合氯醛(0.3 g/kg)腹腔注射麻醉, 开腹分离胆总管而不结扎; 阻塞性黄疸组(OJ组): 手术结扎切断胆总管后关腹, 每日皮下注射生理盐水0.5 mL; Lubiprostone组(Lu组): 阻塞性黄疸动物皮下注射Lubiprostone(大连美仑生物技术公司)0.5 mL(0.2 mg/kg), 连续7 d; 类高血糖素多肽-2(glucagon-like peptide-2, GLP-2)组: 模型动物腹腔注射GLP-2(美国多肽公司)0.5 mL 250[g/(kg•d)], 连续7d; Lubiprostone + GLP-2(Lu+GLP组): 同样剂量的Lubiprostone和GLP-2同时使用7 d.
1.2.2 乳果糖/甘露醇(L/M)比值检测: 实验动物禁食8 h后自由进水, 经胃管喂服2 mL/只检测溶液(含10%乳果糖100 mg和5%甘露醇50 mg, Sigma公司). 随后连续收集6 h尿液, 混匀后取5 mL, 加入1 mg硫柳汞作防腐剂, 置于-20 ℃冰箱保存. 利用色谱仪分析尿中L/M比值. 每只大鼠尿标本分3次各取5 mL, 重复测量3次.
1.2.3 血浆内毒素水平测定: 测量完毕后拉脱法处死动物, 腔静脉穿刺抽血2 mL, 通过鲎试验动态浊度法测定(动态测定试剂盒, 上海市医学化验所)各组动物血浆内毒素水平, 按说明书并参考文献[5]进行操作: 取1 mL抗凝血10倍稀释于75 ℃恒温水浴中加热10 min, 离心10 min(4 000 r/min), 取上清液加入酶反应主剂中, 溶解后转移至标准反应管中, 插入微生物快速动态检测系统中反应1 h, 反应结束后自动计算出血浆内毒素含量(EU/mL).
1.2.4 肠上皮细胞CLC-2蛋白和紧密连接蛋白闭锁小带-1(ZO-1)表达的变化: Western blot分析. 无菌操作, 取原手术切口, 距回盲部10 cm处环形切取回肠, 取1 mm×1 mm×1 mm大小的组织块, 加入1 mL裂解液和10 mL缓冲液, 组织粉碎、匀浆, 冰浴30 min; 4 ℃离心, 取上清液, 采用BCA法用紫外可见分光光度仪(Waters公司, 美国)测定蛋白浓度, 并用蒸馏水将各样本统一稀释为5 g/L, -70 ℃保存. 取各样本10 μL及5 μL的预染Marker, 加入上样缓冲液; 混合后100 ℃煮沸蛋白变性5 min, 分别经7.5%和12% SDS-PAGE凝胶电泳分离1或2 h. 电转30 min; 取出硝酸纤维膜(美国Costar公司), 转移至染色液中染色1 min, 标记, 用含5%脱脂奶粉的TBS-T[20 mmol/L Tris-HCl(pH7.2), 150 mmol/L NaCl, 0.1% Tween 20]洗膜4次. 浸入封闭液中封闭1 h. 分别加一抗ZO-1(1∶1 000稀释)或兔抗鼠CLC-2一抗蛋白 (1∶300稀释) (均属Sigma 公司); 以β-actin(武汉博士德产品)为内参, 1∶2 000稀释, 4 ℃孵育过夜. 加入1∶2 000的二抗〔四甲基异硫酸罗丹明(TRITC)-山羊抗兔IgG, 北京中山生物技术有限公司〕室温下孵育1 h. 将膜放入显色液中, 震荡孵育5-10 min, 暗室下胶片显影, 扫描. 以β-actin蛋白进样对照. Olympus BX41图像采集系统(Image-Pro plus, version 4.5, USA)收集图片信息, Adobe Photoshop软件定量测量平均吸光度(A)值, 以样本A值/同一样本内β-actin蛋白A值来代表样本的相对表达量.
统计学处理 采用SPSS13.0统计软件进行分析. 计量资料以mean±SD表示, 组间计量资料比较, 采用单因素方差分析及配对资料t检验, 检验水准α = 0.05.
L/M比值可以间接反映肠黏膜通透性. 通过研究L/M比值的变化, 发现各实验组的数值均高于Sham组(均P = 0.00), 相比OJ组(0.656±0.04), Lu组(0.545±0.03)、GLP-2组(0.512±0.03)和Lu+GLP(0.482±0.05)组均明显下降(均P = 0.00), 其中GLP-2组和Lu+GLP比较P = 0.01(图1).
通过对血浆内毒素的比较, 各实验组的数值均明显高于Sham组(0.279±0.02 EU/mL)(均P = 0.00), 并且各组间相互比较差异有极显著性意义(均P = 0.00, 图2).
Western blot研究显示ZO-1蛋白条带在200 kD左右(图3). 对表达条带的定量研究显示OJ组的ZO-1相对表达量(0.178±0.03)明显下降, Lu组(0.209±0.03)高于OJ组(P = 0.01)而低于Sham组(P = 0.02), 而Lu+GLP组的作用与Lu组类似, 接近于Sham组(P = 0.19, 图4).
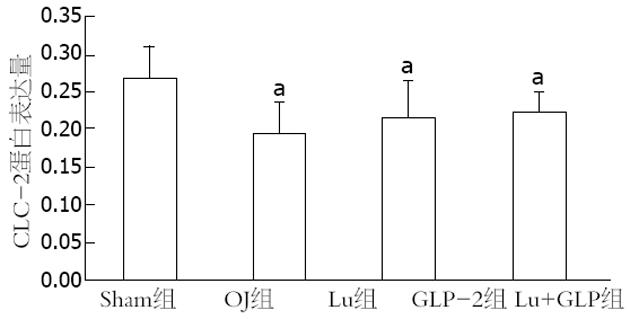
Western blot图片显示CLC-2蛋白的表达条带出现在90-100 kD(图3). 通过对图片的定量分析发现CLC-2蛋白的相对灰度值Sham组为0.267±0.04, 而OJ组(0.195±0.04)、GLP-2组(0.217±0.05)和Lu+GLP组(0.222±0.03)均下降明显(均P = 0.00), OJ组和GLP-2组、Lu+GLP组间没有差异(P = 0.17, 0.06, 图5).
用SPSS软件对阻塞性黄疸动物肠上皮细胞的ZO-1蛋白和CLC-2蛋白的相关性进行分析, 结果显示相关系数r = 0.30, P = 0.11, 说明两者间的变化没有明显相关.
阻塞性黄疸对肠黏膜屏障损坏的机制复杂, 其中对肠上皮细胞间紧密连接及紧密连接蛋白如ZO-1的破坏起关键性作用[6,7]. 阻塞性黄疸降低紧密连接蛋白的数量与分布, 开放紧密连接通道[8], 出现细菌移位, 形成所谓"肠源性脓毒症", 增加多器官功能衰竭的发生率和死亡率[9]. 肠黏膜损伤后的修复涉及到两个主要事件[10], 上皮的重建和细胞旁区域及紧密连接的关闭. 上皮的重建是最初的修复事件, 包括绒毛收缩、上皮细胞迁移, 从而迅速恢复上皮连续性. 细胞旁区域的关闭涉及紧密连接蛋白的重新组装和屏障功能的恢复. 研究表明CLC-2在缺血所造成的肠黏膜屏障损伤的恢复中扮演重要角色[11,12], 氯离子通道在阻塞性黄疸所导致的肠黏膜屏障损伤中的作用尚不清楚. 临床上经常出现的水、电解质紊乱, 其中也包括Cl-失衡[13]. 可能的原因在于液体、营养物质摄入不足; 合并感染导致呕吐或发热, 液体丢失过多; 内毒素血症和高胆红素血症致肾脏受损等[14]. 肠腔液体分泌依靠细胞内外离子浓度差及肠上皮细胞的跨膜离子转运, 氯离子的通透性受胞外氯离子浓度的影响[15], 许多阳离子如K离子、Na离子等也可通过氯通道[16].
我们前期的研究发现在阻塞性黄疸动物模型上, 肠腔氯离子分泌受抑制, 肠上皮细胞内外的氯离子浓度差缩小, 并随阻塞性黄疸程度的加深, 对Cl-分泌的抑制更甚. 此作用与细胞膜上CLC-2的表达降低有关. 而CLC蛋白与紧密连接蛋白有共同分布区域[3], 此次的研究目的是探讨阻塞性黄疸后受破坏的CLC蛋白与紧密连接蛋白间的相互关系.
我们首先发现阻塞性黄疸后反映肠黏膜通透性的L/M比值和血浆内毒素均增高, 也再次印证阻塞性黄疸破坏肠黏膜屏障[17], 不论是单独使用CLC-2激动剂Lubiprostone或紧密连接保护剂GLP-2, 抑或两者联合使用, 均可以降低L/M比值和血浆内毒素, 既对肠黏膜屏障有保护作用. 说明促进或激活肠上皮细胞的CLC-2或紧密连接均可以恢复受损的肠黏膜屏障.
为进一步研究其中的机制, 我们选择紧密连接蛋白的代表ZO-1作为研究对象. 阻塞性黄疸降低ZO-1的表达, 使用Lubiprostone激活CLC-2后, ZO-1表达增高, 同时使用Lubiprostone和GLP-2则作用更强, 接近于假手术组. 说明激活CLC-2后能修复紧密连接蛋白, 恢复肠黏膜屏障, 也表明CLC-2和紧密连接蛋白共同参与肠黏膜屏障的维护.
阻塞性黄疸同时也降低了CLC-2蛋白的表达, 我们从相反的角度通过促进ZO-1表达来研究紧密连接蛋白与CLC-2的相互影响. 结果发现单用GLP-2不能恢复CLC-2表达, 尽管GLP-2具有恢复肠黏膜屏障的作用, 但从我们的实验中看出GLP-2的作用与CLC-2无关. 联合使用GLP-2和Lubiprostone后CLC-2有所恢复, 但此作用并不能排除Lubiprostone所为. 这一点也可以从阻塞性黄疸肠上皮细胞ZO-1和CLC-2蛋白的相关性分析中得到证实, 因为统计分析显示两者间的变化没有明显相关. 结合前面的研究, 反映出CLC-2和紧密连接蛋白间激活存在先后顺序, 激活CLC-2后能活化紧密连接蛋白, 相反恢复紧密连接蛋白并不能改变肠上皮氯离子通道CLC-2. 也就是说抑制ZO-1后能降低CLC-2, 相反, 抑制CLC-2则并不能影响ZO-1表达.
CLC-2是广泛分布的Cl通道之一, 属于Cl通道CLC家族. 受电压和H+、Cl-激活[18]. 其多种生理活动, 包括细胞内pH调节, 维持膜电位, 胞吐作用, 上皮Cl-运输和液体分泌, 器官渗透物的跨膜运输, 以及细胞增生等[19]. 已证实哺乳动物胃肠道上皮细胞内均含有CLC-2, 定位于上皮细胞顶端, 同时也证实基底外侧膜上也存在CLC-2通道, 作为一个Cl-的出口, 帮助细胞尖端和基底外侧区域离子流量相匹配[20].
CLC-2与紧密连接具有共同的分布区域, 两者间具有某种联系[21], 一种可能是CLC-2通过蛋白间相互作用, 作为一种促进各种通道和信号分子间相互调节的方式之一, 二是CLC-2通道介导穿过小肠上皮紧密连接的Cl-运输. 调节黏膜屏障功能伴随绒毛和上皮紧密连接结构的改变, 当然也有相反的结论, CLC-2敲除鼠小肠黏膜上皮细胞的尖端紧密连接的宽度明显减少, 既没有CLC-2存在时紧密连接结构更紧凑, 作用更显著[12]. 这种争议可以用CLC-2在不同细胞器膜表面分布来部分解释. 分布在不同细胞膜或细胞器上的CLC-2具有不同的作用. CLC-2并非固定于小肠上皮尖端质膜[22], 细胞表面的CLC-2通道能迅速内陷并再循环. 此过程能解释细胞内膜结构中大量存在的CLC-2. 因此调节CLC-2运输至膜及其在膜内传动是调节CLC-2活性的方式之一[23]. 由此单独使用GLP-2并不能恢复有效的CLC通道.
临床上阻塞性黄疸出现肠通透性增加、肠黏膜屏障破坏, 其中的原因不甚清楚. 阻塞性黄疸患者可以观察到血清电解质的变化及肠蠕动的改变. 这两者之间是否具有某种联系尚不得而知. 前期已经证实阻塞性黄疸后细胞内外的Cl-浓度变化, 因此本次研究以Cl-为代表, 探讨与Cl-直接相关的氯离子通道蛋白-2与肠上皮紧密连接间的关系.
姚登福, 教授, 南通大学附属医院分子医学中心
肠黏膜屏障中的研究重点是上皮细胞间的紧密连接, 当然其他的屏障如生物屏障、免疫屏障均参与肠上皮对机体的保护. 肠上皮细胞同时具有大量的分泌功能, 阻塞性黄疸破坏肠黏膜屏障的同时也必然损伤其分泌功能. 由于肠屏障功能的维持需要多种因素参加, 本研究仅仅选取其中一个非常小的研究点, 需要进一步研究阻塞性黄疸后其他离子的变化及其各自的生理功能.
CLC-2与紧密连接具有共同的分布区域, 由此推测二者有某种联系. 本研究第一次将阻塞性黄疸肠黏膜屏障的破坏与肠上皮细胞离子分泌联系起来, 进一步探讨阻塞性黄疸肠黏膜屏障的破坏机制.
阻塞性黄疸黏膜屏障的破坏伴随肠腔离子的改变, 通过纠正肠上皮细胞存在的电解质紊乱可以帮助恢复受损的肠黏膜屏障的作用.
本研究能反映目前我国胃肠病学基础研究的水平.
编辑: 曹丽鸥 电编:何基才
| 2. | Assimakopoulos SF, Scopa CD, Zervoudakis G, Mylonas PG, Georgiou C, Nikolopoulou V, Vagianos CE. Bombesin and neurotensin reduce endotoxemia, intestinal oxidative stress, and apoptosis in experimental obstructive jaundice. Ann Surg. 2005;241:159-167. [PubMed] |
| 3. | Moeser AJ, Nighot PK, Engelke KJ, Ueno R, Blikslager AT. Recovery of mucosal barrier function in ischemic porcine ileum and colon is stimulated by a novel agonist of the ClC-2 chloride channel, lubiprostone. Am J Physiol Gastrointest Liver Physiol. 2007;292:G647-G656. [PubMed] [DOI] |
| 4. | Arrieta MC, Bistritz L, Meddings JB. Alterations in intestinal permeability. Gut. 2006;55:1512-1520. [PubMed] [DOI] |
| 6. | Assimakopoulos SF, Vagianos CE, Charonis AS, Alexandris IH, Spiliopoulou I, Thomopoulos KC, Nikolopoulou VN, Scopa CD. Experimental obstructive jaundice alters claudin-4 expression in intestinal mucosa: effect of bombesin and neurotensin. World J Gastroenterol. 2006;12:3410-3415. [PubMed] |
| 7. | Chen ML, Ge Z, Fox JG, Schauer DB. Disruption of tight junctions and induction of proinflammatory cytokine responses in colonic epithelial cells by Campylobacter jejuni. Infect Immun. 2006;74:6581-6589. [PubMed] [DOI] |
| 8. | Assimakopoulos SF, Scopa CD, Vagianos CE. Pathophysiology of increased intestinal permeability in obstructive jaundice. World J Gastroenterol. 2007;13:6458-6464. [PubMed] [DOI] |
| 9. | Assimakopoulos SF, Scopa CD, Charonis A, Spiliopoulou I, Georgiou C, Nikolopoulou V, Vagianos CE. Experimental obstructive jaundice disrupts intestinal mucosal barrier by altering occludin expression: beneficial effect of bombesin and neurotensin. J Am Coll Surg. 2004;198:748-757. [PubMed] [DOI] |
| 10. | Gookin JL, Galanko JA, Blikslager AT, Argenzio RA. PG-mediated closure of paracellular pathway and not restitution is the primary determinant of barrier recovery in acutely injured porcine ileum. Am J Physiol Gastrointest Liver Physiol. 2003;285:G967-G979. [PubMed] |
| 11. | Moeser AJ, Haskell MM, Shifflett DE, Little D, Schultz BD, Blikslager AT. ClC-2 chloride secretion mediates prostaglandin-induced recovery of barrier function in ischemia-injured porcine ileum. Gastroenterology. 2004;127:802-815. [PubMed] [DOI] |
| 12. | Nighot PK, Blikslager AT. ClC-2 regulates mucosal barrier function associated with structural changes to the villus and epithelial tight junction. Am J Physiol Gastrointest Liver Physiol. 2010;299:G449-G456. [PubMed] [DOI] |
| 13. | Assimakopoulos SF, Tsamandas AC, Louvros E, Vagianos CE, Nikolopoulou VN, Thomopoulos KC, Charonis A, Scopa CD. Intestinal epithelial cell proliferation, apoptosis and expression of tight junction proteins in patients with obstructive jaundice. Eur J Clin Invest. 2011;41:117-125. [PubMed] [DOI] |
| 14. | Clarke DL, Pillay Y, Anderson F, Thomson SR. The current standard of care in the periprocedural management of the patient with obstructive jaundice. Ann R Coll Surg Engl. 2006;88:610-616. [PubMed] [DOI] |
| 15. | Bachmann O, Juric M, Seidler U, Manns MP, Yu H. Basolateral ion transporters involved in colonic epithelial electrolyte absorption, anion secretion and cellular homeostasis. Acta Physiol (Oxf). 2011;201:33-46. [PubMed] [DOI] |
| 16. | Sánchez-Rodríguez JE, De Santiago-Castillo JA, Arreola J. Permeant anions contribute to voltage dependence of ClC-2 chloride channel by interacting with the protopore gate. J Physiol. 2010;588:2545-2556. [PubMed] [DOI] |
| 17. | Wang N, Yu H, Ma J, Wu W, Zhao D, Shi X, Tian H, Jiang H. Evidence for tight junction protein disruption in intestinal mucosa of malignant obstructive jaundice patients. Scand J Gastroenterol. 2010;45:191-199. [PubMed] [DOI] |
| 18. | Camilleri M, Bharucha AE, Ueno R, Burton D, Thomforde GM, Baxter K, McKinzie S, Zinsmeister AR. Effect of a selective chloride channel activator, lubiprostone, on gastrointestinal transit, gastric sensory, and motor functions in healthy volunteers. Am J Physiol Gastrointest Liver Physiol. 2006;290:G942-G947. [PubMed] [DOI] |
| 19. | Nighot PK, Moeser AJ, Ryan KA, Ghashghaei T, Blikslager AT. ClC-2 is required for rapid restoration of epithelial tight junctions in ischemic-injured murine jejunum. Exp Cell Res. 2009;315:110-118. [PubMed] [DOI] |
| 20. | Crowell MD, Harris LA, DiBaise JK, Olden KW. Activation of type-2 chloride channels: a novel therapeutic target for the treatment of chronic constipation. Curr Opin Investig Drugs. 2007;8:66-70. [PubMed] |
| 21. | Kirk KL. Chloride channels and tight junctions. Focus on "Expression of the chloride channel ClC-2 in the murine small intestine epithelium". Am J Physiol Cell Physiol. 2000;279:C1675-C1676. [PubMed] |
| 22. | Bijvelds MJ, Bot AG, Escher JC, De Jonge HR. Activation of intestinal Cl- secretion by lubiprostone requires the cystic fibrosis transmembrane conductance regulator. Gastroenterology. 2009;137:976-985. [PubMed] |
| 23. | Cornejo I, Niemeyer MI, Zúñiga L, Yusef YR, Sepúlveda FV, Cid LP. Rapid recycling of ClC-2 chloride channels between plasma membrane and endosomes: role of a tyrosine endocytosis motif in surface retrieval. J Cell Physiol. 2009;221:650-657. [PubMed] [DOI] |