修回日期: 2011-08-26
接受日期: 2011-09-01
在线出版日期: 2011-09-08
目的: 探讨疏肝健脾方药对非酒精性脂肪性肝炎(nonalcoholic steatosis hepatitis, NASH)合并心脏舒张功能不全大鼠干预的作用机制.
方法: 采用高脂饲料喂养复制NASH大鼠实验模型, 各药物组分别灌服疏肝方、健脾方和综合方(疏肝方和健脾方的合方)进行干预, 16 wk后用Visual Sonics Vevo®770TM高分辨率小动物超声诊断仪检测大鼠心脏每搏输出量(SV)、左心室射血分数(LVEF)、左心室短轴缩短率(LVFS)用以评价大鼠心脏收缩功能, 检测E/A比值用以评价大鼠心脏舒张功能. 然后处死大鼠, 腹主动脉采血, 用全自动生化分析仪检测血脂及肝脂的含量; 常规HE染色观察肝组织病理变化; ELISA法检测血清TNF-α和IL-6的水平.
结果: 肝组织病理染色提示大鼠NASH造模成功; 与正常对照组相比, 模型组大鼠心脏舒张功能明显降低(1.59±0.24 vs 1.03±0.13, P<0.01), 血清TNF-α和IL-6含量显著升高(13.57±4.64 vs 28.26±8.60; 59.28±71.53 vs 132.81±74.22, P<0.01、0.05), 血清TC、LDL及肝组织TC、TG含量也明显升高(1.42±0.29 vs 3.82±0.91; 0.30±0.11 vs 0.81±0.27; 0.90±0.14 vs 11.86±1.29; 0.75±0.38 vs 6.17±1.83, 均P<0.01), SV、LVEF、LVFS均比正常组有不同程度的下降; 各药物组大鼠心脏舒张功能较模型组有显著改善, 以健脾高剂量组、综合方高剂量组的E/A比值升高最为明显(1.26±0.23 vs 1.03±0.13; 1.35±0.15 vs 1.03±0.13, 均P<0.01); 各药物组大鼠血清TNF-α及IL-6含量与模型组相比明显下降, 以综合方高剂量组的血清下降最为明显(15.07±6.00 vs 28.26±8.60; 67.72±44.24 vs 132.81±74.22, P<0.01, 0.05); 脂质代谢检测以合方高剂量组的血清TG及肝组织TC、TG下降最为明显(0.45±0.14 vs 0.83±0.26; 9.17±1.02 vs 11.86±1.29; 2.54±0.74 vs 6.17±1.83, 均P<0.01).
结论: NASH大鼠伴有心脏舒张功能不全, 疏肝健脾方药抗NASH及改善NASH大鼠心脏舒张功能可能与其降低血清中炎症因子TNF-α和IL-6的水平有关.
引文著录: 王文晶, 杨钦河, 冯高飞, 王彦平, 何秀敏, 张玉佩, 杨雪萍, 闫海震, 黄进, 李光秋, 赵亚凤, 杨晓蕾, 沈灿宏. 疏肝健脾方药对NASH大鼠心脏舒张功能及炎症因子的影响. 世界华人消化杂志 2011; 19(25): 2615-2622
Revised: August 26, 2011
Accepted: September 1, 2011
Published online: September 8, 2011
AIM: To investigate the effect of Shuganjianpifang on cardiac diastolic dysfunction in rats with nonalcoholic steatosis hepatitis (NASH) and to explore the possible mechanisms involved.
METHODS: NASH was induced in rats by feeding a high-fat diet. Rats were divided into eight groups: normal control group, model group, high- and low-dose Ganfang, Pifang and Shuganjianpifang groups. After treatment for 16 weeks, stroke volume (SV), left ventricular ejection fraction (LVEF), and left ventricular diameter (LVFS) were measured to evaluate cardiac systolic function, and E/A ratio was calculated to evaluate cardiac diastolic function. Serum levels of TC, TG, HDL, and LDL, as well as TC and TG in the hepatic homogenate were detected using an automatic biochemical analyzer. Histopathological changes were observed after HE staining. Serum TNF-α and IL-6 levels were determined by enzyme-linked immunosorbent assay (ELISA).
RESULTS: Compared to the normal group, rats in the model group revealed medium fatty degeneration in hepatocytes, declined cardiac diastolic function (1.59 ± 0.24 vs 1.03 ± 0.13, P < 0.01), increased serum levels TNF-α (13.57 ± 4.64 vs 28.26 ± 8.60, P < 0.01), IL-6 (59.28 ± 71.53 vs 132.81 ± 74.22, P < 0.05), TC (1.42 ± 0.29 vs 3.82 ± 0.91, P < 0.01), LDL (0.30 ± 0.11 vs 0.81 ± 0.27, P < 0.01) and hepatic levels of TC (0.90 ± 0.14 vs 11.86 ± 1.29, P < 0.01) and TG (0.75 ± 0.38 vs 6.17 ± 1.83, P < 0.01), and decreased SV, LVEF and LVFS in the model group. Compared to the model group, cardiac diastolic function was significantly improved in rats in each treatment group, especially prominent in the high-dose Shuganjianpifang group (1.26 ± 0.23 vs 1.03 ± 0.13; 1.35 ± 0.15 vs 1.03 ± 0.13, both P < 0.01). In addition, the levels of blood and liver lipids and serum TNF-α and IL-6 decreased in each treatment group, especially in the high-dose Shuganjianpifang group (0.45 ± 0.14 vs 0.83 ± 0.26; 9.17 ± 1.02 vs 11.86 ± 1.29; 2.54 ± 0.74 vs 6.17 ± 1.83; 15.07 ± 6.00 vs 28.26 ± 8.60; 67.72 ± 44.24 vs 132.81 ± 74.22, all P < 0.01).CONCLUSION: Rats with NASH develop cardiac diastolic dysfunction. Shuganjianpifang could improve cardiac diastolic function possibly by decreasing serum levels of TNF-α and IL-6 in rats with NASH.
- Citation: Wang WJ, Yang QH, Feng GF, Wang YP, He XM, Zhang YP, Yang XP, Yan HZ, Huang J, Li GQ, Zhao YF, Yang XL, Shen CH. Effect of Shuganjianpifang on cardiac diastolic function and inflammatory factors in rats with nonalcoholic steatosis hepatitis. Shijie Huaren Xiaohua Zazhi 2011; 19(25): 2615-2622
- URL: https://www.wjgnet.com/1009-3079/full/v19/i25/2615.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i25.2615
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)是指除外酒精和其他明确的肝损伤因素所致的, 以弥漫性肝细胞大泡性脂肪变为主要特征的临床病理综合征, 包括单纯性脂肪肝(simple fatty liver, SFL)以及由其演变的脂肪性肝炎(nonalcoholic steatosis hepatitis, NASH)和肝硬化[1], 是临床上的常见病和多发病, 正日益严重的影响和威胁着人们的健康. 研究表明[2], NAFLD是代谢综合征(metabolic syndrome, MS)在肝脏中的表现, 而MS是导致动脉粥样硬化和临床心脑血管事件发生的重要原因. 近年来, 临床上发现一些严重NAFLD患者出现心脏舒张功能下降, 并在随访期部分患者出现冠心病发作[3]; Villanova等[4]研究表明NAFLD患者, 尤其是NASH患者10年后出现心血管疾病(cardiovascular disease, CVD)的可能性较正常人增加. NASH 作为NAFLD的一种临床分型, 是NAFL向肝纤维化、肝硬化、肝癌进展的重要中间环节[5,6], 其与CVD的关系如何值得深入探讨. 既往的研究发现[7-9], 疏肝健脾方药可以降低肝细胞PI3Kp85α蛋白的表达、抑制Kupffer细胞ERK1/2和p38MAPK蛋白的表达及磷酸化、下调肝组织NF-κB p65蛋白的表达及磷酸化发挥抑制炎症、调节脂质代谢的作用从而具有良好的抗NAFLD效果. 本研究通过观察NASH大鼠血清中炎症因子TNF-α、IL-6水平及心功能相关指标在药物干预前后的变化, 旨在探讨疏肝健脾方药抗NASH及改善NASH大鼠心功能的作用机制.
SPF级健康♂SD大鼠80只, 体质量(200±20) g, 购于广州中医药大学实验动物中心, 实验动物许可证号: SC×K(粤)2008-0020; 粤监证字: 2008A020. 分笼饲养于室温22 ℃-26 ℃, 相对湿度60%-80%, 明暗各12 h的动物实验室内. Visual Sonics Vevo®770TM高分辨率小动物超声系统: 加拿大VisualSonics公司; TNF-α测定ELISA试剂盒购于北京达科为生物技术有限公司, 其灵敏度为7.8 pg/mL, IL-6测定ELISA试剂盒购于深圳欣博盛生物科技有限公司, 其灵敏度为30 pg/mL. (1)疏肝方(柴胡疏肝散: 柴胡6 g, 川芎5 g, 枳壳5 g, 陈皮6 g, 白芍5 g, 香附5 g, 炙甘草3 g); (2)健脾方(参苓白术散: 人参15 g, 白术15 g, 茯苓15 g, 薏苡仁9 g, 砂仁6 g, 山药15 g, 桔梗6 g, 白扁豆12 g, 莲子9 g, 炙甘草9 g); (3)综合方(柴胡疏肝散与参苓白术散合方). 上述药物均为深圳华润三九医药股份有限公司中药配方颗粒剂, 购自暨南大学附属第一医院中药房. 疏肝方及健脾方组成、剂量均参考第6版《方剂学》教材[10], 综合方乃柴胡疏肝散与参苓白术散的合方. 每组低剂量组药物为临床常规用量, 高剂量组药物为临床常规用量的3倍.
1.2.1 分组及给药: 用随机数字表法将实验动物随机分为: 正常对照组(灌服生理盐水), 模型组(灌服生理盐水), 疏肝高剂量组[灌服9.6 g/(kg·d)剂量的柴胡疏肝散]、疏肝低剂量组[灌服3.2 g/(kg·d)剂量的柴胡疏肝散], 健脾高剂量组[灌服30.0 g/(kg·d)剂量的参苓白术散], 健脾低剂量组[灌服10.0 g/(kg·d)剂量的参苓白术散], 合方高剂量组[灌服35.7 g/(kg·d)剂量的柴胡疏肝散和参苓白术散合方], 合方低剂量组[灌服11.9 g/(kg·d)剂量的柴胡疏肝散和参苓白术散合方], 每组均10只.
1.2.2 造模: 大鼠NASH模型的建立参照我们以往的方法[7-9], 并加以改进. 正常对照组大鼠以基础饲料喂养, 其他各组均以高脂饲料喂养(基础饲料88%, 猪油10%, 胆固醇1.5%, 胆盐0.5%). 在施以造模因素的同时, 按照10 ml/kg·BW分别灌胃给予各组大鼠相应的药物或生理盐水, 每天2次(早晚各1次). 每天上午定时更换大鼠高温消毒饮用水和添加饲料. 各组动物自由饮水进食, 分笼饲养于18 ℃-22 ℃明暗各12 h的暨南大学病理学生理学动物实验室内, 每周定时称体质量1次, 根据体质量调整给药量, 连续16 wk.
1.2.3指标检测: 各组动物于末次给药后, 禁食不禁水12 h, 所有大鼠用3%戊巴比妥钠腹腔麻醉(1 mL/kg·BW), 腹主动脉采血, 取血后迅速摘取肝脏, 距离肝边缘0.5 cm处取相同部位肝右叶组织, 用于病理检测. (1)心功能检测: 于16 wk从各组大鼠中分别随机抽取6只进行超声检查, 然后常规处死做后续检测. 按Visual Sonics Vevo®770TM高分辨率小动物超声诊断仪操作要求将大鼠固定于超声操作台上, 在相应超声探头与小鼠接触部位涂抹超声耦合剂, 运用系统配套RMV707B型高频超声探头在小动物超声仪器的心血管模式(cardiovascular mode)下, 设置频率为 30 MHz, 对大鼠进行实时心血管超声图像采集, 二维超声指导下的胸骨旁左心室短轴M型超声心动图按标准测量左室收缩末径、左室舒张末径、每搏输出量(SV)、左室缩短分数(LVFS), 左室射血分数(LVEF)的测量于标准心尖四腔观用双平面Simpson's法获得, 利用Doppler技术获得二尖瓣口血流频谱, 并测量出二尖瓣口舒张早期峰值(E峰)与二尖瓣口舒张晚期峰值(A峰)速度, 计算其比值(E/A比值), 测量值均为连续3个心动周期测值取平均获得. 以LVEF和LVFS来评价心脏的收缩功能, 以二尖瓣口血流频谱中的E/A比值评价心脏的舒张功能, 当E/A比值小于1, 即认为大鼠心脏舒张功能下降, 为舒张功能不全(DCD); (2)肝组织病理染色: 取距离肝边缘0.5 cm处相同部位肝右叶组织小块, 大小约1 cm×0.5 cm×0.5 cm, 经10%中性甲醛溶液固定标本, 常规脱水、石蜡包埋, 作3μm连续切片, 常规HE染色, 光镜下观察大鼠肝组织病理学改变; (3)脂质的检测: 腹主动脉采血, 用全自动生化分析仪检测血清TC、TG、HDL、LDL的含量. 取肝组织0.1 g加入0.9 mL异丙醇中, 匀浆, 离心(4 ℃, 3 000 r/min, 10 min), 提取上清液, 用全自动生化分析仪检测肝组织匀浆中TC、TG的含量; (4)TNF-α、IL-6检测: 腹主动脉取血5 mL注入试管中, 摇匀4 ℃ 3 000转/min离心10 min, 取血清置于-80 ℃保存, 用双抗体夹心ELISA法检测TNF-α、IL-6的浓度, 具体操作严格按照说明书进行.
统计学处理 采用SPSS13.0统计软件进行分析, 计量资料以mean±SD表示, 多个样本间均数比较用单因素方差分析(One-Way ANOVA), P<0.05为差异有统计学意义.
模型组大鼠的E/A比值为1.03±0.13明显低于正常组1.59±0.24(P<0.01), LVEF和LVFS也较正常组有不同程度的下降, 但无统计学意义; 各用药组大鼠E/A比值均较模型组升高, 其中各药物组的高剂量组均比相应的低剂量组改善明显, 以健脾高剂量组、综合方高剂量组升高最为显著(P<0.01), 其次是合方低剂量组、疏肝高剂量组和疏肝低剂量组(P<0.05). 各用药组大鼠的LVEF和LVFS也较模型组略有不同程度的升高, 但均没有统计学意义(表1).
| 分组 | E/A比值 | LVEF(%) | LVFS(%) |
| 正常组 | 1.59±0.24 | 75.11±2.78 | 45.51±2.65 |
| 模型组 | 1.03±0.13d | 68.91±4.42 | 40.20±3.46 |
| 疏肝高剂量组 | 1.25±0.11a | 74.48±4.59 | 44.96±4.12 |
| 疏肝低剂量组 | 1.24±0.11a | 78.14±5.46 | 48.49±5.62 |
| 健脾高剂量组 | 1.26±0.23b | 74.13±10.50 | 45.51±9.45 |
| 健脾低剂量组 | 1.22±0.16 | 73.05±7.89 | 43.92±7.60 |
| 合方高剂量组 | 1.35±0.15b | 74.59±3.14 | 45.13±3.06 |
| 合方低剂量组 | 1.23±0.17a | 72.33±3.35 | 42.99±2.75 |
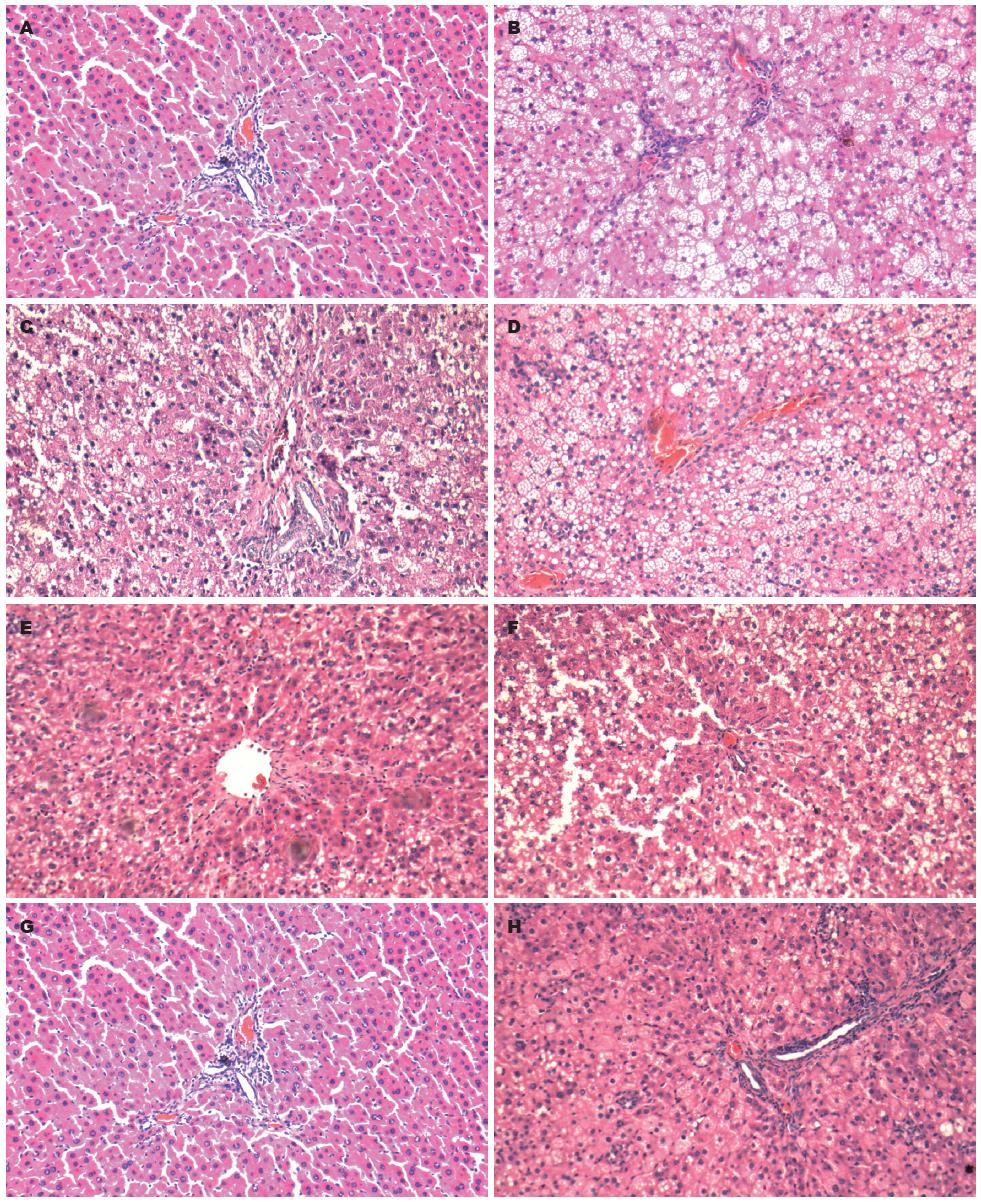
常规HE染色显示: 正常对照组肝小叶结构规则, 细胞索排列整齐, 以中央静脉为中心成放射状向四周排列, 肝窦正常, 肝细胞呈多边形, 边界清, 无明显病变, 核圆结构清晰, 位于细胞中央, 胞浆丰富红染, 细胞质均匀, 肝细胞内无脂滴沉积. 模型组大鼠肝脏脂肪变性明显, 肝细胞肿胀, 胞浆内脂滴大小不一, 以大泡性脂肪滴为主, 核被挤向边缘, 并可见广泛的气球样肝细胞及点灶状坏死; 另可见肝索紊乱, 伴肝小叶内、汇管区炎症细胞浸润, 难以找到正常的肝细胞. 上述改变提示NASH造模成功, 呈中重度脂肪变, 病理模型稳定. 各药物干预组脂滴空泡有所减少, 肝小叶、汇管区炎症细胞浸润情况均较模型组有不同程度的改善, 其中以综合方高剂量组改善最为明显(图1).
与正常组相比, 模型组大鼠血清中TC、LDL及肝组织中TC、TG含量均有显著升高(P<0.01); 与模型组相比各药物组大鼠的血脂及肝脂均有不同程度的下降, 其中各药物组的高剂量组均比相应的低剂量组改变明显, 以合方高剂量组的血清TG及肝组织TC、TG下降最为明显(P<0.01, 表2, 表3).
| 分组 | TC | TG | HDL-C | LDL-C |
| 正常组 | 1.42±0.29 | 0.56±0.27 | 0.67±0.24 | 0.30±0.11 |
| 模型组 | 3.82±0.91d | 0.83±0.26 | 0.63±0.16 | 0.81±0.27a |
| 疏肝高剂量组 | 3.40±0.77 | 0.54±0.18 | 0.53±0.13 | 0.72±0.25 |
| 疏肝低剂量组 | 4.15±0.67 | 0.60±0.19 | 0.59±0.08 | 0.92±0.17 |
| 健脾高剂量组 | 3.67±1.24 | 0.46±0.13a | 0.68±0.12 | 0.73±0.23 |
| 健脾低剂量组 | 3.90±0.82 | 0.72±0.23 | 0.69±0.20 | 0.98±0.30 |
| 合方高剂量组 | 2.76±0.48 | 0.45±0.14b | 0.52±0.07 | 0.64±0.23 |
| 合方低剂量组 | 3.02±0.47 | 0.43±0.09b | 0.67±0.15 | 0.52±0.09 |
与正常对照组相比, 模型组大鼠血清TNF-α、IL-6的含量均有明显升高(P<0.01, P<0.05); 与模型组相比, 各药物组大鼠血清TNF-α、IL-6的含量有不同程度的下降, 其中各药物组的高剂量组均比相应的低剂量组改变明显, 以综合方高剂量组的血清TNF-α、IL-6的含量下降最为明显(P<0.01, P<0.05), 综合方低剂量组、健脾方高剂量组和疏肝方高剂量组的血清TNF-α含量下降较为明显(P<0.05, 表4).
胰岛素抵抗(insulin resistance, IR)是NAFLD发病的始动及中心环节[11], 中央性肥胖是NAFLD的主要发病机制之一[12], 而由此引发的糖脂质代谢紊乱、慢性亚临床炎症状态、炎症细胞因子分泌增加、脂联素分泌减少及内皮细胞功能失调等机制使NAFLD与CVD之间相互影响相互作用[13]. 近年来国内外许多前瞻性的流行病学研究发现NAFLD与CVD关系密切, NAFLD本身就可以导致CVD的发生. Hamaguchi等[14]研究发现, NAFLD患者CVD的发生率明显增加, NAFLD是CVD的独立危险因素, 并且在有MS存在的心血管事件中起关键作用. 黄群等[15]研究在排除了年龄、性别和BMI的影响后发现, NASH患者DCD的发生率显著高于SFL和正常对照组, 而且前者的二尖瓣口血流频谱中E/A比值显著低于后两者, 提示DCD与NASH关系密切, 通过了解NASH患者心脏的舒张功能, 或许能预测未来CVD的发生率. DCD的意义主要表现有3种类型: (1)收缩功能异常的早期表现; (2)与收缩功能异常同时存在; (3)单纯性DCD. 大部分心力衰竭患者左室舒张功能异常早于收缩功能异常, 其中舒张功能不全的占40%-50%, 即使存在收缩功能障碍, 其症状和预后亦主要取决于舒张功能障碍的程度[16,17]. 因此早期发现心脏舒张功能不全有十分重要的临床意义. 另外, 在排除肥厚性心肌病等特殊病因, 冠状动脉硬化性心脏病是导致DCD的最常见原因[14], 而二尖瓣血流频谱(MVF)是目前评价左室舒张功能最常用的一种方法[17].
炎症细胞因子是NAFLD、胰岛素抵抗和慢性心功能不全之间的重要联结因子, 谢伶俐等[18]研究显示, NASH和SFL患者血清TNF-α、IL-6水平均显著高于正常对照组, 以NASH组水平最高, 表明TNF-α、IL-6水平升高是NAFLD患者普遍存在的现象, 而NASH患者TNF-α、IL-6水平达峰值可能与此期肝细胞内NF-κB等信号通路激活产生大量炎症细胞因子以及肝脏发生Th-1极化有关. Tsujimoto等[19]研究显示NASH大鼠伴有多种炎症细胞因子的增多. 于荣波等[20]研究发现血清TNF-α和IL-6水平与心功能的关系密切, 且两者反映心功能的指标发生改变一致, 对评价心脏功能及其严重程度有重要价值. Unal等[21]研究结果也显示了高水平TNF-α和IL-6是心血管疾病的高危险因素. IR引起肝细胞脂肪变性, 同时释放出的活性氧簇损可以损伤肝细胞, 导致TNF-α、IL-6等炎症因子的大量释放以及肝内炎症环境的形成, 同时也给动脉粥样硬化的形成提供了炎症环境. 目前已认识到导致心功能下降发生发展的基本机制是心肌重塑[22], 其发生是机体试图通过增加心室壁厚度以减轻室壁应力来实现的; 而TNF-α和IL-6主要是由激活的单核/巨噬细胞系统分泌的具有多重生物效应的细胞炎症因子, 其活化与胰岛素抵抗、心功能的状态有关, 二者可通过介导左心室重构、降低心肌收缩力、使肾上腺素受体失耦联等作用引发和加重HF[23], 导致左心室功能失调, 加重心功能恶化. 所以我们认为TNF-α、IL-6通过诱导胰岛素抵抗, 不但对NASH疾病本身的发生与发展起重要作用, 还可能参与NAFLD相关疾病代谢综合征的形成, 从而对NAFLD的预后产生影响, TNF-α、IL-6是否可以作为可靠的标志物用于NAFLD严重程度及预后的评估, 或成为有潜力的靶点用于疾病治疗, 有待进一步研究证实.
在评价CDC功能的影像学参数上, 本文采用彩色多普勒超声技术测量二尖瓣口血流频谱中的E/A比值来评价心脏舒张功能, 他具有无创、易重复、操作方便的特点, 已成为目前应用广泛的心功能检查方法. 本实验结果显示模型组大鼠肝细胞脂肪变性明显、血脂及肝脂升高, 出现的脂质代谢紊乱血液黏稠度增加皆是NASH的基本病机, 同时也可能成为加快动脉粥样硬化形成的重要因素; 模型组大鼠的E/A比值明显下降, 与正常组比较有显著统计学意义; 而LVEF和LVFS虽然较正常组有所下降, 但两者之间差异没有统计学意义, 是否大鼠NASH对心功能的影响有一个渐进的过程, 最先影响心脏的舒张功能, 然后随着病情的加重出现心脏收缩功能的异常甚至全心功能的衰竭, 还是存在其他的作用途径, 有待进一步研究; 另外模型组大鼠血清中TNF-α、IL-6水平显著高于正常组, 且变化趋势与E/A比值相似, 提示NASH大鼠出现心脏舒张功能的下降可能与大鼠肝细胞内NF-κB等信号通路激活产生的大量TNF-α、IL-6等炎症细胞因子密切相关.
中医认为"心主身之血脉", 心脏有推动血液在脉管中运行的作用, 而心脏之所以能推动血液的运行全赖于心气的作用, 心气、心血的充盈需要脾运化水谷精微的充养及肝藏血功能的正常. 脂质属于精微物质的范畴, 为人体新陈代谢所必需, 而这种精微物质来源于饮食水谷, 其输布代谢有赖于脾之运化功能与肝之疏泄功能, 二者相互协调、相互为用维持动态平衡, 即脂质代谢自稳态. 当肝失疏泄、脾失健运导致水谷不化、精微不布久则痰瘀互结, 继而出现瘀阻脉络、心气虚弱, 血脉运行无力. 研究发现[24-27], 肝郁脾虚是NAFLD 发病及迁延反复的主要病机, 其在脂肪肝的发生发展中具有重要的作用和地位, 疏肝健脾治法应贯穿NAFLD治疗的始终. 我们在防治脂肪肝的临床研究中发现[26], 从初期到中期的NAFLD患者多为肝郁脾虚证,以疏肝、健脾法作为基本治法, 运用古代经典方柴胡疏肝散及参苓白术散加减治疗NAFLD收到了较好的效果. 本实验采用疏肝健脾治法方药以治其本, 实验结果表明该方药可以改善肝郁、心脾两虚的症状, 减轻肝细胞脂肪变性, 降低血清中脂质含量. 与模型组比较, 各药物组大鼠血清中TNF-α、IL-6水平和心脏E/A比值显著降低, 其中以疏肝健脾综合方高剂量组最为明显, 表明疏肝健脾方药抗NASH和改善心脏舒张功能可能与其降低TNF-α、IL-6水平有关. NASH是NAFLD向肝纤维化肝硬化进展的重要中间阶段, 病情发展较快, 肝郁脾虚症状较为严重, 所以用疏肝健脾合方的高剂量收到较好效果, 可能存在量效依赖关系. 同时提示肝郁脾虚所致的心气虚弱、脉络瘀阻可能是NASH大鼠出现心功能下降的中医病机, 疏肝健脾方药可能发挥抗NASH、改善心功能的作用, 也进一步证明中医药对防治慢性代谢性相关疾病有不容替代的优势, 但其具体详细机制仍需深入细致探讨.
衷心感谢中山大学纪桂元博士的热心帮助.
非酒精性脂肪性肝炎是与胰岛素抵抗和遗传易感性密切相关的获性代谢疾病, 属于非酒精性脂肪性肝病的一种病理分型, 也是单纯性脂肪肝向肝纤维化、肝硬化进展的重要中间环节, 近年来非酒精性脂肪性肝炎的发病率及检出率日益增高, 并呈低龄化趋势.
李军祥, 教授, 北京中医药大学附属东方医院消化内科
非酒精性脂肪性肝炎作为非酒精性脂肪肝病的一种重要临床分型, 是单纯性脂肪肝向肝纤维化、肝硬化、肝癌进展的重要中间环节. 对非酒精性脂肪性肝炎的研究是近些年来国内外医学研究的热点. 运用中医药治疗此病也已经逐渐得到广泛的重视.
非酒精性脂肪性肝炎是代谢综合征在肝脏中的表现, 而MS是导致动脉粥样硬化和临床心脑血管事件发生的重要原因. 国内外的研究发现, 一些严重的非酒精性脂肪肝病患者出现心脏舒张功能下降, 并在随访期部分患者出现冠心病发作, 尤其是非酒精性脂肪性肝炎患者10年后出现心血管疾病的可能性较正常人增加.
本文以非酒精性脂肪性肝炎大鼠为研究对象, 基于前期较好的研究基础, 探讨疏肝健脾治法方药抗非酒精性脂肪性肝炎及改善非酒精性脂肪性肝炎大鼠心功能的作用机制, 充分体现了中医药的特色与优势.
本研究证实了非酒精性脂肪性肝炎大鼠伴有心脏舒张功能不全, 疏肝健脾方药抗非酒精性脂肪性肝炎及改善非酒精性脂肪性肝炎大鼠心脏舒张功能可能与其降低血清中炎症因子TNF-α和IL-6的水平有关, 为非酒精性脂肪性肝炎的机制研究及临床治疗提供参考.
E/A比值: 指血流在二尖瓣口舒张早期峰值速度与二尖瓣口舒张晚期峰值速度的比值, 反映的是组织结构运动的变化, 具有相对不依赖血流负荷的影响, 在二尖瓣血流频谱假性正常化时, 具有重要的鉴别价值, 临床上用于评价左心室的舒张功能, E/A比值小于1, 即认为心脏舒张功能下降.
该论文结构合理, 方法先进, 从另一角度探讨疏肝健脾方药对非酒精性脂肪性肝炎合并心脏舒张功能不全大鼠干预的作用机制, 体现中医的整体观念, 对临床有一定的参考价值.
编辑: 李军亮 电编:何基才
| 2. | Kotronen A, Yki-Järvinen H. Fatty liver: a novel component of the metabolic syndrome. Arterioscler Thromb Vasc Biol. 2008;28:27-38. [PubMed] [DOI] |
| 3. | 黄 群, 陈 小珠, 黄 健, 徐 平如, 何 剑琴, 王 晓玲, 郑 昌京, 李 俊达. 非酒精性脂肪性肝病患者心脏舒张功能变化的研究. 胃肠病学和肝病学杂志. 2010;19:75-77. |
| 4. | Villanova N, Moscatiello S, Ramilli S, Bugianesi E, Magalotti D, Vanni E, Zoli M, Marchesini G. Endothelial dysfunction and cardiovascular risk profile in nonalcoholic fatty liver disease. Hepatology. 2005;42:473-480. [PubMed] [DOI] |
| 6. | Farrell GC, Larter CZ. Nonalcoholic fatty liver disease: from steatosis to cirrhosis. Hepatology. 2006;43:S99-S112. [PubMed] [DOI] |
| 7. | 杨 钦河, 欧 健, 孙 升云, 乔 娜丽, 程 少冰, 陈 万群, 金 玲, 杨 环文, 李 娜, 纪 桂元. 肝健脾方药对非酒精性脂肪性肝病大鼠肝细胞PI3Kp85α蛋白表达的影响. 广东药学院学报. 2009;25:62-67. |
| 8. | 孟 民杰, 杨 钦河, 王 强, 陈 雪梅, 王 凤珍, 王 彦平, 唐 海兰, 程 少冰, 凌 家生, 温 承远. 不同治法方药对脂肪肝大鼠kupffer细胞ERK1/2蛋白活性的影响. 中国病理生理杂志. 2007;23:1551-1555. |
| 9. | 杨 钦河, 谢 芳, 王 凤珍, 凌 家生, 王 强, 程 少冰, 唐 海兰, 胡 巢凤, 王 彦平, 孙 升云. 不同治法方药对脂肪肝大鼠肝组织NF-κB p65及kupffe细胞p38MAPK蛋白表达的影响. 广州中医药大学学报. 2009;27:141-147. |
| 10. | 段 富津. 方剂学. 第1版. 上海: 上海科学技术出版社 1995; 114-115, 178-179. |
| 12. | Tarquini R, Lazzeri C, Boddi M, Marra F, Abbate R, Gensini GF. [Non-alcoholic fatty liver disease: a new challenge for cardiologists]. G Ital Cardiol (Rome). 2010;11:660-669. [PubMed] |
| 13. | Paschos P, Paletas K. Non alcoholic fatty liver disease and metabolic syndrome. Hippokratia. 2009;13:9-19. [PubMed] |
| 14. | Hamaguchi M, Kojima T, Takeda N, Nagata C, Takeda J, Sarui H, Kawahito Y, Yoshida N, Suetsugu A, Kato T. Nonalcoholic fatty liver disease is a novel predictor of cardiovascular disease. World J Gastroenterol. 2007;13:1579-1584. [PubMed] |
| 18. | 谢 伶俐, 周 力, 李 丽滨, 陈 晓琴, 张 永宏, 杨 杰. TNF-α和IL-6在非酒精性脂肪性肝病患者血清中的水平及意义. 世界华人消化杂志. 2010;18:1492-1496. [DOI] |
| 19. | Tsujimoto T, Kawaratani H, Kitazawa T, Yoshiji H, Fujimoto M, Uemura M, Fukui H. Immunotherapy for nonalcoholic steatohepatitis using the multiple cytokine production modulator Y-40138. World J Gastroenterol. 2009;15:5533-5540. [PubMed] [DOI] |
| 21. | Unal S, Gumruk F, Aytac S, Yalnzoglu D, Gurgey A. Interleukin-6 (IL-6), tumor necrosis factor-alpha (TNF-alpha) levels and IL-6, TNF-polymorphisms in children with thrombosis. J Pediatr Hematol Oncol. 2008;30:26-31. [PubMed] |