修回日期: 2011-08-08
接受日期: 2011-08-12
在线出版日期: 2011-08-18
目的: 探讨RNA干扰沉默NHE1基因后对人肝癌细胞株MHCC97-H细胞侵袭迁移的影响.
方法: 应用NHE1基因小干扰RNA(small interfering RNA, siRNA)转染人肝癌细胞株MHCC97-H细胞, 同时设立空白对照组和无关对照组. 转染成功后采用RT-PCR和Western blot分别从基因和蛋白水平检测RNA干扰沉默NHE1基因的效果. MTT法测定转染后三组细胞的增殖状况, Transwell小室检测沉默NHE1基因对MHCC97-H细胞侵袭、转移能力的影响, 进一步采用免疫荧光观察其对MHCC97-H细胞骨架和伪足的影响.
结果: 与两对照组比较, 转染NHE1-siRNA组NHE1 mRNA和蛋白表达水平均明显降低(P<0.05); 细胞侵袭、迁移实验结果显示, NHE1-siRNA组穿透人工基底膜的细胞数(34.1±5.2, 120.2±12.8)较空白对照组(56.9±6.1, 235.2±16.8)和转染无关对照组(57.2±6.1, 231.9±14.7)均明显减少, 差异均有统计学意义(P<0.05), 而空白对照组与无关对照组比较差异无统计学意义; MTT结果显示, 转染后48 h和72 h三组细胞间增殖活性差异无统计学意义; NHE1基因沉默后与两对照组相比, MHCC97-H细胞膜伪足形成减少, 细胞内肌动蛋白网排列紊乱.
结论: siRNA沉默NHE1基因后可能通过影响MHCC97-H细胞骨架的重组和伪足的形成, 从而抑制MHCC97-H细胞的侵袭和迁移能力.
引文著录: 孙伟, 王德盛, 杨薛康, 周亮, 张勇, 苟泽鹏, 祝普利, 张福琴, 窦科峰. siRNA沉默NHE1基因对MHCC97-H肝癌细胞侵袭迁移的影响. 世界华人消化杂志 2011; 19(23): 2437-2442
Revised: August 8, 2011
Accepted: August 12, 2011
Published online: August 18, 2011
AIM: To investigate the effect of small interfering RNA (siRNA)-mediated silencing of the Na+/H+ exchanger 1 (NHE1) gene on cell invasion and migration in human hepatocellular carcinoma cell line MHCC97-H.
METHODS: After MHCC97-H cells were transfected with NHE1-specific siRNA, the levels of NHE1 mRNA and protein were detected by reverse transcription-polymerase chain reaction (RT-PCR) and Western blot, respectively. Cell proliferation was detected by MTT assay. The impact of NHE1 knockdown on cell invasion and migration was determined by Transwell chamber assay. The changes in morphology cytoskeleton and pseudopodia were observed by immunofluorescence.
RESULTS: Compared to negative control and mock control cells, the levels of NHE1 mRNA and protein in MHCC97-H cells transfected with NHE1-specific siRNA decreased significantly (P < 0.05). NHE1 knockdown significantly suppressed the invasion and migration of MHCC97-H cells compared to negative control and mock control cells (34.1 ± 5.2 vs 56.9 ± 6.1, 57.2 ± 6.1; 120.2 ± 12.8 vs 235.2 ± 16.8, 231.9 ± 14.7; all P < 0.05). However, there were no significant differences in cell migration and invasion between the two control groups. Cell proliferation showed no significant differences among the three groups 48 or 72 h after transfection. Compared to the two control groups, deletion of NHE1 decreased the number of membrane pseudopodia and disrupted the cross-linked actin network in MHCC97-H cells.
CONCLUSION: Deletion of NHE1 inhibits cell invasion and migration by influencing cytoskeleton rearrangement and pseudopodia formation in human hepatocellular carcinoma cell line MHCC97-H.
- Citation: Sun W, Wang DS, Yang XK, Zhou L, Zhang Y, Gou ZP, Zhu PL, Zhang FQ, Dou KF. SiRNA-mediated silencing of the NHE1 gene inhibits cell invasion and migration in human hepatocellular carcinoma cell line MHCC97-H. Shijie Huaren Xiaohua Zazhi 2011; 19(23): 2437-2442
- URL: https://www.wjgnet.com/1009-3079/full/v19/i23/2437.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i23.2437
钠氢交换蛋白1(Na+/H+exchanger1, NHE1)是存在于所有真核细胞的一种跨膜蛋白, 其功能是通过Na+、H+交换将细胞内过多的H+排出, 在维持细胞内pH值、稳定细胞容量、参与离子转运、调节肿瘤细胞行为如侵袭和转移等方面具有重要的作用[1-3]. 另有研究表明, NHE1可与肌动蛋白结合蛋白(ezrin, radixin and moesin, ERM)之间发生结构联系, 参与细胞形态的维持以及调节细胞的运动能力[4-6]. 肝癌是我国最常见的恶性肿瘤之一, 其中90%的患者死于肝癌转移, 严重威胁着人类的健康[7,8]. 我们前期研究证明, NHE1 mRNA和蛋白在肝癌组织中的表达程度显著高于正常肝组织和癌旁组织, 提示NHE1可能与肝癌的恶性程度和侵袭转移有密切的关系[9-11]. 本研究以人肝癌细胞株MHCC97-H细胞为研究对象, 采用脂质体转染小干扰RNA沉默NHE1基因, 观察转染后MHCC97-H细胞侵袭、迁移能力的变化, 观察转染后细胞骨架肌动蛋白和细胞伪足的变化, 以期找出抑制肝癌侵袭转移的治疗靶点.
肝癌细胞株MHCC97-H购自上海复旦大学肝癌研究所, DMEM培养基购自Gibco公司. TRIzol、脂质体转染试剂LipofectamineTM2000购自Invitrogen公司. 逆转录试剂盒购自Fermentas公司. NHE1基因siRNA购自上海吉玛生物有限公司(NHE1-siRNA 序列1、正义链: 5'-GCCCUGUUAAUCAUUCCGUTT-3', 反义链: 5'-ACGGAAUGAUUAACAGGGCTT-3'; 序列2、正义链: 5'-GACAAGCUCAACCGGUUUATT-3', 反义链: 5'-UAAACCGGUUGAGCUUGUCTT-3'; 序列3、正义链: 5'-GUGAGCAGAUCAACAACAUTT-3', 反义链: 5'-AUGUUGUUGAUCUGCUCACTT-3'; 无关对照siRNA正义链: 5'-UUCUCCGAACGUGUCACGUTT-3', 反义链: 5'-ACGUGACACGUUCGGAGAATT-3'). 本实验应用抑制效率最高的序列1作为研究序列. NHE1和GAPDH引物由北京奥科鼎盛生物科技有限公司公司合成. 鼠抗人NHE1抗体购自Millipore公司. 鼠抗人β-actin抗体购自Santa Cruz公司. 异硫氰酸荧光素(FITC)标记的鬼笔环肽(Phalloidin)购自sigma公司. Transwell小室购自Millipore公司. Matrigel购自美国BD公司.
1.2.1 细胞培养: 肝癌细胞株MHCC97-H在含100 mL/L胎牛血清的DMEM培养液(含青霉素100 kU/L, 链霉素100 μg/mL), 37 ℃、50 mL/L CO2、饱和湿度环境的条件下连续培养. 待对数生长期时, 收取细胞, 进行实验.
1.2.2 NHE1-siRNA转染及细胞分组: 转染前24 h, 取对数生长期的细胞胰酶消化、计数, 调整细胞数为2.0×105/孔, 接种于6孔板, 孵箱培养, 使细胞密度达到60%. 转染时用Opti-MEM培养基2 mL换去完全培养基. 分别用250 μL的Opti-MEM稀释200 pmol siRNA和5 μL LipofectamineTM2000, 混匀, 室温孵育5 min后, 将250 μl LipofectamineTM2000混合物加入siRNA混合物中, 总体积为500 μL, 混匀, 室温孵育20 min, 将500 μL siRNA/LipofectamineTM2000混合物分别加入6孔板中, 混匀, 培养4-6 h后更换完全培养基, 37 ℃继续培养48-72 h用于实验. 细胞分组: (1)空白对照组: 转染时加入Opti-MEM培养基; (2)无关对照组: 转染时加入非特异性siRNA/LipofectamineTM2000复合物; (3)NHE1-siRNA组: 转染时加入NHE1特异性siRNA/Lipofectaminetm2000复合物.
1.2.3 RT-PCR: 细胞转染48 h后收集细胞, 按TRIzol说明书操作提取细胞总RNA, 按逆转录试剂盒说明书进行逆转录反应, RNA量为1 μg, 引物为Oligo(dT)18, 反应条件为70 ℃ 5 min、0 ℃ 5 min、37 ℃ 5 min、42 ℃ 60 min、70 ℃ 10 min、-20 ℃保存. 用于扩增人NHE1 cDNA的引物序列为: 上游引物序列: 5'-CACACCACCATCAAATACTTCC-3', 下游引物序列: 5'-GAACTTGTTGATGAACCAGGTC-3'; 以人GAPDH为内参照, 上游引物序列为: 5'-ACCACAGTCCATGCCATCAC-3', 下游引物序列为: 5'-TCCACCACCCTGTTGCTGTA-3'. PCR反应条件为: 94 ℃ 5 min预变性, 94 ℃ 30 S, 59 ℃ 30 s, 72 ℃ 30 s, 共30个循环, 72 ℃延伸10 min. 取PCR扩增产物15 μl, 经2.5%琼脂糖凝胶电泳, 溴化乙锭染色后, 用UVP凝胶成像系统进行检测, 并用Gelpro软件对阳性条带的密度进行测定, 以相对光密度率(以NHE1的阳性条带光密度与GAPDH相比)作为NHE1 mRNA的相对表达量. 实验重复3次.
1.2.4 Western blot检测NHE1蛋白的表达: 转染后72 h, 用RIPA和PMSF提取细胞总蛋白. BCA法检测蛋白浓度. 取50 μg蛋白质样品, 与5×上样缓冲液混合, 沸水煮5 min变性, 经SDS-PAGE, 蛋白从凝胶中转移到PVDF膜上, 含5%脱脂奶粉的TBST封闭2 h. 加入鼠抗人NHE1单克隆抗体(1∶500稀释)和鼠抗人β-actin单克隆抗体(1∶500稀释), 4 ℃孵育过夜, TBST漂洗3次, 每次5 min, 加入HRP标记的羊抗鼠二抗(1∶5 000稀释)室温孵育2 h, ECL显影, 并进行密度分析. 实验重复3次.
1.2.5 MTT分析: 取对数生长期的细胞胰酶消化、计数, 调整细胞数为5.0×103/孔, 接种于96孔板, 37 ℃孵箱培养24 h, 常规分组转染细胞, 分别于转染后24 h、48 h和72 h, 各孔加入MTT溶液(5 g/L)20 μL, 37 ℃孵育4 h, 吸弃孔内培养液, 加入DMSO 150 μL, 充分溶解结晶物, 读取各孔光吸收值(490 nm波长). 每组每个时间点设3个平行样本, 取各组值的均数表示细胞的增殖情况, 实验重复3次.
1.2.6 细胞侵袭实验: 将Matrigel胶(50 μL/孔)均匀地铺在Transwell小室膜上, 收集转染48 h后的各组细胞5×104个, 用200 μL无血清DMEM培养液稀释后接种到上室中, 将小室置于加有600 μL 含200 mL/L胎牛血清DMEM培养液的24孔板内, 37 ℃、50 mL/L CO2, 孵育24 h后取出小室, 小心擦掉上室细胞, PBS洗3次, 950 mL/L乙醇固定, 结晶紫染色, 200倍显微镜下计数5个视野穿过微孔的细胞数, 取其均值, 每组3个小室, 实验重复3次.
1.2.7 细胞迁移实验: 迁移实验不铺Matrigel胶, 孵育24 h后取出小室, 其余步骤同侵袭实验.
1.2.8 免疫荧光标记细胞骨架: 转染后48 h细胞爬片, 常规培养24 h后, 吸净培养基, PBS冲洗3遍, 40 g/L多聚甲醛室温下固定20 min, PBS再冲洗3遍, 0.5% Triton X-100透膜10 min, 用FITC-鬼笔环肽室温下孵育30 min标记细胞骨架肌动蛋白, PBS冲洗3遍, 50%甘油封片. 荧光显微镜观察细胞骨架和细胞膜伪足(×400), 并拍照.
统计学处理 采用SPSS13.0统计软件分析, 计量资料以mean±SD表示, 组间比较采用单因素方差分析.
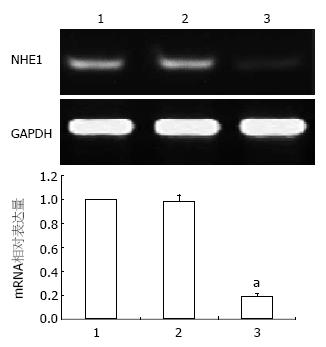
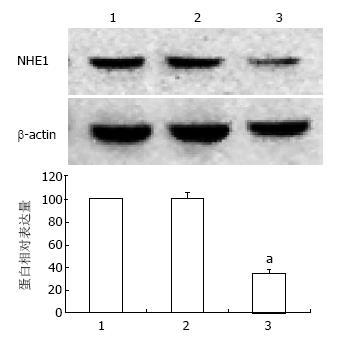
转染48 h后, siRNA组细胞NHE1基因 mRNA水平明显下调, 与空白对照组和无关对照组比较差异有统计学意义(P<0.05), 而空白对照组和无关对照组NHE1 mRNA表达差异无统计学意义(图1); western blot结果显示, NHE1-siRNA转染组NHE1蛋白表达水平较空白对照组和无关对照组明显降低, 差异具有统计学意义(P<0.05), 空白对照组和无关对照组间差异无统计学意义(图2), 表明NHE1基因被成功抑制.
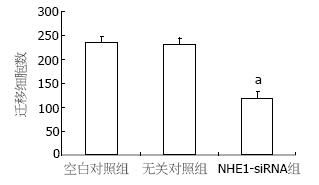
空白对照组迁移细胞数目为235.2±16.8个, 转染无关对照组为231.9±14.7个, 而NHE1-siRNA转染组为120.2±12.8个, 与空白对照组和无关对照组比较差异均有统计学意义(P<0.05, 图3).
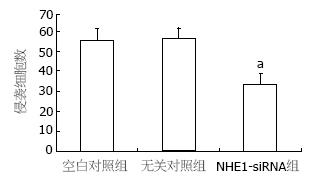
空白对照组穿透人工基底膜细胞数目为56.9±6.1个, 无关对照组为57.2±6.1个, 两者差异无统计学意义, NHE1-siRNA组为34.1±5.2个, 与空白对照组和无关对照组比较差异均有统计学意义(P<0.05, 图4).
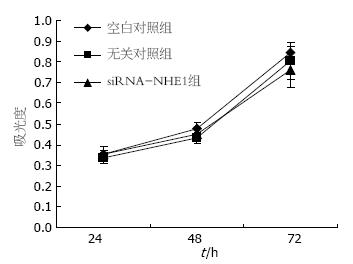
MTT方法检测结果显示, 转染后空白对照组、无关对照组和NHE1-siRNA组间光吸收值无明显差异(48 h: 0.476±0.035, 0.433±0.025 vs 0.450±0.034; 72 h: 0.846±0.032, 0.806±0.087 vs 0.761±0.082), 即转染后48 h和72 h 3组细胞间增殖差异无统计学意义(图5).
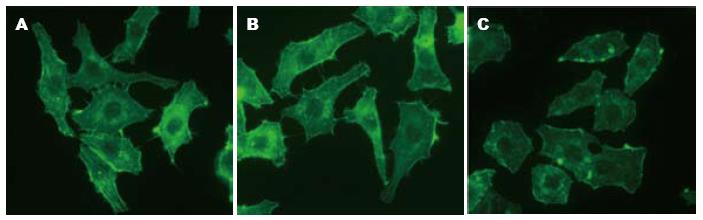
空白对照组和无关对照组MHCC97-H细胞内肌动蛋白网和细胞膜伪足形成正常, 细胞转染NHE1-siRNA后, 与两对照组相比, 细胞内肌动蛋白网排列紊乱, 形成减少, 细胞膜伪足回缩、形成减少或消失(图6).
肝癌是恶性程度极高、预后极差的恶性肿瘤, 侵袭和转移是其作为恶性肿瘤重要的生物学特性, 同时也是肝癌治疗失败和患者致死的主要原因[12], 肝癌的侵袭转移涉及许多方面, 其具体机制尚不明确, 研究肝癌侵袭转移调控的机制对于预防和阻止肝癌侵袭转移至关重要.
NHE1是存在于细胞膜表面的离子转运蛋白, 调控细胞内pH的动态平衡[13,14]. 在肿瘤细胞中, NHE1表达增加及活性增强[15], 形成肿瘤细胞胞内碱性、胞外酸性的特殊微环境. 除此之外, 研究发现, NHE1可以通过与ERM之间发生结构联系锚定肌动蛋白丝, 控制细胞骨架的完整, 从而参与细胞形态的维持及细胞运动的调节[4,16,17]. 在表达突变NHE1的成纤维细胞中, 不影响NHE1的离子交换功能, 但可以阻断NHE1与ERM的结合, 发现这种突变会降低细胞黏附力, 影响细胞的极性和细胞的定向运动[4]. 本研究中, 采用siRNA干扰沉默NHE1基因后, MHCC97-H细胞NHEl mRNA和蛋白含量明显降低, 说明NHEl基因已被成功沉默. 研究发现, NHE1-siRNA转染MHCC97-H细胞后, 与空白对照组和无关对照组相比, 穿透人工基底膜的MHCC97-H细胞明显减少. 提示NHE1可能参与了MHCC97-H细胞移动的调节.
Transwell侵袭小室是体外检测肿瘤细胞侵袭力筛选高转移细胞的经典方法, 其结果反映了细胞对细胞外基质的穿透能力和细胞的侵袭能力. 本研究中发现, 转染NHE1-siRNA的MHCC97-H细胞其侵袭力较空白对照组和无关对照组明显下降, 表明NHE1可能促进了MHCC97-H细胞的侵袭能力.
在肿瘤的侵袭转移过程中, 细胞骨架的重组发挥了重要作用. 而许多侵袭性肿瘤细胞有与侵袭性密切相关的伪足[18-20]. 有研究显示NHE1定位于极性细胞的前端, 对伪足形成和细胞趋化有重要作用[21,22]. 应用NHE1抑制剂可以阻断这种侵袭结构的形成以及减弱细胞的侵袭能力[23]. 在乳腺癌细胞研究中发现, NHE1在侵袭性伪足聚集表达, 并在此区域产生酸性环境, 促进细胞外基质降解, 利于肿瘤侵袭转移[24,25]. 在仓鼠肺成纤维细胞的研究中发现, 抑制NHE1可抑制由RhoA介导的应力纤维的聚合及细胞骨架的调节, 推测NHE1可能作为RhoA的下游分子影响细胞形态的调节[26,27]. Paradiso等[28]研究发现, 血清剥夺可以通过NHE1和RhoA交互作用, 诱导NHE1依赖的细胞形态学和骨架改变, 导致肿瘤细胞趋化和侵袭. 提示RhoA可能通过对NHE1的调节, 引起细胞骨架改变, 从而影响肿瘤细胞侵袭. 另有研究发现, NHE1的活性与细胞伪足的形成有关, 而伪足对肿瘤细胞的运动、黏附至关重要, 用5-(N-ethyl-N-isopropyl) amiloride (EIPA, NHE1抑制剂)抑制转染了鼠肉瘤病毒(MSV)的上皮细胞MSV-MDCK的NHE1活性可以引起该细胞的细胞骨架结构的显著改变. 表现为肌动蛋白纤维松弛, 伪足中肌动蛋白变少, 伪足变浅、消失, 细胞变圆, 细胞从支持物上脱落. 去EIPA后, 伪足又重新形成. 推测NHE1可能与细胞伪足的形成及细胞运动密切相关[29]. 在成纤维细胞研究中发现, 其伪足中存在NHE1、F肌动蛋白和Talin的共区域化, NHE1可以通过其胞质区与肌动蛋白的联系参与灶性黏附作用(focal adhension), 表明NHE1可能直接参与肿瘤细胞伪足形成、运动和黏附过程[30]. 本研究中, 采用siRNA干扰沉默NHE1基因后, 肝癌细胞内的肌动蛋白网排列紊乱, 同时细胞伪足形成减少. 而空白对照组和无关对照组, 无此改变, 提示NHE1与细胞骨架重组及细胞伪足形成相关, 进而影响细胞的侵袭.
总之, NHE1可能通过改变细胞骨架和伪足形成参与了肿瘤的侵袭和转移,这为在肝细胞癌治疗过程中, 采用针对NHE1基因治疗提供了理论依据. 但NHE1调控细胞骨架和伪足形成的具体分子机制尚待进一步研究.
钠氢交换蛋白1广泛存在于细胞膜表面, 可通过排出细胞内H+,形成细胞外酸性微环境, 也可通过与肌动蛋白结合蛋白(ezrin, radixin and moesin, ERM)的联系,参与细胞形态的维持及伪足的形成. 近年来研究表明, 钠氢交换蛋白1在多种肿瘤细胞中表达增加, 并和肿瘤细胞的侵袭转移密切相关.
范学工, 教授, 中南大学湘雅医院感染病科; 荚卫东, 教授, 安徽省立医院肝胆外科
研究表明, NHE1在侵袭性伪足处聚集维持酸性微环境, 通过介导溶酶体向细胞外围转运和胞吐作用, 释放多种蛋白酶以降解细胞外基质, 利于肿瘤侵袭转移, 但其具体机制有待进一步研究.
在乳腺癌细胞中发现, 定位于侵袭性伪足的NHE1可在其周围形成酸性微环境, 利于细胞外基质降解, 进而促进肿瘤侵袭, 为证明NHE1在肿瘤侵袭中的作用提供了结构基础.
既往研究多集中于NHE1通过调节细胞内外的酸碱环境, 进而调节细胞的多种行为, 本文从NHE1与细胞结构关系方面对NHE1在肿瘤侵袭转移中的作用进行了初步研究.
细胞骨架重组和细胞伪足的形成在肿瘤细胞侵袭转移中发挥着重要作用, 研究表明NHE1参与了细胞骨架重组和伪足形成, 故可通过抑制NHE1抑制伪足或伪足形成的中间环节, 进而达到抑制肿瘤侵袭转移的目的.
本文设计尚合理, 内容较新颖, 有一定创新性, 学术价值较好, 为进一步探讨肝癌转移机制提供了有价值的实验结果.
编辑 曹丽鸥 电编 何基才
| 1. | Harguindey S, Orive G, Luis Pedraz J, Paradiso A, Reshkin SJ. The role of pH dynamics and the Na+/H+ antiporter in the etiopathogenesis and treatment of cancer. Two faces of the same coin--one single nature. Biochim Biophys Acta. 2005;1756:1-24. [PubMed] |
| 2. | Malo ME, Fliegel L. Physiological role and regulation of the Na+/H+ exchanger. Can J Physiol Pharmacol. 2006;84:1081-1095. [PubMed] [DOI] |
| 3. | Cardone RA, Casavola V, Reshkin SJ. The role of disturbed pH dynamics and the Na+/H+ exchanger in metastasis. Nat Rev Cancer. 2005;5:786-795. [PubMed] [DOI] |
| 4. | Denker SP, Huang DC, Orlowski J, Furthmayr H, Barber DL. Direct binding of the Na--H exchanger NHE1 to ERM proteins regulates the cortical cytoskeleton and cell shape independently of H(+) translocation. Mol Cell. 2000;6:1425-1436. [PubMed] [DOI] |
| 5. | Putney LK, Denker SP, Barber DL. The changing face of the Na+/H+ exchanger, NHE1: structure, regulation, and cellular actions. Annu Rev Pharmacol Toxicol. 2002;42:527-552. [PubMed] [DOI] |
| 6. | Schneider L, Stock CM, Dieterich P, Jensen BH, Pedersen LB, Satir P, Schwab A, Christensen ST, Pedersen SF. The Na+/H+ exchanger NHE1 is required for directional migration stimulated via PDGFR-alpha in the primary cilium. J Cell Biol. 2009;185:163-176. [PubMed] [DOI] |
| 7. | El-Serag HB, Rudolph KL. Hepatocellular carcinoma: epidemiology and molecular carcinogenesis. Gastroenterology. 2007;132:2557-2576. [PubMed] [DOI] |
| 8. | Bruix J, Llovet JM. Prognostic prediction and treatment strategy in hepatocellular carcinoma. Hepatology. 2002;35:519-524. [PubMed] [DOI] |
| 9. | Yang X, Wang D, Dong W, Song Z, Dou K. Over-expression of Na+/H+ exchanger 1 and its clinicopathologic significance in hepatocellular carcinoma. Med Oncol. 2010;27:1109-1113. [PubMed] [DOI] |
| 10. | 李 杰, 窦 科峰, 张 洪涛, 张 超, 李 韧, 张 福琴, 王 德盛. NHE1 mRNA在肝癌组织的表达及意义. 胃肠病学和肝病学杂志. 2009;18:121-122. |
| 12. | Thomas MB, Zhu AX. Hepatocellular carcinoma: the need for progress. J Clin Oncol. 2005;23:2892-2899. [PubMed] [DOI] |
| 13. | Slepkov ER, Rainey JK, Sykes BD, Fliegel L. Structural and functional analysis of the Na+/H+ exchanger. Biochem J. 2007;401:623-633. [PubMed] [DOI] |
| 14. | Slepkov E, Fliegel L. Structure and function of the NHE1 isoform of the Na+/H+ exchanger. Biochem Cell Biol. 2002;80:499-508. [PubMed] [DOI] |
| 16. | Meima ME, Mackley JR, Barber DL. Beyond ion translocation: structural functions of the sodium-hydrogen exchanger isoform-1. Curr Opin Nephrol Hypertens. 2007;16:365-372. [PubMed] [DOI] |
| 17. | Denker SP, Barber DL. Ion transport proteins anchor and regulate the cytoskeleton. Curr Opin Cell Biol. 2002;14:214-220. [PubMed] [DOI] |
| 18. | Sahai E, Marshall CJ. Differing modes of tumour cell invasion have distinct requirements for Rho/ROCK signalling and extracellular proteolysis. Nat Cell Biol. 2003;5:711-719. [PubMed] [DOI] |
| 19. | Buccione R, Orth JD, McNiven MA. Foot and mouth: podosomes, invadopodia and circular dorsal ruffles. Nat Rev Mol Cell Biol. 2004;5:647-657. [PubMed] [DOI] |
| 20. | Buccione R, Caldieri G, Ayala I. Invadopodia: specialized tumor cell structures for the focal degradation of the extracellular matrix. Cancer Metastasis Rev. 2009;28:137-149. [PubMed] [DOI] |
| 21. | Denker SP, Barber DL. Cell migration requires both ion translocation and cytoskeletal anchoring by the Na-H exchanger NHE1. J Cell Biol. 2002;159:1087-1096. [PubMed] [DOI] |
| 22. | Jia Z, Barbier L, Stuart H, Amraei M, Pelech S, Dennis JW, Metalnikov P, O'Donnell P, Nabi IR. Tumor cell pseudopodial protrusions. Localized signaling domains coordinating cytoskeleton remodeling, cell adhesion, glycolysis, RNA translocation, and protein translation. J Biol Chem. 2005;280:30564-30573. [PubMed] [DOI] |
| 23. | Bourguignon LY, Singleton PA, Diedrich F, Stern R, Gilad E. CD44 interaction with Na+-H+ exchanger (NHE1) creates acidic microenvironments leading to hyaluronidase-2 and cathepsin B activation and breast tumor cell invasion. J Biol Chem. 2004;279:26991-27007. [PubMed] [DOI] |
| 24. | Busco G, Cardone RA, Greco MR, Bellizzi A, Colella M, Antelmi E, Mancini MT, Dell'Aquila ME, Casavola V, Paradiso A. NHE1 promotes invadopodial ECM proteolysis through acidification of the peri-invadopodial space. FASEB J. 2010;24:3903-3915. [PubMed] [DOI] |
| 25. | Frantz C, Karydis A, Nalbant P, Hahn KM, Barber DL. Positive feedback between Cdc42 activity and H+ efflux by the Na-H exchanger NHE1 for polarity of migrating cells. J Cell Biol. 2007;179:403-410. [PubMed] [DOI] |
| 26. | Tominaga T, Barber DL. Na-H exchange acts downstream of RhoA to regulate integrin-induced cell adhesion and spreading. Mol Biol Cell. 1998;9:2287-2303. [PubMed] [DOI] |
| 27. | Vexler ZS, Symons M, Barber DL. Activation of Na+-H+ exchange is necessary for RhoA-induced stress fiber formation. J Biol Chem. 1996;271:22281-22284. [PubMed] [DOI] |
| 28. | Paradiso A, Cardone RA, Bellizzi A, Bagorda A, Guerra L, Tommasino M, Casavola V, Reshkin SJ. The Na+-H+ exchanger-1 induces cytoskeletal changes involving reciprocal RhoA and Rac1 signaling, resulting in motility and invasion in MDA-MB-435 cells. Breast Cancer Res. 2004;6:R616-R628. [PubMed] [DOI] |
| 29. | Lagana A, Vadnais J, Le PU, Nguyen TN, Laprade R, Nabi IR, Noël J. Regulation of the formation of tumor cell pseudopodia by the Na(+)/H(+) exchanger NHE1. J Cell Sci. 2000;113:3649-3662. [PubMed] |
| 30. | Wu KL, Khan S, Lakhe-Reddy S, Jarad G, Mukherjee A, Obejero-Paz CA, Konieczkowski M, Sedor JR, Schelling JR. The NHE1 Na+/H+ exchanger recruits ezrin/radixin/moesin proteins to regulate Akt-dependent cell survival. J Biol Chem. 2004;279:26280-26286. [PubMed] [DOI] |