修回日期: 2011-06-30
接受日期: 2011-07-11
在线出版日期: 2011-07-28
目的: 构建DR-nm23基因慢病毒表达载体及建立DR-nm23基因稳定表达的人结直肠癌SW620细胞系, 为DR-nm23基因功能研究奠定基础.
方法: 应用逆转录聚合酶链反应方法筛选无内源性DR-nm23基因表达的人结直肠癌细胞系. 通过AgeⅠ酶切获得DR-nm23 cDNA片段, 并将其交换连接到慢病毒表达载体pGC-FU中. 慢病毒表达质粒pGC-FU-DR-nm23-GFP和包装质粒共转染293T细胞, 孔稀释法测定慢病毒滴度. 获得重组的慢病毒, 感染人结直肠癌SW620细胞, 荧光显微镜观察绿色荧光蛋白及Western blot检测DR- nm23在SW620细胞中的表达.
结果: 低转移性结直肠癌SW480、HT29细胞DR-nm23基因高表达, 而高转移性SW620细胞不表达. 重组慢病毒质粒pGC-FU-DR-nm23-GFP酶切鉴定结果与目的基因条带吻合, 克隆测序结果与NCBI收录的DR-nm23基因序列(NM_002510)完全一致. 重组慢病毒质粒可高效转染293T细胞, 慢病毒滴度为2E+9 TU/mL. 收集慢病毒上清液感染SW620细胞, 荧光显微镜下观察85%细胞表达绿色荧光. 感染后SW620细胞DR-nm23稳定高表达.
结论: 成功构建了携带DR-nm23与GFP融合基因的慢病毒表达载体pGC-FU-DR-nm23- GFP, 获得了DR-nm23基因稳定表达的结直肠癌SW620细胞系. 该细胞系可作为研究DR-nm23基因功能研究的可靠细胞模型.
引文著录: 曲利娟, 苏娟娟, 梁莉. DR-nm23基因慢病毒表达载体的构建及其在人结直肠癌SW620细胞中的表达. 世界华人消化杂志 2011; 19(21): 2226-2232
Revised: June 30, 2011
Accepted: July 11, 2011
Published online: July 28, 2011
AIM: To construct a lentiviral vector carrying the DR-nm23 gene and to establish a human colorectal carcinoma cell line SW620 stably expressing this gene.
METHODS: Endogenous expression of the DR-nm23 gene in colorectal carcinoma cell lines was investigated by RT-PCR. The DR-nm23 cDNA was cloned into the lentiviral expression vector pGC-FU. Recombinant lentiviruses were produced by 293T cells following the co-transfection of pGC-FU-DR-nm23-GFP and packaging plasmids. Lentivirus titer was determined by serial dilution method. The supernatants of virus-producing cells containing DR-nm23 and GFP genes were used to transfect SW620 cells. GFP fluorescence was detected by fluorescent microscopy. The expression of DR-nm23 protein in SW620 cells was detected by Western blot.
RESULTS: The recombinant lentiviral vector pGC-FU-DR-nm23-GFP was successfully constructed, and the sequence of the DR-nm23 gene in the vector was identical to those recorded in NCBI (NM_002510). The recombinant lentiviral plasmid could effective1y transfect 293T cells, with a lentivirus titer of 2E+9 TU/mL. The supernatants of lentivirus could effectively infect SW620 cells. Abundant green fluorescence was observed by fluorescent microscopy, and more than 85% of SW620 cells stably and highly expressed the target gene.
CONCLUSION: A recombinant lentiviral vector carrying the DR-nm23 gene (pGC-FU-DR-nm23-GFP) has been constructed successfully, and a SW620 subline stably expressing the DR-nm23 gene has been successfully generated.
- Citation: Qu LJ, Su JJ, Liang L. Construction of a lentiviral vector carrying the DR-nm23 gene and its stable expression in colorectal carcinoma SW620 cells. Shijie Huaren Xiaohua Zazhi 2011; 19(21): 2226-2232
- URL: https://www.wjgnet.com/1009-3079/full/v19/i21/2226.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i21.2226
DR-nm23基因是1995年由Ventruelli等[1]从慢性粒细胞性白血病急性发作期的原代细胞中发现并克隆的肿瘤转移抑制基因, 与多种肿瘤的形成和进展有关, 但该基因与结直肠癌侵袭及转移的关系未见文献报道. 我们在前期的研究中发现, DR-nm23蛋白与结直肠癌的发生发展及转移密切相关[2]. 因此本文以DR-nm23基因为研究对象, 拟构建DR-nm23基因慢病毒表达载体, 为其功能研究提供高效稳定的外源基因导入工具, 并通过转染无内源性DR-nm23表达的人结直肠癌SW620细胞, 为进一步研究该基因转染后对结直肠癌细胞生物学特性的影响奠定实验基础.
人结直肠癌细胞SW620、SW480及HT-29由南方医科大学病理教研室惠赠, 293T细胞、结直肠杆菌菌株DH5α、cDNA表达载体pGC-FU Vector、慢病毒包装系统均购自GENECHEM基因化学有限公司, 慢病毒包装系统由pGC-FU载体, pHelper 1.0载体和pHelper 2.0载体3质粒组成. 5 kb DNA Marker、Primer购自捷瑞生物; AgeⅠ内切酶购自NEB公司; In-FusionTM PCR Cloning Kit购自Clontech; Taq聚合酶购自SinoBio; dNTP、PCR kit购自TaKaRa; 质粒抽提试剂盒购自Qiagen公司; Lipofectamine 2000、Opti-MEM培养基购自Invitrogen; DMEM培养基购自Gibco; 逆转录试剂盒购自ToYoBo; 台盼兰、胎牛血清FBS、DMSO、胰酶、琼脂糖等试剂分别购自上海捷倍思、上海微科、上海化学试剂公司; PVDF膜和化学发光液购自Pierce公司; 兔抗人DR-nm23多克隆抗体、鼠抗人GFP购自Santa Cruz公司; DR-nm23及GAPDH引物用Primer 5软件自行设计, 上海英俊生物技术有限公司合成.
1.2.1 RT-PCR法筛选无内源性DR-nm23基因表达的结直肠癌细胞系: 采用含100 mL/L胎牛血清DMEM培养高转移性细胞SW620和低转移性细胞SW480、HT-29. 待细胞长至状态良好, 铺满瓶壁后, 用冰预冷的PBS洗2遍, 参照说明书, 用TRIzol试剂常规提取细胞总RNA, 并用GAPDH引物进行PCR扩增检测有无基因组DNA污染, 按照逆转录试剂盒操作程序进行逆转录反应. DR-nm23引物为P1: 5'-TCATCGGAGCCACGAACCC-3'; P2: 5'-TCAGCAGCCCGTCCAAAGG-3'; 扩增片段307 bp; 反应条件: 96 ℃ 18 s、65 ℃ 18 s、72 ℃ 18 s, 30个循环. 以看家基因GAPDH为内对照, 引物为P1: 5'-ACCACAGTCCATGCCATCA C-3'; P2: 5'-TCCACCACCCTGTTGCTGTA-3'; 扩增片段212 bp; 反应条件: 96 ℃ 30 s、60 ℃ 30 s、72 ℃ 30 s, 30个循环. PCR产物送英潍捷基测序分析.
1.2.2 目的基因DR-nm23 cDNA片段的获得: DR-nm23-F: 5'-GAGGATCCCCGGGTACCGGTCGCCACCATGATCTGCCTGGTGCTG-3', DR-nm23-R: 5'-TACACATGGTGGCGACCGGCTCATACAGCCAGTGC-3', 下划线为AgeⅠ酶切位点, 双下划线为表达增强序列. PCR反应体系: ddH2O 12.4 μL, 5×Taq缓冲液4 μL, dNTPs 1.6 μL, DR-nm23-F 0.4 μL, DR-nm23-R 0.4 μL, 模板1 μL, Taq聚合酶0.2 μL. 反应条件: 94 ℃ 5 min、94 ℃ 30 s、55 ℃ 30 s、72 ℃ 40 s、72 ℃ 10 min, 30个循环. PCR扩增、AgeⅠ酶切, 1.5%琼脂糖凝胶电泳, 切胶回收DR-nm23目的片段.
1.2.3 重组慢病毒表达载体的构建: pGC-FU载体AgeⅠ酶切、纯化. 1.5%琼脂糖凝胶电泳, 切胶回收线性化慢病毒载体片段. 目的基因交换连接线性化慢病毒载体: 目的基因片段2 μL, 载体片段2 μL, 10×In-Fusion交换酶缓冲液2 μL, In-Fusion交换酶0.5 μL, ddH2O 13.5 μL, 25 ℃ 30 min, 42 ℃ 15 min. 阳性对照: GAPDH替代目的基因片段, 自连对照: 无目的基因片段. 重组后命名为: pGC-FU-DR-nm23-GFP. 重组质粒转化感受态大肠杆菌DH5α, 随机挑取数个单菌落, PCR检测阳性转化子. 引物序列为: Ubi-F: 5'-GGGTCAATATGTAATTTTCAGTG-3', EGFP-N-R: 5'-CGTCGCCGTCCAGCTCGACCAG-3'. PCR反应体系: ddH2O 12.4 μL, 5×Taq缓冲液4 μL, dNTPs 1.6 μL, Ubi-F 0.4 μL, EGFP-N-R 0.4 μL, 模板1 μL, Taq聚合酶0.2 μL. 反应条件: 94 ℃ 2 min、94 ℃ 30 s、60 ℃ 30 s、72 ℃ 50 s、72 ℃ 6 min, 30个循环. 分别以ddH2O、空载自连对照转化子为模板作为阴性对照, 以GAPDH阳性对照转化子为模板作为阳性对照. 扩增产物用2.0%琼脂糖凝胶电泳分析. 接种阳性转化子, 37 ℃培养16 h后保存为甘油菌, 分装200 μL送Genechem公司测序.
1.2.4 目的质粒表达检测: 目的质粒pGC-FU-DR-nm23-GFP转染293T细胞24 h后, 倒置荧光显微镜下观察荧光表达. 同时收集细胞进行Western blot检测. 加入5倍体积悬浮缓冲液分散细胞, 再加入等体积的2×SDS凝胶加样缓冲液, 变性后进行SDS-PAGE电泳, 4 ℃、400 mA电转移至PVDF膜. 先加封闭液室温封闭1 h, 再加鼠抗人GFP(1:2 000稀释)4 ℃过夜, 羊抗鼠二抗(1:5 000稀释)室温孵育2 h, 最后显色、X光显影.
1.2.5 慢病毒包装: 转染前1 d, 用胰蛋白酶消化对数生长期的293T细胞, 以含100 mL/L血清的培养基调整细胞密度为1.2×107细胞/20 mL, 重新接种于直径15 cm培养皿, 37 ℃、50 mL/L CO2培养至细胞密度达80%备用. 转染前2 h更换无血清培养基. 分别将pGC-FU-DR-nm23-GFP慢病毒表达质粒20 μg、包装质粒pHelper 1.0 15 μg及pHelper 2.0 10 μg的DNA溶液与相应体积Opti-MEM均匀混合, 调整总体积为2.5 mL, 室温下孵育5 min. 再加入100 μL Lipofectamine 2000与2.4 mL Opti-MEM混合液, 室温下孵育20 min, 共转染293T包装细胞. 转染后8 h更换完全培养基(含100 mL/L FBS的DMEM), 37 ℃、50 mL/L CO2继续培养48 h. 收集富含慢病毒的细胞上清液, 4 ℃、4 000 g离心10 min, 经0.45 μm PVDF膜过滤, 分装后-80 ℃冻存备用.
1.2.6 孔稀释法测定慢病毒滴度: 测定前1 d以4×104细胞/孔接种96孔板传代293T细胞, 体积100 μL. 将慢病毒原液梯度稀释, 吸去细胞培养基, 加入梯度稀释好的病毒溶液, 37 ℃、50 mL/L CO2培养24 h, 更换完全培养基, 4 d后倒置荧光显微镜下观察. 正常情况下, 荧光细胞数随稀释倍数的增加而减少. 计数最大稀释倍数孔中带荧光的细胞个数, 病毒滴度 = 带荧光的细胞个数/病毒原液量.
1.2.7 慢病毒感染结直肠癌SW620细胞: 感染前1 d将SW620细胞接种至24孔板, 2×105细胞/孔, 使细胞达到80%-85%融合. 去除孔内培养基, 加入含病毒的完全培养基, 同时加入工作液浓度5 g/L的聚凝胺(polybrene)增加感染效率. 次日去除含病毒的培养基, 更换为完全培养基. 72 h后倒置荧光显微镜下观察. 将慢病毒感染成功的细胞通过有限稀释法接种于96孔板, 待形成境界清楚的克隆, 挑取带荧光的单克隆至24孔板中, 扩大培养. 以pGC-FU-GFP慢病毒为空白对照(mock). 阳性克隆细胞命名为SW620/DR-nm23, 空白对照克隆细胞命名为SW620/mock.
1.2.8 Western blot检测DR-nm23表达: 收集SW620/DR-nm23、SW620/mock和SW620细胞沉淀, 方法同前. 一抗为兔抗人DR-nm23(1:300稀释), 4 ℃过夜; 抗兔二抗(1:5 000稀释)室温孵育1 h.
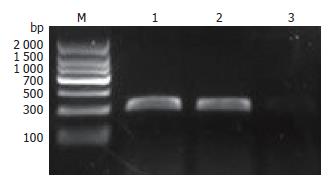
应用RT-PCR检测3种结直肠癌细胞系, 采用1-D Advanced软件进行区带灰度分析, 分别以DR-nm23和GAPDH扩增带的密度比值表示各细胞系的表达水平, 结果表明DR-nm23基因在低转移性细胞SW480和HT-29中高表达, 而在高转移性细胞SW620不表达(图1). 为排除非特异性扩增, 对PCR的扩增产物经胶回收后测序分析, 结果与预期相符.
以DR-nm23引物为模板, 将PCR扩增产物于1.5%琼脂糖电泳. 在500-750 bp之间有一特异条带, 与预计长度553 bp相符(图2).
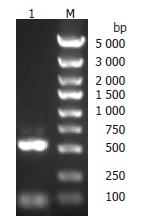
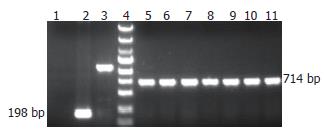
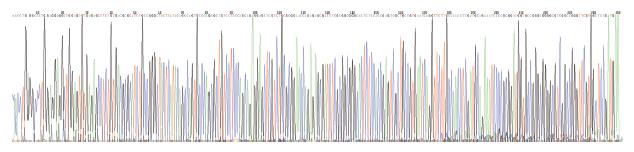
将553 bp目的片段交换连接线性化pGC-FU慢病毒载体后, 交换后产物转化大肠杆菌感受态细胞, 挑取7个转化子, 经PCR检测转化子均为阳性(图3). 收集阳性转化子送测序鉴定, 测序结果与NCBI公布的DR-nm23基因序列(NM_002510)一致(图4), 说明重组慢病毒质粒构建正确.
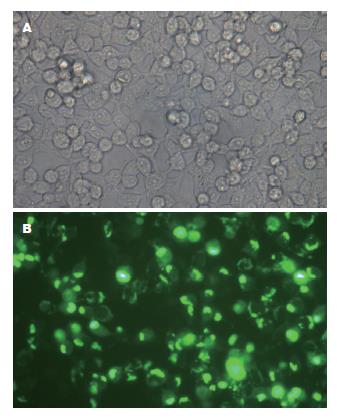
目的质粒pGC-FU-DR-nm23-GFP转染293T细胞24 h后, 倒置荧光显微镜下观察约90%细胞表达荧光(图5), 收集细胞Western blot检测示, 36 000-55 000 Da间有阳性条带(图6), 其大小和DR-nm23-GFP融合蛋白(18 000+28 000 = 46 000 Da)相吻合, 基本判断DR-nm23表达.
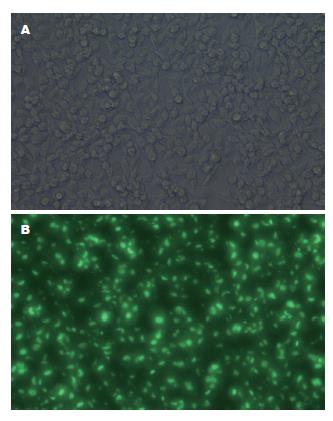
慢病毒表达质粒pGC-FU-DR-nm23-GFP与辅助包装质粒共转染293T细胞, 约90%细胞表达荧光(图7). 转染48 h后收集病毒并浓缩、孔稀释法测定滴度, 在加入1E-6 μL病毒原液的孔中观察到2个带有荧光的细胞, 则病毒滴度 = 2/(1E-6) = 2E+6 TU/μL = 2E+9 TU/mL.
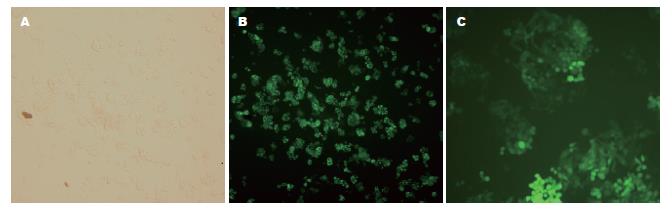
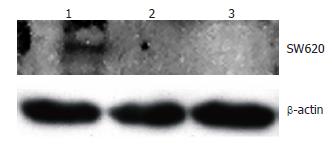
以pGC-FU-DR-nm23-GFP及pGC-FU-GFP慢病毒感染SW620细胞72 h后, 约85%的SW620/DR-nm23和SW620/mock细胞表达荧光(图8), 而SW620细胞不表达. 收集细胞Western blot蛋白印迹检测示SW620/DR-nm23细胞有阳性条带, SW620/mock和SW620细胞阴性(图9).
DR-nm23是新近发现的一个重要的肿瘤转移抑制基因, 是迄今nm23肿瘤转移抑制基因家族10个成员(nm23-H1-nm23-H10)之一, 又称nm23-H3或NME3(non-metastasis cell 3), 基因定位于人染色体16q13[3], 基因编码的蛋白质产物具有二磷酸核苷激酶(nucleoside diphosphate kinase, NDPK)活性[4,5]. NDPK的生物学特性包括组氨酸蛋白激酶活性、丝氨酸自身磷酸化作用及转录激活等[6-8]. DR-nm23基因有亮氨酸-拉链域和精氨酸-甘氨酸-天冬氨酸(arginine-glycine-asparagine, RGD)序列等多个比较重要的结构域[1,9], RGD序列存在于多种黏附蛋白分子中, 是细胞表面与整合素受体特异性结合的配体[10], 在肿瘤的侵袭转移及细胞的信号转导方面都具有重要的作用.
目前已证实DR-nm23基因在神经母细胞瘤和多种肿瘤细胞株如乳腺癌、胰腺癌、结直肠癌、前列腺癌等中有表达[11,12], 但该基因与肿瘤侵袭转移的关系和分子机制并不清楚. 本研究发现DR-nm23在低转移性细胞SW480和HT-29中高表达, 在高转移性细胞SW620不表达, 与我们前期的实验结果一致[13], 进一步说明DR-nm23可能与转移负相关.
肿瘤转移是一个多步骤、多基因、多阶段的复杂病理过程, 包括转移相关基因的激活或失活、黏附特性的丧失、运动能力的增强、表达蛋白水解酶及新生血管形成等一系列改变, 从而在基因水平、信号通路水平和细胞代谢水平等发挥生物学效应. DR-nm23抑制肿瘤转移的机制可能有以下几个方面: Ap-2是DR-nm23转录起始因子相关元件结合位点, 参与调控基因的转录效率及活性, 激活或抑制DR-nm23基因的表达[3]. 61位丝氨酸残基(S61)是赋予抑制肿瘤转移潜能的主要磷酸化位点, 其突变(S61P)可能导致神经细胞分化能力的减弱, 影响蛋白之间的相互作用, 促进肿瘤转移[14]. RGD缺失通过改变蛋白质结构, 影响细胞胞质内与线粒体膜上靶蛋白的相互作用, 削弱野生型DR-nm23的生物学效应, 诱导肿瘤转移[9]. DR-nm23可能还与多种信号分子发生联系, 如有丝裂原活化蛋白激酶/细胞外信号调节激酶、蛋白激酶A、蛋白激酶C、Wnt信号通路、整合素/黏着斑激酶等, 而这些信号分子在肿瘤的侵袭转移过程均发挥重要生物学效应[15-20].
慢病毒载体是以人类免疫缺陷型病毒为基础发展起来的基因治疗载体, 对分裂细胞和非分裂细胞均具有感染能力, 并可以在体内外较长期的表达. 慢病毒载体是目前感染效率最高的载体, 其毒性基因已被剔除并为外源性目的基因所取代, 病毒感染目的细胞后不会再感染其他细胞, 也不会利用宿主细胞产生新的病毒颗粒, 具有"自杀性"灭活病毒、长期稳定表达、安全性高、机体免疫反应小等优点, 适于体内基因治疗. 本研究结果显示, 慢病毒表达质粒pGC-FU-DR-nm23-GFP可高效转染293T细胞, 病毒滴度达2E+9 TU/mL; 同时, 获得慢病毒上清液可高效感染SW620细胞, 荧光显微镜下可观察到90%细胞表达绿色荧光, 感染效率高.
总之, 本研究成功构建重组慢病毒表达载体pGC-FU-DR-nm23-GFP, 所包装的重组慢病毒具有较高的感染效率, 为DR-nm23基因的体内外功能研究提供了优质的稳定转染载体. 此外, 本研究还建立了稳定表达DR-nm23的人结直肠癌细胞亚系SW620/DR-nm23, 为DR-nm23基因功能的深入研究、进一步探讨结直肠癌发生及转移的分子机制奠定实验基础, 具有重要应用价值.
DR-nm23基因是1995年由Ventruelli等从慢性粒细胞性白血病急性发作期的原代细胞中发现并克隆的肿瘤转移抑制基因, 与多种肿瘤的形成和进展有关, 但该基因与结直肠癌侵袭及转移的关系未见文献报道.
任晓峰, 教授, 东北农业大学动物医学学院微生物室
目前已证实DR-nm23基因在神经母细胞瘤和多种肿瘤细胞株如乳腺癌、胰腺癌、结直肠癌、前列腺癌等中有表达.
本研究成功构建了携带DR-nm23与GFP融合基因的慢病毒表达载体pGC-FU-DR-nm23- GFP, 获得了DR-nm23基因稳定表达的结直肠癌SW620细胞系. 该细胞系可作为研究DR-nm23基因功能研究的可靠细胞模型.
本文实验设计完善, 技术成熟, 为继续研究DR-nm23的基因功能奠定基础.
编辑: 李薇 电编:张洋
| 1. | Venturelli D, Martinez R, Melotti P, Casella I, Peschle C, Cucco C, Spampinato G, Darzynkiewicz Z, Calabretta B. Overexpression of DR-nm23, a protein encoded by a member of the nm23 gene family, inhibits granulocyte differentiation and induces apoptosis in 32Dc13 myeloid cells. Proc Natl Acad Sci U S A. 1995;92:7435-7439. [PubMed] [DOI] |
| 3. | Martinez R, Venturelli D, Perrotti D, Veronese ML, Kastury K, Druck T, Huebner K, Calabretta B. Gene structure, promoter activity, and chromosomal location of the DR-nm23 gene, a related member of the nm23 gene family. Cancer Res. 1997;57:1180-1187. [PubMed] |
| 4. | Kim HD, Youn B, Kim TS, Kim SH, Shin HS, Kim J. Regulators affecting the metastasis suppressor activity of Nm23-H1. Mol Cell Biochem. 2009;329:167-173. [PubMed] [DOI] |
| 5. | Boissan M, Dabernat S, Peuchant E, Schlattner U, Lascu I, Lacombe ML. The mammalian Nm23/NDPK family: from metastasis control to cilia movement. Mol Cell Biochem. 2009;329:51-62. [PubMed] [DOI] |
| 6. | Postel EH, Zou X, Notterman DA, La Perle KM. Double knockout Nme1/Nme2 mouse model suggests a critical role for NDP kinases in erythroid development. Mol Cell Biochem. 2009;329:45-50. [PubMed] [DOI] |
| 7. | Miyamoto M, Iwashita S, Yamaguchi S, Ono Y. Role of nm23 in the regulation of cell shape and migration via Rho family GTPase signals. Mol Cell Biochem. 2009;329:175-179. [PubMed] [DOI] |
| 8. | Lombardi D, Mileo AM. Protein interactions provide new insight into Nm23/nucleoside diphosphate kinase functions. J Bioenerg Biomembr. 2003;35:67-71. [PubMed] [DOI] |
| 9. | Venturelli D, Cesi V, Ransac S, Engelhard A, Perrotti D, Calabretta B. The nucleoside diphosphate kinase activity of DR-nm23 is not required for inhibition of differentiation and induction of apoptosis in 32Dcl3 myeloid precursor cells. Exp Cell Res. 2000;257:265-271. [PubMed] [DOI] |
| 10. | Wang Z, Collighan RJ, Gross SR, Danen EH, Orend G, Telci D, Griffin M. RGD-independent cell adhesion via a tissue transglutaminase-fibronectin matrix promotes fibronectin fibril deposition and requires syndecan-4/2 and {alpha}5{beta}1 integrin co-signaling. J Biol Chem. 2010;285:40212-40229. [PubMed] [DOI] |
| 11. | 曲 利娟, 丁 彦青. DR-nm23基因与肿瘤发生发展关系的研究进展. 国外医学·肿瘤学分册. 2005;32:336-339. |
| 12. | Amendola R, Martinez R, Negroni A, Venturelli D, Tanno B, Calabretta B, Raschellà G. DR-nm23 expression affects neuroblastoma cell differentiation, integrin expression, and adhesion characteristics. Med Pediatr Oncol. 2001;36:93-96. [PubMed] [DOI] |
| 14. | Negroni A, Venturelli D, Tanno B, Amendola R, Ransac S, Cesi V, Calabretta B, Raschellà G. Neuroblastoma specific effects of DR-nm23 and its mutant forms on differentiation and apoptosis. Cell Death Differ. 2000;7:843-850. [PubMed] [DOI] |
| 15. | Brown MD, Sacks DB. Protein scaffolds in MAP kinase signalling. Cell Signal. 2009;21:462-469. [PubMed] [DOI] |
| 16. | Backert S, Kenny B, Gerhard R, Tegtmeyer N, Brandt S. PKA-mediated phosphorylation of EPEC-Tir at serine residues 434 and 463: A novel pathway in regulating Rac1 GTPase function. Gut Microbes. 2010;1:94-99. [PubMed] [DOI] |
| 17. | Nie Q, Zhou QH, Zhu W, Liu LX, Fu JK, Li DB, Li Y, Che GW. [nm23-H1 gene inhibits lung cancer cell invasion through down-regulation of PKC signal pathway]. Zhonghua Zhongliu Zazhi. 2006;28:334-336. [PubMed] [DOI] |
| 19. | 杨 育生, 刘 斌, 邢 传平, 高 自芳, 顾 立萍, 钱 震, 董 亮, 苏 勤军. 胃癌组织中Caveolin-1, nm23及MMP-2的表达及其意义. 世界华人消化杂志. 2007;15:1725-1730. [DOI] |
| 20. | Mitra SK, Hanson DA, Schlaepfer DD. Focal adhesion kinase: in command and control of cell motility. Nat Rev Mol Cell Biol. 2005;6:56-68. [PubMed] [DOI] |