修回日期: 2010-08-04
接受日期: 2010-08-10
在线出版日期: 2011-01-18
目的: 探讨超声造影(CEUS)对高强度聚焦超声(HIFU)消融治疗胰腺癌早期疗效评价的应用价值.
方法: 29例胰腺癌患者于HIFU治疗前1-3 d行CEUS检查, 观察肿瘤大小、边界及内部血流灌注情况, 制定出HIFU治疗计划; 治疗后1-3 d行CEUS, 对比观察HIFU治疗后肿瘤大小、边界及内部血流灌注的改变, 判断消融治疗的范围和程度. 其中15例患者超声造影结果与核磁共振成像(MRI)检查结果进行比较.
结果: 29例患者中23例(79.3%)在HIFU治疗前超声造影过程中表现为轻度增强, 增强程度低于胰腺实质, 6例(20.7%)患者呈等至高增强, 造影剂清除早于胰腺实质. HIFU治疗后, 29例患者均见肿瘤出现不同程度的无血流灌注区, 8例第1次HIFU消融后肿瘤完全无血流灌注; 12例第2次HIFU消融治疗后肿瘤内无血流灌注, 4例第3次HIFU消融治疗后肿瘤内无血流灌注; 5例患者经过3次HIFU消融后边缘仍然有少量血流灌注现象, 提示有残留病灶存在, 需再次HIFU消融治疗. 患者超声造影与MRI检查比较, 超声造影在肿瘤灭活诊断中的准确性与MRI相近(86.7% vs 93.3%, P>0.05).
结论: HIFU对胰腺癌消融治疗后, 利用CEUS技术能及时准确地判断出消融的范围和程度, 并为HIFU消融胰腺癌早期疗效评价和治疗方案的制定提供了依据.
引文著录: 林玲, 桂永忠, 鲁晓, 陈健, 卢强, 闽敏, 敬新蓉, 姚丽. 超声造影在高强度聚焦超声治疗胰腺癌早期疗效评价中的应用价值. 世界华人消化杂志 2011; 19(2): 196-199
Revised: August 4, 2010
Accepted: August 10, 2010
Published online: January 18, 2011
AIM: To evaluate the role of contrast-enhanced ultrasound (CEUS) in assessing the short-term therapeutic response to high-intensity focused ultrasound (HIFU) in patients with pancreatic carcinoma.
METHODS: Twenty-nine patients with pancreatic carcinoma received HIFU treatment. CEUS was performed to monitor the response of tumor vessels to HIFU ablation before and after treatment. Meanwhile, 15 patients underwent magnetic resonance imaging (MRI) for comparison.
RESULTS: Before treatment, hypoenhancement was found on CEUS in 23 (79.3%) patients, and isoenhancement to hyperenhancement in 6 (20.7%) patients. Contrast agent washout was significantly faster in pancreatic carcinoma lesions than in normal pancreatic tissue in all cases. Complete non-enhancement area was noted in 8 cases after first HIFU therapy, in 12 cases after second therapy, and in 4 cases after third treatment. Five cases presented hypoenhancement at the boundary of the lesion even after third treatment and needed more treatments. The accuracy of CEUS was similar to that of MRI in assessing the response to HIFU therapy (86.7% vs 93.3 %, P > 0.05).
CONCLUSION: CEUS allows to accurately differentiate tumor necrosis and evaluate response to HIFU treatment in patients with pancreatic carcinoma.
- Citation: Lin L, Gui YZ, Lu X, Chen J, Lu Q, Min M, Jing XR, Yao L. Role of contrast-enhanced ultrasound in assessing short-term therapeutic response to high-intensity focused ultrasound in patients with pancreatic carcinoma. Shijie Huaren Xiaohua Zazhi 2011; 19(2): 196-199
- URL: https://www.wjgnet.com/1009-3079/full/v19/i2/196.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i2.196
胰腺癌是常见消化系统肿瘤之一, 确诊时多数病例已到晚期, 失去了根治性外科手术的机会[1]. 高强度聚焦超声(high intensity focused ultrasound, HIFU)是近几年飞速发展起来的非侵入性局部肿瘤灭活消融新技术, 其原理是通过超声波汇聚于靶区引起组织瞬间升温而发生凝固性坏死, 从而达到对肿瘤进行局部热消融的目的[2-4]. 对其疗效观察的影像学方法有超声、CT和MRI等. 超声造影(contrast-enhanced ultrasound, CEUS)能够实时地显示病灶内的微血管灌注, 在肿瘤微创治疗疗效评价中的应用受到肯定[5]. 我们利用CEUS对胰腺癌行HIFU治疗后的近期疗效进行观察, 发现其可以较准确地评价HIFU治疗胰腺癌的效果, 现将结果报道如下.
2007-03/2010-03在四川大学华西医院行HIFU热消融治疗的胰腺癌患者29例, 治疗前后均行CEUS, 其中男21例、女8例; 年龄34-69岁. 病灶大小3.5-7.2 cm. 24例为胰头癌患者, 5例为胰腺体尾癌, 4例经手术或穿刺病理确诊, 25例经CT、MRI、CEUS和肿瘤标志物等检查确诊, 4例合并肝内转移病灶, 18例有阻塞性黄疸, HIFU消融治疗后采用经内镜逆行胰胆管造影(encoscopic retrograde cholangio-pancreatography, ERCP)的方法安装支架减黄. 超声仪器采用Philips IU 22, C5-2宽频凸阵探头, 匹配实时造影成像技术. 超声造影剂采用意大利Bracco公司生产的血池显影剂SonoVue, 造影微泡为磷脂微囊六氟化硫(SF6), 微泡平均直径2.5 μm. HIFU消融采用重庆海扶(HIFU)技术有限公司生产的JC型聚焦超声肿瘤治疗系统, 治疗参数: 频率0.8 MHz, 焦距135 mm, 治疗声功率180-350 W.
HIFU消融治疗采用定点和直线扫描, 治疗时间560-1 246 s. 治疗时, 通过超声探头实时监控定位, 确定病灶治疗范围, 进行靶区的三维立体扫描治疗, 根据每个层面治疗前后靶区超声声像图变化, 判断HIFU治疗效(HIFU治疗后靶区声像图回声较治疗前增强, 表示消融治疗有效), 同时根据声像图变化反馈调节治疗声功率.
胰腺癌HIFU治疗前后1-3 d分别行CEUS检查. CEUS方法: 造影前先用常规二维超声扫查胰腺肿瘤, 记录病灶的位置、大小、数目及回声特征, 作出造影前初步判断. 造影剂使用前注入生理盐水5 mL, 震荡混匀后抽出2.4 mL以团注法经肘静脉注入, 在注射造影剂的同时启动超声仪器的低机械指数造影条件, 实时动态、不间断地观察病灶区域及周围组织的增强变化全过程并行图像存储.
HIFU治疗后以治疗覆盖区域CEUS全过程均无增强作为灭活的依据, 以造影过程中局部有增强或增强表现同治疗前相似为肿瘤残存. 肿瘤灭活或残存的最终诊断依据两种以上影像学手段(超声、CT、MRI)、肿瘤标志物水平、临床随访综合判断.
统计学处理 采用SPSS11.0统计软件, 计数资料做组间χ2检验, 以P<0.05为差异有显著性意义.
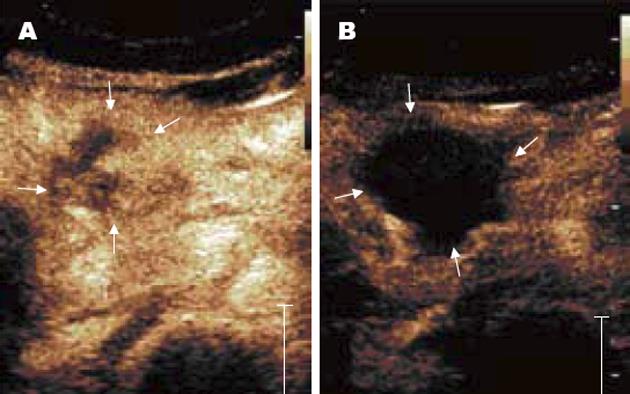
胰腺癌多数为少血供, 本组29例患者中23例(79.3%)在造影过程中表现为轻度增强, 增强程度低于胰腺实质, 分布不均匀, 病变形态不规则; 6例(20.7%)患者呈等至偏高增强; 造影剂清除早于胰腺实质; 13例(50%)患者造影显示原病灶范围比二维超声结果稍大, 此结果有助于确定HIFU消融范围(图1A).
治疗后1-3 d再行CEUS, 29例患者均见肿瘤出现不同程度的无造影强化即无血流灌注区, 8例第1次HIFU消融后肿瘤完全无血流灌注; 21例见肿瘤边缘有部分血流灌注, 提示有部分残留病灶; 12例第2次HIFU消融治疗后, CEUS见肿瘤内无血流灌注; 4例经过3次HIFU消融治疗后达到肿瘤内无血流灌注; 5例肿瘤边缘仍然有少量血流灌注现象, 提示仍然有残留病灶存在, 需要再次HIFU消融治疗(图1B, 表1).
| HIFU次数 | n | 瘤灶回声 | CEUS下肿瘤血供变化 | |
| 改变 | 完全无血供 | 边缘部分血供 | ||
| 第1次 | 29 | 29 | 8 | 21 |
| 第2次 | 21 | 21 | 12 | 9 |
| 第3次 | 9 | 9 | 4 | 5 |
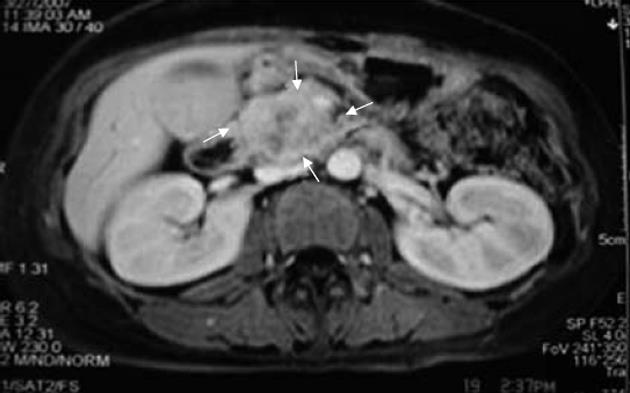
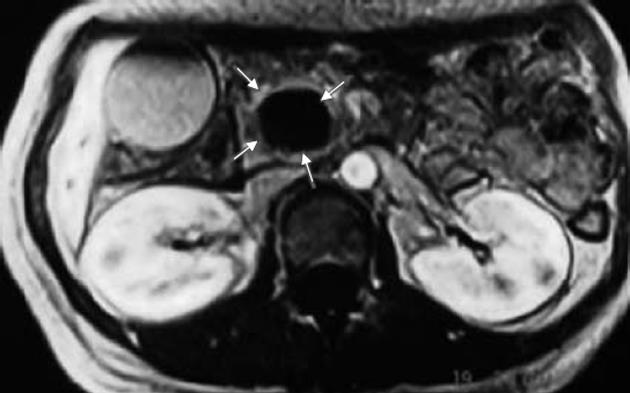
与最终诊断相比, CEUS对肿瘤灭活诊断的敏感性为90.9%, 特异性为75.0%, 准确性为86.7%. MRI对肿瘤灭活诊断的敏感性为100%, 特异性为75.0%, 准确性为93.3%, CEUS在肿瘤灭活诊断的准确性与MRI相近, 二者差异无统计学意义(86.7% vs 93.3%, P>0.05, 表2, 图2, 3).
| 检查方法 | 诊断结果 | 最终诊断 | 敏感性(%) | 特异性(%) | 准确性(%) | |
| 灭活 | 残存 | |||||
| CEUS | 灭活 | 10 | 1 | 90.9 | 75.0 | 86.7 |
| 残存 | 1 | 3 | ||||
| MRI | 灭活 | 11 | 1 | 100.0 | 75.0 | 93.3 |
| 残存 | 0 | 3 | ||||
HIFU是一种通过热消融对实体肿瘤的局部治疗手段, 其原理是利用超声波具穿透性和可聚焦性等物理特征, 将体外低能量超声波聚焦于体内深部肿瘤病灶, 焦点区产生的瞬态高温效应和空化效应使肿瘤组织发生凝固性坏死, 同时破坏肿瘤滋养血管, 使肿瘤血供障碍产生继发性损伤[5-7]. HIFU消融治疗成功的关键在于肿瘤是否发生凝固性坏死, 以及消融的范围和程度, 是否需要进一步HIFU消融治疗. 因此, 采用适当的影像学方法及时判断肿瘤的坏死状况至关重要.
近年来, 随着新型CEUS剂及造影成像技术的发展, CEUS在肿瘤介入治疗和射频消融治疗疗效评价中的应用已有较多报道[8-11]. 本文旨在探讨CEUS在HIFU治疗胰腺癌疗效评价中的应用价值.
CEUS可以实时、动态、连续地观察胰腺肿瘤病灶的位置、大小、数目及病灶范围及周围组织的灌注状况和增强变化过程, 并存储整个CEUS的灌注过程. 在HIFU治疗前, CEUS的意义在于: (1)更客观准确地反应瘤灶范围大小, 从而为HIFU治疗的方案制订提供了可靠的依据[1]. 本组病例中13例(50%)造影显示病灶范围比二维超声结果稍大, 分析原因是胰腺癌侵犯周围组织, 边界不清, 无造影情况下超声仅能显示肿瘤内部的不均匀的结节样弱回声, 容易导致肿瘤范围的判断出现误差而低估肿瘤实际浸润范围; (2)为HIFU治疗后CEUS对照作参照依据. HIFU治疗后CEUS的意义: (1)判断超声消融范围, 观察超声消融治疗后血流灌注的情况, 以及残余肿瘤的血流灌注情况; (2)为肿瘤是否需要再次HIFU消融治疗以及再次治疗的瘤灶位置提供依据. CEUS能够准确清晰地显示消融坏死区是基于CEUS剂为血池显影剂、随血流灌注而成像的特点, 造影剂微泡的分布同血循环中红细胞的分布一致[12-14]. 无论是热消融区还是由于血管闭塞形成的梗死区, 都因坏死而没有血流灌注, 因而也没有造影剂微泡的进入, 造影剂充盈缺损呈无回声; 未凝固消融的组织因存在微循环灌注, 造影呈强化区. 二者形成鲜明对比, 消融区的边界即可得到清晰显示. 本资料中, 29例患者HIFU消融治疗后CEUS均见肿瘤出现不同程度的无灌注区, 部分病例CEUS见肿瘤有残留病灶血流灌注, 及时进行第2次、第3次HIFU消融治疗后, 23例(79.3%)患者达到肿瘤内无血流流灌注, 6例(20.7%)患者肿瘤中心大片无灌注区, 边缘仍然有少量血流灌注现象, 提示有残留病灶存在, 需再次HIFU消融治疗.
HIFU消融治疗后, 通过造影增强图像准确判断已消融的体积及残留病灶的大小评价消融的范围, 如果消融坏死区体积没有达到预测值, 可继续消融治疗. 本资料中患者CEUS与MRI检查比较, CEUS在肿瘤灭活诊断的准确性与MRI相近, 差异没有统计学意义(86.7% vs 93.3%, P>0.05).
新型CEUS剂的相对安全性及超声检查的方便、实时、可重复性, 可以短期内多次进行造影检查, 因此具有增强CT、增强MRI无法替代的优势. 我们将CEUS技术应用于对HIFU热消融治疗胰腺癌的疗效评价中, 能够及时判断肿瘤凝固性坏死的状况, 消融的范围和程度, 评价HIFU消融胰腺癌的疗效, 为胰腺癌HIFU消融治疗方案的制定提供及时准确的影像学支持.
高强度聚焦超声(HIFU)是近年才开始应用于临床的微创治疗实体肿瘤的新技术, HIFU治疗胰腺癌的临床应用已有研究报道, 但对其疗效评价的影像新方法报道尚少. 超声造影可以敏感地显示肿瘤的供血以及微血管灌注情况, 能够为胰腺癌的微创治疗疗效评价提供较为准确的信息.
季国忠, 教授, 南京医科大学第二附属医院消化科
超声造影(CEUS)是现代超声领域研究的热点之一,对于CEUS在胰腺肿瘤诊断和治疗中的应用尤其受到关注, 尤其CEUS在胰腺肿瘤的微创治疗疗效评估中的应用有待积极探索.
超声造影(CEUS)技术的应用为胰腺肿瘤HIFU治疗的疗效评估提供了一种新思路和手段.
本文选题新颖, 具有一定的临床借鉴意义.
编辑: 曹丽鸥 电编:何基才
| 6. | Wu F, Wang ZB, Chen WZ, Zou JZ, Bai J, Zhu H, Li KQ, Jin CB, Xie FL, Su HB. Advanced hepatocellular carcinoma: treatment with high-intensity focused ultrasound ablation combined with transcatheter arterial embolization. Radiology. 2005;235:659-667. [PubMed] [DOI] |
| 7. | Wang XJ, Yuan SL, Lu YR, Zhang J, Liu BT, Zeng WF, He YM, Fu YR. Growth inhibition of high-intensity focused ultrasound on hepatic cancer in vivo. World J Gastroenterol. 2005;11:4317-4320. [PubMed] |
| 8. | Li CX, Xu GL, Jiang ZY, Li JJ, Luo GY, Shan HB, Zhang R, Li Y. Analysis of clinical effect of high-intensity focused ultrasound on liver cancer. World J Gastroenterol. 2004;10:2201-2204. [PubMed] |
| 9. | Maruyama H, Yoshikawa M, Yokosuka O. Current role of ultrasound for the management of hepatocellular carcinoma. World J Gastroenterol. 2008;14:1710-1719. [PubMed] [DOI] |
| 10. | 胡 建群, 叶 新华, 范 伯强, 林 红军, 汪 惠宁, 彭 小静, 苗 毅, 郭 峰, 范 钦和, 俞 同福. 超声造影在肝脏恶性肿瘤射频或微波治疗后近期疗效应用评价. 南京医科大学学报(自然科学版). 2007;27:1290-1293. |