修回日期: 2010-05-06
接受日期: 2011-05-11
在线出版日期: 2011-05-18
目的: 探讨外排泵ABC转运蛋白基因msbA和spab在幽门螺杆菌(Helicobacter pylori, H.pylori)多重耐药中的作用.
方法: 从临床上胃炎和消化性溃疡患者的胃黏膜标本分离H.pylori. 采用琼脂二倍稀释法测定氨苄西林、头孢曲松、四环素、克拉霉素、氧氟沙星和呋喃唑酮对H.pylori的最小抑菌浓度(MIC). 应用氯霉素对敏感株和标准菌株进行体外诱导多重耐药. 采用RT-PCR的方法分别测定敏感株和多重耐药株中msbA和spab基因的相对表达量. 分别构建msbA和spab的基因敲除株, 分别测定敲除前后菌株对9种抗生素的敏感性.
结果: 诱导出包括标准菌株NCTC11637在内的5株多重耐药株. 多重耐药株中msbA和spab基因的相对表达量明显高于敏感株(1.8200±0.5310, 1.8340±0.2726 vs 0.8420±0.0789, P = 0.018, 0.015). 成功构建了msbA和spab基因敲除株(H.pylori MZ1006ΔmsbA和H.pylori MZ1006Δspab), 两株基因敲除株对4种抗生素的敏感性相对于野生株分别有明显的增加. 在临床分离的20株H.pylori中均检测出msbA和spab基因, 未发现基因缺失株.
结论: ABC转运蛋白msbA和spab基因在H.pylori多重耐药机制中起重要作用.
引文著录: 米阳, 郑鹏远, 张炳勇, 刘志强, 宋春花, 杨平常. 外排泵ABC转运蛋白基因msbA和spab在幽门螺杆菌多重耐药中的重要作用. 世界华人消化杂志 2011; 19(14): 1500-1505
Revised: May 6, 2010
Accepted: May 11, 2011
Published online: May 18, 2011
AIM: To evaluate the potential role of ATP-binding cassette (ABC) transporter genes msbA and spab in multidrug resistance (MDR) of Helicobacter pylori (H.pylori).
METHODS: H.pylori strains were isolated from patients with peptic ulcer or gastritis. The minimal inhibitory concentrations (MICs) of ampicillin, ceftriaxone, tetracycline, clarithromycin, ofloxacin and furazolidone for H.pylori strains were determined by agar dilution test. Five sensitive H.pylori strains (four is H.pylori olates and one standard strain NCTC11637) were used to induce multidrug resistance with chloramphenicol. The mRNA expression of msbA and spab in these multidrug-resistant strains was determined by RT-PCR. Two H.pylori gene knockout mutants (MZ1006ΔmsbA and MZ1006Δspab) were constructed by inserting the kanamycin resistance cassette from the pEGFP-N2 vector into the msbA and spab genes, and their susceptibility profiles to nine antibiotics were estimated.
RESULTS: The expression levels of ABC transporter genes msbA and spab in multidrug-resistant H.pylori strains were higher than those in sensitive strains (1.8200 ± 0.5310 vs 0.8420 ± 0.0789, P = 0.018, for msbA; 1.8340 ± 0.2726 vs 1.2180 ± 0.0743, P = 0.015, for spab). MZ1006ΔmsbA and H.pylori MZ1006spab mutants were constructed successfully, and their sensitivity to four of nine antibiotics was significantly enhanced compared to their parental wild-type strains. Both the msbA and spab genes were detected in all isolated strains.
CONCLUSION: ABC transporter genes msbA and spab play an important role in multidrug resistance of H.pylori.
- Citation: Mi Y, Zheng PY, Zhang BY, Liu ZQ, Song CH, Yang PC. Role of ABC transporter genes msbA and spab in multidrug resistance of Helicobacter pylori. Shijie Huaren Xiaohua Zazhi 2011; 19(14): 1500-1505
- URL: https://www.wjgnet.com/1009-3079/full/v19/i14/1500.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i14.1500
幽门螺杆菌(Helicobacter pylori, H.pylori)在人群中感染率为40%-90%, 是慢性胃炎、消化性溃疡和胃黏膜相关淋巴组织淋巴瘤的主要病因, 并与胃癌的发生密切相关, 临床中常联合应用抗生素对H.pylori进行根除治疗[1]. 随着抗生素的广泛应用, H.pylori的耐药率逐年上升, 并且已经出现同时对阿莫西林、克拉霉素和甲硝唑耐药的多重耐药(multidrug resistance)株[2,3]. 目前针对细菌多重耐药的机制已成为研究的热点. 其中, 外排泵(efflux pump)被认为在细菌多重耐药机制中起重要作用[4,5], 他是细菌中可将不同结构底物泵出菌体外的一类膜转运蛋白, 可分为5个家族[6-9]: (1)ATP结合盒转运体类(ATP-binding cassettes transporters, ABC); (2)主要易化因子家族(major facilitator super-family, MFS); (3)小多重耐药家族(small multidrug resistance, SMR); (4)多重药物与毒物外排家族(multidrug and toxic compound extrusion, MATE); (5)耐受-生节-分裂家族(resistance nodulation division family, RND). ABC转运蛋白家族为其中之一. Reyes等[10]发现ABC转运蛋白msbA基因在革兰阴性菌多重耐药中起作用, 其外排底物包括柔红霉素、阿霉素、长春碱、琥乙红霉素、溴化乙锭、四苯膦等. Woebking等[11]发现ABC转运蛋白msbA基因在乳酸球菌中表达使其对红霉素的耐药程度提高了86倍. 国内外和我们前期[12,13]对RND类外排泵在H.pylori多重耐药中机制研究已有报道, 但对于ABC转运蛋白基因在H.pylori多重耐药株中的作用研究较少. Chiu[14]等发现msbA基因可能参与H.pylori对疏水性药物的耐药, 但是研究对象仅限于3种临床上不常用的疏水性抗生素(红霉素、利福平和新生霉素). 本研究在我们前期研究的基础上, 从GenBank筛选出ABC转运蛋白家族基因中的两个典型的多重耐药蛋白基因msbA和spab, 测定其在H.pylori多重耐药株中的表达, 并构建对应的基因敲除株, 测定敲除前后对应菌株对各种抗生素的敏感性, 研究两种基因在H.pylori多重耐药中的作用. 进一步阐明在H.pylori多重耐药中起作用的外排泵的种类和意义, 为临床上H.pylori多重耐药的研究打下理论基础.
于郑州大学第二附属医院胃镜室随机取胃炎或消化性溃疡患者胃黏膜标本(2009-10/2010-06), 研磨之后涂布于含10%无菌脱纤维羊血的布氏琼脂培养基, 置于CO2培养箱内37 ℃微需氧培养3-7 d, 刮取菌落经HE染色和尿素酶鉴定为H.pylori临床分离株. 氨苄西林、头孢曲松、四环素、克拉霉素、卡那霉素、氯霉素、氧氟沙星、呋喃唑酮、利福平等购自中国药品生物制品检验所. DNA提取试剂盒购自北京天根生物科技公司. TRIzol、cDNA第一链合成试剂盒和Taq酶购自北京全式金生物公司. 内参选gyrB基因(DNA旋转酶B亚单位基因), 引物由上海Invitrogen生物技术公司合成, 引物序列如表1. 质粒提取试剂盒、胶回收试剂盒、T4连接酶购自北京天根生物科技公司. XhoⅠ、XbaⅠ、BamHⅠ、BglⅡ限制性内切酶购自北京Promega生物技术公司.
| 引物名称 | 序列 | 扩增长度(bp) |
| msbA | F: 5'-ATGTGGCGTATGGTTTAG-3' | 303 |
| R: 5'-GGTTGTGCGAGATGAGAA-3' | ||
| spab | F: 5'-TACTGCTTGGCTCATCT-3' | 424 |
| R: 5'-GCATTAGTCGGTAGGAA-3' | ||
| gyrB | F: 5'-TTACTACGACTTATCTGGGGCTAGCGCTG-3' | 500 |
| R: 5'-CCCATCAATTTCCACATTCTCCGC-3' | ||
| msbAM | F: 5'-GATCTCTAGAAGCGTATTTGGGTAAGAGTGG-3' | 1 398 |
| R: 5'-CCGCTCGAGGGGTTGTGCGAGATGAGAAT-3' | ||
| kmM | F: 5'-CGGGATCCAATGATTGAACAAGATGGATTG-3' | 800 |
| R: 5'-CGGGATCCTCAGAAGAACTCGTCAAGAAG-3' | ||
| spabS | F: 5'-GATCTCTAGAAACAATTCGTAAAATAAGCC-3' | 860 |
| R: 5'-CCGCTCGAGTCTACTGAGCAGCAACTACA-3' | ||
| kmS | F: 5'-GCAGATCTAATGATTGAACAAGATGGATTG-3' | 800 |
| R: 5'-GCAGATCTTCAGAAGAACTCGTCAAGAAG-3' |
表1 PCR引物列表
1.2.1 诱导并鉴定H.pylori多重耐药株: 培养并传代临床分离株, 测定其对诱导剂氯霉素的最小抑菌浓度(minimal inhibitory concentration, MIC), 刮取取对数生长期的菌落, 涂布于含1/2 MIC氯霉素的布氏琼脂培养基上, 于37 ℃微需氧培养2-3 d, 重复传代培养, 逐渐成倍增加诱导剂浓度至128倍MIC, 然后接种菌落于含4倍MIC诱导剂培养基上, 传代培养后分别接种于含4倍MIC氨苄西林、头孢曲松、四环素、克拉霉素、卡那霉素、氧氟沙星、呋喃唑酮的布氏琼脂培养基上. 37 ℃微需氧培养2-3 d, 能在大于等于3种抗生素平板上生长的菌株即为多重耐药株[15].
1.2.2 采用琼脂二倍稀释法测定菌株对抗生素的MIC: 选取培养2-3 d处于对数生长期的菌株, 刮取菌落溶于无菌生理盐水, 用分光光度计调浓度至0.5麦氏浓度, 分别接种于不同梯度浓度的抗生素平板, 测定临床分离株和诱导多重耐药株对各种抗生素的MIC.
1.2.3 H.pylori msbA和spab基因的检测: 应用DNA提取试剂盒提取H.pylori的全基因组DNA为模板. PCR扩增体系: 上下游引物各1 μL, DNA模板2 μL, 2×Taq PCR mix 25 μL, ddH2O补总体系至50 μL. 反应条件: 94 ℃预变性5 min, PCR循环参数 94 ℃ 30 s, spab、msbA基因退火温度分别为50 ℃和53 ℃, 30 s, 72 ℃ 60 s共35个循环, 最后72 ℃延伸6 min.
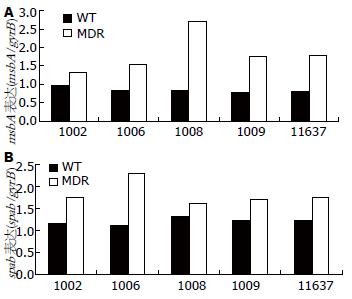
1.2.4 RT-PCR分别测定msbA和spab的表达: 于培养基上刮取处于对数生长期的H.pylori溶于生理盐水中, 用可见分光光度计测定, 当 A660 = 0.1时, 取1 mL用TRIzol法提取H.pylori的RNA, 溶于10 μL DEPC水中. 紫外分光光度计测定RNA含量. 反转录体系如下: Total RNA 8 μL, oligo(dT)18(0.5 g/L)1 μL, Easy Script RT 1 μL, 2×ES Reaction Mix 10 μL, 反应总体系20 μL. 反应条件: 42 ℃ 30 min, 85 ℃ 5 min, 4 ℃ 5 min. PCR反应体系: cDNA 2 μL, 上下游引物各1 μL, 10×Easy Taq Buffer 5 μL, 2.5 mmol/L dNTP 4 μL, Easy Taq DNA Polymerase 1 μL, ddH2O补总体系至50 μL. 反应条件: 94 ℃预变性5 min, PCR循环参数 94 ℃ 30 s, spab、msbA和gyrB基因退火温度分别为50 ℃、53 ℃和62 ℃, 退火30 s, 72 ℃ 60 s共28个循环, 最后72 ℃延伸6 min. 取6 μL PCR产物在含0.5 mg/L EB的2%琼脂糖凝胶中85 V电泳30 min, 并拍照. 得到图像用Gel-pro4.5 Analyzer分析软件做灰度分析, 得出基因表达相对值.
1.2.5 msbA基因敲除株和spab基因敲除株的构建: 参考相关文献[16,17], 以临床分离株H.pylori MZ1006(分离于浅表性胃炎患者)为模板, PCR分别扩增msbA和spab基因编码区195-1 592 bp, 长度1 398 bp(msbAM)和20-879 bp, 长度860 bp(spabS)的大片段(参照GenBank上H.pylori P12 msbA和spab的序列设计引物). 以pEGFP-N2质粒为模板, 分别PCR扩增卡那霉素抗性基因kmM和kmS引物设计及扩增长度见表1. DNA测序由上海英俊生物技术公司完成. msbAM, spabS和pBluescript Ⅱ SK(-)分别经XbaⅠ和XhoⅠ双酶切后, msbAM和pBluescript Ⅱ SK(-), spabS和pBluescript Ⅱ SK(-)酶切产物分别连接鉴定并测序. 分别在msbAM基因737 bp处选择酶切位点BamHⅠ和spabS基因359 bp处选择酶切位点BglⅡ, 分别插入卡那霉素抗性基因kmM和kmS, 转化入DH-5α大肠杆菌, 用试剂盒提取重组质粒以备电击转化所用. 将在琼脂培养基上培养72 h的H.pylori刮取溶于1 mL 15%甘油溶液中, 在5 000 r/min 4 ℃离心10 min, 重复3次, 然后将沉淀重悬于50 μL 15%甘油溶液中, 用紫外分光可见光度计(U-2001)测定A660(A660 = 1, 对应细菌浓度为1×1011 CFU/L), 把细菌浓度调整为1×1013 CFU/L. 于4 ℃放置10 min, 然后分别加打靶载体pBSK-msbA-mutant或pBSK-spab-mutant 500 ng, 放置冰上5 min, 放入-20 ℃预冷的0.2 cm电击池冰浴5 min. 将电击池放置电穿孔架上, 设定电击条件为: 2.5 kv, 25 F, 200 Ω, 9.62 ms, 于电击之后加SOC缓冲液100 μL混入电击池的细菌中, 放置5 min后, 把电转液均匀的涂在布氏琼脂平板上, 在37 ℃培养48 h后, 将平板上所有菌落刮取溶于无菌生理盐水, 涂抹于含25 mg/L卡那霉素的布氏琼脂平板上继续培养3-5 d, 挑取单个菌落鉴定. 采用琼脂二倍稀释法分别测定9种抗生素对msbA和spab基因敲除前后的菌株的最小抑菌浓度.
统计学处理 采用配对t检验的方法分别分析敏感株和诱导多重耐药株两种基因的mRNA相对表达量的差异. 应用SPSS10.0统计软件包进行统计分析.
将临床分离敏感株和标准株经氯霉素诱导, 成功诱导出多重耐药株5株, 经琼脂二倍稀释法鉴定对各种抗生素的MIC, 5株多重耐药株对氨苄西林、头孢菌素、四环素、克拉霉素、氧氟沙星和呋喃唑酮的MIC相对于敏感株均有不同程度的提高(表2).
| 菌株 | 处理 | 氨苄西林 | 头孢曲松 | 四环素 | 克拉霉素 | 氧氟沙星 | 呋喃唑酮 |
| 1002 | 诱导前MIC | 0.500 | 0.250 | 0.125 | 0.500 | 0.063 | 0.125 |
| 诱导后MIC提高倍数 | 4× | 8× | 8× | 16× | 16× | 1× | |
| 1006 | 诱导前MIC | 0.250 | 0.125 | 0.250 | 1.000 | 0.125 | 0.0625 |
| 诱导后MIC提高倍数 | 8× | 4× | 4× | 8× | 8× | 8× | |
| 1008 | 诱导前MIC | 0.250 | 0.250 | 0.125 | 0.500 | 0.125 | 0.125 |
| 诱导后MIC提高倍数 | 16× | 8× | 8× | 16× | 8× | 4× | |
| 1009 | 诱导前MIC | 0.500 | 0.125 | 0.250 | 1.000 | 0.063 | 0.250 |
| 诱导后MIC提高倍数 | 2× | 8× | 4× | 4× | 8× | 8× | |
| 11637 | 诱导前MIC | 0.250 | 0.125 | 0.125 | 1.000 | 0.250 | 0.125 |
| 诱导后MIC提高倍数 | 16× | 16× | 8× | 8× | 16× | 4× |
随机选择20株临床分离株, 均检测出msbA和spab基因, 大小分别为303 bp和424 bp, 未发现两种基因的缺失株.
5株敏感株和诱导耐药株中均可检测出不同程度msbA和spab基因的表达. msbA基因在敏感株中相对表达量为0.8420±0.0789, 而在多重耐药株中相对表达量为1.8200±0.5310, MDR组msbA表达明显高敏感组(P = 0.018). spab基因在敏感株中相对表达量为1.2180±0.0743, 而在多重耐药株中相对表达量为1.8340±0.2726, MDR组spab表达明显高敏感组(P = 0.015, 图1).
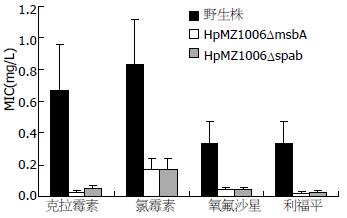
成功构建了msbA基因敲除株(H.pylori MZ1006ΔmsbA)和spab基因敲除株(H.pylori MZ1006Δspab). msbA基因基因编码区内1 390 bp和spab基因编码区内860 bp大小片段分别被测序并提交GenBank数据库(登录号分别为JF427566和JF427567). 采用琼脂二倍稀释法分别测定9种抗生素(氨苄西林、头孢曲松、四环素、克拉霉素、卡那霉素、氯霉素、氧氟沙星、呋喃唑酮、利福平)对两株基因敲除株的MIC, 与基因敲除前野生株H.pylori MZ1006相比, 发现对于H.pylori MZ1006ΔmsbA, 克拉霉素的MIC降低了24倍, 氯霉素的MIC降低了5倍, 氧氟沙星的MIC降低了8倍, 利福平的MIC降低了16倍; 对于H.pylori MZ1006Δspab, 克拉霉素的MIC降低了12倍, 氯霉素的MIC降低了5倍, 氧氟沙星的MIC降低了8倍, 利福平的MIC降低了12倍(图2).
细菌对抗生素的耐药问题, 特别是细菌多重耐药机制, 已成为当前研究的热点. 外排泵(efflux pump)是细菌产生多重耐药的主要原因, 其转运底物非常广泛, 导致细菌对各种结构完全不同的抗菌药物产生耐药. 在外排泵5个家族中, 国内外前期对RND类外排泵做了相关研究, 发现其在革兰阴性菌多重耐药中起重要作用, 我们前期也发现RND类外排泵hefA基因在H.pylori多重耐药中起重要作用[12]. 外排泵抑制剂CCCP和质子泵抑制剂雷贝拉唑、泮托拉唑可以提高多重耐药H.pylori对药物的敏感性[13]. 但是在革兰阴性菌中, 同一株细菌中可存在不同种类的外排泵[18]. 如大肠杆菌中就存在5种家族的外排泵[19]. 除了RND家族, 其他家族外排泵在H.pylori多重耐药中的作用研究甚少. ABC转运蛋白广泛存在于哺乳动物、细菌、真菌、原虫等细胞中, 是ABC驱动泵的一种, 每个成员都有高度保守的ATP结合盒结构, 以主动转运方式完成多种分子(包括蛋白质、小肽、氨基酸、环状糖、离子和抗生素)的跨膜转运, 主动转运的能量来自于ATP的水解[20]. 宋春花等[21]发现在志贺菌基因转移多重耐药株中, 98号ABC转运蛋白表达量相对于敏感株明显上升, 表明其在志贺菌多重耐药中起重要作用.
本研究以ABC转运蛋白中两个典型基因msbA和spab为研究对象, 在临床胃炎和消化性溃疡患者胃黏膜标本中培养筛选出H.pylori敏感株. 采用氯霉素梯度诱导H.pylori多重耐药株的方法, 建立了5株H.pylori多重耐药模型. 采用琼脂二倍稀释法测定了氨苄西林、头孢曲松、四环素、克拉霉素、氧氟沙星、呋喃唑酮对诱导多重耐药株MIC, 发现相对于敏感株都有不同程度的提高, 提示了外排泵可能在多重耐药株中发挥作用. 也证明了在临床上长期低剂量抗生素的滥用, 会导致细菌耐药. 通过RT-PCR半定量的方法, 发现在诱导多重耐药株中msbA和spab的表达相对于敏感株有明显的提高(P = 0.018, 0.015), 说明两种基因可能与H.pylori多重耐药密切相关. 对中国H.pylori临床分离株MZ1006分别敲除其msbA和spab基因, 分别使对应的ABC转运蛋白系统失活, 并检测基因敲除前后菌株对9种抗生素的敏感性, 发现对其中4种抗生素敏感性明显上升, 进一步证明了msbA和spab基因在H.pylori的多重耐药中起重要作用. 而且也证明了除了RND家族的外排泵外, ABC转运蛋白家族外排泵也可能在H.pylori的多重耐药中起作用.
与细菌多重耐药相关的外排泵可分5个家族. 关于外排泵对药物转运的机制, 还存在有许多争论, 但是目前有两种模型认同度比较高.一种为"疏水性的真空吸尘器"(vacuum cleaner), 这种模型认为药物能自由移动到膜的脂层, 接触到转运蛋白的中央通道, 药物从中央通道被排除[22], RND家族的外排泵可以使用该模型解释. 另一种是"翻转酶模式"(flippases)模型: 认为药物自由移动到脂层并与转运蛋白接触, 通过酶的翻转将底物送到外膜[23], 酶所需要的能量一般由ATP水解提供, 这种模型被用来描述多种ABC型的外排泵, 如人类MDR3和MRP基因所编码的外排泵[24]. 在各类外排泵中, 除ABC转运蛋白类以ATP作为能源外排药物外, 其余各类均以质子驱动力为能量并形成质子与药物的反转运体(antiporters). 随着各种外排泵在细菌耐药中越来越多地被发现, 外排泵抑制剂逐渐成为当前研究的热点. 国内外前期针对H.pylori多重耐药外排泵的研究集中在RND类外排泵, 并对可以逆转H.pylori多重耐药的外排泵抑制剂进行了进一步研究. 本研究发现ABC转运蛋白基因与H.pylori多重耐药密切相关, 为H.pylori外排泵抑制剂的研究提供了新的思路, 为今后临床上研究H.pylori多重耐药打下理论基础.
在临床上, 常应用抗生素清除H.pylori以治疗胃炎和消化性溃疡. 随着H.pylori菌株对抗生素的耐药率上升和多重耐药株的出现, H.pylori多重耐药的机制成为研究的热点问题. 目前研究认为, 外排泵在细菌多重耐药的机制中起重要作用.
刘改芳, 主任医师, 河北医科大学第三医院消化内科
细菌对抗生素的耐药问题, 特别是细菌多重耐药机制, 已成为当前研究的热点.
Christopher等发现ABC转运蛋白msbA基因在革兰阴性菌多重耐药中起作用, 其外排底物包括柔红霉素、阿霉素、长春碱、琥乙红霉素、溴化乙锭、四苯膦等. Barbara等发现ABC转运蛋白msbA基因在乳酸球菌中表达, 使其对红霉素的耐药程度提高了86倍.
本文以中国临床分离株为研究对象, 采用氯霉素诱导多重耐药的H.pylori菌株, RT-PCR检测msbA和spab基因在敏感株和多重耐药株中的表达, 并构建对应的基因敲除株, 测定敲除前后菌株对9种抗生素的敏感性的变化.
本研究显示ABC转运蛋白基因在H.pylori多重耐药中起重要作用. 本文更加全面地阐述了外排泵在H.pylori多重耐药机制中的作用, 并为外排泵抑制剂的研究提供了新的理论依据.
本文选题新颖, 设计合理、科学, 具有一定的临床考价值.
编辑: 曹丽鸥 电编:李薇
| 1. | Shi R, Xu S, Zhang H, Ding Y, Sun G, Huang X, Chen X, Li X, Yan Z, Zhang G. Prevalence and risk factors for Helicobacter pylori infection in Chinese populations. Helicobacter. 2008;13:157-165. [PubMed] [DOI] |
| 2. | Boyanova L, Gergova G, Nikolov R, Davidkov L, Kamburov V, Jelev C, Mitov I. Prevalence and evolution of Helicobacter pylori resistance to 6 antibacterial agents over 12 years and correlation between susceptibility testing methods. Diagn Microbiol Infect Dis. 2008;60:409-415. [PubMed] [DOI] |
| 3. | Wueppenhorst N, Stueger HP, Kist M, Glocker E. Identification and molecular characterization of triple- and quadruple-resistant Helicobacter pylori clinical isolates in Germany. J Antimicrob Chemother. 2009;63:648-653. [PubMed] [DOI] |
| 4. | Borges-Walmsley MI, Walmsley AR. The structure and function of drug pumps. Trends Microbiol. 2001;9:71-79. [PubMed] [DOI] |
| 5. | Pagès JM, Sandrine AF, Mahamoud A, Bolla JM, Davin-Regli A, Chevalier J, Garnotel E. Efflux pumps of gram-negative bacteria, a new target for new molecules. Curr Top Med Chem. 2010;10:1848-1857. [PubMed] |
| 6. | Cattoir V. [Efflux-mediated antibiotics resistance in bacteria]. Pathol Biol (Paris). 2004;52:607-616. [PubMed] [DOI] |
| 7. | Andersen C, Hughes C, Koronakis V. Electrophysiological behavior of the TolC channel-tunnel in planar lipid bilayers. J Membr Biol. 2002;185:83-92. [PubMed] [DOI] |
| 8. | Hasdemir U. [The role of cell wall organization and active efflux pump systems in multidrug resistance of bacteria]. Mikrobiyol Bul. 2007;41:309-327. [PubMed] |
| 9. | Zgurskaya HI, Krishnamoorthy G, Tikhonova EB, Lau SY, Stratton KL. Mechanism of antibiotic efflux in Gram-negative bacteria. Front Biosci. 2003;8:s862-s873. [PubMed] [DOI] |
| 10. | Reyes CL, Ward A, Yu J, Chang G. The structures of MsbA: Insight into ABC transporter-mediated multidrug efflux. FEBS Lett. 2006;580:1042-1048. [PubMed] [DOI] |
| 11. | Woebking B, Reuter G, Shilling RA, Velamakanni S, Shahi S, Venter H, Balakrishnan L, van Veen HW. Drug-lipid A interactions on the Escherichia coli ABC transporter MsbA. J Bacteriol. 2005;187:6363-6369. [PubMed] [DOI] |
| 12. | Liu ZQ, Zheng PY, Yang PC. Efflux pump gene hefA of Helicobacter pylori plays an important role in multidrug resistance. World J Gastroenterol. 2008;14:5217-5222. [PubMed] [DOI] |
| 13. | Zhang Z, Liu ZQ, Zheng PY, Tang FA, Yang PC. Influence of efflux pump inhibitors on the multidrug resistance of Helicobacter pylori. World J Gastroenterol. 2010;16:1279-1284. [PubMed] [DOI] |
| 14. | Chiu HC, Lin TL, Yang JC, Wang JT. Synergistic effect of imp/ostA and msbA in hydrophobic drug resistance of Helicobacter pylori. BMC Microbiol. 2009;9:136. [PubMed] [DOI] |
| 16. | Yuan JP, Li T, Shi XD, Hu BY, Yang GZ, Tong SQ, Guo XK. Deletion of Helicobacter pylori vacuolating cytotoxin gene by introduction of directed mutagenesis. World J Gastroenterol. 2003;9:2251-2257. [PubMed] |
| 17. | Burns BP, Hazell SL, Mendz GL, Kolesnikow T, Tillet D, Neilan BA. The Helicobacter pylori pyrB gene encoding aspartate carbamoyltransferase is essential for bacterial survival. Arch Biochem Biophys. 2000;380:78-84. [PubMed] [DOI] |
| 18. | Poole K. Efflux-mediated multiresistance in Gram-negative bacteria. Clin Microbiol Infect. 2004;10:12-26. [PubMed] [DOI] |
| 19. | Paulsen IT, Chen J, Nelson KE, Saier MH. Comparative genomics of microbial drug efflux systems. J Mol Microbiol Biotechnol. 2001;3:145-150. [PubMed] |
| 20. | Jones PM, George AM. The ABC transporter structure and mechanism: perspectives on recent research. Cell Mol Life Sci. 2004;61:682-699. [PubMed] [DOI] |
| 22. | Raviv Y, Pollard HB, Bruggemann EP, Pastan I, Gottesman MM. Photosensitized labeling of a functional multidrug transporter in living drug-resistant tumor cells. J Biol Chem. 1990;265:3975-3980. [PubMed] |
| 23. | van Veen HW, Higgins CF, Konings WN. Multidrug transport by ATP binding cassette transporters: a proposed two-cylinder engine mechanism. Res Microbiol. 2001;152:365-374. [PubMed] [DOI] |
| 24. | Ades S, Maxfield LF, Gould CJ, Jones GK, Levy SB. Selection of non-P-glycoprotein mediated high-level etoposide resistant cell lines by adriamycin with P-gp inhibitors. Int J Oncol. 2006;28:747-753. [PubMed] |