修回日期: 2011-05-09
接受日期: 2011-05-17
在线出版日期: 2011-05-18
目的: 研究人的蛋白激酶A调节亚基RIIβ (PKARIIβ)基因的绿色荧光蛋白(GFP)真核表达载体融合蛋白在胃癌细胞BGC-823内的表达和定位, 初步探讨其在肿瘤细胞中的分子作用机制.
方法: 以pRSETB-PKARIIβ质粒为模板, PCR扩增出全长PKARIIβ编码序列, 用XhoⅠ和EcoRⅠ双酶切后, 亚克隆至含有GFP标签的融合表达载体pEGFP-C1中. 测序正确后, 将重组质粒转染到胃癌细胞BGC-823中, 提取细胞蛋白进行Western bolt检测. 利用共聚焦激光扫描显微镜观察pEGFP-PKARIIβ在人胃癌细胞BGC-823内的定位.
结果: 将人全长PKARIIβ编码序列克隆到了真核表达载体pEGFP-C1中, 酶切鉴定片段为1.2 kb, 在预期的位置产生条带. Western blot检测到了融合蛋白正确表达, 分子量约为72 000 Da. 并观察到GFP-PKARIIβ在HEK293和BGC-823细胞内都有表达, 且定位以细胞质为主, 在细胞核内少量表达.
结论: 成功构建了人全长PKARIIβ编码序列的pEGFP-PKARIIβ真核表达载体, 证实GFP-PKARIIβ蛋白在BGC-823细胞质内特异表达, 为进一步研究PKARIIβ的在胃癌中的功能提供了重要的实验材料.
引文著录: 王桂玲, 姜佩佳, 王孝会, 陈薇. 人pEGFP-PKARIIβ重组质粒的构建及其在BGC-823胃癌细胞中的表达. 世界华人消化杂志 2011; 19(14): 1446-1450
Revised: May 9, 2011
Accepted: May 17, 2011
Published online: May 18, 2011
AIM: To construct a eukaryotic expression plasmid encoding the human protein kinase A regulatory subunit II beta (PKAR IIβ) gene and to examine its expression and localization in BGC-823 gastric cells using green fluorescent protein as a reporter.
METHODS: The coding sequence of the PKAR IIβ gene was amplified from the plasmid pRSETB-PKARIIβ by PCR and subcloned into pEGFP-C1 vector after digestion with Xho I and EcoR I. After the identity of recombinant plasmid was verified by direct sequencing, the plasmid was transfected into BGC-823 cells. The expression of the recombinant plasmid in BGC-823 cells was detected by Western blot. The localization of GFP-PKARIIβ in BGC-823 cells was observed by laser scanning confocal microscopy.
RESULTS: The coding sequence of the PKARIIβ gene was inserted into the pEGFP-C1 vector successfully. Restriction enzymes digestion showed that the length of the insert was 1.2 kb, matching the expected size. The expression of GFP-PKARIIβ fusion protein, which had a molecular weight of 72 000 Da, was detected in BGC-823 cells by Western blot. The GFP-PKARIIβ protein was localized predominantly to the cytoplasm but sparsely to the nucleus of HEK293 and BGC-823 cells.
CONCLUSION: A recombinant plasmid expressing the PKARIIβ gene has been successfully constructed and provides a tool for future investigation of PKARIIβ functions. The GFP-PKARIIβ fusion protein was expressed mainly in the cytoplasm of HEK293 and BGC7901 cells.
- Citation: Wang GL, Jiang PJ, Wang XH, Chen W. Construction of a eukaryotic expression plasmid encoding the human PKAR IIβ gene and its expression in human gastric cancer BGC-823 cells. Shijie Huaren Xiaohua Zazhi 2011; 19(14): 1446-1450
- URL: https://www.wjgnet.com/1009-3079/full/v19/i14/1446.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i14.1446
蛋白激酶A(protein kinase A, PKA), 是最早被发现同时也是最重要的几个激酶之一, 在细胞的很多信号通路中起到重要作用. 他是由两个催化亚基(catalytic subunit, C)与两个调节亚基(regulatory subunit, R)组成的四聚体, 通常是以无活性形式存在[1-3], 当第二信使3, 5'-环腺苷酸(cAMP)结合到调节亚基上时, 释放出具有活性的催化亚基, 从而PKA被激活[4]. 活化的PKA催化亚基可使细胞内某些蛋白的丝氨酸或苏氨酸残基磷酸化, 通过改变这些蛋白的活性, 来进一步影响其相关基因的表达[5]. PKA在细胞核和细胞质都有分布, 参与众多的信号转导通路. 特别在心血管功能调节, 类固醇激素的生物合成, 细胞的增殖分化和侵袭转移以及免疫系统中发挥着重要功能[6-10]. PKA的催化亚基有3种亚型Cα、Cβ和Cγ, 其调节亚基有4种亚型RIα、RIβ、RIIα和RIIβ, 他们有着不同的理化性质[11]. 现有研究表明, PKA信号通路在多种肿瘤的发生和发展中起重要作用[12-15].
PKARIIβ是目前研究的最为广泛的PKA调节亚基, 他存在于大多数被检测的组织中, 如胃、卵巢、肺和结肠等[10,11]. PKARIIβ参与一系列的细胞生物学过程, 如与PKA锚定蛋白(A-kinase anchoring protein, AKAP)相互作用把PKA锚定到细胞内特定区域从而使PKA特异性地磷酸化其底物, 来参与不同的信号通路[16]. 他的异常表达和定位可能与某些肿瘤的发生相关[17]. 目前有关PKARIIβ的研究越来越引起了人们的关注. 在本研究中我们利用基因重组技术成功构建了pEGFP-PKARIIβ真核表达载体, 并在胃癌细胞BGC-823内表达和定位, 为今后进一步研究PKARIIβ在胃癌的生物学功能奠定了基础.
大肠杆菌DH5α为本实验室保存, 原核表达载体pEGFP-C1购自美国Clontech公司; 各种限制性内切酶、PyrobestTM DNA polymerase、电泳凝胶回收试剂盒均购自TaKaRa公司; T4 DNA连接酶购自NEB公司, ECL试剂盒购自Pharmacia公司; 蛋白分子质量标准购自MBI公司; anti-GFP抗体购自Cell Signaling公司; HRP标记羊抗鼠IgG购自Promega公司; ECL发光试剂盒购自Pharmacia; 其他试剂均为国产分析纯; 引物序列合成及DNA序列测定由南京金思瑞公司完成. pRSETB-PKARIIβ质粒由加州大学Susan S. Taylor教授馈赠.
1.2.1 全长人PKARIIβ编码序列扩增: 以pRSETB-PKARIIβ为模板, 利用PCR技术对PKARIIβ进行扩增. 上游引物: 5'-CCGCTCGAGATGAGCATCGAGATCCCG-3', 下游引物: 5'-CCGAATTCCTTCATGCAGTGGGTTCAAC-3', 包括XhoⅠ和EcoRⅠ酶切位点. 反应条件分别为: 94 ℃变性5 min后, 94 ℃ 30 s, 54 ℃ 30 s, 72 ℃ 2 min, 循环30次, 最后于72 ℃延伸5 min. 反应终止后, 1%琼脂糖凝胶电泳, 与标准DNA片段(Mark神对照, 紫外线检测仪观察, 胶回收试剂盒回收约1.2 kb的PKARIIβ的PCR产物.
1.2.2 pEGFP-PKARIIβ表达载体的构建、鉴定与测序: 用XhoⅠ和EcoRⅠ对PKARIIβ PCR纯化产物及pEGFP-C1分别进行酶切, 纯化后以T4 DNA连接酶于16 ℃连接16 h得到连接产物. 取3 μL上述连接反应液转化感受态细胞E.coli DH5α中, 涂布于含卡那霉素的LB琼脂平板, 37 ℃培养过夜. 挑取白色菌落4个, 接种于含卡那霉素3 mL的LB培养液中, 37 ℃振荡过夜. 用碱裂解法制备质粒DNA, 再用XhoⅠ和EcoRⅠ酶切重组质粒并测序, 最后测序证实, 将构建的质粒命名为pEGFP-PKARIIβ.
1.2.3 瞬时转染pEGFP-PKARIIβ表达载体: BGC-823细胞系及HEK-293细胞, 用DMEM高糖培养基培养, 细胞铺于6孔板或12孔板至70%-80%, 用脂质体LipofectamineTM 2000介导转染BGC-823胃癌细胞及HEK-293细胞. 根据转染质粒及细胞类型的不同分为HEK-293细胞pEGFP-PKARIIβ转染组及对照组, BGC-823细胞pEGFP-PKARIIβ转染组. 转染方法按照LipofectaminTM 2000说明书进行.
1.2.4 蛋白提取与Western blot鉴定: 转染36 h后, 分别将转染空质粒pEGFP-C1和转染pEGFP-PKARIIβ的BGC-823细胞培养皿置于冰上, 弃掉培养基, 用PBS清洗两遍. 在细胞中加入60 μL含有蛋白酶抑制剂的RIPA裂解液, 用橡皮刮刀将细胞缓慢刮下. 收集所有液体到新的离心管中, 冰上放置10 min, 裂解细胞. 13 000 g 4 ℃离心30 min, 将上清转到新的离心管中, 取上清5 μL进行定量. 将蛋白定量后, 取80 μg总蛋白经10% SDS-PAGE凝胶分离, 4 ℃过夜恒压转移至PVDF膜上, 5%脱脂奶粉封闭3 h, TBST洗膜15 min, 3次. 用anti-GFP抗体(1:1 000稀释), TBST洗膜15 min, 3次. 再用辣根过氧化物酶标记的羊抗鼠(1:5 000稀释)二抗孵育1 h, TBST洗膜15 min, 3次. ECL显色, 压片. 以GAPDH为内对照, 分别检测两组实验细胞PKARIIβ的表达.
1.2.5 荧光及共聚焦激光扫描显微镜观察pEGFP-PKARIIβ细胞内定位: 瞬时转染pEGFP-PKARIIβ及pEGFP-C1中瞬时转染到HEK-293细胞及胃癌细胞BGC-823, 培养24 h后, 用荧光显微镜及激光共聚焦扫描显微镜进行扫描, 激发光波长为488 nm, 观察转染后细胞内绿色荧光表达.
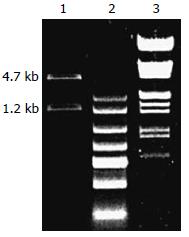
PCR扩增结果显示, 目的条带约为1.2 kb左右(图1), 片段大小与已报道的PKARIIβ基因片段大小相同.
将pEGFP-PKARIIβ经XhoⅠ和EcoRⅠ双酶切后电泳显示, 得到约4.7 kb和1.2 kb左右的两条带, 与预期结果相符, 初步确定得到预期重组质粒(图2). 对酶切鉴定的重组质粒pEGFP-PKARIIβ测序, 结果正确, 无碱基突变.
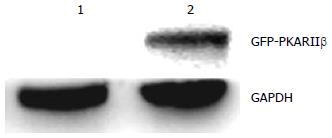
融合GFP-PKARIIβ蛋白在转然后的BGC-823细胞中表达, 其中重组质粒pEGFP-PKARIIβ在72 000 Da附近出现一明显的特异性蛋白带, 其分子量与预期相符(图3).
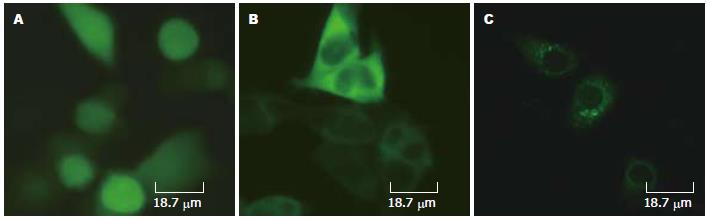
pEGFP-PKARIIβ在细胞内的定位, 转染pEGFP-PKARIIβ及空质粒pEGFP-C1的HEK-293细胞, 荧光显微镜观察空质粒pEGFP-C1的HEK-293细胞绿色荧光遍布核质(图4A); 而pEGFP-PKARIIβ在细胞质内均匀分布, 细胞核内有少量表达(图4B). 为进一步观察pEGFP-PKARIIβ在胃癌BGC-823细胞质内定位, 共焦激光扫描显微镜观察pEGFP-PKARIIβ在细胞质内特异定位(图4C).
人源PKARIIβ位于第7号染色体上, 其cDNA大小为1 257 bp, 编码418个氨基酸[18]. 生物信息学分析表明PKARIIβ的序列与其他PKA调节亚基的序列上有很大的差别, 只有大约50%序列相同, 而正是PKARIIβ与其他PKA调节亚基在结构上的差异提示PKARIIβ可能具有不同的生物学功能[19]. 因此, 目前对PKARIIβ的功能及其作用机制的研究已逐渐成为热点. 然而, 目前国内外对PKA调节亚基在肿瘤细胞中的功能方面研究还不是很多, 尤其对于他们在肿瘤细胞中参与的信号转导通路的机制仍不很清楚.
绿色荧光蛋白(green fluorescent protein, GFP)来源于海洋生物水母, 在蓝光或紫光下可发出荧光, 可用来进行实时检测, 目前已被广泛的用作报告基因进行在体和离体的实验研究[20,21]. 同时在研究基因表达, 细胞分化及蛋白在生物体内定位和转运方面起到了重要作用[22-24], 并且还可用以检测目的基因的高效转染和表达[25,26].
在本研究中, 我们以pRSETB-PKARIIβ为模板, 设计了2对特异性的引物, 并在引物中掺入了限制性酶切位点, 扩增出PKARIIβ基因cDNA全长序列, 联合利用酶切鉴定以及基因测序分析的方法, 证实了pEGFP-PKARIIβ重组质粒构建成功. 并将融合质粒转染到HEK293和BGC-823细胞中, 经Western blot验证了融合蛋白在两种细胞中的都成功表达, 利用荧光显微镜和激光扫描共聚焦显微镜观察到绿色荧光所代表的融合蛋白主要在细胞质中表达, 证实了该重组蛋白在两种细胞内的表达与定位, 并且可以清楚地观察到两种细胞中pEGFP-PKARIIβ定位的差异. 通过构建pEGFP-PKARIIβ融合蛋白真核表达载体, 我们可以比较正常细胞和肿瘤细胞中PKARIIβ功能上的差异, 并能利用其对细胞进行瞬时或稳定转染, 使细胞中PKARIIβ高表达, 进而检测PKARIIβ调节的下游靶基因的启动子、mRNA及蛋白水平的表达, 分析PKARIIβ在信号转导中所担当的角色; 而且, 利用稳定高表达PKARIIβ的细胞系还可以观察PKARIIβ对肿瘤细胞生长、侵袭、凋亡、细胞周期等的影响[27].
目前已有证据表明, 多种癌症的发生, 包括食管癌、卵巢癌、胰腺癌以及急性成淋巴细胞性白血病等, 都与PKA的异常激活相关[29-35], 但对于胃癌中PKA信号通路的研究目前还很少, 因此对PKARIIβ参与的信号通路的研究可能为胃癌治疗提供一条新的途径. 寻找肿瘤治疗靶点是目前肿瘤研究的热点, 通过比较正常细胞和胃癌细胞中PKARIIβ在信号通路中功能的差异可能为我们研究肿瘤提供更广泛的思路, 而我们对于PKARIIβ结构和功能的探索将为未来治疗胃癌及其他恶性肿瘤药物的开发提供新的策略.
蛋白激酶A(PKA)是最早发现并且研究最为广泛的激酶之一, 他的异常表达和激活可以引起包括恶性肿瘤在内的各种疾病. 在我国胃癌的死亡率居各种恶性肿瘤之首, 他的发生是由许多因素共同参与和积累造成的, 其中将激酶信号通路确定为肿瘤治疗的靶点是未来抗肿瘤药物的一项研发策略.
李淑德, 主任医师, 中国人民解放军第二军医大学长海医院消化内科
PKARIIβ是PKA激酶重要的调节亚基, 因在结构上的差异提示PKARIIβ可能具有与其他调节亚基不同的生物学功能. 目前对PKARIIβ的功能及其作用机制的研究已逐渐成为热点. 但对其在胃癌细胞中参与的信号转导通路的机制及功能仍不很清楚.
目前, 对PKA研究的重点已逐渐从PKA的催化亚基转移到PKA的调节亚基上, 如在2006年, Inan等报道了PKARIIβ在cAMP-PKA信号通路中的作用. 但对于胃癌中PKA信号通路的研究目前还很少. 因此对其重要的调节亚基PKARIIβ参与的信号通路的研究可能为胃癌治疗提供一条新的途径.
PKARIIβ的研究对阐明PKA信号调控的机制有重要意义. 本文创新之处在于选择了PKA的一个具有广泛调控作用并在胃癌中研究较少的调节亚基PKARIIβ, 将其构建到真核表达载体pEGFP-C1中, 使其在胃癌细胞BGC-823中表达, 为研究PKARIIβ在胃癌发生发展中的作用奠定了实验基础.
本文通过构建GFP-PKARIIβ载体, 并成功在胃癌BGC-823细胞中表达及定位, 通过比较正常细胞和胃癌细胞中PKARIIβ在信号通路中功能的差异可能为研究肿瘤提供新的思路和干预靶点,为探讨PKARIIβ在胃癌发生发展中的作用具有重要的意义.
本文方法先进, 设计合理, 对胃癌发病机制探讨有重要的临床意义.
编辑: 李薇 电编:何基才
| 1. | Taskén K, Aandahl EM. Localized effects of cAMP mediated by distinct routes of protein kinase A. Physiol Rev. 2004;84:137-167. [PubMed] [DOI] |
| 2. | Skalhegg BS, Tasken K. Specificity in the cAMP/PKA signaling pathway. Differential expression,regulation, and subcellular localization of subunits of PKA. Front Biosci. 2000;5:D678-D693. [PubMed] [DOI] |
| 3. | Kim C, Vigil D, Anand G, Taylor SS. Structure and dynamics of PKA signaling proteins. Eur J Cell Biol. 2006;85:651-654. [PubMed] [DOI] |
| 4. | Shemarova IV. cAMP-dependent signal pathways in unicellular eukaryotes. Crit Rev Microbiol. 2009;35:23-42. [PubMed] [DOI] |
| 5. | Wojtal KA, Hoekstra D, van Ijzendoorn SC. cAMP-dependent protein kinase A and the dynamics of epithelial cell surface domains: moving membranes to keep in shape. Bioessays. 2008;30:146-155. [PubMed] [DOI] |
| 6. | Scott JD, Santana LF. A-kinase anchoring proteins: getting to the heart of the matter. Circulation. 2010;121:1264-1271. [PubMed] [DOI] |
| 7. | Yuan W, López Bernal A. Cyclic AMP signalling pathways in the regulation of uterine relaxation. BMC Pregnancy Childbirth. 2007;7 Suppl 1:S10. [PubMed] [DOI] |
| 8. | Luconi M, Cantini G, Baldi E, Forti G. Role of a-kinase anchoring proteins (AKAPs) in reproduction. Front Biosci. 2011;16:1315-1330. [PubMed] [DOI] |
| 9. | Gerits N, Kostenko S, Shiryaev A, Johannessen M, Moens U. Relations between the mitogen-activated protein kinase and the cAMP-dependent protein kinase pathways: comradeship and hostility. Cell Signal. 2008;20:1592-1607. [PubMed] [DOI] |
| 10. | Yaqub S, Taskén K. Role for the cAMP-protein kinase A signaling pathway in suppression of antitumor immune responses by regulatory T cells. Crit Rev Oncog. 2008;14:57-77. [PubMed] |
| 11. | Colledge M, Scott JD. AKAPs: from structure to function. Trends Cell Biol. 1999;9:216-221. [PubMed] [DOI] |
| 12. | Merkle D, Hoffmann R. Roles of cAMP and cAMP-dependent protein kinase in the progression of prostate cancer: cross-talk with the androgen receptor. Cell Signal. 2011;23:507-515. [PubMed] [DOI] |
| 13. | Boikos SA, Stratakis CA. Molecular genetics of the cAMP-dependent protein kinase pathway and of sporadic pituitary tumorigenesis. Hum Mol Genet. 2007;16 Spec No 1:R80-R87. [PubMed] [DOI] |
| 14. | Mantovani G, Bondioni S, Lania AG, Rodolfo M, Peverelli E, Polentarutti N, Veliz Rodriguez T, Ferrero S, Bosari S, Beck-Peccoz P. High expression of PKA regulatory subunit 1A protein is related to proliferation of human melanoma cells. Oncogene. 2008;27:1834-1843. [PubMed] [DOI] |
| 15. | Li Y, Chen Y, Tao Y, Wang Y, Chen Y, Xu W. Fibronectin increases RhoA activity through inhibition of PKA in the human gastric cancer cell line SGC-7901. Mol Med Report. 2011;4:65-69. [PubMed] |
| 16. | Welch EJ, Jones BW, Scott JD. Networking with AKAPs: context-dependent regulation of anchored enzymes. Mol Interv. 2010;10:86-97. [PubMed] [DOI] |
| 17. | Gu L, Lau SK, Loera S, Somlo G, Kane SE. Protein kinase A activation confers resistance to trastuzumab in human breast cancer cell lines. Clin Cancer Res. 2009;15:7196-7206. [PubMed] [DOI] |
| 18. | Solberg R, Sistonen P, Träskelin AL, Bérubé D, Simard J, Krajci P, Jahnsen T, de la Chapelle A. Mapping of the regulatory subunits RI beta and RII beta of cAMP-dependent protein kinase genes on human chromosome 7. Genomics. 1992;14:63-69. [PubMed] [DOI] |
| 19. | Inan M, Lu HC, Albright MJ, She WC, Crair MC. Barrel map development relies on protein kinase A regulatory subunit II beta-mediated cAMP signaling. J Neurosci. 2006;26:4338-4349. [PubMed] [DOI] |
| 20. | Kisgati M, Asmis R. Generation of retroviruses for the overexpression of cytosolic and mitochondrial glutathione reductase in macrophages in vivo. Cytotechnology. 2007;54:5-14. [PubMed] [DOI] |
| 21. | Santos MG, Jorge SA, Brillet K, Pereira CA. Improving heterologous protein expression in transfected Drosophila S2 cells as assessed by EGFP expression. Cytotechnology. 2007;54:15-24. [PubMed] [DOI] |
| 22. | Malecaze F, Couderc B, de Neuville S, Serres B, Mallet J, Douin-Echinard V, Manenti S, Revah F, Darbon JM. Adenovirus-mediated suicide gene transduction: feasibility in lens epithelium and in prevention of posterior capsule opacification in rabbits. Hum Gene Ther. 1999;10:2365-2372. [PubMed] [DOI] |
| 23. | Hanawa H, Hematti P, Keyvanfar K, Metzger ME, Krouse A, Donahue RE, Kepes S, Gray J, Dunbar CE, Persons DA. Efficient gene transfer into rhesus repopulating hematopoietic stem cells using a simian immunodeficiency virus-based lentiviral vector system. Blood. 2004;103:4062-4069. [PubMed] [DOI] |
| 24. | Lin Y, Luo E, Chen X, Liu L, Qiao J, Yan Z, Li Z, Tang W, Zheng X, Tian W. Molecular and cellular characterization during chondrogenic differentiation of adipose tissue-derived stromal cells in vitro and cartilage formation in vivo. J Cell Mol Med. 2005;9:929-939. [PubMed] [DOI] |
| 25. | Zhong F, Zhong ZY, Liang S, Li XJ. [Transfection of GFP mRNA in dendritic cells and analysis of some factors involved]. Xibao Yu Fenzi Mianyixue Zazhi. 2006;22:716-719. [PubMed] |
| 27. | Diviani D. Modulation of cardiac function by A-kinase anchoring proteins. Curr Opin Pharmacol. 2008;8:166-173. [PubMed] [DOI] |
| 28. | 刘 康栋, 王 瑾瑾, 赵 继敏, 杨 洪艳, 黄 幼田, 郑 智敏, 董 子明. 互隔交链孢霉素活化NIH3T3细胞中蛋白激酶A. 世界华人消化杂志. 2010;18:2637-2641. [DOI] |
| 29. | Naviglio S, Caraglia M, Abbruzzese A, Chiosi E, Di Gesto D, Marra M, Romano M, Sorrentino A, Sorvillo L, Spina A. Protein kinase A as a biological target in cancer therapy. Expert Opin Ther Targets. 2009;13:83-92. [PubMed] [DOI] |
| 30. | Park SY, Cho SJ, Kwon HC, Lee KR, Rhee DK, Pyo S. Caspase-independent cell death by allicin in human epithelial carcinoma cells: involvement of PKA. Cancer Lett. 2005;224:123-132. [PubMed] [DOI] |
| 31. | Chen Y, Wang Y, Yu H, Wang F, Xu W. The cross talk between protein kinase A- and RhoA-mediated signaling in cancer cells. Exp Biol Med (Maywood). 2005;230:731-741. [PubMed] |
| 32. | Waschek JA, Dicicco-Bloom E, Nicot A, Lelievre V. Hedgehog signaling: new targets for GPCRs coupled to cAMP and protein kinase A. Ann N Y Acad Sci. 2006;1070:120-128. [PubMed] [DOI] |
| 33. | Stratakis CA. New genes and/or molecular pathways associated with adrenal hyperplasias and related adrenocortical tumors. Mol Cell Endocrinol. 2009;300:152-157. [PubMed] [DOI] |
| 34. | Cheadle C, Nesterova M, Watkins T, Barnes KC, Hall JC, Rosen A, Becker KG, Cho-Chung YS. Regulatory subunits of PKA define an axis of cellular proliferation/differentiation in ovarian cancer cells. BMC Med Genomics. 2008;1:43. [PubMed] [DOI] |
| 35. | Ji Z, Mei FC, Miller AL, Thompson EB, Cheng X. Protein kinase A (PKA) isoform RIIbeta mediates the synergistic killing effect of cAMP and glucocorticoid in acute lymphoblastic leukemia cells. J Biol Chem. 2008;283:21920-21925. [PubMed] [DOI] |