修回日期: 2011-03-30
接受日期: 2011-04-11
在线出版日期: 2011-05-08
目的: 研究内质网应激条件下肝癌细胞SMMC-7721蛋白质组的表达, 为人类肝细胞癌的诊治提供新的靶点.
方法: 培养肝癌细胞株SMMC-7721, 随机分为两组, 即实验组和对照组. 实验组加入二硫苏糖醇(DTT, 2.5 mmol/L), 对照组加入等量的培养基, 裂解细胞, 提取全细胞蛋白. 双向电泳(2-DE)分离, Image Master 2D Platinum软件进行差异表达蛋白质组分析, 基质辅助激光解吸附离子化飞行时间质谱(MALDI-TOF-MS)鉴定蛋白质.
结果: 实验组肝癌细胞SMMC-7721的2-DE图谱上共检出蛋白质斑点(844±46)个, 对照组共检出蛋白质斑点(1 015±63)个, 对照组与实验组自动匹配配对(593±23)对, 匹配率约71%左右, 绝大多数蛋白集中于pH5.2-6.5, 相对分子质量15 000-80 000 Da; 获得组间标准化总灰度值(%Vol)相差2倍及以上的蛋白斑点3个, 通过MALDI-TOF-MS分析鉴定了3个差异蛋白质点, 分别是: fem-1同源蛋白B、细胞周期素A1、增殖诱导蛋白44.
结论: 鉴定的3个肝癌细胞株SMMC-7721在内质网应激下表达改变的蛋白质, 其功能涉及细胞增殖、细胞凋亡以及细胞周期等, 具有潜在的作为肝癌诊断、预后标记物或治疗靶点的意义.
引文著录: 严冬梅, 刘友平, 代荣阳, 段春燕, 陈绍坤. 肝癌细胞蛋白质组在DTT诱导内质网应激条件下的表达. 世界华人消化杂志 2011; 19(13): 1331-1335
Revised: March 30, 2011
Accepted: April 11, 2011
Published online: May 8, 2011
AIM: To explore new therapy targets for human hepatocellular carcinoma by proteomic profiling of human hepatocellular carcinoma SMMC-7721 cells under endoplasmic reticulum stress.
METHODS: Cultured SMMC-7721 cells were divided into two groups: experimental group and control group. The experimental group was treated with dithiothreitol (DTT, 2.5 mmol/L), while the control group was treated with equal volume of culture medium. After treatment, total cell proteins were prepared and resolved by two-dimensional electrophoresis (2-DE). The two-dimensional electrophoresis maps for the two groups of cells were analyzed using ImageMaster 2D Platinum software. Proteins that showed obvious expression alteration in the experimental group were identified by matrix-assisted laser desorption ionization time-of-flight mass spectrometry (MALDI-TOF-MS).
RESULTS: There were 844 ± 46 protein spots in the 2-DE map for the experimental group and 1 015 ± 63 protein spots for the control group. There were 593 ± 23 pairs of matched protein spots between the two groups, and the matching rate was about 71%. Most of the proteins have an isoelectric point at pH5.2-6.5 and a molecular weight of 15 000-80 000 Da. Three protein spots showed 2-fold or greater differential expression between the two groups and were identified by MALDI-TOF-MS. They were protein fem-1 homolog B, cyclin A1, and proliferation-inducing protein 44.
CONCLUSION: Three differentially expressed proteins in SMMC-7721 cells under endoplasmic reticulum stress were identified and may be useful molecular targets for the diagnosis and treatment of hepatocellular carcinoma.
- Citation: Yan DM, Liu YP, Dai RY, Duan CY, Chen SK. Proteomic profiling of human hepatocellular carcinoma SMMC-7721 cells under endoplasmic reticulum stress induced with dithiothreitol. Shijie Huaren Xiaohua Zazhi 2011; 19(13): 1331-1335
- URL: https://www.wjgnet.com/1009-3079/full/v19/i13/1331.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i13.1331
内质网是一种重要的真核细胞器, 由于各种原因引起的内质网中未折叠或错误折叠蛋白质的堆积能引起未折叠蛋白反应(unfolded protein response, UPR), 导致内质网应激(endoplasmic reticulum stress, ER stress)[1-4]. UPR对应激细胞恢复正常功能起重要作用, 但是当细胞面临过强或持续性内质网应激时, UPR则会启动凋亡信号清除不能恢复功能的细胞. UPR与肿瘤关系密切, 其通过促进血管生成、促进肿瘤细胞休眠及降低肿瘤细胞对某些化学药物的敏感性等发挥促癌作用[5,6]. 肝细胞癌(hepatocellular carcinoma, HCC)是我国最常见的恶性肿瘤之一, 在我国为第2位的癌症死因[7], 其发病率近年来仍有上升趋势[8]. 其发生是一个多基因、多途径的复杂过程, 新近研究[9,10]表明UPR与HCC的发生、发展密切相关.
蛋白质组学以组织或细胞的全部蛋白质为研究对象, 以蛋白质整体表达水平的研究为特点. 近年来, 肝癌细胞系的蛋白组学研究为揭示HCC发生机制奠定了重要的实验基础. 如Fujii等运用蛋白质组学技术研究了不同HCC细胞系抑癌基因结合蛋白、转录调节蛋白、细胞周期调节蛋白等在正常细胞和癌细胞之间表达的差异性, 并建立了HCC细胞系HepG2的蛋白电泳图谱和数据库, 在HCC蛋白质谱研究领域具有里程碑式的意义[11,12]. 然而如何早期诊断及治疗HCC仍是目前面临的一大难题. 本研究从整体的角度出发, 采用内质网应激诱导剂二硫苏糖醇(dithiothreitol, DDT)刺激HCC细胞株SMMC-7721, 运用蛋白质组学方法[13-15], 通过双向凝胶电泳、质谱分析和生物信息学等技术方法, 获得HCC细胞双向电泳图谱. 通过对这些图谱进行蛋白质表达差异分析并结合GenBank数据库资料, 确定与HCC细胞SMMC-7721内质网应激相关的蛋白质分子的表达变化, 从而全面了解蛋白表达改变与HCC细胞内质网应激的关系, 以期为HCC的诊治提供新的靶点.
DTT购自Sigma公司, 丙烯酰胺、甲叉双丙烯酰胺(N, N-methyleuebisacrylamide)、三羟甲基氨基甲烷(Tris)、尿素(urea)、3-[(3-胆酰胺丙基)-二乙胺]-丙磺酸(CHAPS)、甘氨酸、N, N, N, N, -四甲基乙二胺(TEMED)、过硫酸铵(APS)、十二烷基磺酸钠(SDS)、固相pH梯度干胶条(pH4-7, 17 cm)和矿物油购自Bio-Rad公司; 蛋白分子质量Marker和苯甲基磺酰氟(PMSF)购自碧云天生物技术研究所; 其他常规试剂均购自GE Healthcare公司. 低温台式离心机(TDZ4.WS)购自长沙湘仪离心机仪器有限公司; 双向电泳系统、ChemiDoc XRS蛋白凝胶成像系统购自Bio-Rad公司; 高速冷冻离心机购自Sigma公司.
1.2.1 实验分组及样品制备: HCC细胞株SMMC- 7721在50 mL/L CO2, 37 ℃孵箱内用DMEM完全培养基(含102 mL/L FBS、20 mmol/L NaHCO3、20 mmol/L HEPES、100 kU/L青霉素和100 mg/L链霉素)培养, 根据具体情况更换培养基. 实验组用DTT(2.5 mmol/L)诱导HCC细胞内质网应激反应[16,17], 对照组加入等量的培养基, 24 h后弃去培养基, 生理盐水清洗2次, 加细胞裂解液, 4 ℃振摇30 min, 4 ℃ 12 000 r/min离心30 min, 收集上清液即为蛋白质提取物, 运用Bradford法[18]测定总蛋白浓度.
1.2.2 蛋白质的双向凝胶电泳: 将150 μg蛋白质样品与样品水化液充分混匀后, 加入水化槽中. 将IPG胶条(pH4-7, 17 cm)放入水化槽, 室温下被动水化12 h. 根据资料[19-21], 17 ℃进行第一向电泳, 等电聚焦总伏时数为80 000 V; 二向电泳采用10% SDS-PAGE, 电泳至溴酚蓝到达凝胶底部.
1.2.3 数据分析及质谱鉴定: 采用银染法[22]对双向电泳后的凝胶进行染色. 运用Image Master 2D Platinum5.0分析软件进行蛋白质的差异分析, 初步筛选出实验组和对照组差异表达的蛋白质. 以上每个样品重复实验3次. 取组间标准化总灰度值(%Vol)都相差2倍及以上[23]的蛋白斑点3个, 胶内酶切, 进行基质辅助激光解吸附离子化飞行时间质谱(matrix-assisted laser desorption ionization time of flight mass spectrometry, MALDI-TOF-MS)鉴定, 获得各差异蛋白质斑点的肽指纹图谱. 再结合这些蛋白质斑点的等电点和分子量等信息, 使用肽指纹图谱匹配软件Mascot检索匹配GenBank数据库进行蛋白质斑点的鉴定.
统计学处理 所有数据的统计分析在Excel及SPSS11.0软件上进行.
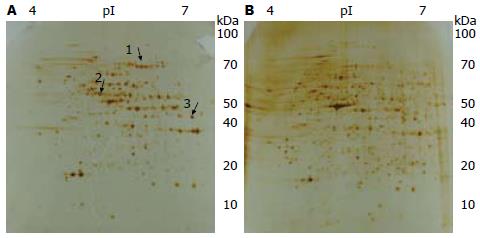
培养HCC细胞株SMMC-7721, DTT诱导内质网应激, 裂解细胞提取蛋白, 双向凝胶电泳分离、银染法染色获得背景较清晰、分辨率高、重复性好的2-DE图谱. 通过Image Master 2D Platinum5.0分析软件对2-DE图谱的斑点进行自动检测, 实验组即DTT诱导内质网应激组共有可稳定重复的蛋白斑点(844±46)个, 对照组共有可稳定重复的蛋白斑点(1 015±63)个, 对照组与实验组自动匹配配对(593±23)对, 匹配率约71%左右. 绝大多数蛋白集中于pH5.2-6.5, 相对分子质量15 000-80 000 Da(图1).
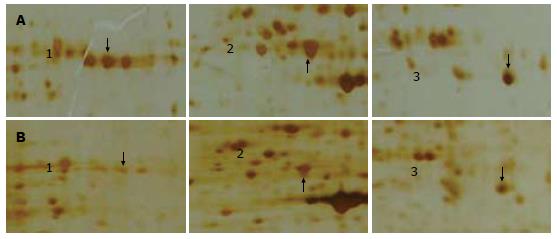
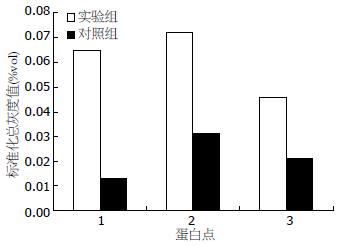
实验组较对照组的蛋白质表达谱在3次双向电泳图谱中均出现总灰度差达2倍以上的蛋白点视为差异表达蛋白点, 其中变化明显的蛋白点3个, 见图1, 2所示的蛋白点1-3. 将各差异蛋白的表达量进行柱状分析: HCC细胞SMMC-7721内质网应激条件下各差异表达蛋白点都表现为明显上调趋势(图3).
通过Image Master 2D Platinum5.0分析软件匹配对比分析, 筛选出内质网应激下HCC细胞SMMC-7721表达明显改变的蛋白质斑点3个进行质谱检测鉴定, 获得了这些蛋白质斑点的肽指纹图谱, 采用Mascot软件将各蛋白质斑点的肽指纹图谱与GenBank数据库中已知蛋白的标准肽指纹图谱相比较, 获得各蛋白质斑点的鉴定结果(表1).
| 蛋白编号 | 蛋白名称 | GenBank号 | 蛋白匹配分值 | 肽段匹配数 | 理论分子质量(Da)/等电点 | 实验分子质量(Da)/等电点 | 功能 |
| 1 | fem-1同源蛋白B | gi|7657265 | 48 | 13 | 71 189/6.14 | 70 000/5.8 | 细胞的凋亡 |
| 2 | 细胞周期素A1 | gi|2183079 | 42 | 11 | 46 993/5.22 | 50 000/5.4 | 细胞周期的调控 |
| 3 | 增殖诱导蛋白44 | gi|46981977 | 52 | 10 | 55 601/6.93 | 40 000/6.5 | 蛋白质的合成 |
肿瘤细胞具有旺盛的蛋白合成和分泌功能, 因而其内质网稳态的维持显得尤为重要. 肿瘤生长过程中缺氧、过酸和营养不足能激活未折叠蛋白反应, 进而使肿瘤细胞适应不利环境, 未折叠蛋白反应的激活对肿瘤的发展起着重要作用[5,24-26]. 我们前期的实验结果表明HCC细胞对内质网应激的耐受能力远远强于正常肝细胞[27], 这就表明HCC细胞具有更强的抵抗内质网应激诱导凋亡的机制, HCC细胞正是利用这些机制维持了其在内质网应激环境中的存活. HCC细胞抵抗内质网应激诱导的凋亡是未折叠蛋白反应发挥促HCC作用的核心事件, 目前对HCC细胞耐受内质网应激凋亡的机制还很不清楚.
已鉴定的内质网应激条件下HCC细胞SMMC-7721差异表达的蛋白质3个. 其中fem-1同源蛋白B是E3蛋白连接酶复合体的组成成分, 有研究表明, fem-1作为CED-3底物可能介导哺乳动物细胞的凋亡[28], 在结肠癌细胞中, fem-1b作为一种凋亡前体蛋白, 调节蛋白酶体抑制剂介导的细胞凋亡[29]. 本研究发现HCC细胞SMMC-7721在DTT诱导下发生内质网应激, fem-1蛋白的表达量明显增高, 提示fem-1蛋白与HCC细胞内质网应激诱导的凋亡有关. cyclin家族对于细胞周期具有重要的调控作用, 包括cyclin A-H. cyclin A只出现在细胞核, 可与p34cdc2和cdc2有关的激酶结合. 有资料表明[30-32], cyclin A基因的持续表达可能与HCC的发生有关. cyclin A与p34cdc2结合, 诱导细胞分裂, 他在细胞中的水平持续增高可使细胞停止在有丝分裂期. cyclin A与细胞周期蛋白依赖性激酶(cyclin dependent kinase, CDK)结合之后才显示酶的活性, 可促进DNA复制顺利完成, 并且为分裂期所需的蛋白质合成做好准备. cyclin A包括: 表达于减数分裂和非常早期胚胎的胚胎特异型cyclin A1和在所有体细胞中都可见到的体细胞型cyclin A2. cyclin A1在细胞周期调节蛋白家族中发现较晚, 在细胞周期中, G1晚期到S期是细胞增殖最重要的时期, 有研究发现, 减少cyclin A1依赖的激酶2(CDK2)可以使细胞阻滞于S期[33]. 本研究发现HCC细胞内质网应激诱导下cyclin A1表达增加, 提示cyclin A1蛋白水平的升高, 促进细胞周期发展及细胞增殖, 与HCC的发生有关. 增殖诱导蛋白44是一种氨基酰tRNA合成酶, 其表达增强可促进蛋白质翻译过程.
总之, 本研究发现的内质网应激条件下HCC细胞SMMC-7721差异表达的蛋白质3个与细胞凋亡、细胞周期以及细胞增殖有关, 说明了内质网应激与HCC的病理生理密切相关, 进一步明确相关蛋白在HCC中的作用机制, 有望为HCC的诊治提供新的突破点.
内质网是细胞储存Ca2+和加工蛋白的主要场所, 其功能紊乱将导致内质网应激. 肿瘤细胞具有旺盛的蛋白合成和分泌功能, 因而其内质网稳态的维持显得尤为重要. 肿瘤生长过程中缺氧、过酸和营养不足能激活未折叠蛋白反应, 进而使肿瘤细胞适应不利环境, 未折叠蛋白反应的激活对肿瘤的发展起着重要作用. 肝细胞癌是我国最常见的恶性肿瘤之一, 未折叠蛋白反应与肝癌的发生、发展密切相关.
周南进, 研究员, 江西省医学科学研究所
如何早期诊断及治疗HCC仍是目前面临的一大难题.
本研究通过双向电泳结合质谱技术检测出内质网应激条件下肝癌细胞SMMC-7721与对照组相比有3个差异蛋白质点, 分别是: fem-1同源蛋白 B, 细胞周期素A1, 增殖诱导蛋白44. 这3个差异表达蛋白质的表达量较对照组都明显增高.
内质网应激条件下肝癌细胞SMMC-7721与对照组差异表达蛋白质的变化很可能是肝癌细胞抵抗内质网应激的物质基础. 如果对以上差异表达蛋白质的进一步研究将为揭示肝癌发病的分子机制及寻找诊断治疗靶标提供可靠的实验依据.
本文设计合理, 方法恰当, 内容新颖, 具有较好的临床指导意义.
编辑: 李薇 电编:何基才
| 1. | Friedlander R, Jarosch E, Urban J, Volkwein C, Sommer T. A regulatory link between ER-associated protein degradation and the unfolded-protein response. Nat Cell Biol. 2000;2:379-384. [PubMed] [DOI] |
| 2. | Kaufman RJ. Stress signaling from the lumen of the endoplasmic reticulum: coordination of gene transcriptional and translational controls. Genes Dev. 1999;13:1211-1233. [PubMed] [DOI] |
| 3. | Harding HP, Calfon M, Urano F, Novoa I, Ron D. Transcriptional and translational control in the Mammalian unfolded protein response. Annu Rev Cell Dev Biol. 2002;18:575-599. [PubMed] [DOI] |
| 4. | Schröder M, Kaufman RJ. ER stress and the unfolded protein response. Mutat Res. 2005;569:29-63. [PubMed] [DOI] |
| 5. | Ma Y, Hendershot LM. The role of the unfolded protein response in tumour development: friend or foe? Nat Rev Cancer. 2004;4:966-977. [PubMed] [DOI] |
| 6. | Healy SJ, Gorman AM, Mousavi-Shafaei P, Gupta S, Samali A. Targeting the endoplasmic reticulum-stress response as an anticancer strategy. Eur J Pharmacol. 2009;625:234-246. [PubMed] [DOI] |
| 7. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] [DOI] |
| 8. | Llovet JM. Updated treatment approach to hepatocellular carcinoma. J Gastroenterol. 2005;40:225-235. [PubMed] [DOI] |
| 9. | Al-Rawashdeh FY, Scriven P, Cameron IC, Vergani PV, Wyld L. Unfolded protein response activation contributes to chemoresistance in hepatocellular carcinoma. Eur J Gastroenterol Hepatol. 2010;22:1099-1105. [PubMed] [DOI] |
| 10. | Narjoz C, Marisa L, Imbeaud S, Paris A, Delacroix H, Beaune P, De Waziers I. Genomic consequences of cytochrome P450 2C9 overexpression in human hepatoma cells. Chem Res Toxicol. 2009;22:779-787. [PubMed] [DOI] |
| 11. | Fujii K, Kondo T, Yokoo H, Yamada T, Iwatsuki K, Hirohashi S. Proteomic study of human hepatocellular carcinoma using two-dimensional difference gel electrophoresis with saturation cysteine dye. Proteomics. 2005;5:1411-1422. [PubMed] [DOI] |
| 12. | Fujii K, Kondo T, Yokoo H, Okano T, Yamada M, Yamada T, Iwatsuki K, Hirohashi S. Database of two-dimensional polyacrylamide gel electrophoresis of proteins labeled with CyDye DIGE Fluor saturation dye. Proteomics. 2006;6:1640-1653. [PubMed] [DOI] |
| 13. | Shu H, Kang X, Guo K, Li S, Li M, Sun L, Gan L, Liu Y, Qin X. Diagnostic value of serum haptoglobin protein as hepatocellular carcinoma candidate marker complementary to α fetoprotein. Oncol Rep. 2010;24:1271-1276. [PubMed] |
| 15. | 丁 守怡, 钱 冬萌, 闰 志勇, 宋 旭霞, 牟 文凤, 王 斌. 蛋白质芯片飞行质谱技术检测体外培养的肝癌细胞株与转染HBV的肝癌细胞株蛋白质的差异表达. 世界华人消化杂志. 2005;13:1684-1687. [DOI] |
| 16. | Lai CW, Aronson DE, Snapp EL. BiP availability distinguishes states of homeostasis and stress in the endoplasmic reticulum of living cells. Mol Biol Cell. 2010;21:1909-1921. [PubMed] [DOI] |
| 17. | Qin L, Wang Z, Tao L, Wang Y. ER stress negatively regulates AKT/TSC/mTOR pathway to enhance autophagy. Autophagy. 2010;6:239-247. [PubMed] [DOI] |
| 18. | Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 1976;72:248-254. [PubMed] [DOI] |
| 20. | Ding SJ, Li Y, Shao XX, Zhou H, Zeng R, Tang ZY, Xia QC. Proteome analysis of hepatocellular carcinoma cell strains, MHCC97-H and MHCC97-L, with different metastasis potentials. Proteomics. 2004;4:982-994. [PubMed] [DOI] |
| 21. | Cui JF, Liu YK, Pan BS, Song HY, Zhang Y, Sun RX, Chen J, Feng JT, Tang ZY, Yu YL. Differential proteomic analysis of human hepatocellular carcinoma cell line metastasis-associated proteins. J Cancer Res Clin Oncol. 2004;130:615-622. [PubMed] [DOI] |
| 22. | 范 云峰, 谢 虹, 梁 建生. 双向电泳中4种常用染色方法的灵敏度比较. 扬州大学学报(农业与生命科学版). 2008;29:80-83. |
| 24. | Kim R, Emi M, Tanabe K, Murakami S. Role of the unfolded protein response in cell death. Apoptosis. 2006;11:5-13. [PubMed] [DOI] |
| 25. | Scriven P, Brown NJ, Pockley AG, Wyld L. The unfolded protein response and cancer: a brighter future unfolding? J Mol Med. 2007;85:331-341. [PubMed] [DOI] |
| 26. | Mann MJ, Hendershot LM. UPR activation alters chemosensitivity of tumor cells. Cancer Biol Ther. 2006;5:736-740. [PubMed] [DOI] |
| 27. | Dai RY, Chen Y, Fu J, Dong LW, Ren YB, Yang GZ, Qian YW, Cao J, Tang SH, Yang SL. p28GANK inhibits endoplasmic reticulum stress-induced cell death via enhancement of the endoplasmic reticulum adaptive capacity. Cell Res. 2009;19:1243-1257. [PubMed] [DOI] |
| 28. | Chan SL, Tan KO, Zhang L, Yee KS, Ronca F, Chan MY, Yu VC. F1Aalpha, a death receptor-binding protein homologous to the Caenorhabditis elegans sex-determining protein, FEM-1, is a caspase substrate that mediates apoptosis. J Biol Chem. 1999;274:32461-32468. [PubMed] [DOI] |
| 29. | Subauste MC, Sansom OJ, Porecha N, Raich N, Du L, Maher JF. Fem1b, a proapoptotic protein, mediates proteasome inhibitor-induced apoptosis of human colon cancer cells. Mol Carcinog. 2010;49:105-113. [PubMed] |
| 30. | Zhang Y, Peng Z, Qiu G, Wang Z, Gu W. Overexpression of cyclin A in hepatocellular carcinoma and its relationship with HBx gene integration. Zhonghua Zhongliu Zazhi. 2002;24:353-355. [PubMed] |
| 31. | Wang X, Meng X, Sun X, Liu M, Gao S, Zhao J, Pei F, Yu H. Wnt/beta-catenin signaling pathway may regulate cell cycle and expression of cyclin A and cyclin E protein in hepatocellular carcinoma cells. Cell Cycle. 2009;8:1567-1570. [PubMed] [DOI] |
| 32. | Wang XH, Liu BR, Qu B, Xing H, Gao SL, Yin JM, Wang XF, Cheng YQ. Silencing STAT3 may inhibit cell growth through regulating signaling pathway, telomerase, cell cycle, apoptosis and angiogenesis in hepatocellular carcinoma: potential uses for gene therapy. Neoplasma. 2011;58:158-171. [PubMed] [DOI] |
| 33. | Xu ZW, Wang FM, Gao MJ, Chen XY, Hu WL, Xu RC. Targeting the Na(+)/K(+)-ATPase alpha1 subunit of hepatoma HepG2 cell line to induce apoptosis and cell cycle arresting. Biol Pharm Bull. 2010;33:743-751. [PubMed] [DOI] |