修回日期: 2011-03-29
接受日期: 2011-04-11
在线出版日期: 2011-04-28
目的: 探讨乙型肝炎病毒X(HBVX)基因及其产物对肝细胞凋亡相关基因表达的影响.
方法: 将实验用SPF级成年♂KM小鼠分为实验组、空质粒对照组、生理盐水对照组. 实验组以构建好的PCDNA3.1-HBVX质粒, 空质粒对照组以PCDNA3.1质粒, 生理盐水对照组以生理盐水, 通过尾静脉高压注入动物体内, 在第48小时处死小鼠后, 取肝组织, 以RT-PCR, 凝胶回收测序及Western blot检测HBVX表达, 以RT-PCR半定量检测小鼠肝组织内bax、c-myc及bcl-2的表达.
结果: 实验组RT-PCR显示465 bp处有清楚条带, 肝组织内有HBVX mRNA的存在, 两对照组无HBVX mRNA存在, Western blot检测实验组有HBVX蛋白的表达; 两对照组则无HBVX蛋白表达. 通过对小鼠肝组织凋亡相关因子的半定量RT-PCR, 相对于空质粒对照组和生理盐水对照组, 转染HBVX基因的小鼠肝组织bax、c-myc及bcl-2的mRNA相对表达量明显增高, 差异有显著性意义(bax: 1.3127±0.0900 vs 1.0023±0.1670, 0.9094±0.1081; c-myc: 1.6294±0.0672 vs 1.2869±0.0880, 0.9757±0.0397; bcl-2: 1.5567±0.1257 vs 0.6856±0.1554, 0.5488±0.1278, 均P<0.05).
结论: 成功建立了表达HBVX的小鼠动物模型, 并证明转染HBVX基因后小鼠肝脏组织内bax、bcl-2及c-myc的mRNA表达同时上调.
引文著录: 郭晨, 李丹, 林纳, 黄月红, 陈治新, 王小众. 表达HBVX基因的小鼠模型的建立及对肝细胞凋亡因子的影响. 世界华人消化杂志 2011; 19(12): 1225-1230
Revised: March 29, 2011
Accepted: April 11, 2011
Published online: April 28, 2011
AIM: To investigate the impact of the hepatitis B virus X gene (HBVX) on the expression of apoptosis factors in liver cells.
METHODS: The eukaryotic expression vector PCDNA3.1-HBVX was injected into the caudal vein of mice to establish a mouse model expressing the HBVX gene. Mice injected with empty PCDNA3.1 vector or normal saline were used as controls. RT-PCR and Western blot were performed to detect the expression of HBVX in liver tissue 48 h after injection. Semi-quantitative RT-PCR was used to evaluate the expression of bax, bcl-2, and c-myc in liver cells of different groups of mice.
RESULTS: HBX mRNA and protein were detected in liver tissue in mice injected with the PCDNA3.1-HBVX vector, but not in controls. Compared to controls, the expression of bax, c-myc and bcl-2 was up-regulated in liver tissue in mice injected with the PCDNA3.1-HBVX vector (bax: 1.3127 ± 0.0900 vs 1.0023 ± 0.1670, 0.9094 ± 0.1081; c-myc: 1.6294 ± 0.0672 vs 1.2869 ± 0.0880, 0.9757 ± 0.0397; bcl-2: 1.5567 ± 0.1257 vs 0.6856 ± 0.1554, 0.5488 ± 0.1278, all P < 0.05).
CONCLUSION: A mouse model harboring the HBVX gene has been established successfully. Expression of the HBx gene can up-regulate the expression of Bax, c-Myc and Bcl-2 in liver cells.
- Citation: Guo C, Li D, Lin N, Huang YH, Chen ZX, Wang XZ. Establishment of a mouse model harboring the hepatitis B virus X gene and analysis of expression of apoptosis factors in liver cells of this mouse line. Shijie Huaren Xiaohua Zazhi 2011; 19(12): 1225-1230
- URL: https://www.wjgnet.com/1009-3079/full/v19/i12/1225.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i12.1225
乙型肝炎病毒(hepatitis B virus, HBV)是一种双链不完全闭合的DNA病毒, 有4个开放读码框, 分别编码S、C、X、P蛋白. 其慢性感染是导致肝细胞癌(hepatocellular carcinoma, HCC)的主要危险因素. 随着HCC研究的进一步深入以及HBV基因序列的破解, 人们发现HBV基因组中的X基因(hepatitis B virus X gene, HBVX)及其产物X蛋白与HCC的发生发展密切相关. X基因是HBV基因组最小的开放读码框, 位于HBV基因组的1 374-1 838 bp处, 全长435-462 bp, 全长转录体编码的X蛋白含154个氨基酸, 分子量约为16 500 Da. 在HBV发生发展过程中, HBV DNA与宿主DNA的整合常发生于此区域. HBVX参与病毒的复制; 反式激活多种病毒和细胞基因; 并可通过影响正常的细胞周期, 干扰DNA的修复及调节肝细胞增殖、分化和凋亡等. 本实验以小鼠肝组织为研究对象, 通过流体动力学体内高压质粒注射, 在动物体内转染PCDNA3-HBVX质粒, 建立表达HBVX基因的动物模型, 以RT-PCR半定量检测转染后动物肝组织内HBVX及凋亡相关基因bax、bcl-2及c-myc的表达情况, 进而了解X基因在活体组织内对细胞凋亡相关因子的作用.
pcDNA3-HBVX载体由福建医科大学附属协和医院消化研究所制备并保存, 质粒大抽提试剂盒购自美国Qiagen公司, 逆转录试剂盒购自美国Promega公司RNA抽提试剂盒购自深圳生物晶美有限公司, DNA Marker购自Invitrogen公司TransIT In Vivo Gene Delivery System试剂盒购自Mirus公司, 鼠抗人HBVX单克隆抗体购自美国Chemicon公司; 羊抗小鼠IgG二抗购自北京中杉金桥生物技术有限公司; 蛋白印迹实验的ECL显色试剂购自中国中杉公司. 超低温冰箱MDF-283型(苏州安泰空气技术有限公司)、PCR仪AB2720型(美国AB公司)、稳压稳流电泳仪(DYY-6c型)(北京六一仪器厂)、紫外透射分析仪(上海长明光电子仪器厂)、凝胶成像系统IS2000-200(Olympus公司生产)、蛋白电泳及转印设备(美国Bio-Rad公司)、电动匀浆器(Cole-Parmer公司). SPF级成年♂KM小鼠9只, 体质量20 g±2 g, 由上海斯莱克实验动物有限公司提供[许可证号SCXK(沪)2007-0005].
1.2.1 分组: 9只小鼠随机分为实验组、空质粒对照组、生理盐水对照组, 每组各3只. 动物饲养在SPF级环境中, 实验动物光照强度15 k, 光照时间明暗各半. 饲养室温度: 23 ℃±3 ℃, 湿度: 50%. 动物饲喂全价颗粒料, 自由采食和饮水.
1.2.2 各基因PCR引物的合成: 根据HBVX基因, β-actin、bax、bcl-2及c-myc基因序列自行设计引物, 合成由上海英骏生物技术有限公司完成.
1.2.3 造模: 实验组小鼠按照TransIT In Vivo Gene Delivery System体内转染试剂盒的说明, 先取浓度约为1.0 g/L的质粒pcDNA3.1-HBVX 10 μL与试剂In Vivo Polymer Solution 10 μL在无核酶EP管内混合, 加生理盐水100 μL至总体积200 μL, 充分混匀, 室温静置5 min. 将190 μL 10×In Vivo Delivery Solution用生理盐水稀释成1.9 mL 1×Delivery Solution, 然后将其与第一步的混合物混合, 使溶液总体积为2.1 mL. 小鼠尾静脉4-6 s内匀速注射完毕. 空质粒对照组以等量PCDNA3.1质粒, 生理盐水对照组以等量生理盐水注射. 48 h后处死小鼠, 无菌取肝组织块, -80 ℃冻存备用.
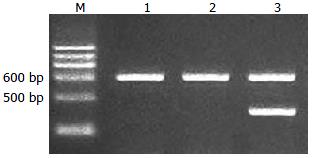
1.2.4 以RT-PCR检测小鼠肝组织中HBVX mRNA的表达: 取肝组织, 加入细胞裂解液, 匀浆后, 按RNA抽提试剂盒说明进行总RNA的提取, 再以RT反应获得cDNA, 取cDNA 5 μL作为模板, 扩增HBVX基因片段和内参β-actin. 反应条件见表1, 扩增产物在1.5%脂糖凝胶中电泳, 观察结果.
| 基因 | 片段长度(bp) | 引物 | 反应条件 |
| HBVX | 465 | 上游: 5'-ATGCAAGCTTATGGCTGCTAGGCTGTACTG-3' | 95 ℃预变性5 min, 95 ℃变性45 s, 60 ℃退火30 s, 72 ℃延伸1 min |
| 下游: 5'-TGCGAATTCTTAGGCAGAGGTGAAAAAGTT-3' | |||
| β-actin | 600 | 上游: 5'-GGCATCGTGATGGACTCCG-3' | 95 ℃预变性5 min, 95 ℃变性45 s, 60 ℃退火30 s, 72 ℃延伸1 min |
| 下游: 5'-GCTGGAAGGTGGACAGCGA-3' | |||
| bax | 246 | 上游: 5'-TTTGCTTCAGGGTTTCATCC-3' | 94 ℃预变性5 min, 94 ℃变性45 s, 58 ℃退火30 s, 72 ℃延伸1 min, 30个循环 |
| 下游: 5'-CAGTTGAAGTTGCCGTCAGA-3' | |||
| bcl-2 | 198 | 上游 5'-GGCTGGGATACTTTTGTGGA-3' | 94 ℃预变性5 min, 94 ℃变性45 s, 64 ℃退火30 s, 72 ℃延伸40 s, 25个循环 |
| 下游: 5'-ATGTGGTGGAGCAGAGAAGG-3' | |||
| c-myc | 203 | 上游: 5'-TTCGGGTAGTGGAAAACCAG-3' | 94 ℃预变性5 min, 94 ℃变性45 s, 58 ℃退火30 s, 72 ℃延伸1 min, 30个循环 |
| 下游: 5'-CAGCAGCTCGAATTTCTTCC-3' |
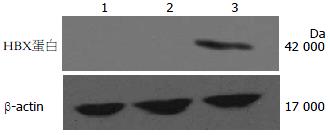
1.2.5 Western blot法检测小鼠肝组织中HBVX基因产物的表达: 肝组织匀浆破碎抽提蛋白, SDS-PAGE分离、转膜、封闭, 一抗、二抗孵育, ECL显色. 拍照并保存.
1.2.6 半定量RT-PCR检测bax、bcl-2、c-myc的表达: 抽提肝组织总RNA, 逆转录为cDNA, 以cDNA为模板共扩增内参β-actin及bax、bcl-2、c-myc基因片段, 反应条件见表1. 扩增产物在1.5%脂糖凝胶中电泳, 并以凝胶灰度扫描系统扫描灰度值以各基因与内参基因的灰度比值为相对表达量, 比较各组的差别, 同样实验重复3次.
实验组小鼠肝组织中大约460 bp处可见1条带(图1), 大小与HBVX基因相符, 内参β-actin条带大小约为600 bp, 空质粒对照组与生理盐水组只可见内参β-actin条带, 无HBVX基因mRNA表达, 表明HBVX基因成功转染至实验组小鼠肝组织内.
显影后阳性条带大小约为17 000 Da, 与HBVX蛋白大小基本相符, 空质粒对照组与生理盐水对照组只可见内参β-actin条带, 表明HBVX蛋白在实验组小鼠肝脏组织中有表达(图2).
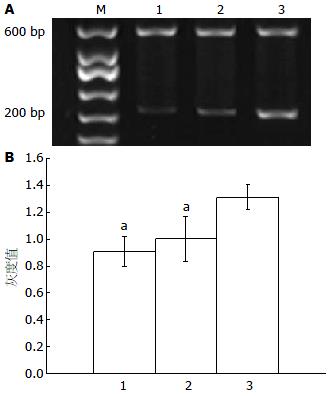
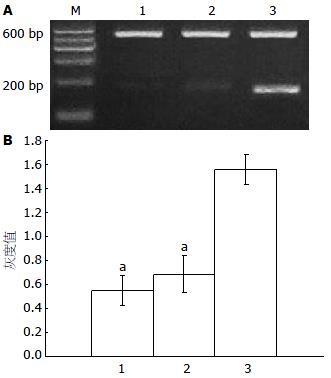
转染HBVX的实验组小鼠肝脏组织c-myc基因的相对表达量较转染空质粒对照组和生理盐水对照组明显增高, 差异有显著性意义(均P<0.05), 说明HBVX能上调bax的表达(表2, 图3).
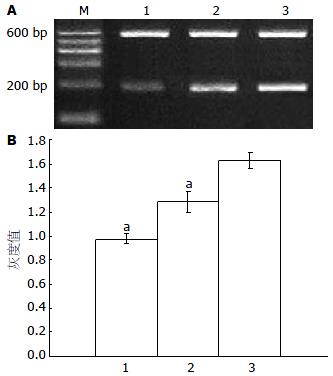
| 分组 | bax | bcl-2 | c-myc |
| 实验组 | 1.3127±0.0900 | 1.5567±0.1257 | 1.6294±0.0672 |
| 空质粒对照组 | 1.0023±0.1670 | 0.6856±0.1554 | 1.2869±0.0880 |
| 生理盐水对照组 | 0.9094±0.1081 | 0.5488±0.1278 | 0.9757±0.0397 |
转染HBVX的实验组小鼠肝脏组织Bax基因的相对表达量较转染空质粒对照组和生理盐水对照组明显增高, 差异有显著性意义(均P<0.05), 说明HBVX能上调c-myc的表达(表2, 图4).
HBVX基因及其编码的HBVX蛋白具有多种作用和多种功能. 目前, HBVX的翻译产物HBVX蛋白的亚细胞定位尚存在争议. Henkler等[1]认为HBVX蛋白在感染细胞中的定位依赖于HBVX基因的总表达水平, HBVX蛋白在低表达的细胞中大部分定位于细胞核内, 而过量表达的HBVX蛋白则分布于胞质中. 另有学者观察到HBVX在细胞质内的水平高于细胞核, 且细胞质中的HBVX主要分布于线粒体外膜上, 并可作用于人电压依赖阴离子通道, 导致跨膜电势的改变和线粒体功能变化, 但其具体调节机制尚未阐明[2]. 1989年Murakami[3]报道通过HBVX基因片段的表达载体转染小鼠成纤维细胞系诱发其体外转化, 经裸鼠移植可在裸鼠体内形成肿瘤, 使人们对HBVX基因的致癌作用有了突破性的认识. 自此, HBVX基因成了肝癌发病机制研究的热点. 目前发现HBVX可直接或间接激活多种核转录因子, 使细胞对凋亡信号敏感性增强[4-6], 细胞周期调定点失控[1,7-10]以及调节细胞蛋白质分解途径[11-14], 最终引起肝细胞的转化[15,16], 如通过激活PI-3激酶途径拮抗TGF-β的促凋亡作用[17], 以P53非依赖形式抑制凋亡[18], 抑制caspase-3活性[19], 上调FasL, 诱导表达Fas的T淋巴细胞凋亡而逃避免疫监视[20,21]等, 而近几年的研究又发现, HBVX同样具有促进细胞凋亡的作用, HBVX蛋白促进IL-18 mRNA的转录、蛋白质表达, 进而促进Fas/FasL的表达而促进细胞凋亡[22], 拮抗Fas/FasL介导的凋亡抑制作用, 使细胞对极低浓度的TNF-α诱导的凋亡敏感[23], 还可引起引起caspase-9募集细胞凋亡蛋白酶活化因子1(apoptotic protease activating factor-1, APFA1), 激活线粒体/CytC凋亡途径[24]. 这些针对HBVX基因的研究主要基于转染肝癌细胞株及转基因动物模型, 而转基因动物模型虽然能稳定地表达目的基因, 但是由于其所携带的HBVX基因多以显微注射法等方法整合在宿主染色体上, 没有经过病毒与靶细胞受体结合穿透的过程, 所以与病毒在自然状态下感染机体的状态不甚相同, 而且建立过程复杂, 技术难度较大, 所需资金及时间也长, 本实验利用流体动力学体内转染法, 将HBVX基因载体质粒短时间内大量注射入小鼠体内, 使小鼠静脉系统及肝窦充血, 以静脉压将质粒转入肝细胞, 无大的创伤性操作, 时间也较短, 注射后小鼠均成活, 状态良好, 且小鼠肝组织可稳定表达HBVX基因及其产物.
Bcl-2家族在细胞凋亡的基因调控过程中起着至关重要的作用, Bcl-2家族可以分为2类: 一类是抗细胞凋亡基因, 代表基因是bcl-2基因; 另一类是促细胞凋亡基因, 代表基因是bax基因, 他们通过激活一系列下游基因发挥调节凋亡作用, 二者在细胞中的比例显著影响细胞对死亡信号的敏感性[25-28]. 本实验中半定量RT-PCR的结果表明HBVX基因转染后, 小鼠体内bax及bcl-2两者表达均升高, 表明HBVX基因在细胞凋亡途径的双向性.
c-myc是一种细胞癌基因, 可作为转录因子影响着细胞的生长、增殖、分化、凋亡和细胞周期的进行, 在肿瘤发生、转移、氧化应激等重要生理病理过程中起重要作用, 有研究表明HBVX和c-myc共表达使WT 3T3细胞对TNF-α介导的凋亡敏感性增高约10倍, 且这种促凋亡作用超过了NF-κB的抗凋亡作用而表现出细胞凋亡[29]. 本实验肝组织中转染HBVX基因后c-myc的表达明显升高.
本实验中我们运用流体动力学尾静脉注射体内转染法将HBVX基因转染入小鼠活体肝组织内, 成功构建了表达HBVX基因的小鼠活体动物模型, RT-PCR结果显示转染HBVX基因的小鼠肝组织中, 促凋亡基因bax、c-myc的表达均上升, 并且抑制凋亡的基因bcl-2表达也提高, 证明在肝组织中, HBVX参与了对bax、bcl-2和c-myc转录水平的调节, 并且其对凋亡因子的作用存在双向性, 哪一方面占主导取决于多种因素共同的作用, 为下一步针对肝癌致病机制和基因治疗的进一步研究打下基础, 但是这其中的机制尚未阐明, 有待我们进一步研究.
在HBV发生发展过程中, HBV DNA与宿主DNA的整合常发生于此区域. HBVX参与病毒的复制; 反式激活多种病毒和细胞基因; 并可通过影响正常的细胞周期, 干扰DNA的修复及调节肝细胞增殖、分化和凋亡等.
陈洪, 主任医师, 东南大学附属中大医院消化科
1989年Murakami报道通过HBVX基因片段的表达载体转染小鼠成纤维细胞系诱发其体外转化, 经裸鼠移植可在裸鼠体内形成肿瘤, 使人们对HBVX基因的致癌作用有了突破性的认识. 自此, HBVX基因成了肝癌发病机制研究的热点.
Henkler等认为HBVX蛋白在感染细胞中的定位依赖于HBVX基因的总表达水平, HBVX蛋白在低表达的细胞中大部分定位于细胞核内, 而过量表达的HBVX蛋白则分布于胞质中.
本实验成功建立了表达HBVX的小鼠动物模型, 并证明转染HBVX基因后小鼠肝脏组织内Bax、Bcl-2及c-Myc的mRNA表达同时上调.
本文选题较好, 方法先进, 具有一定的临床参考价值.
编辑: 李薇 电编:何基才
| 1. | Henkler F, Hoare J, Waseem N, Goldin RD, McGarvey MJ, Koshy R, King IA. Intracellular localization of the hepatitis B virus HBx protein. J Gen Virol. 2001;82:871-882. [PubMed] |
| 2. | Huh KW, Siddiqui A. Characterization of the mitochondrial association of hepatitis B virus X protein, HBx. Mitochondrion. 2002;1:349-359. [PubMed] |
| 3. | Murakami S. Hepatitis B virus X protein: a multifunctional viral regulator. J Gastroenterol. 2001;36:651-660. [PubMed] [DOI] |
| 4. | Diao J, Khine AA, Sarangi F, Hsu E, Iorio C, Tibbles LA, Woodgett JR, Penninger J, Richardson CD. X protein of hepatitis B virus inhibits Fas-mediated apoptosis and is associated with up-regulation of the SAPK/JNK pathway. J Biol Chem. 2001;276:8328-8340. [PubMed] [DOI] |
| 5. | Su F, Schneider RJ. Hepatitis B virus HBx protein activates transcription factor NF-kappaB by acting on multiple cytoplasmic inhibitors of rel-related proteins. J Virol. 1996;70:4558-4566. [PubMed] |
| 6. | Chen GG, Lai PB, Chan PK, Chak EC, Yip JH, Ho RL, Leung BC, Lau WY. Decreased expression of Bid in human hepatocellular carcinoma is related to hepatitis B virus X protein. Eur J Cancer. 2001;37:1695-1702. [PubMed] [DOI] |
| 7. | Terradillos O, de La Coste A, Pollicino T, Neuveut C, Sitterlin D, Lecoeur H, Gougeon ML, Kahn A, Buendia MA. The hepatitis B virus X protein abrogates Bcl-2-mediated protection against Fas apoptosis in the liver. Oncogene. 2002;21:377-386. [PubMed] [DOI] |
| 8. | Leupin O, Bontron S, Schaeffer C, Strubin M. Hepatitis B virus X protein stimulates viral genome replication via a DDB1-dependent pathway distinct from that leading to cell death. J Virol. 2005;79:4238-4245. [PubMed] [DOI] |
| 9. | Melegari M, Wolf SK, Schneider RJ. Hepatitis B virus DNA replication is coordinated by core protein serine phosphorylation and HBx expression. J Virol. 2005;79:9810-9820. [PubMed] [DOI] |
| 10. | Zhang JL, Zhao WG, Wu KL, Wang K, Zhang X, Gu CF, Li Y, Zhu Y, Wu JG. Human hepatitis B virus X protein promotes cell proliferation and inhibits cell apoptosis through interacting with a serine protease Hepsin. Arch Virol. 2005;150:721-741. [PubMed] [DOI] |
| 12. | Lee SH, Park SG, Lim SO, Jung G. The hepatitis B virus X protein up-regulates lymphotoxin alpha expression in hepatocytes. Biochim Biophys Acta. 2005;1741:75-84. [PubMed] |
| 13. | Chung TW, Lee YC, Kim CH. Hepatitis B viral HBx induces matrix metalloproteinase-9 gene expression through activation of ERK and PI-3K/AKT pathways: involvement of invasive potential. FASEB J. 2004;18:1123-1125. [PubMed] |
| 14. | Chan CF, Yau TO, Jin DY, Wong CM, Fan ST, Ng IO. Evaluation of nuclear factor-kappaB, urokinase-type plasminogen activator, and HBx and their clinicopathological significance in hepatocellular carcinoma. Clin Cancer Res. 2004;10:4140-4149. [PubMed] [DOI] |
| 15. | Jin YM, Yun C, Park C, Wang HJ, Cho H. Expression of hepatitis B virus X protein is closely correlated with the high periportal inflammatory activity of liver diseases. J Viral Hepat. 2001;8:322-330. [PubMed] [DOI] |
| 16. | Hu Z, Zhang Z, Kim JW, Huang Y, Liang TJ. Altered proteolysis and global gene expression in hepatitis B virus X transgenic mouse liver. J Virol. 2006;80:1405-1413. [PubMed] [DOI] |
| 17. | Shih WL, Kuo ML, Chuang SE, Cheng AL, Doong SL. Hepatitis B virus X protein inhibits transforming growth factor-beta -induced apoptosis through the activation of phosphatidylinositol 3-kinase pathway. J Biol Chem. 2000;275:25858-25864. [PubMed] [DOI] |
| 18. | Shintani Y, Yotsuyanagi H, Moriya K, Fujie H, Tsutsumi T, Kanegae Y, Kimura S, Saito I, Koike K. Induction of apoptosis after switch-on of the hepatitis B virus X gene mediated by the Cre/loxP recombination system. J Gen Virol. 1999;80:3257-3265. [PubMed] |
| 19. | Gottlob K, Fulco M, Levrero M, Graessmann A. The hepatitis B virus HBx protein inhibits caspase 3 activity. J Biol Chem. 1998;273:33347-33353. [PubMed] [DOI] |
| 20. | Lee MO, Kang HJ, Cho H, Shin EC, Park JH, Kim SJ. Hepatitis B virus X protein induced expression of the Nur77 gene. Biochem Biophys Res Commun. 2001;288:1162-1168. [PubMed] [DOI] |
| 21. | Ou DP, Tao YM, Chang ZG, Tang FQ, Yang LY. Hepatocellular carcinoma cells containing hepatitis B virus X protein have enhanced invasive potential conditionally. Dig Liver Dis. 2006;38:262-267. [PubMed] [DOI] |
| 22. | Lee MO, Choi YH, Shin EC, Kang HJ, Kim YM, Jeong SY, Seong JK, Yu DY, Cho H, Park JH. Hepatitis B virus X protein induced expression of interleukin 18 (IL-18): a potential mechanism for liver injury caused by hepatitis B virus (HBV) infection. J Hepatol. 2002;37:380-386. [PubMed] [DOI] |
| 23. | Korkolopoulou P, Goudopoulou A, Voutsinas G, Thomas-Tsagli E, Kapralos P, Patsouris E, Saetta AA. c-FLIP expression in bladder urothelial carcinomas: its role in resistance to Fas-mediated apoptosis and clinicopathologic correlations. Urology. 2004;63:1198-1204. [PubMed] [DOI] |
| 24. | Zhang X, Dong N, Yin L, Cai N, Ma H, You J, Zhang H, Wang H, He R, Ye L. Hepatitis B virus X protein upregulates survivin expression in hepatoma tissues. J Med Virol. 2005;77:374-381. [PubMed] [DOI] |
| 25. | Bouillet P, Strasser A. BH3-only proteins - evolutionarily conserved proapoptotic Bcl-2 family members essential for initiating programmed cell death. J Cell Sci. 2002;115:1567-1574. [PubMed] |
| 26. | Lee YH, Yun Y. HBx protein of hepatitis B virus activates Jak1-STAT signaling. J Biol Chem. 1998;273:25510-25515. [PubMed] [DOI] |
| 27. | Capano M, Crompton M. Bax translocates to mitochondria of heart cells during simulated ischaemia: involvement of AMP-activated and p38 mitogen-activated protein kinases. Biochem J. 2006;395:57-64. [PubMed] [DOI] |