修回日期: 2011-02-21
接受日期: 2011-03-02
在线出版日期: 2011-04-18
目的: 研究线粒体转运蛋白质超家族新成员SLC25A40(MCFP) RNA干扰(RNAi)慢病毒表达载体对人肝癌细胞系HepG2细胞中MCFP基因的沉默效果.
方法: 通过RNAi序列设计软件进行MCFP干涉片段设计, 筛选出MCFP基因的RNAi有效靶序列, 进一步合成靶序列的Oligo DNA, 构建pSiCoR-MCFP慢病毒载体并包装产生慢病毒干涉毒液. 运用病毒感染HepG2细胞获得稳定干涉MCFP的细胞株, 利用PCR和Western blot方法检测稳定细胞株中MCFP的干涉效果.
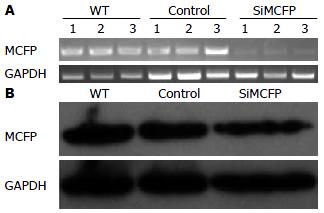
结果: 成功构建具有MCFP干涉效果的慢病毒干涉载体并获得了稳定干涉MCFP及对照的HepG2细胞株. 收集慢病毒上清, 流式测定干涉病毒滴度为1.45×1010 pfu/L, 对照病毒滴度为1.78×1010 pfu/L. PCR和Western blot实验均证实干涉MCFP后, HepG2细胞株中MCFP蛋白表达水平明显降低(P<0.001).
结论: 成功构建具有MCFP干涉效果的慢病毒干涉载体及稳定干涉MCFP的HepG2细胞株.
引文著录: 笪倩, 于淼, 杨晓明, 汪思应. MCFP慢病毒干涉载体及HepG2稳定细胞系的构建. 世界华人消化杂志 2011; 19(11): 1115-1121
Revised: February 21, 2011
Accepted: March 2, 2011
Published online: April 18, 2011
AIM: To construct a lentiviral vector carrying a short hairpin RNA (shRNA) targeting the mitochondrial carrier functional protein SLC25A40 (MCFP) gene and to detect the silencing effect of the vector in HepG2 cell line.
METHODS: A double-stranded shRNA targeting the MCFP gene was designed, synthesized and cloned into the pSiCoR vector. The resulting lentiviral vector containing the MCFP shRNA was named pSiCoR-MCFP. HepG2 cells were transfected with the pSiCoR-MCFP lentivirus to obtain a cell line stably expressing the MCFP shRNA. After transfection, the mRNA and protein expression of MCFP in HepG2 cells was detected by RT-PCR and Western blot, respectively.
RESULTS: A lentiviral vector carrying an shRNA targeting the MCFP gene was successfully constructed and a HepG2 cell line stably transfected with the vector was established. The recombinant lentivirus and control lentivirus harvested from 293 cells had a titer of 1.78 × 1010 pfu/L and 1.45 × 1010 pfu/L, respectively. RT-PCR and Western blot analyses confirmed that the expression of MCFP was down-regulated in HepG2 cell line stably transfected with the recombinant vector (both P < 0.001).
CONCLUSION: A lentiviral vector carrying an shRNA targeting the MCFP gene was successfully constructed and a HepG2 cell line stably transfected with the vector was established.
- Citation: Da Q, Yu M, Yang XM, Wang SY. Construction of a lentiviral vector carrying an MCFP shRNA and generation of a HepG2 cell line stably transfected with this vector. Shijie Huaren Xiaohua Zazhi 2011; 19(11): 1115-1121
- URL: https://www.wjgnet.com/1009-3079/full/v19/i11/1115.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i11.1115
线粒体是真核细胞重要的细胞器, 其参与维持细胞内环境稳定, 并能调节细胞凋亡. 研究表明线粒体基因表达异常和肿瘤发生密切相关. SLC25家族是线粒体转运蛋白超家族, 这个家族的成员广泛存在于真核生物的线粒体中, 并定位于线粒体的内膜上. 他们在结构上十分相似, 均包含3个串联重复的同源区, 每个区域含约100个氨基酸, 这些氨基酸形成6个α螺旋疏水区插入到线粒体内膜, N末端和C末端暴露于线粒体膜间隙. SLC25家族蛋白质负责各类可溶性物质跨线粒体内膜的转运并参与机体多种生命活动, 主要包括: 氨基酸代谢、能量代谢、线粒体DNA复制以及细胞凋亡[1].
SLC25A40(以下简称MCFP)是Tatjana等于2006年鉴定到的14个SLC25家族新成员之一, 相对分子质量为37 500 Da, 定位于7q21.12. 研究表明MCFP在所有组织中均有表达, 并在中枢神经系统冠状缝切面的Ⅰ、Ⅱ、Ⅶ区域以及小脑中高表达[1]. MCFP和其家族成员SLC25A39具有52%的同源性; 和酵母的可溶性转运蛋白质MTM1具有32%-35%的同源性. MTM1、MCFP、SLC25A39这3个蛋白的底物结合口袋中部分氨基酸残基是相同的[1]. 作为一个新基因, MCFP的功能尚不清楚, 有待于研究. 有文献表明MCFP或许和小脑发育不全第三型(小脑进行性萎缩)有关[2]. 本研究成功构建了MCFP基因的小发夹RNA(short hairpin RNA, shRNA)慢病毒载体, 通过293FT细胞包装后产生的病毒能够成功感染HepG2细胞并能持续稳定地降低内源MCFP的表达. 这一稳定干涉MCFP细胞系的建立, 为进一步研究MCFP沉默后对肿瘤生长的影响提供了稳定的感染细胞模型.
TA克隆载体、PCR及酶切产物纯化试剂盒、细菌质粒DNA小量提取试剂盒均购于美国Promega公司; Taq DNA聚合酶、dNTP、DNA分子量标准、DNA限制性内切酶均购自大连宝生物工程(TaKaRa)有限公司; DMEM粉末、胰酶购自Gibco公司; 胎牛血清购自四季青生物技术公司; 慢病毒干涉载体pSicoR及慢病毒包装质粒pLPl、pLP2和包膜质粒pLP-VSVG由中国人民解放军军事医学科学院野战输血研究所惠赠; 转染试剂Lipofectamine 2000购自Invitrogen公司; 丙酮酸钠、非必需氨基酸、L-谷氨酰胺为Sigma公司产品; T4 DNA连接酶、预染蛋白分子量标准购于纽英伦生物技术(北京)有限公司; MCFP抗体购于Abcam公司; 羊抗鼠二抗, 羊抗兔二抗购于北京中杉金桥公司; E.coli JM109以及HEK293、293FT、HepG2细胞为本实验室保存.
1.2.1 人MCFP基因的慢病毒干涉载体构建: 由网络RNAi序列设计软件(http://hydra1.wistar.upenn.edu/Projects/siRNA/siRNAindex.htm)设计产生针对人MCFP基因的符合RNA干涉片段特征的19 bp RNA序列, 根据慢病毒干涉载体pSicoR插入序列要求设计酶切位点, 具体序列如下: 正义链: 5'-TGGCCTAATTCCTCGCTTAATTCAAGAGATTAAGCGAGGAATTAGGCCTTTTTTC-3'; 反义链: 5'-TCGAGGAAAAAGGCCTAATTCCTCGCTTAATCTCTTGAATTAAGCGAGGAATTAGGCCA-3'. 将以上两合成片段进行5'端磷酸化, 互补片段退火后与经XhoⅠ、HpaⅠ双酶切后纯化回收的pSiCoR载体片段进行连接反应, 连接产物用一步法转化JM109, 挑选阳性克隆, 摇菌提质粒用PstⅠ、BamHⅠ进行双酶切鉴定. 将酶切鉴定正确的克隆送至大连宝生物(TaKaRa)工程有限公司测序.
1.2.2 RNAi慢病毒的包装: 在一个无菌的5 mL玻璃离心管中加入1.5 mL无血清Opti-MEM® I培养基, 随后加入4.2 μg pLP1、2 μg pLP2、2.8 μg pLP/VSVG和5 μg慢病毒表达质粒轻轻混匀. 另一个无菌的5 mL管将42 μL Lipofectamine 2000稀释于1.5 mL无血清Opti-MEM® I培养基中, 轻轻混匀. 两玻璃管均室温放置5 min. 混匀以上2管液体, 室温放置20 min形成DNA-Lipofectamine 2000复合物. 将DNA-Lipofectamine 2000复合物加入到含有5 mL不含抗生素的生长培养基的10 cm细胞培养皿中. 将约含有6×106个细胞的293FT细胞悬液加入到上述细胞培养皿中, 轻轻地前后移动培养皿混匀. 将细胞置于37 ℃、50 mL/L CO2孵箱中培养过夜. 转染24 h后用10 mL包含丙酮酸钠的完全培养基更换含有DNA-Lipofectamine复合物的培养基. 转染48-72 h后收集上清于15 mL无菌离心管中. 4 ℃ 3 000 r/min离心15 min去除细胞碎片. 用0.45 μm滤膜过滤后将病毒液分装, 冻存于-70 ℃备用.
1.2.3 流式细胞术测定病毒滴度: 测定前1 d, 细胞传代, 24孔板每孔加入约1.0×105个293细胞. 用生长培养基稀释Polybrene至终浓度为8 mg/L, 每孔加入1 mL. 再将病毒储存液1 μL、3 μL依次加到细胞孔中, 放入37 ℃, 50 mL/L CO2培养箱中培养. 24 h后, 每孔更换1 mL新鲜培养液. 48 h后运用流式细胞术检测病毒滴度.
1.2.4 获得稳定干涉MCFP的HepG2细胞: 去除HepG2细胞的培养基, 加入含MCFP或对照干涉片段的慢病毒毒液及含终浓度为8 mg/L的Polybrene的生长培养基, 置于37 ℃, 50 mL/L CO2的孵箱中培养过夜. 次日去除毒液, 更换新鲜培养液, 待细胞生长至80%-90%融合时, 按1:2的比例传代. 荧光显微镜下观察表达绿色荧光蛋白的细胞, 干涉MCFP的HepG2细胞和脱靶对照HepG2细胞分别命名为HepG2-siMCFP和HepG2-Control.
1.2.5 PCR检测MCFP基因的表达: 用TRIzol试剂按照说明书方法分别提取HepG2-siMCFP和HepG2-Control细胞的总RNA. 各取l μg RNA, 反转录成cDNA. 以GAPDH为内参, 用PCR方法检测MCFP基因的表达情况. 所用PCR检测引物序列为: GAPDH sense: GAA GGT GAA GGT CGG AGTC, GAPDH antisense: GAA GAT GGT GAT GGG ATT TC; MCFP sense: GTG TCT GTG AAG AGG GAG G, MCFP antisense: TAC TGC ACC AAA TCT GGC.
1.2.6 Western blot检测MCFP蛋白的表达: 用总蛋白抽提试剂盒按照说明书方法分别提取HepG2-siMCFP和HepG2-Control细胞的总蛋白, 进行SDS-PAGE. 电泳完毕后用iblot(Invitrogen)进行转膜, 转印膜在5%脱脂奶粉中室温封闭2 h后, MCFP一抗为1:200稀释, 4 ℃反应过夜. 次日用TBST洗涤3次, 每次5 min, 羊抗鼠二抗为1:2 000稀释, 室温孵育45 min后, 用TBST洗涤4次, 每次10 min, ECL显影. 以GAPDH为内参, GAPDH一抗为1:1 000稀释, 羊抗兔二抗为1:2 000稀释.
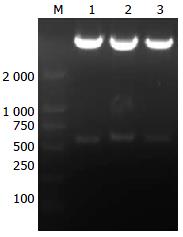
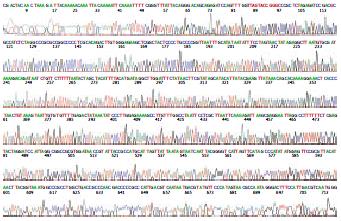
在500 bp左右位置出现电泳条带, 大小与预期相符(图1); 质粒经测序后运用序列同源性比对证实与所设计的引物序列完全吻合, 表明MCFP干涉片段已正确插入pSiCoR载体(图2).
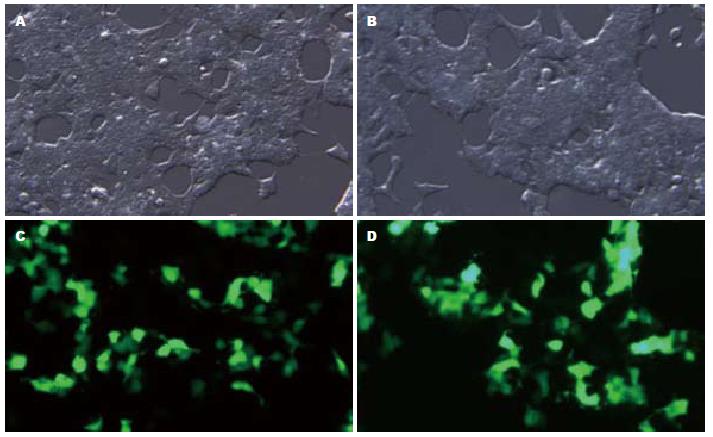
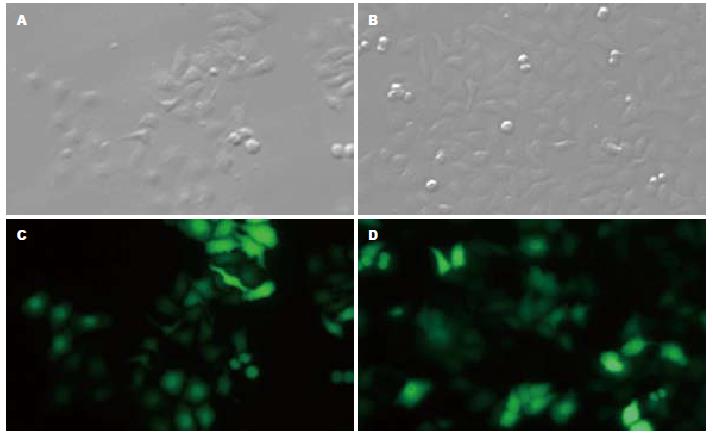
pSiCoR-MCFP及pSiCoR-Control慢病毒载体质粒转染293FT细胞48 h后, 荧光显微镜下(×40)观察可见部分细胞发出绿色荧光(图3). 这说明293FT细胞包装pSiCoR-MCFP及pSiCoR-Control慢病毒载体质粒成功, 所收集的病毒颗粒为重组pSiCoR-MCFP基因及pSiCoR-Control的RNAi慢病毒颗粒.
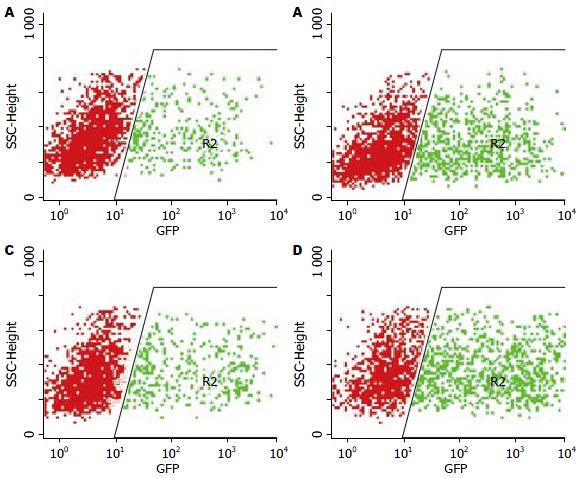
pSiCoR-MCFP滴度为1.78×1010 pfu/L, pSiCoR-Control滴度为1.45×1010 pfu/L(图4).
实验所得慢病毒毒液感染HepG2细胞, 48 h后荧光显微镜下观察约50%细胞出现绿色荧光, 表明慢病毒已经整合到细胞基因组并开始表达MCFP和Control干涉片段, 细胞呈现正常的HepG2细胞形态(图5).
肝癌是严重危害人类健康的重大疾病之一[3], 尤其是原发性肝癌具有流行性广、病程短、病死率高等特点[4]. 在我国每年有11万人死于肝癌, 占肿瘤死因的第3位. 由于肝癌的手术切除率低, 对放化疗药物均不敏感, 目前对于肝癌也缺乏有效的系统治疗策略, 因此寻找影响肿瘤发生发展的因素对人类健康有着重大的意义. 目前趋向认为肿瘤的生物学特征取决于核内遗传物质和核外线粒体DNA, 越来越多证据也表明线粒体DNA异常可能参与肿瘤发生发展[5-8]. 据文献报道, 在人类多种实体瘤例如头颈、乳腺、肝脏、前列腺和卵巢等处的恶性肿瘤细胞中均发现mtDNA突变或表达异常, 例如Nomoto等[9]研究19例肝细胞癌患者, 发现其肿瘤组织中有13/19(68%)例存在mtDNA D环区的突变. SLC25家族成员对线粒体的功能起着十分重要的作用, 比如: UCPs是一类位于线粒体内膜上的载体, 他的缺乏会导致ATP合成降低、氧化应激增加、钙失调、膜电位降低、线粒体功能失调等[10]; 腺苷酸转运蛋白质AAC不仅转运ADP进入线粒体基质参与线粒体的能量代谢, 还可以与BAX及tBid发生相互作用从而参与调节线粒体凋亡途径[11]. 因此, 我们推测MCFP在肝癌细胞的能量代谢中也可能会发挥重要作用. 作为一个新基因, MCFP的功能尚不明确, 我们在研究中成功构建具有MCFP干涉效果的慢病毒干涉载体及稳定干涉MCFP的HepG2细胞株, 有助于我们进一步了解MCFP在HepG2细胞中的调控作用.
RNA干扰(RNA interference, RNAi), 又称转录后基因沉默(post transcriptional gene silencing, PTGS)[12], 是由双链RNA诱发的基因沉默现象, 当细胞中导入和内源性mRNA编码区同源的双链RNA时导致基因表达沉默[13]. 这项技术是一种高效的特异性强的基因阻断技术, 其特点是具有级联式放大效应, 高穿透性和基因抑制效果确切等, 因而广泛应用于恶性肿瘤的研究中[14-16]. 本实验采用基于慢病毒载体介导的shRNA生成的导入途径, shRNA是由1个loop环和两个短反方向重复序列组成发夹结构, 由U6启动子控制, 随后再连上5-6个T作为RNA聚合酶Ⅲ的转录终止子[17]; shRNA作为介导子可引起特异性地降解相同序列的mRNA, 从而阻断相应基因表达的转录后基因沉默机制[18].
慢病毒载体系统是能高效地将目的基因(或RNAi)导入动物和人的原代细胞或细胞系的病毒载体系统. 慢病毒介导的基因表达或RNAi干扰作用持续稳定, 目的基因可整合到宿主细胞基因组中, 并有效感染并整合到非分裂细胞中[19]. 与其他病毒载体相比, 慢病毒的优点是可将目的基因整合至靶细胞基因组持久稳定地表达, 扩大了载体感染细胞的范围, 并可以用于体内基因治疗[20,21]. 慢病毒载体系统作为siRNA的携带者, 充分发挥病毒载体自身所具备的优势[21-25], 并特异使基因表达沉默, 为研究基因功能做出重大贡献[26-28].
慢病毒干涉载体有效结合了慢病毒载体和RNAi技术的特点, 使其整合进宿主基因组从而发挥稳定的RNA干涉效果, 使得RNA干涉技术在基因功能研究中发挥重要作用[29,30]. 我们设计了特异针对人MCFP基因的干涉RNA片段, 通过构建慢病毒干涉载体, 利用293FT细胞包装慢病毒, 获得具有感染力的能够稳定干涉人MCFP的慢病毒毒液. 将慢病毒毒液感染HepG2细胞, 从mRNA水平和蛋白质水平均检测出构建的慢病毒干涉载体成功稳定干涉HepG2细胞中内源MCFP基因的表达. 稳定干涉MCFP细胞的获得是为今后更深入的研究MCFP在HepG2细胞中的调控作用. MCFP沉默后对肿瘤的生物学功能的影响打下坚实的基础, 为体内外实验研究也提供可靠的技术平台, 对于MCFP蛋白的功能探索具有十分重要的意义.
感谢中国人民解放军军事医学科学院放射与辐射医学研究所曹彦、黄蕤等老师和同事在课题研究过程中的帮助; 感谢安徽医科大学病理生理学教研室郑红、李菲菲、储著郎等老师对本课题的支持.
SLC25A40(MCFP)是线粒体转运蛋白超家族的新成员, 存在于线粒体内膜上. 目前有关MCFP的功能研究甚少.
任晓峰, 教授, 东北农业大学动物医学学院微生物室
Nomoto等研究19例肝细胞癌患者, 发现其肿瘤组织中有13/19(68%)例存在mtDNA D环区的突变.
本研究成功构建具有MCFP干涉效果的慢病毒干涉载体, 并成功构建了稳定干涉MCFP的HepG2细胞株.
稳定干涉MCFP细胞的获得为今后更深入地研究MCFP在HepG2细胞中的调控作用奠定基础, 为体内外实验研究提供可靠的技术平台, 对于MCFP蛋白的功能探索具有十分重要的意义.
本文目的明确, 结果理想, 为下一步功能分析奠定了一定的基础.
编辑: 李薇 电编:何基才
| 1. | Haitina T, Lindblom J, Renström T, Fredriksson R. Fourteen novel human members of mitochondrial solute carrier family 25 (SLC25) widely expressed in the central nervous system. Genomics. 2006;88:779-790. [PubMed] [DOI] |
| 2. | Durmaz B, Wollnik B, Cogulu O, Li Y, Tekgul H, Hazan F, Ozkinay F. Pontocerebellar hypoplasia type III (CLAM): extended phenotype and novel molecular findings. J Neurol. 2009;256:416-419. [PubMed] [DOI] |
| 4. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] [DOI] |
| 5. | Olson M, Kornbluth S. Mitochondria in apoptosis and human disease. Curr Mol Med. 2001;1:91-122. [PubMed] [DOI] |
| 6. | Teufel A, Staib F, Kanzler S, Weinmann A, Schulze-Bergkamen H, Galle PR. Genetics of hepatocellular carcinoma. World J Gastroenterol. 2007;13:2271-2282. [PubMed] |
| 7. | Martin J, Dufour JF. Tumor suppressor and hepatocellular carcinoma. World J Gastroenterol. 2008;14:1720-1733. [PubMed] [DOI] |
| 9. | Nomoto S, Yamashita K, Koshikawa K, Nakao A, Sidransky D. Mitochondrial D-loop mutations as clonal markers in multicentric hepatocellular carcinoma and plasma. Clin Cancer Res. 2002;8:481-487. [PubMed] |
| 10. | Andrews ZB, Diano S, Horvath TL. Mitochondrial uncoupling proteins in the CNS: in support of function and survival. Nat Rev Neurosci. 2005;6:829-840. [PubMed] [DOI] |
| 11. | Marzo I, Brenner C, Zamzami N, Jürgensmeier JM, Susin SA, Vieira HL, Prévost MC, Xie Z, Matsuyama S, Reed JC. Bax and adenine nucleotide translocator cooperate in the mitochondrial control of apoptosis. Science. 1998;281:2027-2031. [PubMed] [DOI] |
| 12. | Agrawal N, Dasaradhi PV, Mohmmed A, Malhotra P, Bhatnagar RK, Mukherjee SK. RNA interference: biology, mechanism, and applications. Microbiol Mol Biol Rev. 2003;67:657-685. [PubMed] [DOI] |
| 13. | Fire A, Xu S, Montgomery MK, Kostas SA, Driver SE, Mello CC. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 1998;391:806-811. [PubMed] [DOI] |
| 14. | Pushparaj PN, Aarthi JJ, Manikandan J, Kumar SD. siRNA, miRNA, and shRNA: in vivo applications. J Dent Res. 2008;87:992-1003. [PubMed] [DOI] |
| 15. | Stevenson M. Therapeutic potential of RNA interference. N Engl J Med. 2004;351:1772-1777. [PubMed] [DOI] |
| 16. | Takeshita F, Ochiya T. Therapeutic potential of RNA interference against cancer. Cancer Sci. 2006;97:689-696. [PubMed] [DOI] |
| 17. | Noguchi K, Ishitu Y, Miyano-Kurosaki N, Takaku H. Expression of shRNA using intron splicing. Nucleic Acids Symp Ser (Oxf). 2007;409-410. [PubMed] [DOI] |
| 18. | Herold MJ, van den Brandt J, Seibler J, Reichardt HM. Inducible and reversible gene silencing by stable integration of an shRNA-encoding lentivirus in transgenic rats. Proc Natl Acad Sci U S A. 2008;105:18507-18512. [PubMed] [DOI] |
| 19. | Buchschacher GL Jr, Wong-Staal F. Development of lentiviral vectors for gene therapy for human diseases. Blood. 2000;95:2499-2504. [PubMed] |
| 20. | Philpott NJ, Thrasher AJ. Use of nonintegrating lentiviral vectors for gene therapy. Hum Gene Ther. 2007;18:483-489. [PubMed] [DOI] |
| 21. | Nguyen TH, Bellodi-Privato M, Aubert D, Pichard V, Myara A, Trono D, Ferry N. Therapeutic lentivirus-mediated neonatal in vivo gene therapy in hyperbilirubinemic Gunn rats. Mol Ther. 2005;12:852-859. [PubMed] [DOI] |
| 22. | Neschadim A, McCart JA, Keating A, Medin JA. A roadmap to safe, efficient, and stable lentivirus-mediated gene therapy with hematopoietic cell transplantation. Biol Blood Marrow Transplant. 2007;13:1407-1416. [PubMed] [DOI] |
| 23. | Rubinson DA, Dillon CP, Kwiatkowski AV, Sievers C, Yang L, Kopinja J, Rooney DL, Zhang M, Ihrig MM, McManus MT. A lentivirus-based system to functionally silence genes in primary mammalian cells, stem cells and transgenic mice by RNA interference. Nat Genet. 2003;33:401-406. [PubMed] [DOI] |
| 24. | Follenzi A, Battaglia M, Lombardo A, Annoni A, Roncarolo MG, Naldini L. Targeting lentiviral vector expression to hepatocytes limits transgene-specific immune response and establishes long-term expression of human antihemophilic factor IX in mice. Blood. 2004;103:3700-3709. [PubMed] [DOI] |
| 25. | Kang Y, Stein CS, Heth JA, Sinn PL, Penisten AK, Staber PD, Ratliff KL, Shen H, Barker CK, Martins I. In vivo gene transfer using a nonprimate lentiviral vector pseudotyped with Ross River Virus glycoproteins. J Virol. 2002;76:9378-9388. [PubMed] [DOI] |
| 26. | VandenDriessche T, Thorrez L, Naldini L, Follenzi A, Moons L, Berneman Z, Collen D, Chuah MK. Lentiviral vectors containing the human immunodeficiency virus type-1 central polypurine tract can efficiently transduce nondividing hepatocytes and antigen-presenting cells in vivo. Blood. 2002;100:813-822. [PubMed] [DOI] |
| 27. | Park F, Ohashi K, Kay MA. The effect of age on hepatic gene transfer with self-inactivating lentiviral vectors in vivo. Mol Ther. 2003;8:314-323. [PubMed] [DOI] |
| 28. | Ohashi K, Park F, Kay MA. Role of hepatocyte direct hyperplasia in lentivirus-mediated liver transduction in vivo. Hum Gene Ther. 2002;13:653-663. [PubMed] [DOI] |