修回日期: 2011-02-18
接受日期: 2011-02-22
在线出版日期: 2011-04-08
目的: 验证血浆凝溶胶蛋白作为肿瘤侵袭转移关联基质金属蛋白酶类的作用底物, 对结直肠癌患者根治术后化疗疗效和预后复发的预测性.
方法: 将手术后病理证实的40例结直肠癌患者按照临床分期分为两组, A组: Ⅰ、Ⅱ期; B组: Ⅲ期. 并且, 根据B组病例随访预后复发情况, 又进一步将B组分为, B1组: 术后辅助化疗转移组; B2组: 术后辅助化疗未转移组. 应用化学发光免疫分析方法时相性监测化疗前与第1周期化疗后血浆凝溶胶蛋白的含量, 对检测数据进行系统分析, 结合足疗程化疗后定期随访的影像学诊断结果, 客观评价血浆凝溶胶蛋白检测与结直肠癌根治术后化疗疗效和预后的相关性.
结果: A组化疗前血浆凝溶胶蛋白检测均值为76.22 mg/L, 高于B组均值56.15 mg/L(B1组62.04 mg/L, B2组50.25 mg/L), 无统计学差异(P = 0.215); B1、B2组化疗前比较, 亦无统计学差异(P = 0.300). 化疗1周期后, B1组均值降为54.33 mg/L, B2组升高至84.20 mg/L, 两组出现了反向变化趋势, 差异有显著性(t = -2.540, P = 0.032). 对B1、B2组之间个体化疗前后变化率的均值进行比较, B1组均值下降了10.56%, 而B2组均值升高了47.36%, 差异亦有显著性(t = -4.430, P = 0.002).
结论: 对结直肠癌根治术后化疗的患者, 于化疗初期时相性监测血浆凝溶胶蛋白含量有助于预测远期的化疗疗效, 进而早期判断预后.
引文著录: 银新, 宁守斌, 任世奇, 沈恩允. 血浆凝溶胶蛋白与结直肠癌根治术化疗疗效及预后的关系. 世界华人消化杂志 2011; 19(10): 1089-1093
Revised: February 18, 2011
Accepted: February 22, 2011
Published online: April 8, 2011
AIM: To investigate the correlation of plasma gelsolin, a substrate for matrix metalloproteinase, with tumor invasion and metastasis and to explore the possibility of using plasma gelsolin as a putative marker for prediction of chemotherapy efficacy and prognosis in patients with colorectal cancer after radical resection.
METHODS: The clinical data for 40 patients with pathologically confirmed colorectal cancer after surgery were retrospectively analyzed. These patients were divided into two groups according to the progression of the disease, with group A containing patients with stages I and II disease and group B containing those with stage III disease. Patients in group B were further subdivided into group B1 and B2 according to prognosis, with B1 containing patients who underwent postoperative chemotherapy and had metastasis, and B2 containing those who underwent postoperative chemotherapy but had no metastasis. Chemiluminescence immunoassay was used for the monitoring of plasma concentration of gelsolin before and after the first cycle of chemotherapy.
RESULTS: Mean plasma gelsolin before chemotherapy showed no significant differences between groups A and B (76.22 mg/L vs 56.15 mg/L, P > 0.05) and between groups B1 and B2 (62.04 mg/L vs 50.25 mg/L, P > 0.05). After one cycle of chemotherapy, plasma gelsolin was reduced to 54.33 mg/L in group B1, but increased to 84.20 mg/L in group B2 (t =- 2.540, P = 0.032). Mean plasma gelsolin decreased by 10.56% in group B1 but increased by 47.36% in group B2, showing a significant difference between the two groups (t =- 4.430, P = 0.002).
CONCLUSION: Monitoring of plasma gelsolin in patients with colorectal cancer after radical resection during early chemotherapy can help predict long-term efficacy of chemotherapy and prognosis.
- Citation: Yin X, Ning SB, Ren SQ, Shen EY. Correlation of plasma gelsolin with chemotherapy efficacy and prognosis in patients with colorectal cancer after radical resection. Shijie Huaren Xiaohua Zazhi 2011; 19(10): 1089-1093
- URL: https://www.wjgnet.com/1009-3079/full/v19/i10/1089.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i10.1089
结直肠癌(colorectal cancer, CRC)是当前最常见的消化系统恶性肿瘤之一. 肝脏是CRC首发的血行转移和术后复发部位[1], 近半数的CRC患者在根治手术后发生异时性肝转移. 转移性肝癌患者大多治疗困难, 预后差, 国内外学者都在探索更为有效的治疗方法, 但迄今为止, CRC肝转移的治疗仍没有突破性的进展. 目前认为, CRC肝转移的分子机制包括细胞外基质(extracellular matrix, ECM)的降解、细胞黏附性能的改变、肿瘤细胞局部浸润、肿瘤血管生成、肿瘤细胞循环内播散和免疫逃逸、肿瘤细胞血管内栓塞及肿瘤细胞在新的微环境重新生长等几方面[2,3]. 其中的多个机制都有基质金属蛋白酶(matrix metalloproteinases, MMPs)的参与[4,5]. 在急性呼吸窘迫症、脓毒症、烧伤等多种危重症中, MMPs也直接参与了对血浆凝溶胶蛋白(gelsolin)的水解代谢和消耗, 是血浆gelsolin水平显著降低的原因之一[6,7]; 所以, gelsolin作为MMPs的直接和/或间接作用底物, 理论上具备了与肿瘤增殖和侵袭转移直接关联的生物标志物的基本特征. 但是, 迄今为止, 国内外未有相关文献报道. 为论证该科研设想的可行性, 我们首先分别针对30例初诊CRC患者血清和30例健康体检者血清进行了gelsolin检测, 实验结果显示CRC患者血清gelsolin显著低于健康体检者, 有显著的统计学意义, 此预实验结果初步明确了gelsolin与肿瘤的直接关联性. 因此本次临床研究拟进一步针对CRC根治术后患者首次化疗前后血清gelsolin的检测以及跟踪随访调查, 观察血浆gelsolin对CRC根治术后化疗疗效评价的指示作用以及CRC根治术后肝转移的预后预测性.
收集2009-02/2010-5在中国人民解放军空军总医院消化科住院的CRC患者40例, 所有患者术前均接受影像学检查未发现转移, 术后经病理证实为CRC, 入院前未接受过放、化疗, 其中男26例, 女14例, 按照临床分期分为两组: A组(11例): Ⅰ、Ⅱ期(术后病理证实有脉管癌栓需接受辅助化疗); B组(29例): Ⅲ期. 根据B组病例随访预后复发情况, 又进一步将B组分为: B1组(10例): 术后辅助化疗转移组; B2组(19例): 术后辅助化疗未转移组. 中位年龄: A组59.5 (25-76)岁, B组60.50(36-76)岁. 其中, 中分化腺癌24例, 中-低分化腺癌16例, 均于术后2-4 wk首次接受化疗, 化疗方案为FORFOX 4-8周期, 药物用量严格按照每位患者公斤体质量计算, 并结合各自身体耐受情况进行适当调整剂量. 术前和术后的影像学评价均采用了统一规范的方式和评判标准. 滨松BHP9504微孔板发光分析仪及北京拓普分析仪器有限公司DEM-Ⅲ型自动酶标洗板机.
对入选的每一位患者在首次化疗前、第1周期化疗后10-12 d(即第2周期化疗前)采集空腹时肘静脉血4 mL, 分离血清, 获取合格的样本, -40 ℃低温保存. 2 wk内采用双抗体夹心法测定gelsolin水平. 具体检测方法: 用一株单抗包被微孔板制成固相抗体, 用另一株单抗标记辣根过氧化物酶制成酶标志物. 在包被板微孔中加入含有gelsolin的校准品或待测血清及酶标记物, 温育后即形成固相抗体-抗原-酶标抗体的复合物. 充分洗涤后加入化学发光底物液, 于3-10 min内测定其相对发光强度(relative luminescence intensity, RLU), 根据校准曲线即可算出样品中gelsolin的含量, 样品的RLU值随gelsolin浓度的增加而升高. gelsolin正常参考范围: 200 mg/L±50 mg/L.
统计学处理 采用配对t检验评价治疗前(BV1)和第2周期化疗前(BV2)gelsolin水平的差异. gelsolin检测结果用mean±SD表示, 化疗前后gelsolin下降的百分比(Dec%)用(BV2-BV1)/BV1×100%计算. P<0.05为差异有统计学意义.
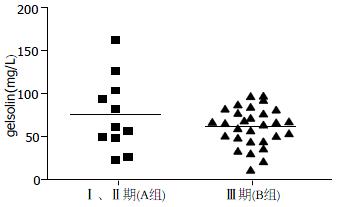
40例CRC患者中, 其中39例(97.5%)患者化疗前gelsolin水平均明显低于临界值, 仅1例患者略高于临界值下限(图1). 所有患者均接受结直肠癌根治术, 术后临床分期属于Ⅰ、Ⅱ期的11例, Ⅲ期的29例, 在术后进行辅助化疗之前, 检测血浆gelsolin值分别为76.22±43.09, 56.15±21.34, 无统计学差异(t = -1.323, P = 0.215, 表1).
| 特征 | Ⅰ、Ⅱ期(A组, n = 11) | Ⅲ期( B1+B2组, n = 29) | P值 |
| 性别(男:女) | 7:4 | 19:10 | |
| 中位年龄(范围)(岁) | 59.5(25-76) | 60.50(36-76) | |
| BV1 gelsolin(mg/L) | 76.22±43.09 | 56.15±21.34 | 0.215 |
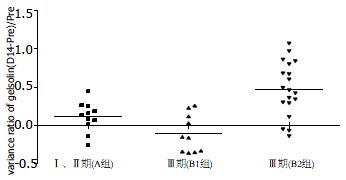
病例平均随访时间为18 mo, Ⅰ、Ⅱ期患者(A组, 11例)都未见其他脏器转移, Ⅲ期患者29例(B组), 其中10例(B1组)已经发生肝转移, 与没有出现转移的19例(B2组)Ⅲ期患者相比, 化疗之前2组之间gelsolin检测均值无显著差异(t = 1.099, P = 0.300); 接受1个周期化疗后, 2组gelsolin水平均出现了明显的变化趋势, 差异有显著性(t = -2.540, P = 0.032). 对B1、B2组之间个体化疗前后变化率的均值进行比较, B1组均值下降了10.56%,而B2组均值升高了47.36%, 有显著性差异(t = -4.430, P = 0.002, 表2, 图2). 显示出化疗初期时相性监测gelsolin指标对于预测预后的潜在优势.
| B1组(mg/L) | B2组(mg/L) | P值 | |
| BV1 | 62.04±25.39 | 50.25±21.40 | 0.300 |
| BV2 | 54.33±18.30 | 84.20±40.95 | 0.032 |
| Dec% | -10.56 | 47.36 | 0.002 |
gelsolin是胞质内重要的actin调节蛋白, 在机体生命活动中发挥重要的作用[8], 也已有研究显示gelsolin具有明显的肿瘤抑制作用, 在多种肿瘤中表达明显降低, 与恶性肿瘤的发生和发展密切相关, 被认为是1个候选的抑癌基因[9,10]. 本课题研究的对象-血浆gelsolin, 是一种分泌型的gelsolin异构体; 在血液中, 血浆gelsolin是肌动蛋白清除系统的重要成员, 在许多危重疾病中发挥机体保护作用; 由于在危重疾病中血浆gelsolin是MMPs的明确作用底物[11,12], 同时, MMPs更是肿瘤增殖和侵袭转移的重要蛋白酶类, 因此, 本研究通过对CRC患者化疗初期动态监测gelsolin水平, 以验证其作为肿瘤侵袭转移关联蛋白酶的作用底物, 能否可以作为早期评估CRC根治术后辅助化疗的疗效, 以及预测肝脏转移可能性的有效指标.
研究数据显示: 在40例样本中, 39例(97.5%)CRC根治术后患者化疗前gelsolin水平均明显低于正常临界值, 仅1例患者略高于正常临界值下限. 该结果进一步应证了血浆gelsolin与恶性肿瘤密切相关的设想; 而且, 由于是针对术后肿瘤患者血浆gelsolin的检测, 所以, 血浆gelsolin水平不对应于原发灶肿瘤, 而很可能是与潜在或隐性的转移灶肿瘤密切关联. 进而, 我们又比较分析了大肠癌根治术后辅助化疗前后血浆gelsolin水平, 观察血浆gelsolin同化疗疗效及肿瘤预后复发的相关性; 截至目前为止, 病例随访时间平均为18 mo, Ⅰ、Ⅱ期患者都未见其他脏器转移, 而部分Ⅲ期患者已经发生肝转移, 所以将Ⅲ期患者进一步分为转移组和未转移组分析, 采用化疗前后gelsolin变化率进行比较, 结果显示: 转移组gelsolin化疗前后值变化呈下降趋势, 而未转移组均升高了近半数, 两组数据显示出明显的反向趋势, 经统计学分析, 差异有显著性. 转移灶肿瘤在继发部位的新生和增殖需要大量MMPs的参与, 化疗药物对肿瘤的杀伤也直接阻止了MMPs的表达和分泌, 最终抑制了血浆gelsolin的降解, 所以, 血浆gelsolin化疗后的升高最终预示着化疗药物对转移灶肿瘤的有效杀伤效果, 反之则反之. 该Ⅲ期CRC根治术后患者都经过相同的FORFOX 4-8周期方案化疗, 该数据显示出首次化疗第1周期前后动态监测血浆gelsolin水平对结直肠癌根治术后辅助化疗疗效及肿瘤预后复发有明确的预测性, 同时证明了该临床检测方法的科学性. 虽然, 血浆gelsolin只是MMPs的作用底物, 与肿瘤发生发展过程不直接关联, 但是, 通过与肿瘤直接关联的MMPs蛋白酶作用的生物信号放大, 反而提升了血浆gelsolin作为肿瘤发生发展指示作用的灵敏度. 血浆gelsolin与CEA、AFP、PSA和CA系列等等肿瘤自身抗原所代表的常规肿瘤标志物比较, 具有完全不同的特殊代表性, 属于非肿瘤源性的间接肿瘤指示性生物标志物, 该间接性的生物信号放大特征为新型肿瘤标志物的筛选提供了完全新颖的科研设计思路.
在此次临床研究中, 我们还按照临床分期对该40例CRC根治术后患者gelsolin水平进行了比较, 试图发现gelsolin水平与肿瘤临床分期的相关性, 进一步找寻gelsolin与肿瘤侵袭转移乃至隐性肿瘤转移灶预测的关联依据, 检测结果发现Ⅰ、Ⅱ期患者血浆gelsolin高于Ⅲ期, 但没有统计学意义. Ⅰ、Ⅱ期患者潜在肿瘤转移的风险低于Ⅲ期, 也就是说, Ⅰ、Ⅱ期患者所代表肿瘤转移代表特征的MMPs低于Ⅲ期, 进而提示gelsolin水平Ⅰ、Ⅱ期患者高于Ⅲ期. 该检测结果有一定的高低趋势, 但是, 由于血浆gelsolin正常值范围广(150-250 mg/L), 个体差异性大, 因而在小样本病例中不能得到统计学依据. 考虑到血浆gelsolin个体差异性大的因素, 对肿瘤患者时相性监测, 个体监测数据前后分析更符合血浆gelsolin的生物学特征, 进而突出了血浆gelsolin作为肿瘤标志物个体化时相性诊断的临床应用价值.
总之, 血浆gelsolin在首次化疗第1周期前后的时相性监测对结直肠癌根治术后辅助化疗疗效及肿瘤预后复发有明确的预测性; 血浆gelsolin不同于肿瘤抗原类常规肿瘤标志物, 属于非肿瘤源性的间接肿瘤指示性生物标志物, 该间接性的生物信号放大特征为新型肿瘤标志物的筛选提供了完全新颖的科研设计思路; 在检测方法上, 时相性监测血浆gelsolin以及个体化数据分析更符合血浆gelsolin的生物学特征, 突出了血浆gelsolin作为肿瘤标志物, 个体化时相性诊断的临床应用价值.
结直肠癌(CRC)是当前最常见的消化系统恶性肿瘤之一. 肝脏是CRC首发的血行转移和术后复发部位, 近半数的CRC患者在根治手术后发生异时性肝转移. 转移性肝癌患者大多治疗困难, 预后差, 国内外学者都在探索更为有效的治疗方法, 但迄今为止, CRC肝转移的治疗仍没有突破性的进展.
黄培林, 教授, 东南大学
已有研究显示gelsolin具有明显的肿瘤抑制作用, 在多种肿瘤中表达明显降低, 与恶性肿瘤的发生和发展密切相关.
对结直肠癌根治术后化疗的患者, 于化疗初期时相性监测血浆凝溶胶蛋白含量有助于预测远期的化疗疗效, 进而早期判断预后.
本文科学性、实用性较好, 但可读性一般.
编辑: 李军亮 电编:李薇
| 1. | Bruin SC, Klijn C, Liefers GJ, Braaf LM, Joosse SA, van Beers EH, Verwaal VJ, Morreau H, Wessels LF, van Velthuysen ML. Specific genomic aberrations in primary colorectal cancer are associated with liver metastases. BMC Cancer. 2010;10:662. [PubMed] [DOI] |
| 2. | Valcárcel M, Arteta B, Jaureguibeitia A, Lopategi A, Martínez I, Mendoza L, Muruzabal FJ, Salado C, Vidal-Vanaclocha F. Three-dimensional growth as multicellular spheroid activates the proangiogenic phenotype of colorectal carcinoma cells via LFA-1-dependent VEGF: implications on hepatic micrometastasis. J Transl Med. 2008;6:57. [PubMed] [DOI] |
| 3. | Rudmik LR, Magliocco AM. Molecular mechanisms of hepatic metastasis in colorectal cancer. J Surg Oncol. 2005;92:347-359. [PubMed] [DOI] |
| 4. | Hald A, Rønø B, Melander MC, Ding M, Holck S, Lund LR. MMP9 is protective against lethal inflammatory mass lesions in the mouse colon. Dis Model Mech. 2011;4:212-227. [PubMed] [DOI] |
| 5. | Roy R, Yang J, Moses MA. Matrix metalloproteinases as novel biomarkers and potential therapeutic targets in human cancer. J Clin Oncol. 2009;27:5287-5297. [PubMed] [DOI] |
| 6. | Park SM, Hwang IK, Kim SY, Lee SJ, Park KS, Lee ST. Characterization of plasma gelsolin as a substrate for matrix metalloproteinases. Proteomics. 2006;6:1192-1199. [PubMed] [DOI] |
| 7. | Rothenbach PA, Dahl B, Schwartz JJ, O'Keefe GE, Yamamoto M, Lee WM, Horton JW, Yin HL, Turnage RH. Recombinant plasma gelsolin infusion attenuates burn-induced pulmonary microvascular dysfunction. J Appl Physiol. 2004;96:25-31. [PubMed] [DOI] |
| 8. | Hu S, Biben T, Wang X, Jurdic P, Géminard JC. Internal dynamics of actin structures involved in the cell motility and adhesion: Modeling of the podosomes at the molecular level. J Theor Biol. 2011;270:25-30. [PubMed] [DOI] |
| 9. | Li GH, Arora PD, Chen Y, McCulloch CA, Liu P. Multifunctional roles of gelsolin in health and diseases. Med Res Rev. 2010; [Epub ahead of print]. [PubMed] |
| 10. | Osborn TM, Verdrengh M, Stossel TP, Tarkowski A, Bokarewa M. Decreased levels of the gelsolin plasma isoform in patients with rheumatoid arthritis. Arthritis Res Ther. 2008;10:R117. [PubMed] [DOI] |