修回日期: 2010-02-02
接受日期: 2010-02-09
在线出版日期: 2010-03-28
目的: 探讨肿瘤坏死因子-α(TNF-α)对Caco-2细胞间通透性的影响及作用机制.
方法: 利用Caco-2细胞建立肠上皮细胞屏障模型, 模型分为正常对照组(C组)和TNF-α预处理组(TNF-α组), TNF-α组根据预处理时间又分为3、6、12、24 h 4个亚组. 应用电阻仪测定TNF-α预处理后各组Caco-2细胞的跨上皮细胞电阻(transepithelial electrical resistance, TEER)变化; 罗丹明-鬼笔环肽直接染色观察细胞骨架改变; 同时采用荧光素酶报告基因检测NF-κB活性.
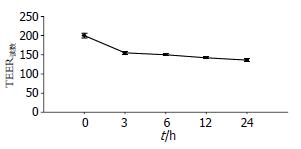
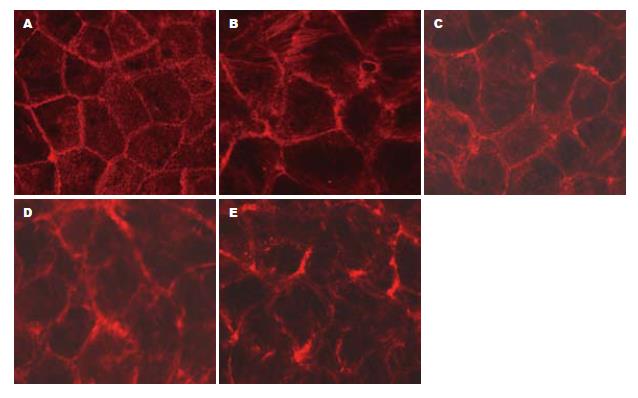
结果: TNF-α各亚组TEER均降低, 与C组比较均有显著性差异(均P<0.05), 其中TNF-α 24 h亚组TEER降低明显, 与C组及TNF-α 3、6、12 h亚组比较有显著性差异(均P<0.05); TNF-α 3、6、12 h亚组NF-κB活性增高, 与C组比较均有显著性差异(均P<0.05), 且TNF-α 12 h亚组NF-κB活性明显增高, 与C组及TNF-α 3、6、24 h亚组比较均有显著性差异(均P<0.05); 罗丹明-鬼笔环肽直接染色可见C组的F-actin沿细胞膜分布, 呈蜂巢状线性荧光, 100 μg/L TNF-α预处理后导致F-actin荧光信号减弱, 并呈锯齿状异常分布.
结论: TNF-α导致Caco-2细胞间的通透性增加, 其机制可能与NF-κB活化及F-actin重组有关.
引文著录: 王国丽, 尹菁华, 毛定安, 何芳, 尹飞. TNF-α体外对Caco-2细胞通透性的影响及其机制. 世界华人消化杂志 2010; 18(9): 942-946
Revised: February 2, 2010
Accepted: February 9, 2010
Published online: March 28, 2010
AIM: To investigate the effects of tumor necrosis factor-α (TNF-α) on the paracellular permeability of Caco-2 cell monolayers and to explore potential mechanisms involved.
METHODS: Caco-2 cells were cultured in vitro to establish a model of intestinal epithelial barrier and divided randomly into two groups: control group and TNF-α treatment group. The TNF-α treatment group was further divided into four subgroups for testing at 3, 6, 12 and 24 h after TNF-α treatment. The changes in transepithelial electrical resistance (TEER) of Caco-2 cells were measured using an electrical resistance system. The changes in cytoskeleton were observed by direct staining with rhodamine-phalloidin. The activation of nuclear factor-κB (NF-κB) was determined by luciferase reporter gene assay.
RESULTS: The TEER significantly decreased in all four treatment subgroups compared to the control group (all P < 0.05). The TEER was significantly lower in the 24-h treatment subgroup than in other subgroups (all P < 0.05). The activation level of NF-κB was significantly raised in 3-, 6- and 12-h treatment subgroups compared to the control group (all P < 0.05). The activation level of NF-κB in 12-h treatment subgroup was significantly higher than those in other subgroups (all P < 0.05). In the control group, rhodamine-phalloidin staining showed that F-actin was visualized around the cell membrane and exhibited a honeycomb pattern of fluorescent staining. After treatment with TNF-α, the fluorescence signals were weakened and distributed in a serrated pattern.
CONCLUSION: TNF-α increases the paracellular permeability of Caco-2 cell monolayers perhaps by inducing NF-κB activation and actin reorganization.
- Citation: Wang GL, Yin JH, Mao DA, He F, Yin F. Tumor necrosis factor-α increases the paracellular permeability of Caco-2 cell monolayers in vitro. Shijie Huaren Xiaohua Zazhi 2010; 18(9): 942-946
- URL: https://www.wjgnet.com/1009-3079/full/v18/i9/942.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i9.942
炎症性肠病(inflammatory bowel disease, IBD)是一组病因不明的慢性肠道炎症性疾病, 他包括溃疡性结肠炎和克罗恩病, 近年来其发病率有逐年增高趋势. IBD的病因和发病机制尚不清楚, 目前普遍认为免疫反应异常所导致的肠黏膜通透性增加在其发病中起重要作用[1,2]. 已有的研究发现IBD患者血清中促炎细胞因子水平显著增高[3,4], 这可能是IBD发病的重要机制之一. TNF-α作为重要的前炎性细胞因子之一, 在不同的体内、外研究中均证实可以引起肠上皮细胞屏障通透性增加[5-7], 抗TNF-α抗体可以恢复受损的肠上皮细胞屏障功能[8], 但是TNF-α引起肠黏膜屏障通透性增高的具体机制尚不清楚. 本研究利用Caco-2细胞建立体外肠上皮细胞屏障模型, 观察TNF-α对其通透性影响并探讨其可能的机制.
胎牛血清(四季青, 中国); 电阻仪ESR-001(millipore, 日本); transwell(millipore, 日本); 罗丹明-鬼笔环肽(invitrogen, 美国); Pnf-kb-luc(美国芝加哥大学章坚教授馈赠); Lipofectamine 2000(invitrogen, 美国); 其余分析试剂为国产或进口分装.
1.2.1 肠上皮细胞屏障模型的建立: Caco-2细胞株, 来源于人大肠癌细胞. 应用含有200 mL/L胎牛血清、10 g/L非必需氨基酸、10 g/L谷氨酰胺和青霉素-链霉素双抗液的DMEM培养液, 将Caco-2细胞在37 ℃、50 mL/L CO2条件下进行培养, 3-4 d可基本融合. 将分化良好的Caco-2细胞接种于Transwell板上(孔径1 μm, 有效膜面积0.33 cm2), 接种密度为0.5×104/cm2, 隔天换液(Transwell上层加入300 μL培养液, 下层加入1 200 μL培养液), 倒置显微镜下观察细胞生长情况. 约21 d后细胞形成紧密单层.
1.2.2 分组: 待Caco-2细胞成紧密单层后, 无血清培养24 h, 将其分为: 正常对照组(C组)和TNF-α预处理组(TNF-α组). 根据TNF-α预处理时间又分为3、6、12、24 h 4个亚组, 各亚组于其相应的时间点在Transwell基底侧加入TNF-α 100 μg/L分别孵育3、6、12、24 h.
1.2.3 跨上皮细胞电阻(transepithelial electrical resistance, TEER)的测定: 参照文献方法应用电阻仪测定各组Caco-2细胞的TEER[5]. 为保证数值的准确性, 整个过程在恒定温度下(37 ℃)进行, 每个Transwell均取不同方向的3个点, 重复测定3次, 取均值乘以Transwell膜面积, 即为该样品的TEER值, 以Ω·cm2示. 因为Transwell膜本身也具有一定的TEER, 因此标准的TEER应将样品的实测TEER值减去空白对照的TEER值.
1.2.4 F-actin染色: 各组Coca-2细胞用PBS漂洗: 2 min, 3次, 37 g/L多聚甲醛4 ℃孵育10 min, 冷PBS漂洗2 min, 3次, 再用5 g/L Triton-x100于4 ℃孵育15 min, 冷PBS漂洗: 2 min, 3次, 最后用2 kU/L罗丹明-鬼笔环肽(Rhodamine-Phalloidin)室温避光孵育1 h, PBS漂洗: 2 min, 3次. 染色结束后用荧光倒置相差显微镜进行荧光镜检及拍照.
1.2.5 NF-κB活性检测: 将Caco-2细胞以(1.5-2)×105个/孔的密度接种到24孔板中, 隔天待其生长融合至70%-80%时, 利用Lipofectamine 2000将Pnf-κb-luc质粒转染入该细胞. 具体方法如下: 在A、B两个eppendorf管中分别加入1 μg Pnf-κb-luc质粒+serum free DMEM 至终体积50 μL每孔; 1.5 μL lipofectamine 2000+48.5 μL serum free DMEM至终体积为每孔50 μL, 室温放置5 min, 将A、B二者混合, 室温放置20-30 min后将混合液缓慢而均匀地加到24孔板细胞液中, 每孔再加入无血清DMEM 400 μL, 轻轻摇晃, 使DNA分布均匀, 37 ℃、50 mL/L CO2培养24 h后, 给每孔更换500 μL正常的完全培养基. 按照1.2.2实验分组方法, 分别于转染24、36、42、45 h后在Transwell基底侧加入100 μg/LTNF-α, 继续孵育至48 h收取细胞, 得到TNF-α 24、12、6、3四个亚组. 每组取3个样品, 按荧光素酶活性检测试剂操作指南及参考文献[9]提供的方法裂解、离心, 取20 μL上清, 分别与100 μL荧光检测试剂混合, 置TD-20/20荧光检测仪(Bio-Rad)中得到各组的单光子仪读数, 进行统计学分析.
统计学处理 应用SPSS13.0软件进行统计学分析. 所有数据均以mean±SD表示, 采用配对t检验或单因素方差分析(AVONA)的LSD方法对各组间数据进行比较. 以P<0.05为有统计学差异.
TNF-α各亚组Caco-2细胞TEER值均降低, 与C组比较统计学差异有显著性(均P<0.05), 其中TNF-α 24 h亚组TEER降至最低, 与C组及TNF-α 3、6、12 h亚组比较有显著性差异(均P<0.05, 表1, 图1).
TNF-α 3、6、12 h组NF-κB活性增高, 与C组比较统计学差异有显著性(均P<0.05), 其中TNF-α 12 h亚组NF-κB活性最高, 与C组及TNF-α 3、6、24 h亚组组比较有显著性差异(均P<0.05, 表1).
C组的F-actin主要分布在细胞周边, 线条完整连续, 显示出典型的鹅卵石样轮廓, 称为外周致密束. 细胞间连接紧密, 未见明显缝隙形成. 核的周围也有少量分布, 形成核骨架(图2A); TNF-α 3、6 h组细胞的F-actin无明显改变(图2B, C); TNF-α 12 h组细胞外周致密带边缘变得毛糙不规整, 细胞荧光染色减弱(图2D), TNF-α 24 h组外周轮廓模糊难辨, 逐渐出现锯齿样断裂, 趋于变细崩解消散(图2E).
肠黏膜屏障是机体重要的免疫防御屏障, 将机体与肠道内的外源性物质隔离开, 避免病原微生物侵袭和抗原分子对机体的损伤. 肠黏膜屏障包括肠上皮细胞屏障、免疫屏障和微生物屏障, 其中肠上皮细胞屏障是最重要的一道屏障, 是肠黏膜具有选择性通透的基础. 已有的资料显示TNF-α可导致肠上皮细胞通透性改变[5-7], 但其具体的损伤和调控机制尚不明确. 而肠上皮通透性增加是IBD的主要病理改变之一, 因此对这一问题的深入研究有可能对IBD的治疗提供新的思路.
由跨膜蛋白、细胞骨架蛋白及胞质附着蛋白组成的紧密连接在肠上皮细胞间隙顶端形成渗透屏障, 调节水和电解质的极向运动, 防止大分子物质经肠腔漏到周围组织中, 是肠上皮屏障的重要结构基础. 其中肌动蛋白(actin)是细胞骨架蛋白主要组成成分之一, 有单体型(G-actin)和纤维多聚体型(F-actin)两种存在方式. F-actin可通过与肌球蛋白和原肌球蛋白等组成不同的微丝束类型, 调节细胞形态和细胞间连接, 参与维持细胞的屏障功能. 已有研究表明, 内皮细胞受到外界刺激, 如: LPS、TNF-α等作用时, 细胞通过多种信号转导的途径介导肌动蛋白微丝发生重组, 导致血管壁通透性增加[10]. F-actin的分布变化与细胞的屏障功能改变密切相关.
TEER是检测细胞屏障的指标[5], 其值越大代表细胞的屏障功能越好. 本实验发现TNF-α损伤Caco-2细胞屏障功能, 导致其通透性增加, 作用24 h时细胞屏障功能最低; TNF-α预处理12 h后Caco-2细胞actin发生重组, 24 h后重组程度加重. 我们的结果与Schmitz等[5]在大肠上皮细胞株HT-29/B6中的发现一致, 其指出TNF-α(100 μg/L)可以降低TEER达81%, 并且冷冻蚀刻电镜显示TJ组分减少, 提示TNF-α破坏肠上皮屏障功能是通过改变TJ的结构和功能来实现的. Claude[11]进一步证明TJ的数量与TEER直接相关, 呈对数关系, 更加支持我们的结论: TNF-α是通过actin重组来破坏Caco-2细胞紧密连接的完整性进而增加其通透性. 那么什么信号参与了上述上皮细胞肌动蛋白微丝重组、通透性增加过程中的调控呢?Amarro等[12,13]的研究认为活化的RhoA能够通过激活Rho激酶调控其下游肌球蛋白轻链磷酸化, 引起黏着斑和应力纤维形成, 调控F-actin的重构. Adam等[14]指出豆蔻酸佛波酰乙酯-蛋白激酶C通路, 调控F-actin细胞骨架重构, 引起内皮细胞通透性增加. 虽然目前相关信号途径研究甚多, 但具体调控机制尚不明确. NF-κB是一种重要的细胞转录因子, 其活化可启动炎症相关基因的转录. 有研究表明, NF-κB活化与TNF-α致肠上皮细胞屏障功能损害密切相关[7], Banan等[15]的研究认为NF-κB的激活在酒精致肠道黏膜屏障完整性损害方面发挥作用, 并且该过程与F-actin解聚密切相关. Puthenedam等[16]也指出NF-κB是上皮细胞F-actin重构的重要调控分子. 以上提示, NF-κB活化是TNF-α致肠上皮细胞F-actin重构的重要环节, 但对该问题的研究目前国内未见相关报道.
NF-κB荧光素酶报告基因检测是将反应元件(κB基序)构建到报告基因(荧光素酶)上, 通过荧光素酶分析试剂测定荧光素酶的活性来反映与κB基序相互作用的NF-κB活性. 该法可较好检测NF-κB反式激活能力, 与目前国内大多数学者采用的EMSA法相比更为快速、灵敏[17-19]. 本实验利用脂质体2000将含NF-κB启动子和荧光素酶报告基因的质粒DNA转染入Caco-2细胞, 结合荧光酶报道基因系统, 检测各组细胞的NF-κB活性变化. 实验发现TNF-α作用3 h后Caco-2细胞的NF-κB活性开始增高, 12 h达高峰. 提示, TNF-α致NF-κB活性增加与上皮细胞F-actin重构、细胞屏障功能改变密切相关.
总之, TNF-α可损伤肠黏膜屏障, 导致细胞间通透性增加. 其中actin重组及NF-κB活化可能是其重要机制. 对这个问题的进一步研究, 将有助于对IBD发病机制的深入了解.
铂类配合物是临床上广泛应用的抗肿瘤药物, 其中最常用的有顺铂、卡铂、奥沙利铂. 这些药物均有一定的毒副作用, 抗肿瘤谱窄, 易产生耐药性; 而且, 分子量小, 仅能识别2-3个碱基, 特异性不高, 易损伤正常细胞的DNA. 另外, 他们与靶分子的结合作用弱, 与DNA单加合后, 会引起DNA结构的改变, 从而导致药效的降低. 因此, 研究与经典铂类配合物结构不同的非经典的配合物, 克服现有的铂类配合物的缺点, 增加疗效, 是目前研究的重点和热点.
崔立红, 副教授, 中国人民解放军海军总医院消化内科
目前研究铂类配合物的重点和热点是对现有的经典结构的改造, 如将单核的铂类配合物改为双核或多核, 增加特异性和疗效; 增加空间阻位, 防止耐药性的发生; 引入新的极性离子, 增加可溶性; 增加脂溶性, 来改变用药途径, 等等. 以此达到高效、低毒、水溶性好、选择性高、与顺铂无交叉耐药性、可口服的新型铂类.
Amarro等的研究认为活化的RhoA能够通过激活Rho激酶调控其下游肌球蛋白轻链磷酸化, 引起黏着斑和应力纤维形成, 调控F-actin的重构.
本研究选题结合临床, 设计合理, 结果对临床工作有一定指导.
编辑: 李瑞敏 电编:吴鹏朕
| 1. | Shih DQ, Targan SR. Immunopathogenesis of inflammatory bowel disease. World J Gastroenterol. 2008;14:390-400. [PubMed] [DOI] |
| 2. | Yamamoto-Furusho JK. Genetic factors associated with the development of inflammatory bowel disease. World J Gastroenterol. 2007;13:5594-5597. [PubMed] |
| 3. | Xia B, Crusius JBA, Meuwissen SGM, Pena AS. Inflammatory bowel disease: definition, epidemiology, etiologic aspects, and immunogenetic studies. World J Gastroenterol. 1998;4:446-458. [PubMed] [DOI] |
| 4. | Rogler G, Andus T. Cytokines in inflammatory bowel disease. World J Surg. 1998;22:382-389. [PubMed] [DOI] |
| 5. | Schmitz H, Fromm M, Bentzel CJ, Scholz P, Detjen K, Mankertz J, Bode H, Epple HJ, Riecken EO, Schulzke JD. Tumor necrosis factor-alpha (TNFalpha) regulates the epithelial barrier in the human intestinal cell line HT-29/B6. J Cell Sci. 1999;112:137-146. [PubMed] |
| 6. | Ma TY, Boivin MA, Ye D, Pedram A, Said HM. Mechanism of TNF-{alpha} modulation of Caco-2 intestinal epithelial tight junction barrier: role of myosin light-chain kinase protein expression. Am J Physiol Gastrointest Liver Physiol. 2005;288:G422-G430. [PubMed] [DOI] |
| 7. | Ma TY, Iwamoto GK, Hoa NT, Akotia V, Pedram A, Boivin MA, Said HM. TNF-alpha-induced increase in intestinal epithelial tight junction permeability requires NF-kappa B activation. Am J Physiol Gastrointest Liver Physiol. 2004;286:G367-G376. [PubMed] [DOI] |
| 8. | Suenaert P, Bulteel V, Lemmens L, Noman M, Geypens B, Van Assche G, Geboes K, Ceuppens JL, Rutgeerts P. Anti-tumor necrosis factor treatment restores the gut barrier in Crohn's disease. Am J Gastroenterol. 2002;97:2000-2004. [PubMed] [DOI] |
| 9. | Yang X, Sham JS, Ng MH, Tsao SW, Zhang D, Lowe SW, Cao L. LMP1 of Epstein-Barr virus induces proliferation of primary mouse embryonic fibroblasts and cooperatively transforms the cells with a p16-insensitive CDK4 oncogene. J Virol. 2000;74:883-891. [PubMed] [DOI] |
| 10. | Gao J, Zhao WX, Zhou LJ, Zeng BX, Yao SL, Liu D, Chen ZQ. Protective effects of propofol on lipopolysaccharide-activated endothelial cell barrier dysfunction. Inflamm Res. 2006;55:385-392. [PubMed] [DOI] |
| 11. | Claude P. Morphological factors influencing transepithelial permeability: a model for the resistance of the zonula occludens. J Membr Biol. 1978;39:219-232. [PubMed] [DOI] |
| 12. | Amano M, Fukata Y, Kaibuchi K. Regulation and functions of Rho-associated kinase. Exp Cell Res. 2000;261:44-51. [PubMed] [DOI] |
| 13. | Amano M, Chihara K, Kimura K, Fukata Y, Nakamura N, Matsuura Y, Kaibuchi K. Formation of actin stress fibers and focal adhesions enhanced by Rho-kinase. Science. 1997;275:1308-1311. [PubMed] [DOI] |
| 14. | Adam LP, Hathaway DR. Identification of mitogen-activated protein kinase phosphorylation sequences in mammalian h-Caldesmon. FEBS Lett. 1993;322:56-60. [DOI] |
| 15. | Banan A, Keshavarzian A, Zhang L, Shaikh M, Forsyth CB, Tang Y, Fields JZ. NF-kappaB activation as a key mechanism in ethanol-induced disruption of the F-actin cytoskeleton and monolayer barrier integrity in intestinal epithelium. Alcohol. 2007;41:447-460. [PubMed] [DOI] |
| 16. | Puthenedam M, Williams PH, Lakshmi BS, Balakrishnan A. Modulation of tight junction barrier function by outer membrane proteins of enteropathogenic Escherichia coli: role of F-actin and junctional adhesion molecule-1. Cell Biol Int. 2007;31:836-844. [PubMed] [DOI] |
| 17. | Wickremasinghe MI, Thomas LH, Friedland JS. Pulmonary epithelial cells are a source of IL-8 in the response to Mycobacterium tuberculosis: essential role of IL-1 from infected monocytes in a NF-kappa B-dependent network. J Immunol. 1999;163:3936-3947. [PubMed] |
| 18. | Fairchild KD, Singh IS, Patel S, Drysdale BE, Viscardi RM, Hester L, Lazusky HM, Hasday JD. Hypothermia prolongs activation of NF-kappaB and augments generation of inflammatory cytokines. Am J Physiol Cell Physiol. 2004;287:C422-C431. [PubMed] [DOI] |