修回日期: 2010-01-28
接受日期: 2010-02-01
在线出版日期: 2010-03-28
目的: 构建重组质粒PGCsi-Pyk2 shRNA, 并检测所引起的Pyk2 mRNA和蛋白在Lovo结肠癌细胞系中的表达.
方法: 设计合成3对Pky2基因shRNA序列, 形成双链后将其依次连入带有U6启动子并含有潮霉素B的pGCsi空载体, 构建成能产生Pyk2短发卡RNA的质粒; 采用双酶切和测序分析鉴定插入基因的序列; 脂质体介导重组质粒pGCsi-Pyk2 shRNA稳定转染Lovo细胞系并通过潮霉素B筛选, 获得比较单一的转染细胞; 分别采用RT-PCR、Western blot等检测转染前后Pyk2的水平表达.
结果: 酶切鉴定和测序分析表明重组表达质粒pGCsi-Pyk2 shRNA构建无误; 绿色荧光照相及PCR表明质粒转染成功; RT-PCR和Western blot均表明, 与转染空质粒PGCsi组和转染仅含免疫荧光基因组细胞相比, 转染重组表达质粒pGCsi-Pyk2 shRNA细胞中Pyk2 mRNA及蛋白表达水平均明显降低.
结论: 成功构建重组质粒pGCsi-Pyk2 shRNA, 并证明他能降低Pyk2在Lovo细胞株系中的表达, 为进一步研究Pyk2如何调控Hic-5/ARA55, Paxillion等下游靶基因的表达和参与结肠癌表观遗传学发生机制奠定了基础.
引文著录: 胡刚, 汪欣, 郑启军, 万远廉, 刘玉村, 朱静. 携带Pyk2基因的shRNA质粒构建及其在Lovo结肠癌细胞系中的表达. 世界华人消化杂志 2010; 18(9): 877-882
Revised: January 28, 2010
Accepted: February 1, 2010
Published online: March 28, 2010
AIM: To construct the recombinant small hairpin RNA (shRNA) plasmids targeting the proline-rich tyrosine kinase 2 (Pyk2) gene (pGCsi-Pyk2 shRNA) and detect their expression in Lovo cells.
METHODS: Three pairs of Pyk2 shRNA sequences were designed and ligated to the pGCsi vector that contains U6 promoter and hygromycin B to obtain shRNA expression plasmids targeting the Pyk2. The recombinant pGCsi-Pyk2 shRNA plasmids were introduced into Lovo cells by liposome-mediated transfection and selected with hygromycin B. The expression of Pyk2 mRNA and protein was detected by reverse transcription-polymerase chain reaction (RT-PCR) and Western blot, respectively.
RESULTS: Restriction enzyme digestion and sequence analysis showed that recombinant pGCsi-Pyk2 shRNA plasmids were successfully constructed. The expression levels of Pyk2 mRNA and protein in Lovo cells transfected with pGCsi-Pyk2 shRNA plasmids were significantly lower than those in Lovo cells transfected with empty or negative plamsids.
CONCLUSION: Recombinant pGCsi-Pyk2 shRNA plasmids are successfully constructed. Their transfection can silence the expression of Pyk2 gene in Lovo cells. The pGCsi-Pyk2 shRNA plasmids obtained lay a foundation for further study of the role of the Pyk2 gene in the pathogenesis of colorectal cancer.
- Citation: Hu G, Wang X, Zheng QJ, Wan YL, Liu YC, Zhu J. Construction of shRNA expression plasmids targeting the Pyk2 gene and their expression in Lovo cells. Shijie Huaren Xiaohua Zazhi 2010; 18(9): 877-882
- URL: https://www.wjgnet.com/1009-3079/full/v18/i9/877.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i9.877
富含脯氨酸的非受体酪氨酸蛋白激酶2(proline-rich tyrosine kinase-2, Pyk2)是黏着斑激酶FAKs家族成员, 可能在调节细胞的增生与分化, 调节细胞的黏附和迁移能力, 调节转录因子的活性方面发挥作用. 大量的流行病学和实验研究也表明, Pyk2在结直肠癌的发生发展中有重要意义. Guo等[1]研究表明, Pyk2在正常的胃黏膜组织和胃癌组织中表达差异有显著性, 可能在胃癌的发生中起作用. Zhang等[2]研究表明, Pyk2与其他的因素是结直肠癌的预后因素. 在胃肠道肿瘤中, Pyk2作为一种潜在的抑癌基因存在. 而靳西凤等[3]报道认为RNA干扰技术对研究结肠癌的发生机制能提供强有力的支持, RNA干扰技术(siRNA)在结肠癌基础研究中也被广泛应用[4-10]. 本研究拟通过基因重组技术构建Pyk2 shRNA的真核表达载体, 并转染到Lovo结直肠癌细胞系, 研究已经表明, Lovo结直肠癌细胞系是未分化细胞株, 但其Pyk2蛋白呈高表达[11,12], 对结直肠癌的发生发展起抑制作用, 我们通过构建Pyk2 shRNA, 人为地降低Lovo细胞系中Pyk2的表达量, 为探讨Pyk2是否通过Hic-5/ARA55及Paxilion等下游通路的激活抑制肠道肿瘤的发生提供研究基础.
空质粒pGCsi(带有潮霉素B抗体基因片段)购于北京毅新兴业公司, DMEM、胎牛血清、LB培养基均为Gibco公司产品, 感受态细菌购于DH-5α(全式金公司), 限制性内切酶和T4 DNA连接酶为NEB公司产品, 脂质体Lipofectamine 2000购于Invitrogen公司, Protein Ladder (10748010)购自Invitrogen公司, 鼠抗人Pyk2Ab购自Santa Cruz公司(sc-100379), RT-PCR试剂盒及DNA Ladder购自Promega公司, 结肠癌细胞株Lovo由本实验室保存.
1.2.1 合成Pyk2基因干扰寡核苷酸序列: 针对Pyk2 mRNA全序列设计合成4对Pyk2基因干扰寡核苷酸序列, 即Pyk2-1, Pyk2-2, Pyk2-3, Pyk2-4经过BLAST数据库分析未发现同源序列. 其序列如下: Pyk2-1: 5'-GCTTCTATAGCAACAGCTTCA-tcaagag-TGAAGCTGTTGCTATAGAAGC-3'; 3'-GCTTCTATAGCAACAGCTTCA-aatgcag-TGAAGCTGTTGCTATAGAAGC-5', 针对131-151 bp位置; Pyk2-2: 5'-GCTACTTG CCAGAAGACTTCAT-caaga-GTGAAGTCTTCTGGCAAGTAGC-3'; 3'-GGCTACTTGCCAGAAGACTTCAT-aggtc-GTGAAGTCTTCTGGCAAGTAGC-5', 针对401-422 bp位置; Pyk2-3: 5'-GCTGTA CTCACTGCAGATATG-tcaagag-CATATCTGCAGTGAGTACAGC-3'; 3'-GCTGTACTCACTGCAGATATG-agttctc-CATATCTGCAGTGAGTACAGC-5', 针对1 581-1 602 bp位置; Pyk2-4: 5'-GGACATTGCCATGGAGCAAGA-tcaagag-TCTTGCTCCATGGCAATGTCC-3'; 3'- GGACATTGCCATGGAGCAAGA-agttatc-TCTTGCTCCATGGCAATGTCC-5', 针对2 061-2 081 bp位置.
1.2.2 Pyk2的扩增及纯化及重组质粒pGCsi-Pyk2 shRNA的体外构建: 根据GenBank中人Pyk2基因cDNA设计PCR引物, 从人结肠癌手术患者正常切缘组织中提取总RNA, 并用上述引物通过RT-PCR法扩增得到目的基因cDNA片段, 酶切4 h后过柱回收PCR产物. pGCsi载体经HindⅢ酶切5 h, BamHⅠ酶切4 h后加入1 μL去磷酸酶, 反应0.5 h后电泳检测, 切胶回收. 将pGCsi酶切回收后产物和PCR回收后产物用T4连接酶22 ℃连接4 h后, 取3 μL产物热休克法转入感受态细胞DH-5α(全式金公司), 37 ℃倒置培养过夜, 次日挑取单克隆, 接入LB培养基, 37 ℃振荡培养过夜. 提取菌液行PCR和电泳后将PCR鉴定正确的COMF-shRNA载体提取质粒(百泰克公司), 使用pGCsi载体上的序列为引物送测序(华大基因).
1.2.3 脂质体介导的pGCsi-Pyk2 shRNA稳定转染及分选: 脂质体介导的pGCsi-Pyk2 shRNA稳定转染及流式分选: 结肠癌细胞株Lovo体外常规培养并传代维持, 然后取状态良好的细胞以2×108/L接种于6孔板. 待细胞80%汇合时, 采用Lipofectamine 2000介导分别转染pGCsi-Pyk2 shRNA1、pGCsi-Pyk2 shRNA2、pGCsi-Pyk2 shRNA3及带有无义片段的pGCsi载体到Lovo细胞中. 转染空质粒组(pGCsi组), 同时设空白对照组, 只加入等量质脂体, 其余步骤同上, 每组设3复孔. 转染24及72 h后, 荧光显微镜下观察细胞内绿色荧光蛋白表达情况, 评价转染效率. 72 h后收集各组细胞用潮霉素B分选转染和未转染的Lovo细胞.
1.2.4 RT-PCR检测目的基因Pyk2 mRNA在Lovo细胞系中的表达: 针对筛选出来的4组细胞, 选择其中的3组包括Pyk2 shRNA1, Pyk2 shRNA2, Pyk2 shRNA3, 以及转染空载体的Lovo细胞以及转染无义基因的Lovo细胞, 并以未转染载体的Lovo细胞作为对照组. 每组提取1×105个细胞, TRIzol一步法提取细胞总RNA, 先行逆转录48 ℃ 45 min, 并用先前设计的上下游引物, PCR检测Pyk2 mRNA的表达. PCR扩增的条件为: 94 ℃变性2 min, 按下述参数循环40次: 94 ℃变性30 s, 60 ℃退火1 min, 68 ℃延伸2 min; 最后68 ℃延伸7 min, 4 ℃保存. 12%琼脂糖凝胶电泳分析各组PCR产物并拍照保存.
1.2.5 Western blot检测目的蛋白Pyk2在Lovo细胞系中的表达: 选择Pyk2 shRNA1, Pyk2 shRNA2, Pyk2 shRNA3, 并以未转染载体的Lovo细胞, 转染空载体的Lovo细胞以及转染无义基因的Lovo细胞作为对照组. 每组取5×106个细胞, 加100 μL细胞裂解液和2 μL蛋白酶抑制剂, 提取细胞总蛋白. 取50 μg细胞总蛋白, 10% SDS-PAGE电泳, 转硝酸纤维素膜, 1:500稀释的鼠抗人Pyk2单抗, 碱性磷酸酶标记的兔抗鼠二抗, DAB显色, Western blot检测细胞内Pyk2的蛋白表达水平.
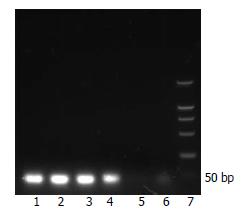
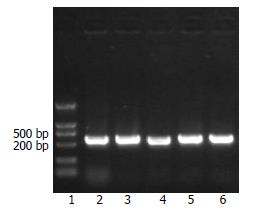
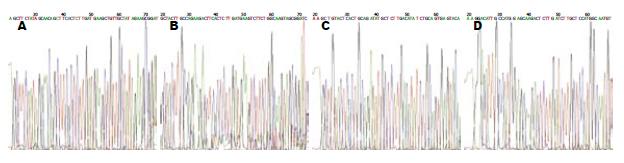
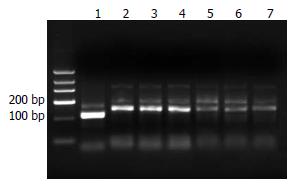
选择Pyk2基因上4个位点, 设计引物行PCR后行12%琼脂糖凝胶电泳分析(图1). 结果显示4个样本的Pyk2均能有效扩增, 片段大小为50 bp左右. 将pGCsi酶切回收后产物和PCR回收后产物分别采用限制性内切酶HindⅢ和BamHⅠ双酶切, 并转入感受态细胞, 提取菌液行PCR并行PCR产物的12%琼脂糖凝胶电泳分析(图2). 结果显示仅转染了空载体的质粒扩增片段为260 bp左右的片段, 而转染了含4种Pyk2片段的质粒的扩增片段均为310 bp左右. 说明空质粒pGCsi中已插入Pyk2 shRNA片段, 且插入方向无误. 选取经酶切鉴定正确的重组质粒进行核苷酸序列测定, 结果表明, 测序序列与GenBank中人Pyk2基因原始序列完全相同, 重组质粒pGCsi-Pyk2 shRNA构建成功(图3).
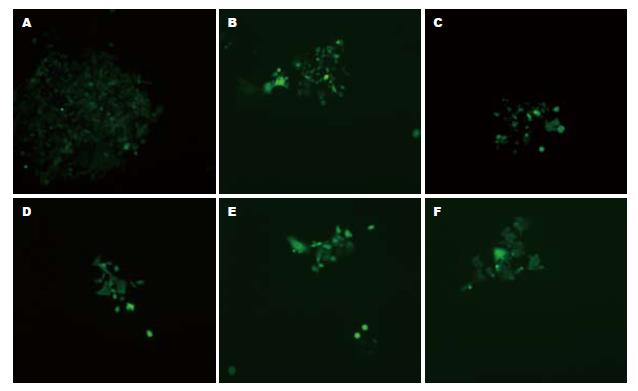
转染24 h后在荧光显微镜下观察可见, 除空白对照组未有明显的绿色荧光外, pGCsi-Pyk2 shRNA1, 2, 3组, 仅转染无义基因片段的载体组和pGCsi空载体组细胞都能发出特异性的绿色荧光(图4), 经潮霉素B分选转染的细胞. 提取RNA后行RT-PCR, 12%琼脂糖凝胶电泳分析(图5). 结果显示未转染载体的Lovo细胞, 转染空载体的Lovo细胞以及转染无义基因的Lovo细胞中Pyk2的表达量明显高于转染Pyk2 shRNA1, 2, 3质粒的Lovo细胞. 说明Pyk2 shRNA能有效地抑制Lovo细胞中Pyk2 mRNA的表达.
选择转染Pyk2 shRNA1, 2, 3的Lovo细胞系, 以未转染载体的Lovo细胞, 转染空载体的Lovo细胞以及转染无义基因的Lovo细胞为对照. 提取细胞总蛋白, 以每个样本100 μg蛋白进行SDS-PAGE, 用Pyk2单抗进行Western blot检测, 以b-actin为内参(图6). 结果显示转染了Pyk2 shRNA1, 2, 3的Lovo细胞中Pyk2蛋白的表达均明显低于对照组中Pyk2蛋白的表达量. 而内参表达量基本一致, 说明转染的Pyk2 shRNA质粒能有效降低Lovo细胞中Pyk2蛋白的表达.
Pyk2是非受体酪氨酸蛋白激酶FAKs家族的成员, 在多种组织中都有Pyk2的表达如在神经组织、造血组织以及小肠、肾、脾、附睾、胃肠、前列腺等[13-17]. Pyk2主要依赖Ca2+浓度[18,19]或PKC参与细胞内的MAPK、PI3K[20,21]或JNK等信号通路转导, 将胞外信息与胞内效应分子联系起来, 催化多种含SH2结构域的底物蛋白磷酸化, 在调节细胞的增生与分化、细胞骨架重组、黏附和迁移以及一些转录因子的活性中发挥作用, 目前的研究发现, 在胃癌、结直肠癌、胰腺癌、乳腺癌、前列腺癌、肺癌等常见肿瘤的发生发展过程的不同阶段发挥着重要的作用[23-33]. 然而, 目前的研究表明, Pyk2在不同部位的肿瘤发生的作用不完全一样. Iiizumi等[25]发现在前列腺癌中, RhoC通过激活Pyk2促进前列腺癌的转移; Vitale等[26]发现Pyk2在cAMP信号通路介导的前列腺癌浸润及核分化中发挥作用; Wang等[30]对Pyk2在前列腺癌细胞中的作用机制进行了研究, 发现Pyk2通过与下游的信号分子ARA55(Hic-5)相互作用并使其磷酸化, 间接改变了雄激素受体的活性, 从而控制前列腺癌细胞的生长; Sun等报道Pyk2通过激活c-Src/ERK通路促进肝细胞癌的增殖和浸润[31,32]. 然而在胃肠道肿瘤中, Pyk2却作为一种抑癌基因而存在, Zhang等[2]报道Pyk2在结直肠癌中低表达, 是结直肠癌的预后指标; Guo等[1]报道Pyk2在胃癌组织中表达明显降低, 其降低程度与胃癌的分期及恶性程度正相关; Cui等[34]报道Pyk2的下游基因Hic-55/ARA55能减少结直肠癌细胞的生长及促进癌细胞的凋亡.
我们构建的Pyk2 shRNA的真核表达载体pGCsi-Pyk2 shRNA经限制性核酸内切酶酶切鉴定、DNA测序证实目的基因Pyk2序列与数据库中相应序列一致, 质粒构建成功; 我们进一步将脂质体介导pGCsi-Pyk2 shRNA质粒稳定转染到Lovo结肠癌细胞中, 通过绿色荧光等实验方法筛选稳定转染的细胞, 然后通过RT-PCR及Western blot方法检测各组细胞中Pyk2的mRNA和蛋白的表达水平差异, 结果表明, 在高表达Pyk2的Lovo结肠癌细胞中转染Pyk2 shRNA后, Pyk2 mRNA和蛋白的表达均明显下降.
目前还没有文献明确报道Pyk2通过何种信号通路介导影响结肠癌的发生发展, 可能与其下游的Hic-5/ARA55及Paxillion等相关, 其在人体的各种肿瘤中的作用也未有定论, 我们构建Pyk2 shRNA质粒, 希望为以后研究Pyk2在结肠癌及其他肿瘤的抗肿瘤治疗中的角色奠定基础.
大量的研究证据表明, Pyk2在调节细胞的增生与分化、细胞骨架重组、黏附和迁移以及一些转录因子的活性中发挥作用, 与人类肿瘤的发生密切相关.
葛海燕, 教授, 同济大学附属第十人民医院普通外科; 王石林, 主任医师, 中国人民解放军空军总医院普通外科.
研究表明Pyk2通过对下游的Hic-5/ARA55, Paxillion等基因的调控, 与降低人类结直肠癌的发病相关, 在结直肠癌中作为一种潜在的抑癌基因发挥作用.
国外已有报道FHIT基因过表达能增加胰腺癌细胞系对外源性凋亡诱导剂的敏感性. 体内实验结果显示FHIT基因的转导能阻止肿瘤的生长, 延长模型小鼠的生存时间, 抑制暴露致癌环境下小鼠体内肿瘤的产生.
本文采用RNA干扰技术体外构建Pyk2 shRNA的真核表达质粒, 并在脂质体的介导下转染进入Lovo结肠癌细胞株, 降低其在Lovo细胞系中的表达, 为研究Pyk2的抑癌作用提供条件.
本文选题合理, 设计得当, 结论可靠, 且具有一定参考价值.
编辑: 李军亮 电编:何基才
| 1. | Guo HJ, Wang X, Liu YC, Wan YL, Yin HF, Li T, Zhu J. [Expression of proline-rich tyrosine kinase-2 (Pyk2) in gastric carcinoma and its significance]. Beijing Daxue Xuebao. 2005;37:261-264. [PubMed] [DOI] |
| 2. | Zhang ZN, Wang X, Li T, Yin HF, Wan YL, Liu YC, Zhu J. [Expression of proline-rich tyrosine kinase-2 in human primary colorectal carcinoma and its prognostic implication]. Zhonghua Waike Zazhi. 2008;46:440-442. [PubMed] [DOI] |
| 6. | 王 鲁平, 杨 善明, 徐 学明, 陈 健, 杨 光之, 张 鲁榕. RNAi抑制结肠癌细胞系DcR3的表达及对癌细胞生长的影响. 世界华人消化杂志. 2008;16:2285-2288. [DOI] |
| 9. | 华 杰, 施 瑞华, 张 红杰, 于 莲珍, 朱 宏, 肖 斌, 张 国新, 郝 波. RNA干扰HIF-1α对血管生成拟态相关基因表达的影响. 世界华人消化杂志. 2009;17:1913-1918. [DOI] |
| 10. | 葛 金华, 朱 月永, 刘 豫瑞, 江 家骥, 董 菁. siRNA降低COX-2基因表达对肝癌细胞系HepG2增殖的影响. 世界华人消化杂志. 2009;17:2244-2250. [DOI] |
| 11. | 倪 志, 刘 南植, 李 林芳, 张 庆, 李 秀梅, 洪 玮. 5-Aza-CdR对人结肠癌Lovo细胞增殖凋亡及抑癌基因RUNX3表达的影响. 世界华人消化杂志. 2006;14:184-188. [DOI] |
| 12. | 倪 志, 鲍 缦夕, 刘 南植, 赵 秋, 覃 华, 杨 彦, 邱 艺坚, 王 婷婷. 结肠癌Lovo细胞RUNX3基因的表达与其增殖及凋亡的关系. 世界华人消化杂志. 2008;16:711-715. [DOI] |
| 13. | Avraham H, Park SY, Schinkmann K, Avraham S. RAFTK/Pyk2-mediated cellular signalling. Cell Signal. 2000;12:123-133. [PubMed] [DOI] |
| 14. | Lipinski CA, Tran NL, Menashi E, Rohl C, Kloss J, Bay RC, Berens ME, Loftus JC. The tyrosine kinase pyk2 promotes migration and invasion of glioma cells. Neoplasia. 2005;7:435-445. [PubMed] [DOI] |
| 15. | Gutenberg A, Brück W, Buchfelder M, Ludwig HC. Expression of tyrosine kinases FAK and Pyk2 in 331 human astrocytomas. Acta Neuropathol. 2004;108:224-230. [PubMed] [DOI] |
| 16. | Eguchi S, Iwasaki H, Inagami T, Numaguchi K, Yamakawa T, Motley ED, Owada KM, Marumo F, Hirata Y. Involvement of PYK2 in angiotensin II signaling of vascular smooth muscle cells. Hypertension. 1999;33:201-206. [PubMed] |
| 17. | Schaller MD. Calcium-dependent Pyk2 activation: a role for calmodulin? Biochem J. 2008;410:e3-e4. [PubMed] [DOI] |
| 18. | Lev S, Moreno H, Martinez R, Canoll P, Peles E, Musacchio JM, Plowman GD, Rudy B, Schlessinger J. Protein tyrosine kinase PYK2 involved in Ca(2+)-induced regulation of ion channel and MAP kinase functions. Nature. 1995;376:737-745. [PubMed] [DOI] |
| 19. | Kohno T, Matsuda E, Sasaki H, Sasaki T. Protein-tyrosine kinase CAKbeta/PYK2 is activated by binding Ca2+/calmodulin to FERM F2 alpha2 helix and thus forming its dimer. Biochem J. 2008;410:513-523. [PubMed] [DOI] |
| 20. | Schlaepfer DD, Hunter T. Focal adhesion kinase overexpression enhances ras-dependent integrin signaling to ERK2/mitogen-activated protein kinase through interactions with and activation of c-Src. J Biol Chem. 1997;272:13189-13195. [PubMed] [DOI] |
| 21. | Tokiwa G, Dikic I, Lev S, Schlessinger J. Activation of Pyk2 by stress signals and coupling with JNK signaling pathway. Science. 1996;273:792-794. [PubMed] [DOI] |
| 22. | Watson JM, Harding TW, Golubovskaya V, Morris JS, Hunter D, Li X, Haskill JS, Earp HS. Inhibition of the calcium-dependent tyrosine kinase (CADTK) blocks monocyte spreading and motility. J Biol Chem. 2001;276:3536-3542. [PubMed] [DOI] |
| 23. | Salgia R, Avraham S, Pisick E, Li JL, Raja S, Greenfield EA, Sattler M, Avraham H, Griffin JD. The related adhesion focal tyrosine kinase forms a complex with paxillin in hematopoietic cells. J Biol Chem. 1996;271:31222-31226. [PubMed] [DOI] |
| 24. | Bagi CM, Roberts GW, Andresen CJ. Dual focal adhesion kinase/Pyk2 inhibitor has positive effects on bone tumors: implications for bone metastases. Cancer. 2008;112:2313-2321. [PubMed] [DOI] |
| 25. | Iiizumi M, Bandyopadhyay S, Pai SK, Watabe M, Hirota S, Hosobe S, Tsukada T, Miura K, Saito K, Furuta E. RhoC promotes metastasis via activation of the Pyk2 pathway in prostate cancer. Cancer Res. 2008;68:7613-7620. [PubMed] [DOI] |
| 26. | Vitale G, Gentilini D, Abbruzzese A, Caraglia M. Pyk2 and Cyr61 at the cross-road of cAMP-dependent signalling in invasiveness and neuroendocrine differentiation of prostate cancer. Cancer Biol Ther. 2009; Mar 11. [Epub ahead of print]. [PubMed] |
| 27. | Behmoaram E, Bijian K, Jie S, Xu Y, Darnel A, Bismar TA, Alaoui-Jamali MA. Focal adhesion kinase-related proline-rich tyrosine kinase 2 and focal adhesion kinase are co-overexpressed in early-stage and invasive ErbB-2-positive breast cancer and cooperate for breast cancer cell tumorigenesis and invasiveness. Am J Pathol. 2008;173:1540-1550. [PubMed] [DOI] |
| 28. | Roelle S, Grosse R, Buech T, Chubanov V, Gudermann T. Essential role of Pyk2 and Src kinase activation in neuropeptide-induced proliferation of small cell lung cancer cells. Oncogene. 2008;27:1737-1748. [PubMed] [DOI] |
| 29. | Zhang S, Qiu X, Gu Y, Wang E. Up-regulation of proline-rich tyrosine kinase 2 in non-small cell lung cancer. Lung Cancer. 2008;62:295-301. [PubMed] [DOI] |
| 30. | Wang X, Yang Y, Guo X, Sampson ER, Hsu CL, Tsai MY, Yeh S, Wu G, Guo Y, Chang C. Suppression of androgen receptor transactivation by Pyk2 via interaction and phosphorylation of the ARA55 coregulator. J Biol Chem. 2002;277:15426-15431. [PubMed] [DOI] |
| 31. | Sahu SN, Nunez S, Bai G, Gupta A. Interaction of Pyk2 and PTP-PEST with leupaxin in prostate cancer cells. Am J Physiol Cell Physiol. 2007;292:C2288-C2296. [PubMed] [DOI] |
| 32. | Sun CK, Ng KT, Sun BS, Ho JW, Lee TK, Ng I, Poon RT, Lo CM, Liu CL, Man K. The significance of proline-rich tyrosine kinase2 (Pyk2) on hepatocellular carcinoma progression and recurrence. Br J Cancer. 2007;97:50-57. [PubMed] [DOI] |
| 33. | Sun CK, Man K, Ng KT, Ho JW, Lim ZX, Cheng Q, Lo CM, Poon RT, Fan ST. Proline-rich tyrosine kinase 2 (Pyk2) promotes proliferation and invasiveness of hepatocellular carcinoma cells through c-Src/ERK activation. Carcinogenesis. 2008;29:2096-2105. [PubMed] [DOI] |
| 34. | Cui W, Wang X, Liu YC, Wan YL, Guo HJ, Zhu J. [Expression of HIC-5/ARA55 in colonrectal cancer and its mechanisms of action]. Beijing Daxue Xuebao. 2006;38:280-283. [PubMed] |
| 35. | Zhang S, Guo D, Jiang L, Zhang Q, Qiu X, Wang E. SOCS3 inhibiting migration of A549 cells correlates with PYK2 signaling in vitro. BMC Cancer. 2008;8:150. [PubMed] [DOI] |
| 36. | Lipinski CA, Tran NL, Viso C, Kloss J, Yang Z, Berens ME, Loftus JC. Extended survival of Pyk2 or FAK deficient orthotopic glioma xenografts. J Neurooncol. 2008;90:181-189. [PubMed] [DOI] |