修回日期: 2010-01-29
接受日期: 2010-02-23
在线出版日期: 2010-03-28
目的: 分离扩增肿瘤干细胞, 并鉴定其生物学性质.
方法: 用无血清培养基培养人胆囊癌GBC-SD细胞得到肿瘤细胞球. 将肿瘤细胞球传代扩增, 并用含血清培养基培养促使其分化; 将肿瘤球和普通GBC-SD细胞分别种入96孔板, MTT检测增殖能力, 并将肿瘤球和普通GBC-SD细胞分别植入裸鼠皮下, 观察移植瘤的形成; 流式细胞术检测CD15s和CD24在肿瘤球细胞和普通GBC-SD细胞中的表达, 筛选细胞表面标志物.
结果: 在无血清培养基中, 胆囊癌细胞可以形成少量的肿瘤细胞球, 并显示很强的自我更新和增殖能力, 含血清环境能够诱导其分化而贴壁生长; 在动物实验中, 肿瘤球细胞较普通GBC-SD细胞显示更强的致瘤能力(80.00% vs 10.00%, P<0.05); 标志物CD15s在肿瘤球的表达较普通GBC-SD细胞明显增高(2.56%±0.38% vs 10.77%±0.93%, t = 18.25, P<0.05).
结论: 人胆囊癌细胞GBC-SD的肿瘤干细胞可以通过无血清培养环境来分离和扩增, CD15s可能为其细胞表面标志物.
引文著录: 石程剑, 秦仁义, 王敏, 田锐, 张志发, 宫伟强. 无血清培养胆囊癌GBC-SD细胞形成肿瘤细胞球的鉴定. 世界华人消化杂志 2010; 18(9): 865-870
Revised: January 29, 2010
Accepted: February 23, 2010
Published online: March 28, 2010
AIM: To isolate and expand cancer stem cells in human gallbladder carcinoma cell line GBC-SD and to identify their biological properties.
METHODS: GBC-SD cells were cultured in serum-free conditions to derive tumor spheres. Tumor spheres were then expanded and cultured in serum-containing medium to permit their differentiation. The proliferative capacity of tumor sphere-forming cells was tested by methyl thiazoly tetrazolium (MTT) assay. The tumorigenicity of tumor sphere-forming cells was evaluated using animal experiments. The expression of CD15s and CD24 on the surface of tumor sphere-forming cells was detected by flow cytometry.
RESULTS: Small number of floating tumor spheres were isolated and expanded in serum-free conditions. These tumor spheres attached to the bottom of culture plates and began to differentiate in serum-containing medium. The proliferation and xenograft tumorigenicity of tumor sphere-forming cells (80.00% vs 10.00%, P < 0.05) significantly increased compared with those cultured in serum-containing conditions. The percentage of CD15s-bearing cell population was significantly higher in tumor spheres than in the common GBC-SD cells (2.56% ± 0.38% vs 10.77% ± 0.93%, t = 18.25, P < 0.05).
CONCLUSION: The cancer stem cells in GBC-SD cell line can be isolated and expanded in serum-free conditions. CD15s may be a cell surface marker for these cancer stem cells.
- Citation: Shi CJ, Qin RY, Wang M, Tian R, Zhang ZF, Gong WQ. Identification of tumor spheres from human gallbladder carcinoma GBC-SD cells cultured in serum-free medium. Shijie Huaren Xiaohua Zazhi 2010; 18(9): 865-870
- URL: https://www.wjgnet.com/1009-3079/full/v18/i9/865.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i9.865
肿瘤干细胞理论认为, 肿瘤中存在肿瘤干细胞, 他们具有自我更新和无限增殖能力, 是肿瘤发生、发展、治疗后复发和转移的根源[1-3]. 到目前, 已经在白血病、脑肿瘤、乳腺癌、胰腺癌、前列腺癌、卵巢癌、尤文肉瘤等[4-10]多种恶性肿瘤中分离出肿瘤干细胞. 我们用无血清培养基成功从人胆囊癌GBC-SD细胞中分离扩增出肿瘤干细胞并进行生物学研究, 现报道如下.
DMEM/F12(1:1)培养基(Gibco); B27添加剂(Gibco); 人表皮生长因子(EGF, Pe-proTech); 人碱性成纤维生长因子(bFGF, Pepro-Tech); L-谷氨酰胺(Sigma); 特级胎牛血清(Hy-clone); 抗CD15s-FITC(Santa Cruz); 抗CD24-PE(BD); 人胆囊癌细胞系GBC-SD购自上海中国科学院研究所; 实验用裸鼠由华中科技大学同济医学院实验动物中心提供.
1.2.1 细胞培养: 人胆囊癌细胞系GBC-SD, 用含100 mL/L胎牛血清、100 kU/L青霉素和100 kU/L链霉素的DMEM/F12培养基, 在37 ℃、50 mL/L CO2饱和湿度条件下培养, 0.2 g/L胰蛋白酶的消化、传代, 实验选用对数生长期的细胞.
1.2.2 肿瘤球的培养和扩增: 取对数生长期的细胞消化后, PBS洗2次, 用无血清培养基悬浮培养, 无血清培养基由DMEM/F12(1:1)、B27(1:50)、EGF(20 µg/L)、bFGF(10 mg/L)、LIF(10 mg/L)和L-谷氨酰胺(2 mmol/L)组成. 每天加入0.25 mL无血清培养基, 观察细胞球形成的过程, 拍照并记录. 10 d后收集细胞球吹散后按1:2传代, 以后每天加入0.25 mL的培养基, 7 d传代续培养扩增.
1.2.3 肿瘤球的分化: 将生长良好的肿瘤球置入含100 mL/L血清的DMEM/F12中培养, 观察细胞的生长情况, 待细胞完全贴壁后, 应用免疫细胞化学法检测胆囊癌的分化标志物CD44s.
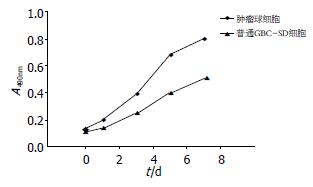
1.2.4 细胞体外增殖能力检测: 将肿瘤球和普通GBC-SD细胞制成细胞密度为1 000个活细胞/100 µL的单细胞悬液, 接种于96孔板, 每孔加液100 µL, 并每孔补加100 µL继续培养, 分别在培养的0、1、3、5、7 d进行MTT比色试验. 每孔加入MTT溶液(5 g/L)20 µL, 37 ℃孵育4 h后, 每孔加入DMSO 150 µL震荡, 选择490 nm波长, 在酶联免疫检测仪测定各孔的吸光度(A)值, 以时间为横轴, A值为纵轴, 绘制细胞生长曲线.
1.2.5 动物体内成瘤实验: 将肿瘤球和普通GBC-SD细胞消化吹散制成单细胞悬液, 用不含血清的PBS洗2次后, PBS重悬, 按1×104数量级分别注入裸鼠右腹部皮下, 观察移植瘤形成时间及生长速度的情况. 自肉眼可观察到移植瘤形成持续观察6 wk, 测量移植瘤的大小, 并处死、解剖裸鼠取出肿瘤.
1.2.6 免疫组织化学: 将裸鼠皮下移植瘤甲醛固定, 制成切片行HE染色, 部分行脱蜡、水化及抗原修复后, 按照说明书应用免疫组织化学SP法检测胆囊癌敏感标志物CA19-9的表达.
1.2.7 流式细胞术检测肿瘤干细胞标志物的表达: 将肿瘤球和普通GBC-SD细胞制成单细胞悬液, 细胞PBS洗2次后, 用含20 mL/L胎牛血清的PBS重悬, 调整细胞密度为1×106/mL, 分别标上肿瘤干细胞标志物的抗体: 抗CD15s-FITC和抗CD24-PE, 冰上避光孵育40 min后, PBS洗2次, 上流式检测其表达.
统计学处理 应用SPSS11.0软件处理数据, 标志物表达差异采用两样本t检验, P<0.05为差异有统计学意义.
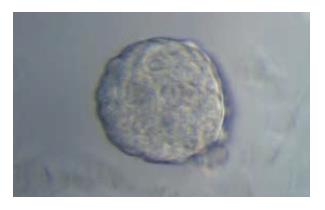
胆囊癌细胞在无血清培养基中培养48 h后, 少部分细胞贴壁, 大部分细胞不贴壁, 可见少量细胞球形成, 细胞数目4-8个不等, 悬浮生长, 细胞间连接较紧密. 随着时间的延长, 细胞球渐增大, 细胞数目增多, 培养5-7 d后, 可观察到数十个细胞组成的细胞球, 细胞呈椭圆形或者类圆形, 随着时间的延长生长速度渐减慢(图1). 经吹散后继续在无血清培养基中培养, 部分细胞仍可继续形成新的肿瘤球, 且在相同细胞密度培养的条件下, 肿瘤球细胞形成的肿瘤球较普通GBC-SD细胞形成的肿瘤球数目明显增多, 但仍有相当一部分的肿瘤球细胞未能形成新的肿瘤球.
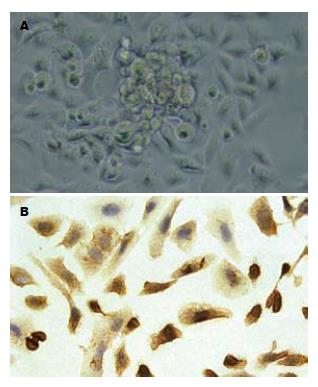
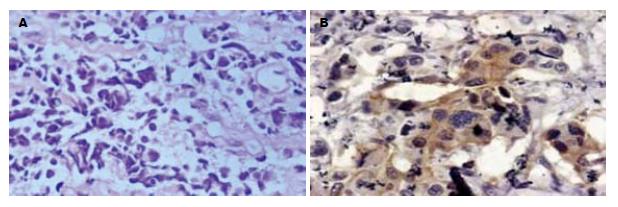
含血清培养基培养6 h时候后, 肿瘤球周边可见细胞贴壁, 贴壁细胞呈梭形, 随着时间的延长, 贴壁细胞增多, 肿瘤渐缩小(图2A), 培养48 h后, 组成肿瘤球的细胞基本上全部贴壁, 肿瘤球消失. 经免疫细胞化学检测, 贴壁细胞明显表达胆囊癌分化相关标志物CD44s(图2B).
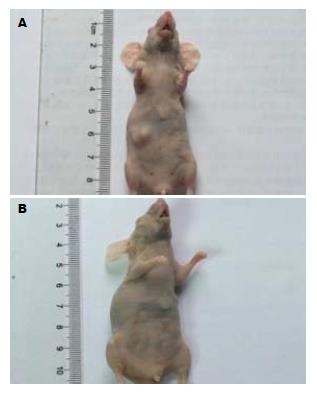
接种肿瘤球细胞裸鼠在5 wk后可观察到形成明显的移植瘤, 成瘤率80.00%(8/10), 而接种普通GBC-SG细胞的裸鼠移植瘤形成不明显,成瘤率仅10.00%(1/10)(图4), 差异有统计学意义(8/10 vs 1/10, P<0.05). 移植瘤经HE染色, 可见细胞核大, 深染, 细胞排列紊乱, 经免疫组织化学检测, 肿瘤球细胞形成的移植瘤明显表达胆囊癌敏感标志物CA19-9(图5).
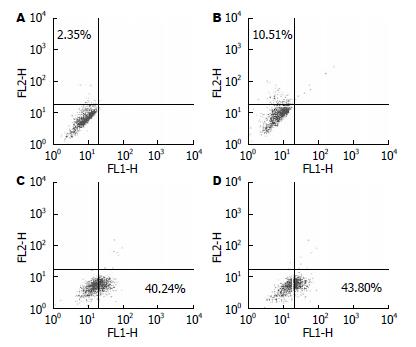
CD15s在普通GBC-SD细胞和肿瘤球细胞中阳性率的差异有统计学意义(2.56%±0.38% vs 10.77%±0.93%, t = 18.25, P<0.05), CD24阳性细胞率差异无统计学意义(t = 1.641, P>0.05, 图6).
胆囊癌是胆道系统最常见的恶性肿瘤, 其难以早期发现并极易发生侵袭转移, 确诊时多数患者因处于晚期而丧失了最佳手术时机, 虽然近年来胆囊癌手术切除范围不断扩大, 其总体5年生存率仍在5%左右[11,12]. 临床实践表明, 目前的手术治疗方法几乎达到了极限, 放疗、化疗等综合治疗仍是有望提高患者生存率的重要手段. 但是遗憾的是, 胆囊癌对目前的各种化疗药物都不敏感. 近来的研究表明, 肿瘤的发生、发展和转移与肿瘤干细胞相关, 这小群细胞具有自我更新、耐受放化疗、高致瘤性等特性, 是治疗后肿瘤复发的原因[13,14]. 因此, 研究胆囊癌干细胞, 阐明其特殊的生物学特性是有效治疗胆囊癌的关键之一.
由于肿瘤干细胞在肿瘤组织中含量很少且分离困难, 因而对其生物学特性的研究具有很大难度. 在长期的研究中, 人们观察到含EGF、bFGF、LIF的无血清培养基可以促进正常干细胞的体外扩增而不发生分化[15], bFGF可以促进神经干细胞进行不对称分裂, 从而实现自我更新并产生具有对EGF反应性的干细胞, 而EGF反应性的干细胞在EGF作用下, 通过有丝分裂进行自我扩增, 并通过不对称分裂来生成具有对bFGF反应性的神经干细胞. LIF有助于保持干细胞的未分化状态, 并延长干细胞体外扩增时间. Singh等[5]用无血清培养基从神经上皮肿瘤中培养出细胞球, 并证实其具有肿瘤干细胞的特性, 在对结肠癌、骨肉瘤、肺癌、黑色素瘤、皮肤癌等肿瘤干细胞的研究中[16-20], 人们也观察到通过无血清培养可以分离扩增出肿瘤干细胞. 据以上研究, 可以通过选择合适的培养基培养肿瘤细胞球来扩增肿瘤干细胞, 并通过免疫学或者利用细胞功能, 将肿瘤干细胞进一步分离纯化. 在此研究中, 我们用含有bFGF、EGF、B27和LIF的培养基来培养胆囊癌细胞, 观察到大部分胆囊癌细胞不能耐受无血清培养基的环境而停止增殖并出现相继凋亡, 少部分细胞在培养48 h后渐出现分裂增殖, 随着培养时间的延长渐形成细胞球并不断增大, 经吹散传10代以上仍可以形成相同的肿瘤球, 且在相同初始细胞密度的条件下, 肿瘤球细胞形成的肿瘤球较由非肿瘤球GBC-SD细胞形成的肿瘤球数目明显增多, 但仍有相当一部分的肿瘤球细胞未能形成新的肿瘤球. 经过在含血清的环境中培养, 肿瘤球细胞出现贴壁生长并基本上均表达胆囊癌分化标志物CD44s[21], 说明肿瘤球中未分化的细胞发生分化. 此外, 高致瘤性是肿瘤干细胞的另一主要特征, 而高致瘤性主要从两个方面来评价[22], 一是肿瘤干细胞的体外克隆形成能力, 另外是肿瘤干细胞在免疫缺陷动物体内形成肿瘤的能力. 在此研究中我们观察到, 来自肿瘤球的细胞体外增殖能力明显高于普通GBC-SD细胞, 此外, 动物实验结果也显示肿瘤球细胞具有更强的形成移植瘤能力, 这些均支持肿瘤球中富含有肿瘤干细胞的设想.
在肿瘤干细胞的研究中, 难点首先在于对肿瘤干细胞的识别, 由于在同一肿瘤中, 肿瘤干细胞和其他普通的肿瘤细胞的形态和大小没有明显区别, 无法从形态学上辨别. 目前很多研究主要通过细胞表面标志物来识别和分离肿瘤干细胞, 如前列腺癌干细胞表达CD44[23]、肝癌干细胞表达CD90[24]、胰腺癌[25]和甲状腺癌[26]干细胞表达CD133等. 为了检测胆囊癌GBC-SD中高致瘤细胞的细胞表型, 我们选择CD15s和CD24蛋白来研究, 近来研究表明CD15s和肿瘤的发展、预后相关[27-30], CD24被证实为多种肿瘤干细胞[6,7]的特异性表面标志. 本实验通过流式分析显示, CD15s+在肿瘤球细胞中的比例明显高于普通细胞, 因而认为CD15s可能为胆囊癌肿瘤干细胞的细胞表面标记.
据以上研究, 我们认为胆囊癌细胞系GBC-SD中存在肿瘤干细胞, 可以通过无血清培养基培养形成肿瘤细胞球的方法得以一定程度的扩增, 为进一步的分离和鉴定提供条件, CD15s可能为其特异性表面标记. 本研究为胆囊癌肿瘤干细胞的进步一研究奠定了基础.
原发性胆囊癌是胆道系统最常见的恶性肿瘤, 恶性程度高, 目前的手术治疗方法几乎达到了极限, 术后易复发, 而对目前的各种化疗药物也都不敏感, 预后差. 近来的研究表明, 肿瘤的发生、发展和转移与肿瘤中的一小亚群细胞-肿瘤干细胞相关, 这小群细胞具有自我更新和分化潜能、耐受放化疗、高致瘤性等特性, 是治疗后肿瘤复发的原因. 因此, 通过对胆囊癌干细胞的研究, 阐明其生物学特性并研究其维持机制, 是攻克胆囊癌的关键所在之一.
吴泰璜, 教授, 山东省立医院肝胆外科.
自1997年Bonnet等从白血病细胞中分离出肿瘤干细胞后, 目前人们已经相继在多种实体肿瘤中分离出肿瘤干细胞, 并进一步研究其生物学特性的维持机制. 目前已经证实细胞信号通路、microRNA等在肿瘤干细胞生物学特性的维持中其重要作用, 有望成为治疗的靶点.
本研究利用在干细胞环境中扩增胆囊癌干细胞, 并根据细胞表面标志物表达的变化来发现可能的肿瘤干细胞标志物, 可有效地避开对非特异标志物的验证, 并首次以CD15s为肿瘤干细胞标志物来研究.
标志物CD15s在肿瘤球细胞中表达上调, 提示可能为特异标志物, 可尝试用来分离细胞亚群并进行生物学鉴定.
肿瘤干细胞: 肿瘤中具有无限自我更新能力, 能产生异质性肿瘤细胞并具有极强致瘤能力的细胞.
本文条理清晰, 分析得当, 有自己的见解, 研究有一定意义.
编辑: 李军亮 电编:吴鹏朕
| 1. | Reya T, Morrison SJ, Clarke MF, Weissman IL. Stem cells, cancer, and cancer stem cells. Nature. 2001;414:105-111. [PubMed] [DOI] |
| 2. | Scadden DT. Cancer stem cells refined. Nat Immunol. 2004;5:701-703. [PubMed] [DOI] |
| 3. | O'Brien CA, Kreso A, Dick JE. Cancer stem cells in solid tumors: an overview. Semin Radiat Oncol. 2009;19:71-77. [PubMed] [DOI] |
| 4. | Bonnet D, Dick JE. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat Med. 1997;3:730-737. [PubMed] [DOI] |
| 5. | Singh SK, Clarke ID, Terasaki M, Bonn VE, Hawkins C, Squire J, Dirks PB. Identification of a cancer stem cell in human brain tumors. Cancer Res. 2003;63:5821-5828. [PubMed] |
| 6. | Al-Hajj M, Wicha MS, Benito-Hernandez A, Morrison SJ, Clarke MF. Prospective identification of tumorigenic breast cancer cells. Proc Natl Acad Sci U S A. 2003;100:3983-3988. [PubMed] [DOI] |
| 7. | Li C, Heidt DG, Dalerba P, Burant CF, Zhang L, Adsay V, Wicha M, Clarke MF, Simeone DM. Identification of pancreatic cancer stem cells. Cancer Res. 2007;67:1030-1037. [PubMed] [DOI] |
| 8. | Collins AT, Berry PA, Hyde C, Stower MJ, Maitland NJ. Prospective identification of tumorigenic prostate cancer stem cells. Cancer Res. 2005;65:10946-10951. [PubMed] [DOI] |
| 9. | Zhang S, Balch C, Chan MW, Lai HC, Matei D, Schilder JM, Yan PS, Huang TH, Nephew KP. Identification and characterization of ovarian cancer-initiating cells from primary human tumors. Cancer Res. 2008;68:4311-4320. [PubMed] [DOI] |
| 10. | Suvà ML, Riggi N, Stehle JC, Baumer K, Tercier S, Joseph JM, Suvà D, Clément V, Provero P, Cironi L. Identification of cancer stem cells in Ewing's sarcoma. Cancer Res. 2009;69:1776-1781. [PubMed] [DOI] |
| 11. | Levy AD, Murakata LA, Rohrmann CA Jr. Gallbladder carcinoma: radiologic-pathologic correlation. Radiographics. 2001;21:295-314; questionnaire, 549-555. [PubMed] |
| 12. | Jemal A, Siegel R, Ward E, Murray T, Xu J, Thun MJ. Cancer statistics, 2007. CA Cancer J Clin. 2007;57:43-66. [PubMed] [DOI] |
| 13. | Wicha MS, Liu S, Dontu G. Cancer stem cells: an old idea--a paradigm shift. Cancer Res. 2006;66:1883-1890; discussion 1895-1896. [PubMed] |
| 14. | Milas L, Hittelman WN. Cancer stem cells and tumor response to therapy: current problems and future prospects. Semin Radiat Oncol. 2009;19:96-105. [PubMed] [DOI] |
| 15. | Martens DJ, Tropepe V, van Der Kooy D. Separate proliferation kinetics of fibroblast growth factor-responsive and epidermal growth factor-responsive neural stem cells within the embryonic forebrain germinal zone. J Neurosci. 2000;20:1085-1095. [PubMed] |
| 16. | Ricci-Vitiani L, Lombardi DG, Pilozzi E, Biffoni M, Todaro M, Peschle C, De Maria R. Identification and expansion of human colon-cancer-initiating cells. Nature. 2007;445:111-115. [PubMed] [DOI] |
| 17. | Wilson H, Huelsmeyer M, Chun R, Young KM, Friedrichs K, Argyle DJ. Isolation and characterisation of cancer stem cells from canine osteosarcoma. Vet J. 2008;175:69-75. [PubMed] [DOI] |
| 18. | Eramo A, Lotti F, Sette G, Pilozzi E, Biffoni M, Di Virgilio A, Conticello C, Ruco L, Peschle C, De Maria R. Identification and expansion of the tumorigenic lung cancer stem cell population. Cell Death Differ. 2008;15:504-514. [PubMed] [DOI] |
| 19. | Fang D, Nguyen TK, Leishear K, Finko R, Kulp AN, Hotz S, Van Belle PA, Xu X, Elder DE, Herlyn M. A tumorigenic subpopulation with stem cell properties in melanomas. Cancer Res. 2005;65:9328-9337. [PubMed] [DOI] |
| 20. | Toma JG, McKenzie IA, Bagli D, Miller FD. Isolation and characterization of multipotent skin-derived precursors from human skin. Stem Cells. 2005;23:727-737. [PubMed] [DOI] |
| 21. | Yanagisawa N, Mikami T, Mitomi H, Saegusa M, Koike M, Okayasu I. CD44 variant overexpression in gallbladder carcinoma associated with tumor dedifferentiation. Cancer. 2001;91:408-416. [PubMed] [DOI] |
| 23. | Simon RA, di Sant'Agnese PA, Huang LS, Xu H, Yao JL, Yang Q, Liang S, Liu J, Yu R, Cheng L. CD44 expression is a feature of prostatic small cell carcinoma and distinguishes it from its mimickers. Hum Pathol. 2009;40:252-258. [PubMed] [DOI] |
| 24. | Yang ZF, Ho DW, Ng MN, Lau CK, Yu WC, Ngai P, Chu PW, Lam CT, Poon RT, Fan ST. Significance of CD90+ cancer stem cells in human liver cancer. Cancer Cell. 2008;13:153-166. [PubMed] [DOI] |
| 25. | Hermann PC, Huber SL, Herrler T, Aicher A, Ellwart JW, Guba M, Bruns CJ, Heeschen C. Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer. Cell Stem Cell. 2007;1:313-323. [PubMed] [DOI] |
| 26. | Zito G, Richiusa P, Bommarito A, Carissimi E, Russo L, Coppola A, Zerilli M, Rodolico V, Criscimanna A, Amato M. In vitro identification and characterization of CD133(pos) cancer stem-like cells in anaplastic thyroid carcinoma cell lines. PLoS One. 2008;3:e3544. [PubMed] [DOI] |
| 27. | Günther K, Dworak O, Remke S, Pflüger R, Merkel S, Hohenberger W, Reymond MA. Prediction of distant metastases after curative surgery for rectal cancer. J Surg Res. 2002;103:68-78. [PubMed] [DOI] |
| 28. | Paganuzzi M, Bobbio B, Marroni P, Filiberti R, Secco GB, Grossi CE. Prognostic role of serum sialyl Lewisx (CD15s) in colorectal cancer. Oncology. 2003;65:52-59. [PubMed] [DOI] |
| 29. | Ellmark P, Belov L, Huang P, Lee CS, Solomon MJ, Morgan DK, Christopherson RI. Multiplex detection of surface molecules on colorectal cancers. Proteomics. 2006;6:1791-1802. [PubMed] [DOI] |
| 30. | Ratei R, Karawajew L, Schabath R, Ehrfeldt A, Grunert F, Ludwig WD. Differential expression of the carcinoembryonic antigen-related cell adhesion molecules panCD66, CD66a, CD66c and of sialyl-Lewis x (CD15s) on blast cells of acute leukemias. Int J Hematol. 2008;87:137-143. [PubMed] [DOI] |