修回日期: 2010-01-05
接受日期: 2010-01-19
在线出版日期: 2010-03-08
目的: 研究HH胶囊体外抗乙型肝炎病毒的作用及其对抗病毒蛋白2'5'-寡腺苷酸合成酶(2'5'-Oligoadenylate Synthetase, 2'5'-OAS)、RAN依赖蛋白激酶(RAN-dependent protein kinase, PKR)的影响.
方法: HepG2.2.15是目前最常用的乙型肝炎病毒感染的体外实验模型, 将细胞随机分为空白对照组、阳性对照组(3TC)、不同浓度的HH胶囊组. 用CCK-8检测药物细胞毒性, 酶联免疫法检测乙型肝炎病毒表面抗原(HBsAg)和乙型肝炎病毒e抗原(HBeAg); 荧光定量聚合酶链反应法检测乙型肝炎病毒脱氧核糖核酸(HBV DNA); 用Western blot、荧光定量PCR方法分别检测细胞内抗病毒蛋白2'5'-OAS、PKR及其mRNA水平.
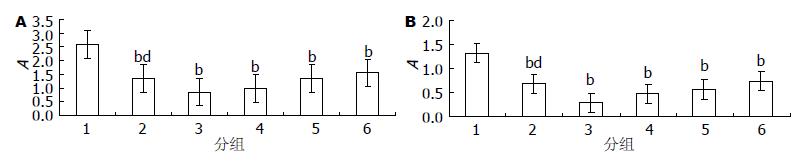
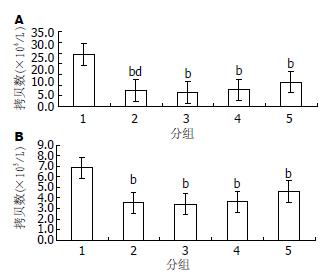
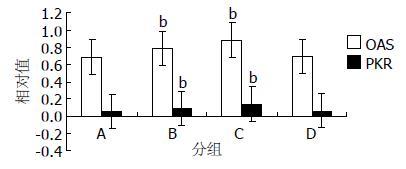
结果: HH胶囊的TC50是2.11 g/L、312.00 mg/L、156.00 mg/L、78.00 mg/L、39.00 mg/L HH胶囊均可以降低细胞外HBeAg(0.285±0.007, 0.462±0.008, 0.565±0.009, 0.733±0.008 vs 1.334±0.007)和HbsAg(0.834±0.008, 1.021±0.011, 1.347±0.017, 1.548±0.015 vs 2.593±0.008)水平, 312.00 mg/L、156.00 mg/L HH胶囊均可以减低细胞内乙型肝炎病毒DNA[(3.423±0.110)×109 copies/L, (3.640±0.082)×109 copies/L vs (6.857±0.060)×109copies/L]、细胞外乙型肝炎病毒DNA(6 547±87、7 710±62 vs 24 300±200), 312.00 mg/L HH胶囊可以增加细胞内OAS mRNA(0.885±0.038 vs 0.688±0.068)、PKR mRNA(0.139±0.06 vs 0.058±0.005)表达及其OAS、PKR蛋白水平.
结论: HH胶囊具有良好的抗乙型肝炎病毒作用, 推测可能与增加细胞内OAS、PKR及其mRNA水平有关.
引文著录: 张传涛, 廖志航, 吴疆, 范昕建, 孟宪丽, 陈东辉. HH胶囊体外抗乙型肝炎病毒的作用及其机制. 世界华人消化杂志 2010; 18(7): 652-656
Revised: January 5, 2010
Accepted: January 19, 2010
Published online: March 8, 2010
AIM: To investigate the anti-hepatitis B virus effects of HH Capsules in HepG 2.2.15 cell line and explore potential mechanisms involved.
METHODS: HepG2.2.15 cells were randomly divided into blank control group, positive control group (lamivudine), and HH Capsule group. The HH Capsule group was further divided into ten subgroups according to the concentration of HH Capsules used. Drug toxicity was detected using Cell Counting Kit-8 (CCK-8). Hepatitis B virus surface antigen (HBsAg) and hepatitis B virus e antigen (HBeAg) were detected by enzyme-linked immunosorbent assay. Hepatitis B virus DNA (HBV DNA) was measured by fluorescence-based quantitative polymerase chain reaction (PCR). The expression of 2′5′-oligoadenylate synthetase (2′5′-OAS) and RNA-dependent protein kinase (PKR) mRNAs and proteins was detected by fluorescence-based quantitative PCR and Western blot, respectively.
RESULTS: The half toxic concentration (TC50) of HH Capsules is 2.113 g/L. HH Capsules at concentrations of 312, 156, 78 and 39 mg/L could reduce the quantity of extracellular HbsAg (0.834 ± 0.008, 1.021 ± 0.011, 1.347 ± 0.017 and 1.548 ± 0.015 vs2.593 ± 0.008) and HbeAg (0.285 ± 0.007, 0.462 ± 0.008, 0.565 ± 0.009 and 0.733 ± 0.008 vs 1.334 ± 0.007). HH Capsules at concentrations of 312 and 156 mg/L could reduce intracellular HBV DNA [(3.423 ± 0.110)×109 copies/L and (3.640 ± 0.082)×109 copies/L vs (6.857 ± 0.060)×109 copies/L] and extracellular HBV DNA levels (6 547 ± 87 and 7 710 ± 62 vs 24 300 ± 200). HH Capsules at a concentration of 312 mg/L could up-regulate the expression of intracellular OAS (0.885 ± 0.038 vs0.688 ± 0.068) and PKR mRNAs (0.139 ± 0.06 vs 0.058 ± 0.005) and proteins.
CONCLUSION: HH Capsules can exert anti-hepatitis B virus effects in vitro perhaps by up-regulating the expression of OAS and PKR mRNAs and proteins.
- Citation: Zhang CT, Liao ZH, Wu J, Fan XJ, Meng XL, Chen DH. Anti-hepatitis B virus effects of HH Capsules in vitro and potential mechanisms involved. Shijie Huaren Xiaohua Zazhi 2010; 18(7): 652-656
- URL: https://www.wjgnet.com/1009-3079/full/v18/i7/652.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i7.652
乙型肝炎病毒(hepatitis B virus, HBV)呈世界性流行, 我国是慢性病毒性乙型肝炎(简称慢性乙型肝炎)的高发地区, 慢性乙型肝炎严重危害我国人民的生命健康, 而对于慢性乙型肝炎的治疗, 目前仍无理想的药物及方法, 因此寻找安全有效的抗HBV药物十分迫切. HepG2.2.15细胞是一种转染了人HBV DNA的人肝癌细胞株, 能持续而稳定地表达HBsAg、HBeAg、HBV DNA, 是目前筛选抗HBV新药的最常用细胞模型. HH胶囊是我们长期临床治疗慢性乙型肝炎的经验方, 我们在国家"十一五"科技支撑计划项目资助下对HH胶囊进行了一系列的新药开发研究, 现将HH胶囊体外抗HBV作用及部分作用机制研究结果报道如下.
HepG2.2.15细胞由四川大学华西医院生物治疗国家重点实验室保种, 细胞接种在含100 mL/L胎牛血清的1640培养液中, 在37 ℃、50 mL/L CO2、95%湿度的培养箱中培养, 实验过程中每周用G418筛选. 拉米夫定(3TC, 葛兰素史克)用二亚基亚砜(DMSO)溶解于培养液, 稀释成不同浓度[1]. HH胶囊由黄连6 g、虎杖15 g、赶黄草15 g、甘草5 g等组成, 由四川省中医药科学院制备水、醇提取物后, 用DMSO溶解于培养液[2]. CCK-8试剂盒(碧云天生物), 原装特优级胎牛血清(赛黙飞世尔生物), G418(Sigma), RPMI 1640培养基干粉(Gibco), 基因扩增仪(Bio-Rad), CO2培养箱(Sanyo), 垂直板电泳转移装置(上海天能生物), 电泳仪(北京君意), PVDF膜(Whatman), 化学发光试剂(ShineGene), OAS/PKR一抗(Santa Cruz), 内参一抗(Santa Cruz).
1.2.1 药物毒性实验: 将浓度为1.0×108/L的细胞悬液接种于96孔板, 细胞分为3个浓度3TC(300.00、200.00、100.00 mg/L)、10个浓度HH组(5.00 g/L、2.50 g/L、1.25 g/L、625.00 mg/L、312.00 mg/L、156.00 mg/L、78.00 mg/L、39.00 mg/L、20.00 mg/L、10.00 mg/L)、0.1% DMSO、空白组, 每组4复孔, 每孔100 μL, 48 h换液1次, 分别在第48、96、144 h进行细胞毒性实验[3], 用酶标仪读取A值, 波长450/650 nm. 计算药物对细胞抑制百分率(%) = (对照孔平均A值-试验孔平均平均A值)/对照孔平均A值×100%, 半数毒性浓度(TC50)计算公式[4]: TC50 = Antilog[B+(50-<50%抑制百分率)/(>50%抑制百分率-<50%抑制百分率)×C], 式中C = A-B, A = log(>50%药物浓度), B = log(<50%药物浓度).
1.2.2 HH胶囊的药效学实验: 将细胞悬液接种于24孔板, 分为DMSO组、3TC组(200.00 mg/L)、4个HH浓度组(312.00、156.00、78.00、39.00 mg/L), 每组4复孔, 每孔600 μL, 48 h换液1次, 144 h时分别收集细胞上清及细胞, -80 ℃冻存, 待测.
1.2.3 上清HBsAg、HBeAg检测: 采用酶联免疫检测试剂盒(上海科华生物)检测上清HBsAg、HBeAg, 严格按试剂盒说明书操作. 药物对HBsAg/HBeAg的抑制百分率 = (A对照孔-A实验孔)/A对照孔×100. 50%抑制浓度(IC50)是对HBsAg、HBeAg抑制率为50%时浓度.
1.2.4 培养上清中HBV DNA检测: 采用荧光定量PCR检测试剂盒(达安基因)检测上清中HBV DNA, 严格按试剂盒说明书操作. 药物对HBV DNA的抑制率 = (对照组HBV DNA拷贝数-实验组HBV DNA拷贝数)/对照组HBV DNA拷贝数×100%.
1.2.5 细胞内中HBV DNA检测: 采用DNA提取试剂盒(天根生化)提取细胞内总DNA, 采用荧光定量PCR检测试剂盒(达安基因)检测细胞内HBV DNA, 严格按试剂盒说明书操作. 药物对HBV DNA的抑制率 = (对照组HBV DNA拷贝数-实验组HRV DNA拷贝数)/对照组HBV DNA拷贝数×100%.
以治疗指数(TI)评价药物临床应用前景, TI = TC50/IC50, TI>2为有效低毒, 2>TI>1为低效有毒, TI<1为有毒性作用. 以药物作用第144 h的TI为标准.
1.2.6 HH胶囊作用机制研究实验: 将浓度1.0×108/L的细胞悬液接种于12孔板, 分为DMSO组、3TC组(200.00 mg/L)、2个HH浓度组(312 mg/L、78 mg/L), 每组3复孔, 每孔1 000 μL, 48 h换液1次, 144 h时收集细胞, -80 ℃冻存, 待测.
1.2.7 细胞内OAS、PKR mRNA的荧光定量PCR检测: 根据互联网生物信息资源辅助设计引物序列为: OASF: CAAGGTGGTAAAGGGTGGCT; OASR: CAAACTTCACGGAAAATGCTCT, 191 bp; PKRF: TAACGAGAAGGCGGAGCG; PKRR: CCATTTGGATGAAAAGGCACT, 197 bp; TRIzol一步法提取细胞总RNA, 取2 μg细胞总RNA为模板进行逆转录, 行PCR反应时, 取1 μL逆转录得到的cDNA为模板, 待测基因引物浓度按30 pmol/50 μL体系进行扩增, PCR扩增条件为94 ℃ 4 min; 94 ℃ 0.5 min; 60 ℃ 0.5 min; 72 ℃ 0.5 min, 循环35次; 72 ℃检测信号.
1.2.8 细胞内OAS、PKR蛋白Western blot检测[5]: 待测细胞用蛋白质裂解液裂解30 min, 13 000 r/min, 4 ℃离心20 min, 取含50 μg总蛋白的上清液以12% SDS-PAGE凝胶电泳, 过夜转膜后, 在摇床上室温封闭4 h, 膜置于含1:500一抗或1:3 000内参一抗的封闭液孵育3 h, Tris碱-氯化钠-吐温20洗液(TBST)洗膜3次, 1:5 000浓度加入二抗孵育1.5 h, TBST洗膜3次, 将化学发光试剂加于膜上, 立即在暗室曝光、洗片, 对胶片进行扫描, 然后用UVP凝胶图像处理系统Labworks4.6软件分析目的条带的灰度值.
统计学处理 采用SPSS13.0统计分析软件, 不同组之间进行t检验分析, 数据用mean±SD表示.
3个浓度3TC、0.1% DMSO对2.2.15细胞均无细胞毒性, 但HH胶囊对细胞有一定细胞毒性, 且毒性具有浓度依赖性, HH胶囊的TC50是2.11 g/L.
312.00、156.00、78.00、39.00 mg/L的HH胶囊可以减低上清中HBeAg(0.285±0.007、0.462±0.008、0.565±0.009、0.733±0.008 vs 1.334±0.007)、HBsAg(0.834±0.008、1.021±0.011、1.347±0.017、1.548±0.015 vs 2.593±0.008), 312.00 mg/L HH胶囊对HBeAg、HBsAg抑制作用强于3TC组(0.285±0.007 vs 0.684±0.008; 0.834±0.008 vs 1.346±0.020), 提示HH胶囊对2.2.15细胞分泌的HBeAg、HBsAg具有抑制作用(图1).
312.00、156.00 mg/L HH胶囊均可以减低细胞内HBV DNA内(3.423±0.110、3.640±0.082 vs 6.857±0.060, ×109 copies/L)、细胞外HBV DNA(6 547±87、7 710±62 vs 24 300±200), 312.00 mg/L HH胶囊对细胞外HBV DNA抑制作用强于3TC组(6 547±87 vs 7 326±25), 提示HH胶囊可以降低细胞内、外HBV DNA水平(图2).
312.00 mg/L HH胶囊、3TC可以增加细胞内OAS(0.885±0.038、0.791±0.018vs 0.688±0.068)、PKR mRNA(0.139±0.06、0.089±0.003 vs 0.058±0.005)水平(图3).
HH胶囊可以增加细胞内OAS、PKR蛋白水平, 与空白组比较, 高浓度HH组差异有统计学意义(P<0.01, 图4).
中医药是我国的特色和优势, 众多专家学者对中医药防治慢性乙型肝炎进行了系列研发, 总结出一系列有效的方药, 如复方六月雪、参灵益肝颗粒、白背叶根、青蒿素、野老鹳草、虎杖、大黄、蕨麻[1-2,6-11]. HH胶囊由黄连、赶黄草、虎杖、甘草等多味中药组成, 具有清热祛湿解毒等功能, 是我们长期临床治疗毒性乙型肝炎的经验基础方, 我们在临床实践中发现具有较好的抗HBV、保肝作用, HH胶囊在国家"十一五"科技支撑计划项目资助下进行了抗HBV开发研究.
为了使HH胶囊中复方成分很好的溶解到培养液中, 我们采用0.1% DMSO作为助溶剂, 药物对细胞毒性实验中, 我们发现0.1% DMSO、3个浓度3TC对2.2.15细胞是无毒性的, 高浓度的HH胶囊对2.2.15细胞有一定毒性, 并且HH胶囊细胞毒性具有浓度依赖性, HH胶囊的TC50是2.11 g/L, HBeAg、HBsAg的IC50若分别按78.00 mg/L、156.00 mg/L算, HBeAg、HBsAg的TI分别是27、14, 所以HH胶囊对HBeAg、HBsAg的实际TI分别大于27、14, 均大于2, 提示HH胶囊抗HBV低毒有效, 具有良好的新药应用前景.
本次实验药效学研究揭示HH胶囊可以不同程度地降低培养上清中HBsAg、HbeAg、细胞内外的HBV DNA, 312.00 mg/LHH胶囊对HBeAg、HBsAg、细胞外HBV DNA抑制作用强于200.00 mg/L 3TC组(P<0.01), 但是在抑制细胞内HBV DNA方面二者无明显差异(P>0.05), 提示HH胶囊体外具有直接抗HBV作用, 另外HH胶囊中的部分单味药或单体已被开发为治疗慢性乙型肝炎的临床新药, 并取得良好效果[12,13], 所以HH胶囊有望开发为临床抗HBV新药.
JAK-STAT信号转导通路是目前临床使用的许多抗HBV药物如3TC、干扰素等发挥抗病毒作用的途径之一, 这些药物通过调控该信号转导通路诱导产生抗病毒蛋白2'5'-OAS、PKR而发挥抗病毒作用的[14-16], 研究抗HBV药物对JAK-STAT信号通路影响已经成为目前该领域研究热点, 但是目前JAK-STAT信号转导通路尚未应用于中医药抗HBV研究领域, 在中医药抗HBV研究领域尚属空白, 所以本次药物的机制学研究中引入JAK-STAT信号转导通路, 采用荧光定量PCR、Western blot方法初步探讨了HH胶囊对该信号通路的效应产物抗病毒蛋白OAS、PKR影响, 具有较高的创新性. 本研究结果提示HH胶囊可以增强2.2.15细胞内OAS、PKR及其mRNA表达水平, 进而引起病毒mRNA降解和抑制蛋白质合成达到抗HBV效果, 推测HH胶囊抗HBV作用可能与增强2.2.15细胞内OAS、PKR及其mRNA表达水平有关, 调控JAK-STAT信号转导通路有可能是HH胶囊抗HBV作用的机制之一, 当然还有必要对JAK-STAT信号转导通路中其他信号进行研究、验证.
总之, 本次研究不仅从体外实验研究了HH胶囊抗HBV作用, 为HH胶囊申报临床新药提供依据, 以降低病毒性肝炎的死亡率及其造成的经济损失, 具有重要社会意义; 另外本研究还首次从信号转导通路的角度探讨了HH胶囊抗HBV作用机制, 有一定的学术创新价值. 当然, 体外实验毕竟不能完全模拟体内过程, 我们正在进一步采用鸭乙型肝炎、HBV转基因小鼠等模型进行体内实验进行验证.
慢性病毒性乙型肝炎(简称慢性乙型肝炎)呈世界性流行, 我国是慢性乙型肝炎的高发地区, 慢性乙型肝炎严重危害我国人民的生命健康, 而对于慢性乙型肝炎的治疗, 目前仍无理想的药物及方法, 因此寻找安全有效的抗乙型肝炎病毒(HBV)药物十分迫切.
王凯, 教授, 山东大学齐鲁医院肝病科.
研发安全有效的抗HBV药物是目前病毒性肝炎防治领域的热点、重点.
一些专家学者对中医药防治慢性乙型肝炎进行了系列研发, 总结出一系列有效的方药, 如复方六月雪、参灵益肝颗粒、白背叶根、青蒿素、野老鹳草、虎杖、大黄、蕨麻. JAK-STAT信号转导通路是目前临床使用的许多抗HBV药物如3TC、干扰素等发挥抗病毒作用的途径之一.
本研究采用荧光定量PCR、Western blot技术, 探讨了HH胶囊体外抗HBV作用, 检测细胞内外HBV DNA, 并首次初步探讨了HH胶囊体外对JAK-STAT信号转导通路部分信号的影响.
本研究将JAK-STAT信号转导通路引入到中药抗HBV研究中, 为以后中药抗HBV研究提供思路.
CCK-8试剂盒: Cell Counting Kit-8简称CCK-8试剂盒, 是一种基于WST-8的广泛应用于细胞增殖和细胞毒性的快速高灵敏度检测试剂盒. WST-8是一种类似于MTT的化合物, 是MTT的一种升级替代产品, 和MTT或其他MTT类似产品如XTT、MTS等相比有明显的优点, 故逐渐广泛应用于细胞增殖和细胞毒性实验.
本文选题明确, 具有一定的创新性, 实验方法简单可靠, 可重复性强, 文题较准确反映了研究工作的科学问题和特定内容, 可读性强.
编辑: 李军亮 电编:吴鹏朕
| 1. | Li J, Huang H, Feng M, Zhou W, Shi X, Zhou P. In vitro and in vivo anti-hepatitis B virus activities of a plant extract from Geranium carolinianum L. Antiviral Res. 2008;79:114-120. [PubMed] [DOI] |
| 2. | Romero MR, Efferth T, Serrano MA, Castaño B, Macias RI, Briz O, Marin JJ. Effect of artemisinin/artesunate as inhibitors of hepatitis B virus production in an "in vitro]replicative system. Antiviral Res. 2005;68:75-83. [PubMed] [DOI] |
| 4. | 汪 延, 方 光如, 徐 跃定, 冯 伟民, 陶 佩珍, 滕 立. 螺旋藻多糖在2215细胞培养中对乙型肝炎病毒表面抗原和e抗原及HBV-DNA的抑制作用. 江苏农业学报. 2000;16:41-45. |
| 5. | 卢 圣栋. 现代分子生物学实验技术. 第2版. 北京: 北京协和科大学出版社 2001; 398-400. |
| 8. | Zhao YL, Cai GM, Hong X, Shan LM, Xiao XH. Anti-hepatitis B virus activities of triterpenoid saponin compound from Potentilla anserine L. Phytomedicine. 2008;15:253-258. [PubMed] [DOI] |
| 11. | Chang JS, Liu HW, Wang KC, Chen MC, Chiang LC, Hua YC, Lin CC. Ethanol extract of Polygonum cuspidatum inhibits hepatitis B virus in a stable HBV-producing cell line. Antiviral Res. 2005;66:29-34. [PubMed] [DOI] |
| 14. | 张 权, 魏 来, 王 燕. ISGF3:IFN-α抗乙型肝炎病毒信号转导机制的重要因子. 中华实验和临床病毒学杂志. 2005;19:110-113. |
| 15. | Kisseleva T, Bhattacharya S, Braunstein J, Schindler CW. Signaling through the JAK/STAT pathway, recent advances and future challenges. Gene. 2002;285:1-24. [PubMed] [DOI] |
| 16. | 管 世鹤, 陆 蒙吉, Roggendorf M, Schlaak JF. 3TC部分调节2.2.15细胞干扰素诱导基因表达. 中华实验和临床病毒学杂志. 2005;19:400. |