修回日期: 2009-12-31
接受日期: 2010-01-04
在线出版日期: 2010-02-18
目的: 探讨重组人p53腺病毒基因(rAd-p53, 1×1012 VP/支)经介入在兔VX2肝癌中的表达特点, 为临床应用提供理论依据.
方法: 将30只新西兰大白兔采用移植法建立兔VX2移植性肝癌模型, 于移植术11 d行MRI、CT检查. 随机抽取27只移植成功的荷瘤兔, 平均分成3组: A组: 经肝动脉单纯灌注rAd-p53(5×106 VP); B组: rAd-p53(5×106 VP)+超液态碘油(每只0.5 mL)经肝动脉灌注; C组: 瘤内rAd-p53(5×106 VP)直接导入. 所有荷瘤兔术中均行DSA. 介入术后24、72 h, 6 d分别处死实验兔, 免疫组织化学方法检测肿瘤组织及瘤周P53和Bax、Bcl-2蛋白的表达.
结果: 30只大白兔均经MRI及CT检查, 证实有27只种瘤成功, 成功率95%. 免疫组织化学检测各组中P53和Bax蛋白均有表达, 于72 h达到最高峰, 以C组表达率最高, 与其他两组有显著性差异(P53: 70.3%±3.4% vs 62.4%±3.2%, 65.4%±2.1%; Bax: 43.7%±2.1% vs 35.7%±1.3%, 37.6%±2.4%, 均P<0.05); C组对Bcl-2蛋白表达率最低, 在72 h达最低点, 与其他两组有显著性差异(12.0%±2.6% vs 18.0%±4.3%, 16.2%±3.1%, 均P<0.05).
结论: P53、Bax、Bcl-2蛋白在兔VX2肝癌模型中的表达呈现时间曲线关系; 不同rAd-p53介入导入方式P53蛋白表达不同, 以瘤内及瘤周直接注射方式表达最高, 超液态碘油混合灌注及单纯肝动脉灌注次之.
引文著录: 罗仕华, 郑传胜, 冯敢生, 梁惠民, 周国锋, 夏向文. 重组人p53腺病毒基因经介入后在兔VX2肝癌中表达. 世界华人消化杂志 2010; 18(5): 437-442
Revised: December 31, 2009
Accepted: January 4, 2010
Published online: February 18, 2010
AIM: To investigate the expression of recombinant human adenovirus-p53 gene (rAd-p53, 1×1012 VP) delivered into rabbit VX2 tumors by interventional methods.
METHODS: Thirty New Zealand rabbits were used to establish an animal model of hepatocarcinoma by implantation of the VX2 tumors into the liver. Eleven days after implantation, magnetic resonance imaging (MRI) and computed tomography (CT) scans were performed. Successful implantation was achieved in 27 rabbits. These rabbits were randomly divided into three groups: A, B and C. Groups A and B were infused through the hepatic artery with rAd-p53 (5 × 106 VP) alone and rAd-p53 (5 × 106 VP) plus lipiodol ultra fluid (0.5 mL), respectively, while group C was injected with rAd-p53 (5 × 106 VP) into tumors by surgery. All model rabbits underwent digital subtraction angiography (DSA) during operation. The expression of P53, Bax and Bcl-2 proteins in tumor and peritumoral tissue was detected by immunohistochemistry at 24 and 72 hours and on 6 days after the operation.
RESULTS: MRI and CT scans showed that successful implantation was achieved in 27 rabbits, and the success rate was 95%. Immunohistochemical analysis indicated that P53, Bax and Bcl-2 proteins were expressed in all the three groups. The expression levels of P53 and Bax reached the peak at 72 hours. The expression levels of P53 and Bax in group C at 72 hours were significantly higher than those in groups A and B (P53: 70.3% ± 3.4% vs 62.4% ± 3.2% and 65.4% ± 2.1%; Bax: 43.7% ± 2.1% vs 35.7% ± 1.3% and 37.6% ± 2.4%, respectively; all P < 0.05). In contrast, the expression level of Bcl-2 in group C at 72 hours was significantly lower than those in groups A and B (12.0% ± 2.6% vs 18.0% ± 4.3% and 16.2% ± 3.1%, respectively; both P < 0.05).
CONCLUSION: P53 protein is expressed in rabbit VX2 tumors in a time-dependent manner. The expression level of P53 protein depends on the delivery methods used. The highest expression of P53 protein is achieved by intratumoral injection, followed by infusion of rAd-p53 plus lipiodol ultra fluid and rAd-p53 alone through the hepatic artery.
- Citation: Luo SH, Zheng CS, Feng GS, Liang HM, Zhou GF, Xia XW. Expression of recombinant human adenovirus-p53 gene delivered into rabbit VX2 tumors by interventional methods. Shijie Huaren Xiaohua Zazhi 2010; 18(5): 437-442
- URL: https://www.wjgnet.com/1009-3079/full/v18/i5/437.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i5.437
肝癌作为第4大恶性肿瘤, 每年患者已逾100万[1]. 在中国, 每年约30万人死于原发性肝癌[2]. 兔VX2肝癌细胞因其与人体肝癌细胞生长方式相近, 目前被广泛应用于介入治疗的动物实验研究. 由于野生型P53蛋白的半衰期很短, 在细胞内含量低, 所以正常肝细胞内难以检测到P53蛋白的表达[3]. 本实验旨在建立兔VX2移植性肝癌模型, 采用介入学方法将抑癌基因p53导入兔VX2移植性肝癌模型内, 观察P53、Bax及Bcl-2蛋白表达特点, 为临床应用rAd-p53治疗肝癌提供理论依据.
新西兰大白兔30只, 雌雄不限, 体质量2-2.5 kg, 由华中科技大学同济医学院实验动物中心提供; VX2肿瘤细胞由华中科技大学同济医院肝胆外科穆拉德博士惠赠; 重组人p53腺病毒基因注射液(rAd-p53, 1×1012 VP/支)由深圳赛百诺基因技术有限公司惠赠; 超液态碘油为法国Aulnay-sous-Bios公司生产; 兔麻醉用速眠新Ⅱ注射液购自军事医学科学院军事兽医研究所.
1.2.1 造模: 参照文献[4]的方法建立兔VX2肝癌模型, 术后氨苄青霉素抗炎处理.
1.2.2 分组及治疗: 分别于移植术后11 d行MRI、CT检查, 采用Siemens Avanto 1.5 T MRI仪, CT检查采用Somatom Sensation 16螺旋CT扫描仪. 所有荷瘤兔均行DSA摄影, DSA使用Siemens Bicor Top型血管造影机, 选用1 mL非离子型对比剂优维显(Ultravist300)推注. 将27只经影像检测种瘤成功荷瘤兔随机平均分为3组, A组: 经肝动脉单纯灌注rAd-p53(5×106 VP); B组: rAd-p53(5×106 VP)+超液态碘油每只0.5 mL经肝动脉灌注; C组: 瘤内rAd-p53(5×106 VP)直接导入. 1.2.3 介入导入: (1)经肝动脉途径: 参照文献方法[5], 在完成影像检查后随即用自制的带有连接管的细针行经肝动脉途径治疗; (2)直接注射途径: 参照文献方法[6], 荷瘤兔在完成影像检查, 在直视下用1 mL注射器向瘤内、肿瘤边缘及瘤周注射药物.
1.2.4 免疫组织化学检测: 介入导入术后分别于24 h、72 h、6 d处死实验兔, 通过免疫组织化学法检测肿瘤组织及瘤周0.5 cm处P53和Bax、Bcl-2蛋白的表达. 取固定于100 g/L中性甲醛1-2 wk的组织标本, 将标本固定于标本台上, 常规石蜡包埋. 兔抗兔P53、Bax及Bcl-2抗体及相应二抗均购自武汉博士德生物工程有限公司; SP试剂盒及3'3二氨基联苯胺(浓缩型DAB)显色试剂盒购自美国Santa Cruz公司, 北京中杉生物技术有限公司国内分装. 免疫组织化学采用HistostainTM S-P(链霉卵白素-过氧化物酶)法免疫组织化学LAB-S技术, 用PBS代替一抗作阴性对照, 免疫组织化学染色按试剂盒方法进行. 每张切片3个视野, 400倍, 计数100个细胞中阳性细胞数, 取均值, 以百分数(%)表示, 均以平均阳性细胞>10%定为阳性. P53、Bax、Bcl-2结果判断: P53蛋白表达阳性: P53蛋白定位于肿瘤胞核, 呈棕黄色颗粒状或团块、簇状; Bax蛋白表达阳性: Bax的表达阳性为胞质棕黄色; Bcl-2蛋白表达阳性: Bcl-2蛋白阳产物定位于肿瘤胞质内, 呈棕黄色染色.
统计学处理 多组间的比较采用方差分析, 多组的两两间比较采用Student-Newman-Keuls法检验, 两组间比较采用成组t检验, 对方差不齐者采用秩和检验, 确定P<0.05为有统计学意义.
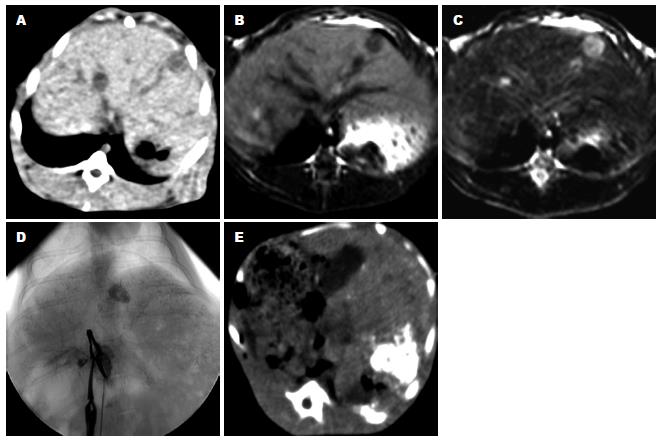
移植术11 d影像检查显示27只种植成功, 2只术后死亡, 1只经影像学检查未发明显瘤灶. 瘤灶位于肝左叶, 呈单一肿块. CT平扫呈结节样低密度或等密度, 与周围正常肝组织分界清楚. MRI扫描TW1低信号, TW2高信号, 信号均匀, 边界清楚, 13例肿瘤中心出现不同程度坏死, 与未坏死组织信号对比TW1上表现为更低信号, TW2表现为更高信号, 平均直径为8.2 mm±0.6 mm. 血管造影示肿瘤血供主要来自于肝动脉, 为富血管性, 见较多小血管, 其走行不规则, 排列紊乱, 部分供血动脉被瘤体推压成"抱球状", 可见肿瘤染色, 有时呈结节状染色, 且染色可持续数分钟. 介入导入术后CT平扫示碘油沉积良好(图1).
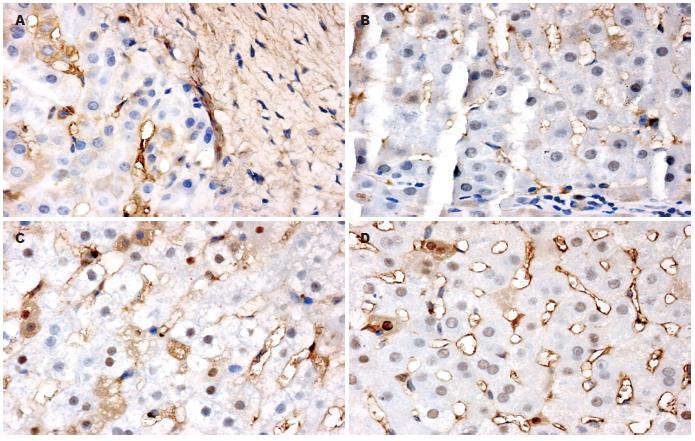
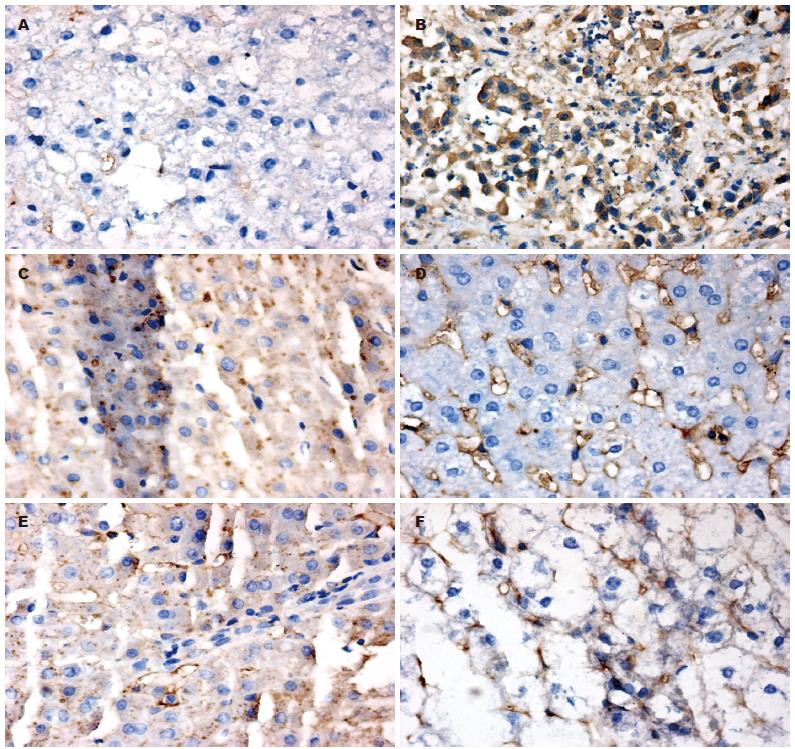
正常肝细胞内未见P53蛋白表达(图2A), 在癌细胞核内P53蛋白表达呈棕黄色颗粒状或团块、簇状染色, 且于24 h处于一般水平, 72 h较高, 6 d后复降至一般水平, 表明P53蛋白的表达呈现时间上升下降曲线关系; 三组中, 两两比较有显著性意义(P<0.05), 以C组表达水平最高. Bax蛋白表达表现为癌细胞胞质内呈棕黄色颗粒状、簇状染色, 与P53蛋白表达一样具有24 h处于一般水平, 72 h较高, 6 d后复降至一般水平的现象, 表明Bax蛋白的表达呈现时间上升下降曲线关系; 同时, 三组中, 两两比较有显著性意义(均P<0.05), 以C组表达水平最高. Bcl-2蛋白的表达在癌细胞胞质中呈簇状、条状棕黄色染色, 以24 h及6 d时表达水平较高, 72 h时处于较低水平表达, 呈现时间性下降上升关系, 两两比较有显著性意义(P<0.05), 以C组表达水平最低(表1, 图2, 3).
| 分组 | P53 | Bax | Bcl-2 | ||||||
| 24 h | 72 h | 6 d | 24 h | 72 h | 6 d | 24 h | 72 h | 6 d | |
| A组 | 19.6±5.2 | 62.4±3.2 | 18.7±3.4 | 8.5±1.2 | 35.7±1.3 | 9.8±2.4 | 30.4±3.0 | 18.0±4.3 | 29.6±4.3 |
| B组 | 20.2±4.3 | 65.4±2.1 | 19.6±4.2 | 11.3±2.1 | 37.6±2.4 | 10.3±2.1 | 28.3±2.2 | 16.2±3.1 | 27.7±3.3 |
| C组 | 26.5±6.0 | 70.3±3.4 | 26.3±4.3 | 17.6±2.2 | 43.7±2.1 | 16.8±1.6 | 24.2±4.3 | 12.0±2.6 | 23.8±2.5 |
| P值 | <0.05 | <0.05 | <0.05 | <0.05 | <0.05 | <0.05 | <0.05 | <0.05 | <0.05 |
p53基因属于一种抑癌基因, 主要参与细胞周期调控, 作为反式作用因子或转录因子调节基因的表达[7], 还参与细胞间信号传递途径, 以及和细胞生长及迁移有关[8]. p53基因突变或功能缺失是许多肿瘤发生重要原因[9]. 突变型p53基因可灭活野生型p53基因的功能, 导致上述功能的丧失, 促进肿瘤的发生[10]. 导入重组人p53腺病毒基因治疗各种肿瘤已广泛应用于临床, 较明显效果的是头颈部肿瘤, 但存在全身不良反应大, 转染效率不高等特点[11]. rAd-p53治疗各种肿瘤已经广泛应用于临床, 亦有经介入途径导入移植性兔VX2肝癌模型进行实验研究[12], 但其结果只限于P53蛋白表达与否, 未见报道从动物实验出发将重组人p53腺病毒基因导入肝癌组织内来阐明其具体表达特点.
本实验采用重组人p53腺病毒基因为目的基因, 以局部靶向给药的方式以期望p53基因的定向表达, 一方面可以达到靶向给药浓度, 提高表达效率, 另一方面又能降低外周血药浓度, 从而减轻腺病毒的全身不良反应, 提高基因治疗的安全性. 实验结果显示P53蛋白在三组不同的给药方式中均能表达, 表达率高于50%, 表现为VX2肝癌细胞核中棕黄色小体形成. 三组中导入rAd-p53于肝癌细胞24 h后, P53蛋白在核内已见表达, 72 h可见强阳性表达, 到第6天则已为弱阳性表达, 呈现时间曲线关系, 造成此类现象的原因可能为当基因片段载入肝癌细胞后, 与P53蛋白的代谢、自身构象所致半衰期短及基因片段已耗尽有关[13]. 目前基因治疗的一大难题是转染的效率不高[14], 表达效率则更为低[15], 本实验P53蛋白的表达均已达50%以上, 单纯肝动脉灌注及与超液态碘油混合无明显差异, 而直接瘤周及瘤周注射较高, 表明直接导入方式更适合于基因的表达, 可能与经肝动脉方式导入后基因片段容易随血流分布到肿瘤区域之外, 降低了局部基因片段浓度所致. 有学者报道腺病毒基因在临床上全身应用能导致病毒颗粒及转导细胞强烈的免疫反应[16], 产生急性炎症反应[17], 从而使腺病毒载体及基因片段受到破坏, 都有可能造成其表达效率降低[18]. 而直接注射方式避免了上述原因, 从而有较高的表达效率, 但此种方式亦有不能使整个肿瘤区域细胞转染的缺点, 所以直接导入方式与常规肝动脉介入治疗配合应用则可增强肝癌综合治疗效果. 实验结果显示仍有部分阴性表达, 其原因可能是导入rAd-p53的量不够, 瘤内注射的药物不能到达整个肿块, 也有可能是腺病毒载体受到破坏转染失败所致.
实验结果显示Bax及Bcl-2蛋白均在肝癌细胞胞质内呈现棕黄色染色. bax及bcl-2基因是由p53基因介导的细胞凋亡调控相关基因[19]. 当p53基因活化表达P53蛋白后, P53蛋白可通过促进bax基因, 胰岛素样生长因子结合蛋白3(insulin-like growth factor binding protein 3, IGF-BP3)及fas受体基因的转录[20], 表达出的产物Bax蛋白可与Bcl-2蛋白结合, 阻断他的抑制凋亡作用[21], 产物IGF-BP3可使胰岛素样生长因子失活, 从而抑制与之有关的抗凋亡信号转导[22]; fas受体表达则有利于fas介导的细胞凋亡[23]. 本实验发现三组Bcl-2家族Bax蛋白增高, 在导入P53于肝癌组织细胞24 h后, 肿瘤细胞胞质内已见表达, 72 h可见强阳性表达, 到第6天则已为弱阳性表达. 而与之相反的Bcl-2蛋白在导入p53基因于肝癌组织细胞24 h, 肿瘤细胞胞质内阳性表达, 72 h可见弱阳性表达, 到第6天则已为强阳性表达. 表明P53蛋白通过Bax、Bcl-2途径诱导肿瘤细胞凋亡机制而使Bax蛋白与P53蛋白的表达同样呈时间曲线关系, 而Bcl-2则相反, 验证了P53蛋白的促进肝癌细胞凋亡的作用.
总之, 经介入途径导入重组人p53腺病毒基因于兔VX2移植性肝癌模型, P53蛋白安全高效表达, 呈现时间曲线关系, Bax、Bcl-2蛋白的表达与P53蛋白表达相关; 不同的rAd-p53介入导入方式P53、Bax、Bcl-2蛋白表达不同, 以瘤内及瘤周直接注射方式表达最高, 超液态碘油混合灌注及单纯肝动脉灌注次之. 通过对rAd-p53在兔VX2肝癌中表达特点的观察, 表明rAd-p53于临床应用时, 以直接瘤内及瘤周注射方式效果最好, 亦可与传统碘油混合行栓塞治疗, 但基因表达效果次之.
随着基因工程技术的发展, 基因治疗肿瘤已经成为新的趋势. 重组人p53腺病毒基因(rAd-p53)是野生型p53基因重组入腺病毒的重组体, 已经广泛应用于临床. 目前介入治疗已成为不可切除肝癌的主要治疗方法, 而经介入引入rAd-p53治疗肝癌可能会成为导入目的基因的一种新途径.
范学工, 教授, 中南大学湘雅医院感染病科.
rAd-p53基因已经广泛应用于临床, 特别是在头颈部肿瘤中的应用, 并已经取得了较好的临床效果, 患者的带瘤生存率有一定的提高, 生活质量得到改善.
本研究结合传统肝癌介入疗法导入rAd-p53基因, 重点研究了p53及其凋亡相关蛋白在肿瘤组织中的表达特点.
本研究表明, rAd-p53基因与传统介入方法结合能增强介入治疗肝癌的效果. 且rAd-p53基因治疗肝癌以介入导入方法较佳.
本文对肝癌的不同介入治疗方式进行了研究, 其结果为临床治疗的实施提供了较好的参考.
编辑: 李军亮 电编:吴鹏朕
| 1. | Cha C, DeMatteo RP, Blumgart LH. Surgery and ablative therapy for hepatocellular carcinoma. J Clin Gastroenterol. 2002;35:S130-S137. [PubMed] |
| 3. | Hainaut P, Wiman KG. 30 years and a long way into p53 research. Lancet Oncol. 2009;10:913-919. [PubMed] [DOI] |
| 5. | Seol JG, Heo DS, Kim HK, Yoon JH, Choi BI, Lee HS, Kim NK, Kim CY. Selective gene expression in hepatic tumor with trans-arterial delivery of DNA/liposome/transferrin complex. In Vivo. 2000;14:513-517. [PubMed] |
| 6. | 官 泳松, 孙 龙, 周 翔平, 李 肖, 贺 庆, 刘 源. 重组人P53腺病毒基因局部注射联合肝动脉化疗栓塞治疗原发性肝癌. 世界华人消化杂志. 2005;13:125-127. [DOI] |
| 7. | Spurgers KB, Gold DL, Coombes KR, Bohnenstiehl NL, Mullins B, Meyn RE, Logothetis CJ, McDonnell TJ. Identification of cell cycle regulatory genes as principal targets of p53-mediated transcriptional repression. J Biol Chem. 2006;281:25134-25142. [PubMed] [DOI] |
| 8. | Zhang Y, Lu H. Signaling to p53 ribosomal proteins find their way. Cancer Cell. 2009;16:369-377. [PubMed] [DOI] |
| 9. | Bourdon JC. p53 and its isoforms in cancer. Br J Cancer. 2007;97:277-282. [PubMed] [DOI] |
| 10. | Suad O, Rozenberg H, Brosh R, Diskin-Posner Y, Kessler N, Shimon LJ, Frolow F, Liran A, Rotter V, Shakked Z. Structural basis of restoring sequence-specific DNA binding and transactivation to mutant p53 by suppressor mutations. J Mol Biol. 2009;385:249-265. [PubMed] [DOI] |
| 11. | Frank DK. Gene therapy for head and neck cancer. Surg Oncol Clin N Am. 2002;11:589-606, vi-vii. [PubMed] [DOI] |
| 12. | Gu T, Li CX, Feng Y, Wang Q, Li CH, Li CF. Trans-arterial gene therapy for hepatocellular carcinoma in a rabbit model. World J Gastroenterol. 2007;13:2113-2117. [PubMed] |
| 13. | Peñuelas I, Mazzolini G, Boán JF, Sangro B, Martí-Climent J, Ruiz M, Ruiz J, Satyamurthy N, Qian C, Barrio JR. Positron emission tomography imaging of adenoviral-mediated transgene expression in liver cancer patients. Gastroenterology. 2005;128:1787-1795. [PubMed] [DOI] |
| 14. | Farlow SJ, Jerusalmi A, Sano T. Enhanced transduction of colonic cell lines in vitro and the inflamed colon in mice by viral vectors, derived from adeno-associated virus serotype 2, using virus-microbead conjugates bearing lectin. BMC Biotechnol. 2007;7:83. [PubMed] [DOI] |
| 15. | Kang Y, Zhang X, Jiang W, Wu C, Chen C, Zheng Y, Gu J, Xu C. Tumor-directed gene therapy in mice using a composite nonviral gene delivery system consisting of the piggyBac transposon and polyethylenimine. BMC Cancer. 2009;9:126. [PubMed] [DOI] |
| 16. | Gérolami R, Cardoso J, Bralet MP, Cuenod CA, Clément O, Tran PL, Bréchot C. Enhanced in vivo adenovirus-mediated gene transfer to rat hepatocarcinomas by selective administration into the hepatic artery. Gene Ther. 1998;5:896-904. [PubMed] [DOI] |
| 17. | Su C, Cao H, Tan S, Huang Y, Jia X, Jiang L, Wang K, Chen Y, Long J, Liu X. Toxicology profiles of a novel p53-armed replication-competent oncolytic adenovirus in rodents, felids, and nonhuman primates. Toxicol Sci. 2008;106:242-250. [PubMed] [DOI] |
| 18. | Krougliak VA, Krougliak N, Eisensmith RC. Stabilization of transgenes delivered by recombinant adenovirus vectors through extrachromosomal replication. J Gene Med. 2001;3:51-58. [PubMed] [DOI] |
| 19. | Sun T, Chen C, Wu Y, Zhang S, Cui J, Shen P. Modeling the role of p53 pulses in DNA damage- induced cell death decision. BMC Bioinformatics. 2009;10:190. [PubMed] [DOI] |
| 20. | el-Deiry WS. Regulation of p53 downstream genes. Semin Cancer Biol. 1998;8:345-357. [PubMed] [DOI] |
| 21. | Tucker CA, Kapanen AI, Chikh G, Hoffman BG, Kyle AH, Wilson IM, Masin D, Gascoyne RD, Bally M, Klasa RJ. Silencing Bcl-2 in models of mantle cell lymphoma is associated with decreases in cyclin D1, nuclear factor-kappaB, p53, bax, and p27 levels. Mol Cancer Ther. 2008;7:749-758. [PubMed] [DOI] |
| 22. | Tagawa M, Kawamura K, Shimozato O, Ma G, Li Q, Suzuki N, Shimada H, Ochiai T. Virology- and immunology-based gene therapy for cancer. Cancer Immunol Immunother. 2006;55:1420-1425. [PubMed] [DOI] |
| 23. | Kong XT, Gao H, Stanbridge EJ. Mechanisms of differential activation of target gene promoters by p53 hinge domain mutants with impaired apoptotic function. J Biol Chem. 2001;276:32990-33000. [PubMed] [DOI] |