修回日期: 2010-01-06
接受日期: 2010-01-11
在线出版日期: 2010-02-18
目的: 探讨零下非结冰保存肝细胞的效果及其与细胞凋亡的关系.
方法: UW液保存的C3A细胞悬液分为3组: -0.8 ℃组(零下非结冰组), 0 ℃组(0 ℃非结冰组), 4 ℃组(对照组). 低温保存24、48及72 h后, 采用流式细胞术分别测定细胞存活率及凋亡率, 同时测定LDH、乳酸释放, 细胞内ATP含量、尿素合成功能及白蛋白分泌功能, 同时观察细胞形态.
结果: 零下非结冰组较0 ℃非结冰组及对照组明显提高了低温保存72 h的C3A细胞的存活率(86.49%±2.80% vs 81.50%±2.83%, 77.83%±3.40%, 均P<0.05), 降低了细胞凋亡率(1.26%±0.84% vs 5.34%±1.20%, 9.16%±1.99%, 均P<0.05); 明显抑制了低温保存72 h乳酸以及LDH释放(乳酸: 10.38 μg/106 cells±1.40 μg/106 cells vs 12.02 μg/106 cells±1.64 μg/106 cells, 17.41 μg/106 cells±2.40 μg/106 cells; LDH: 80.10 U/L±11.10 U/L vs 120.04 U/L±14.32 U/L, 148.98 U/L±15.37 U/L, 均P<0.05); 更好地维持了低温保存72 h C3A细胞内ATP含量、尿素合成功能、及白蛋白分泌功能(均P<0.05). 形态上, 零下非结冰组保存细胞死亡比例少, 细胞接触良好, 未见对照组及0 ℃非结冰组细胞膜周围出现"毛刺"样改变及细胞内的"空泡样"改变.
结论: 在零下非结冰条件下保存肝细胞, 建立一个"血库样"(ready to use)肝细胞库, 可以有效促进生物人工肝的发展.
引文著录: 李庆勇, 张清华, 蒋知新, 沙杭, 林虎, 李安全, 龙炫辉, 高毅. 超分子铂类药物西茜铂体内外对消化系肿瘤的抑制作用. 世界华人消化杂志 2010; 18(5): 428-436
Revised: January 6, 2010
Accepted: January 11, 2010
Published online: February 18, 2010
AIM: To investigate whether subzero nonfreezing storage (-0.8 °C) is superior to conventional cold storage in preservation of C3A hepatocytes for use in bioartificial liver support systems.
METHODS: C3A hepatocytes suspended in University of Wisconsin (UW) solution were divided into three groups: subzero nonfreezing group (-0.8 °C), zero nonfreezing group (0 °C) and control group (4 °C). After 24, 48 and 72 hours of hypothermic storage, cell viability and apoptosis were detected by flow cytometry; intracellular adenosine triphosphate (ATP) content, lactate dehydrogenase (LDH) release, lactic acid production, urea synthesis and albumin secretion were determined; and cell morphological changes were observed.
RESULTS: Compared to the zero nonfreezing group and the control group, after 72 hours of hypothermic storage, the percentage of viable C3A hepatocytes was significantly higher (86.49% ± 2.80% vs 81.50% ± 2.83% and 77.83% ± 3.40%, respectively; both P < 0.05), and cell apoptosis rate was significantly lower (1.26% ± 0.84% vs 5.34% ± 1.20% and 9.16% ± 1.99%, respectively; both P < 0.05) in the subzero nonfreezing group. Lactic acid and LDH production was more significantly suppressed (lactic acid: 10.38 μg/106 cells ± 1.40 μg/106 cells vs 12.02 μg/106 cells ± 1.64 μg/106 cells and 17.41 μg/106 cells ± 2.40 μg/106 cells; LDH: 80.10 U/L ± 11.10 U/L vs 120.04 U/L ± 14.32 U/L and 148.98 U/L ± 15.37 U/L, respectively; all P < 0.05), and the ability of hepatocytes to synthesize urea and secrete albumin was better maintained in the subzero nonfreezing group (both P < 0.05). Moreover, cells in the subzero nonfreezing storage group had lower death rate and better cellular morphology. A burr-like structure around the cell membrane and an intracellular vacuole-like structure were found in cells in the zero nonfreezing group and the control group, but not in the subzero nonfreezing group.
CONCLUSION: Subzero nonfreezing storage (-0.8 °C) of hepatocytes to construct a "ready-to-use" hepatocyte bank like the "blood bank" will efficiently promote the development of bioartificial liver support systems.
- Citation: Li QY, Zhang QH, Jiang ZX, Sha H, Lin H, Li AQ, Long XH, Gao Y. Subzero nonfreezing storage of C3A hepatocytes for use in bioartificial liver support systems. Shijie Huaren Xiaohua Zazhi 2010; 18(5): 428-436
- URL: https://www.wjgnet.com/1009-3079/full/v18/i5/428.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i5.428
生物人工肝(bioartificial liver support system, BALSS)的发展为肝功能衰竭的治疗开辟了新的途径[1-3]. 而获得高质量、数量足且能够快速临床应用的肝细胞是BALSS的核心[4]. 因此, 探索出一种实用可靠的肝细胞低温保存方法, 建立一个随时可用(ready to use)的肝细胞库是BALSS普遍推广的基础[5]. 温度是影响低温保存效果的关键因素: 一般而言温度越低, 细胞的代谢活性就越低, 保存时间就越长[6]. 零下非结冰温度(subzero nonfreezing temperature, SZNFT)是指0 ℃到某溶液冰点之间的温度范围, 一方面可以使代谢降至最低, 不同于常规低温保存(4 ℃), 另一方面可以避免"冰晶形成"、"细胞凋亡"等低温保存损伤[7], 理论上SZNF是一种理想的细胞保存形式[8]. SZNF最早用于供肝的保存, 使供肝的保存时间明显延长[9], 但供肝的保存混杂有缺血再灌注损伤的影响[10], 不能完全反应对肝细胞的保存效果. 目前, SZNF对人源性肝细胞的保存效果仍然不明确. 因此, 本文将用UW液SZNF保存人源性C3A细胞, 同常规低温(4 ℃及0 ℃)比较, 以明确SZNF保存肝细胞的效果以及同细胞凋亡的关系.
C3A永生化肝细胞株(ATCC, 美国); DMEM/F-12培养基、优级胎牛血清(FBS)、青霉素/链霉素溶液(100×)、重组人表皮生长因子(EGF)、胰岛素溶液、0.25%胰酶及PBS缓冲液(Invitrogen, 美国); UW液(Bristol-Myers Squibb); 50 mL培养瓶、2 mL冻存管及6孔培养板(Costar Corning); 氯化铵(Sigma); Labofuge400R型离心机(Heraeus, 德国); 人白蛋白ELISA试剂盒(R&D, 美国), Mode1450型酶标仪(BIO-RAD, 美国); CK2型倒置显微镜及IX70型倒置荧光显微镜(Olympus, 日本); Annexin V-FITC凋亡试剂盒(南京凯基); Live/Dead活力和细胞毒性分析试剂盒(Invitrogen, 美国); 乳酸测定试剂盒(Boehringer Mannhein); Du530型分光光度仪(Beckman, 德国); ATP检测试剂盒(Sigma); Flextek2型全自动酶标仪(阿克苏诺贝尔, 荷兰); DXC800型全自动生化仪及FACScan型流式细胞仪(Beckman coulter, 美国); MIR-151型微电脑程控低温培养箱(温度范围: -10 ℃-60 ℃, 温度精度: ±0.1 ℃)及MCO-175型二氧化碳培养箱(SANYO, 日本); 海尔智能温度记录仪(温度范围: -100 ℃-120 ℃, 精度±0.1 ℃); 超净工作台(北京昌平长城空气净化工程公司).
1.2.1 分组: 制备好UW液保存的C3A细胞悬液分为以下3组: -0.8 ℃组(零下非结冰组); 0 ℃组(0 ℃非结冰组); 4 ℃组(对照组).
1.2.2 细胞培养制备: (1)取C3A细胞约1×106个, 接种到50 mL培养瓶. 所用基础培养基为DMEM/F-12, 同时添加EGF: 20 μg/L, 胰岛素10 mg/L, 青霉素: 10 kU/L, 链霉素: 10 g/L, 100 mL/L FBS. (2)将培养瓶置于37 ℃, 50 mL/L CO2, 100%湿度的培养箱内培养. (3)倒置显微镜观察80%以上细胞贴壁后换液1次, 以后每24 h换液1次, 直至内壁长满. (4)取内壁长满的1瓶细胞, 吸除培养液, 加0.25%胰酶1-1.5 mL, 于室温消化1-3 min, 同时观察细胞形态, 一旦发现胞质回缩细胞间隙增大, 即刻吸除胰酶, 终止消化. (5)加2 mL含10% FBS的DMEM/F-12培养液, 用吸管反复吹打内壁, 使细胞完全脱离甁壁. (6)将同批多瓶C3A细胞悬液混合, 取一滴至血细胞计数板, 计算细胞细胞密度, 最终将细胞浓度调至2×109/L, 分装至2 mL冻存管.
1.2.3 低温保存及复温: (1)2 mL冻存管, 1 000 r/min, 离心2 min, 将含100 mL/L FBS的DMEM/F-12培养液置换为2 mL UW液, 混匀. 分别至-0.8 ℃组、0 ℃组及4 ℃组, 每组6个标本. (2)低温保存24、48及72 h后, 各组均取6个标本, 采用快速复温法, 放入37 ℃水浴中震荡l-2 min. (3)复温后的标本1 000 r/min, 离心2 min, 将UW液置换为含100 mL/L FBS的DMEM/F-12培养液2 mL, 混匀, 于37 ℃, 50 mL/L CO2, 100%湿度的培养箱内培养30 min.
1.2.4 复温后各指标的测定: (1)取l mL C3A细胞悬液, 加入到1 mL含4 mmol/L氯化铵及100 mL/L FBS的DMEM/F-12培养液的6孔培养板中, 于37 ℃、50 mL/L CO2、100%湿度的培养箱内培养24 h后, 一方面: 取上清, 2 000 r/min, 离心20 min, 于全自动生化仪测定尿素的浓度(氯化铵转化试验)及LDH浓度. 同时按照人白蛋白ELISA试剂盒说明, 测定上清人白蛋白含量. 另一方面: 用PBS缓冲液轻轻冲洗6孔板, 按照Live/Dead活力和细胞毒性分析试剂盒要求, 对贴壁细胞荧光染色, 使用荧光显微镜定性观察0及72 h细胞存活、死亡及细胞形态. (2)取0.5 mL C3A细胞悬液, 1 000 r/min, 离心2 min. 一方面: 取上清, 按照乳酸测定试剂盒的要求, 于分光光度仪测定乳酸含量. 另一方面: 沉淀的细胞按照Annexin V-FITC凋亡试剂盒要求, 于流式细胞仪定量测定细胞存活率、凋亡率及死亡率. (3)取0.5 mL C3A细胞悬液, 按照ATP试剂盒的说明, 于全自动酶标仪测定细胞内ATP含量.
统计学处理 所有计量资料以mean±SD表示. 同时间点不同组样本均数比较采用One-way ANOVA, 多重比较采用LSD检验, 方差不齐时多重比较采用多个孤立样本非参数分析Kruskal-Wallis检验. 采用SPSS13.0统计软件分析, P<0.05有统计学差异.
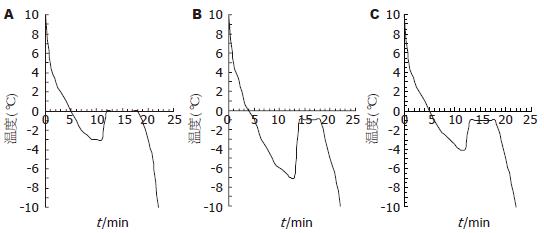
不同溶液的降温曲线及冰点不同. 蒸馏水的降温曲线: 当温度缓慢降至-3 ℃时, 蒸馏水仍然呈液态, 继续降温, 蒸馏水的温度突然升至0 ℃, 冰晶开始形成, 完全结冰后, 蒸馏水的温度随着外界温度的下降而下降. 因此, 蒸馏水的冰点是0 ℃(图1A); UW液的降温曲线: 当温度缓慢降至-7 ℃时, UW液仍然呈液态, 继续降温, 冰晶开始形成, 温度突升至-1 ℃, 完全结冰后, UW液的温度随着外界温度的下降而下降. 因此, UW液的冰点是-1 ℃, 零下非结冰温度为0 ℃-(-1) ℃(图1B); C3A细胞: 当温度缓慢降至-4 ℃时, C3A细胞外无冰晶形成, 继续降温, 冰晶开始形成, 温度升至-1 ℃. 因此C3A细胞冰点为-1 ℃, C3A细胞的零下非结冰温度为0 ℃-(-1) ℃(图1C).
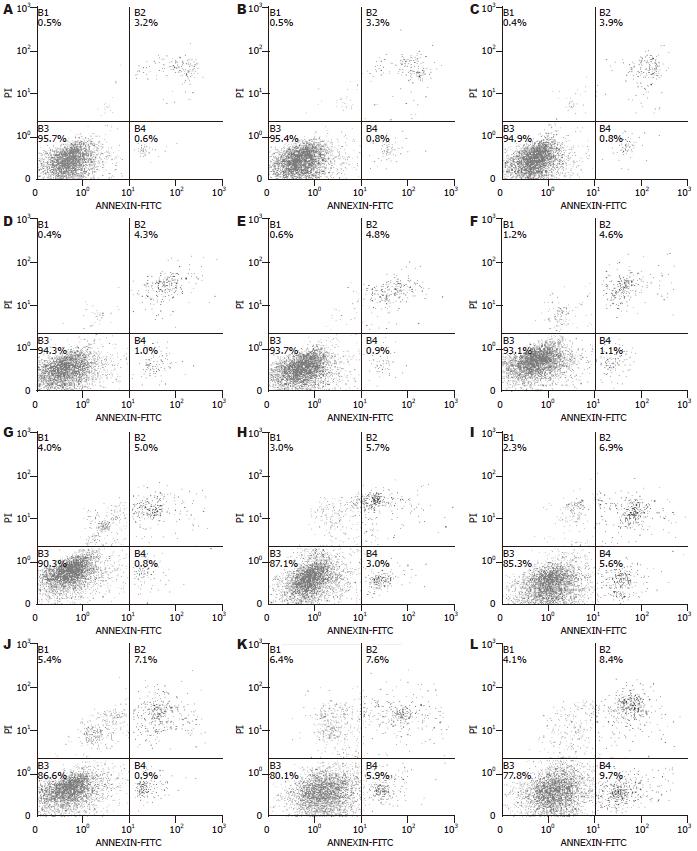
新鲜细胞(0 h)存活率为95.21%±0.55%, 凋亡率为0.72%±0.19%, 死亡率为3.39%±0.47%. 随低温保存时间延长, 各组细胞存活率呈下降趋势. 48 h, -0.8 ℃组细胞存活率同0 ℃组及4 ℃组相比, 开始出现差异. 低温保存72 h, 细胞存活率均明显下降, 但-0.8 ℃组明显优于0 ℃组及4 ℃组(表1, 图2); 随低温保存时间延长, 各组细胞凋亡率呈上升趋势. 24 h, -0.8 ℃组同0 ℃组及4 ℃组相比, 开始出现差异. 48、72 h, 各组细胞凋亡率明显增加, 但-0.8 ℃组明显低于0 ℃组及4 ℃组(表1, 图2); 各组细胞死亡率呈上升的趋势, 但各时间点, 各组无统计学差异(表1, 图2). 因此, 零下非结冰(-0.8 ℃)较0 ℃及4 ℃明显提高了低温保存C3A细胞的存活率, 而存活率的提高主要是通过降低细胞凋亡实现的.
| 分组 | 细胞存活率 | 细胞凋亡率 | 细胞死亡率 | ||||||
| 24 h | 48 h | 72 h | 24 h | 48 h | 72 h | 24 h | 48 h | 72 h | |
| -0.8 ℃组 | 94.23±0.73 | 90.24±1.48 | 86.49±2.80 | 0.82±0.21 | 1.05±0.57 | 1.26±0.84 | 3.93±0.55 | 5.51±1.08 | 7.65±0.89 |
| 0 ℃组 | 93.86±0.74 | 88.33±1.53a | 81.50±2.83a | 0.91±0.22 | 3.01±0.86a | 5.34±1.20a | 4.26±0.61 | 5.72±1.12 | 7.89±1.01 |
| 4 ℃组 | 93.51±0.79 | 85.16±1.57a | 77.83±3.40ac | 1.05±0.23a | 5.04±0.93ac | 9.16±1.99ac | 4.39±0.69 | 5.91±1.03 | 8.18±1.05 |
新鲜细胞LDH释放为(28.43±1.04) U/L. 随低温保存时间延长, 反应细胞损伤程度的LDH释放呈上升趋势. 24 h, -0.8 ℃组同0 ℃组及4 ℃组相比, 开始出现差异. 48、72 h, 各组LDH释放明显增加, 但-0.8 ℃组明显低于0 ℃组及4 ℃组(表2). 因此, 零下非结冰(-0.8 ℃)明显减轻了细胞低温保存损伤.
新鲜细胞细胞内ATP含量为(11.70±1.73) μg/106 cells, 随低温保存时间延长, 细胞内ATP含量呈下降趋势. 24 h, -0.8 ℃组同0 ℃组及4 ℃组相比, 开始出现差异. 低温保存48、72 h, 各组细胞内ATP含量明显降低, -0.8 ℃组明显优于0 ℃组及4 ℃组(表2).
新鲜细胞为(2.57±0.91) μg/106 cells. 随低温保存时间延长, 反应无氧代谢程度的乳酸释放呈现升高的趋势. 24 h, -0.8 ℃组乳酸释放同0 ℃组及4 ℃组相比, 开始出现差异. 48、72 h, 各组乳酸释放明显增加, -0.8 ℃组明显低于0 ℃组及4 ℃组(表3).
新鲜细胞尿素合成为1.10 mmol/L±0.18 mmol/L. 随着低温保存时间的延长, C3A细胞尿素合成功能呈下降趋势. 低温保存24 h, -0.8 ℃组尿素合成同0 ℃组及4 ℃组相比, 开始出现差异. 低温保存48、72 h, 各组尿素合成明显降低, -0.8 ℃组明显优于0 ℃组及4 ℃组(表3). 因此, 零下非结冰(-0.8 ℃)较好地维持了细胞尿素合成功能.
新鲜细胞白蛋白分泌量为2.46 g/L±0.22 g/L. 随着低温保存时间的延长, C3A细胞白蛋白分泌功能呈下降趋势. 低温保存48 h, -0.8 ℃组白蛋白分泌功能同0 ℃组及4 ℃组相比, 开始出现差异. 低温保存72 h, -0.8 ℃组明显优于0 ℃组及4 ℃组(表4). 因此, 零下非结冰(-0.8 ℃)较好地维持了细胞白蛋白分泌功能.
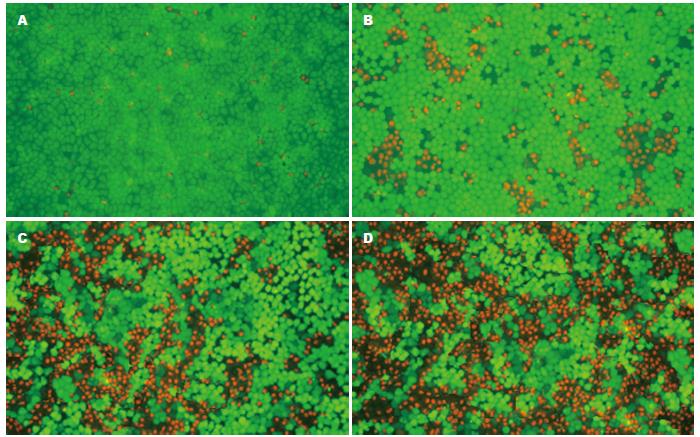
新鲜细胞0 h细胞贴壁良好, 未见悬浮细胞, 细胞接触良好, 死亡细胞少; 低温保存72 h, 4 ℃组及0 ℃组细胞较-0.8 ℃组死亡比例明显增加, 悬浮细胞增多, 细胞间隙变大, 细胞膜周围出现"毛刺"样改变, 细胞内可见"空泡样"改变(图3).
低温保存是基于低温可以延缓细胞代谢速率、阻止细胞能量枯竭从而长时间保存细胞. 根据Van't Hoffs定律, 温度每下降10 ℃, 大多数细胞的酶活性将下降1.5至2.0倍[11]. 为获得较高的细胞存活率及延长低温保存时间, 许多学者对多种保护剂进行了研究, 但常规低温(4 ℃)保存肝细胞48 h后细胞存活率均明显下降[12,13], 因此, 研究者开始把细胞低温保存转向SZNF保存或超冷保存[14]. SZNFT是指0 ℃到某溶液冰点(freezing point)之间的温度范围, 而超冷温度是指冰点至冰晶形成阈值温度之间的温度范围. 如: 当蒸馏水外界温度缓慢降至0 ℃, 蒸馏水并不结冰并保持液态. 继续缓慢降温, 当蒸馏水温度降至
-3 ℃, 冰晶开始形成同时释放热能, 蒸馏水内部的温度突然上升至0 ℃, 完全结冰后, 蒸馏水的温度随外界温度的降低而下降并保持一致. 蒸馏水的SZNFT是0 ℃, 超冷温度是0 ℃-(-3 ℃). UW液的SZNFT是0 ℃-(-1 ℃), 超冷温度是(-1 ℃)-(-7 ℃). C3A细胞的SZNFT是0 ℃-(-1 ℃), 超冷温度是(-1 ℃)-(-4 ℃). 为了避免低温保存过程中冰晶形成且将细胞代谢降至最低, 本研究将用UW液于-0.8 ℃低温保存C3A细胞且缓慢降温(温度由4 ℃降至-0.8 ℃时间大于60 min).
细胞膜及细胞内细胞器质膜的完整性程度是影响细胞功能的重要因素[15,16]. 温度变化可以引起细胞膜脂质双分子位相变换(磷脂酰丝氨酸由脂质双层内侧翻向外侧, 并可与Annexin V特意结合, 是早期细胞凋亡的敏感指标)或者通透性改变(PI不能通过正常细胞膜, 但可以通过晚期凋亡细胞和死亡细胞的不完整细胞膜, 与细胞核核酸结合)等损伤, 从而影响低温保存肝细胞的活性[17]. 本研究通过Annexin V-FITC/PI双染法, 使用流式细胞仪测定细胞存活率及凋亡率发现: -0.8 ℃较4 ℃及0 ℃明显维持了细胞膜的完整性、提高了低温保存48及72 h C3A细胞的存活率, 减少了C3A细胞凋亡率. 不同低温保存时间点, -0.8 ℃较4 ℃及0 ℃均明显抑制了反应细胞膜损伤程度的LDH的释放.
细胞内ATP含量及乳酸的释放是反应细胞内无氧代谢的敏感指标[18]. 依靠分解ATP供能在细胞抵抗低温损伤过程中发挥着重要的作用, ATP的耗竭可引起一系列的级联反应并最终导致不可逆的细胞损伤[19]. 本研究发现: SZNF较4 ℃及0 ℃明显提高了低温保存72 h C3A细胞内ATP含量, 抑制了72 h细胞乳酸的释放. 即4 ℃并未完全阻断C3A细胞内无氧代谢进程, 也提示SZNF可抑制低温保存过程中降解酶的释放而减轻低温细胞损伤. 另外, 细胞内ATP可保护线粒体氧化磷酸化的进行, 减轻低温保存引起的细胞肿胀及细胞内"空泡"形成, 同本研究形态观察的结果基本是一致的: -0.8 ℃低温保存C3A细胞72 h, 细胞体积较新鲜细胞略变大, 但是未出现4 ℃及0 ℃保存C3A细胞引起的细胞膜周围"毛刺"样改变及细胞内"空泡样"改变. Rodríguez
等[20]用UW液保存胶原酶法分离的鼠肝细胞120 h发现: 超冷温度(-4 ℃)较0 ℃明显提高了细胞存活率, 减轻了细胞膜低温保存损伤, 可能系-4 ℃明显抑制了细胞代谢, 提高细胞内ATP含量以及糖原含量有关, 同本研究的结果趋势基本是一致的. 理论上, 超冷温度(-4 ℃)同零下非结冰温度(-0.8 ℃)相比, 将细胞保存于冰点以下, 可将细胞代谢降的更低, 但是外界温度的微变均有引起冰晶形成的可能, 进而引起不可逆的细胞损伤, 为不安全温度范围, 而零下非结冰将细胞保存于冰点以上, 为安全的温度范围, 可以有效避免冰晶的形成, 两者有无差别目前仍然不明确.
作为BLASS生物材料体外培养的肝细胞, 应具备体内肝细胞氨基清除功能(氯化铵转化试验)及白蛋白分泌等主要功能. 而低温保存对不同种属肝细胞氨基清除能力及白蛋白分泌的影响可能不同: Calligaris等[21]用UW液4 ℃保存鼠肝细胞72 h, 发现低温保存的肝细胞氨基清除能力和尿素合成能力同新鲜细胞无明显差异. Almada等[22]进一步用UW液0 ℃保存鼠肝细胞120 h, 测定尿素合成过程中两重要限速酶(氨甲酰基合成酶Ⅰ及鸟氨酸合成酶)活性及基因的表达. 结果显示0 ℃低温保存肝细胞同新鲜分离鼠肝细胞的尿素合成酶的活性及基因表达无统计学差异. 本研究零下非结冰保存C3A细胞, 其氨基清除能力及白蛋白分泌随时间延长呈下降的趋势, 可能系C3A为人源性高分化肿瘤细胞, 其相关酶系分化不完全[23], 同原代鼠肝细胞相比, 易于受到低温细胞损伤. 但是各时间点-0.8 ℃较4 ℃及0 ℃均更好的维持了肝细胞的氨基清除(尿素合成)功能及白蛋白分泌功能.
有关肝细胞在低温保存过程中死亡的机制尚未完全阐明, 除了冰晶形成、渗透压改变及化学改变如pH外, Fu等[24]在肝细胞深低温冻存复苏后, 采用膜联蛋白相关的TUNEL法、流式细胞术及DNA梯度分析发现: 同未冻存细胞相比, 冻存后洗白凋亡指数明显增加. Kao等[25]用UW液4 ℃低温保存鼠肝细胞24 h发现: 同新鲜细胞相比, 低温保存细胞凋亡指数明显增加, 同时伴有热休克蛋白(hot shock protein, HSP)表达的下降. 因此, 细胞凋亡是除了坏死之外, 低温保存肝细胞死亡的另一个重要途径. 本研究也通过流式细胞术分析发现: 零下非结冰(-0.8 ℃)较0 ℃及4 ℃明显提高了低温保存C3A细胞的存活率, 而存活率的提高主要是通过降低细胞凋亡实现的.
细胞凋亡有两个独立的途径: (1)死亡受体途径[26-28](外源性途径即由Fas/CD95和TNFR介导的通路). (2)线粒体途径[29-31](内源性途径即Cty.C, Caspase3等介导的通路). 两个途径并不是孤立存在, 具有交互作用, 而且在不同的水平还受多种调控因子的调节: Bcl-2、HSP可以通过不同途径抑制凋亡的发生, 而Bax、Bad则促进凋亡的发生, Bcl-2/Bax比值是衡量细胞凋亡指数的一个指标[32]. 关于低温保存引起细胞凋亡的具体机制仍然不清除, 但也取得了一定的进展: Fu等[33]将肝细胞由37 ℃降至32 ℃培养12 h, 采用流式细胞术及DNA梯度分析Fas介导的细胞凋亡作用. 结果显示, 低温抑制了Fas介导的细胞凋亡. Matsushita等[34]在冻存前细胞培养液中加入25 mmol/L广谱细胞凋亡蛋白酶抑制剂IDN-1965, 液氮冻存2 wk后复苏, 立即检测细胞凋亡指数(TUNEL法)、Caspase3活性及Cty.C释放. 结果: IDN-1965明显提高了细胞存活率, 抑制了Caspase3活性及Cty.C释放. Baust等[35]液氮冻存人成纤维细胞, 于复苏后0、6、12及24 h测定细胞存活率及Bcl-2/Bax比值, 发现: Bcl-2/Bax比值同冻存诱导的细胞凋亡明显相关. 因此, 线粒体途径相关的细胞凋亡在细胞冻存损伤中发挥了重要的作用, 但是零下非结冰是否是通过线粒体途径抑制了低温损伤引起的细胞凋亡仍然不明确, 有待进一步研究.
总之, 同常规低温(4 ℃及0 ℃)相比, 使用UW液零下非结冰保存肝细胞可以明显的提高复温后细胞存活率及细胞内ATP含量, 降低低温损伤引起的细胞凋亡, 有效的保护肝细胞尿素合成功能和白蛋白分泌功能. 采用零下非结冰保存肝细胞, 建立一个"血库样"随时可用(ready to use)的肝细胞库, 可以有效地促进BLASS的发展.
目前肝功能衰竭病死率达80%左右, 现有病因治疗及支持治疗疗效甚微. 肝移植被认为是最有效的治疗手段, 但存在供体严重不足、终生免疫治疗及费用昂贵等缺点. 生物人工肝的发展为肝衰竭的治疗提供了新的途径: 通过人工肝支持, 一方面可使可逆肝衰竭患者正常肝细胞再生恢复肝功能, 另一方面可为不可逆肝衰竭患者最终的肝移植赢得宝贵的供肝时间.
朱亮, 副教授, 大连医科大学生理教研室.
获得大量的生物转化和分泌功能好且能快速临床应用的肝细胞是生物人工肝的核心. 而探索出一种有效的肝细胞低温保存体系, 建立一个"ready to use"肝细胞库, 临床随时可以得到大量高活率有功能的肝细胞, 可有效解决制约人工肝发展的瓶颈, 是人工肝推广的基础.
目前肝细胞低温保存分为两大类: (1)-196 ℃深低温冻存; (2)4 ℃常规低温保存. 为提高低温保存复温后肝细胞的存活率, 学者们对多种冻存保护剂进行了研究, 发现细胞凋亡是除了坏死之外, 低温保存肝细胞死亡的另一个重要途径.
本文首次用UW液采用零下非结冰温度(-0.8 ℃)保存生物人工肝用人源性C3A细胞, 同常规低温(4 ℃及0 ℃)比较, 分析了零下非结冰保存人源肝细胞的效果以及同细胞凋亡的关系.
本研究提示, 零下非结冰不同于深低温冻存和常规低温保存, 是一种有效的肝细胞低温保存方法. 采用零下非结冰保存肝细胞, 建立一个(ready to use)肝细胞库, 可能对人工肝普遍推广有很大的促进作用.
零下非结冰温度: 是指0 ℃到某溶液冰点(freezing point)之间的温度范围, 超冷温度是指某溶液冰点到冰晶形成阈值温度之间的温度范围. 如本文中UW液降温曲线, 冰点为-1 ℃, 冰晶形成阈值温度为-7 ℃, 因此UW液零下非结冰温度是: 0 ℃-(-1) ℃, 超冷温度是: (-1) ℃-(-7) ℃.
本研究为生物人工肝研究中肝细胞保存提供了新的思路和理论依据, 有一定的应用价值和参考意义.
编辑: 李军亮 电编:吴鹏朕
| 1. | Demetriou AA, Brown RS Jr, Busuttil RW, Fair J, McGuire BM, Rosenthal P, Am Esch JS 2nd, Lerut J, Nyberg SL, Salizzoni M, Fagan EA, de Hemptinne B, Broelsch CE, Muraca M, Salmeron JM, Rabkin JM, Metselaar HJ, Pratt D, De La Mata M, McChesney LP, Everson GT, Lavin PT, Stevens AC, Pitkin Z, Solomon BA. Prospective, randomized, multicenter, controlled trial of a bioartificial liver in treating acute liver failure. Ann Surg. 2004;239:660-667; discussion 667-670. [PubMed] [DOI] |
| 2. | Gerlach JC, Mutig K, Sauer IM, Schrade P, Efimova E, Mieder T, Naumann G, Grunwald A, Pless G, Mas A. Use of primary human liver cells originating from discarded grafts in a bioreactor for liver support therapy and the prospects of culturing adult liver stem cells in bioreactors: a morphologic study. Transplantation. 2003;76:781-786. [PubMed] [DOI] |
| 4. | Fiegel HC, Kaufmann PM, Bruns H, Kluth D, Horch RE, Vacanti JP, Kneser U. Hepatic tissue engineering: from transplantation to customized cell-based liver directed therapies from the laboratory. J Cell Mol Med. 2008;12:56-66. [PubMed] [DOI] |
| 5. | Lloyd TD, Orr S, Berry DP, Dennison AR. Development of a protocol for cryopreservation of hepatocytes for use in bioartificial liver systems. Ann Clin Lab Sci. 2004;34:165-174. [PubMed] |
| 6. | Llarrull MS, Pizarro MD, Scandizzi AL, Bottai H, Guibert EE, Rodriguez JV. Cold preservation of isolated hepatocytes in UW solution: experimental studies on the respiratory activity at 0 degrees C. Cryo Letters. 2007;28:313-328. [PubMed] |
| 7. | Fleming KK, Hubel A. Cryopreservation of hematopoietic and non-hematopoietic stem cells. Transfus Apher Sci. 2006;34:309-315. [PubMed] [DOI] |
| 8. | Matsumoto N, Yoshizawa H, Kagamu H, Abe T, Fujita N, Watanabe S, Kuriyama H, Ishiguro T, Tanaka J, Suzuki E. Successful liquid storage of peripheral blood stem cells at subzero non-freezing temperature. Bone Marrow Transplant. 2002;30:777-784. [PubMed] [DOI] |
| 9. | Soltys KA, Batta AK, Koneru B. Successful nonfreezing, subzero preservation of rat liver with 2,3-butanediol and type I antifreeze protein. J Surg Res. 2001;96:30-34. [PubMed] [DOI] |
| 10. | Ambros JT, Herrero-Fresneda I, Borau OG, Boira JM. Ischemic preconditioning in solid organ transplantation: from experimental to clinics. Transpl Int. 2007;20:219-229. [PubMed] [DOI] |
| 11. | Belzer FO, Southard JH. Principles of solid-organ preservation by cold storage. Transplantation. 1988;45:673-676. [PubMed] [DOI] |
| 12. | Shanina IV, Kravchenko LP, Fuller BJ, Grischenko VI. A comparison of a sucrose-based solution with other preservation media for cold storage of isolated hepatocytes. Cryobiology. 2000;41:315-318. [PubMed] [DOI] |
| 14. | Guibert EE, Almada LL, Mamprin ME, Bellarosa C, Pizarro MD, Tiribelli C, Rodriguez JV. Subzero nonfreezing storage of rat hepatocytes using UW solution and 1,4-butanediol. II- functional testing on rewarming and gene expression of urea cycle enzymes. Ann Hepatol. 2009;8:129-133. [PubMed] |
| 15. | Limaye LS, Kale VP. Cryopreservation of human hematopoietic cells with membrane stabilizers and bioantioxidants as additives in the conventional freezing medium. J Hematother Stem Cell Res. 2001;10:709-718. [PubMed] [DOI] |
| 16. | Sasnoor LM, Kale VP, Limaye LS. Supplementation of conventional freezing medium with a combination of catalase and trehalose results in better protection of surface molecules and functionality of hematopoietic cells. J Hematother Stem Cell Res. 2003;12:553-564. [PubMed] [DOI] |
| 17. | Katenz E, Vondran FW, Schwartlander R, Pless G, Gong X, Cheng X, Neuhaus P, Sauer IM. Cryopreservation of primary human hepatocytes: the benefit of trehalose as an additional cryoprotective agent. Liver Transpl. 2007;13:38-45. [PubMed] [DOI] |
| 18. | Dabos KJ, Parkinson JA, Nelson LJ, Sadler IH, Hayes PC, Plevris JN. The effect of hypothermia on primary porcine hepatocyte metabolism monitored by (1H) nuclear magnetic resonance spectroscopy. Eur J Gastroenterol Hepatol. 2003;15:283-293. [PubMed] [DOI] |
| 20. | Rodríguez JV, Almada LL, Mamprin ME, Guibert EE, Furno G. Subzero nonfreezing storage of rat hepatocytes using modified University of Wisconsin solution (mUW) and 1,4-butanediol. I- effects on cellular metabolites during cold storage. Ann Hepatol. 2009;8:57-62. [PubMed] |
| 21. | Calligaris SD, Almada LL, Guibert EE, Tiribelli C, Rodriguez JV. Ammonium detoxifying activity is maintained after 72 hours of cold preservation of rat hepatocytes in University of Wisconsin (UW) solution. Cryo Letters. 2002;23:245-254. [PubMed] |
| 22. | Almada L, Bellarosa C, Giraudi P, Mamprín M, Mediavilla M, Guibert E, Tiribelli C, Rodríguez J. Gene expression and activity of urea cycle enzymes of rat hepatocytes cold stored up to 120h in University of Wisconsin solution. Cryobiology. 2006;52:393-400. [PubMed] [DOI] |
| 23. | Kinasiewicz A, Gautier A, Lewinska D, Bukowski J, Legallais C, Weryński A. Culture of C3A cells in alginate beads for fluidized bed bioartificial liver. Transplant Proc. 2007;39:2911-2913. [PubMed] [DOI] |
| 24. | Fu T, Guo D, Huang X, O'Gorman MR, Huang L, Crawford SE, Soriano HE. Apoptosis occurs in isolated and banked primary mouse hepatocytes. Cell Transplant. 2001;10:59-66. [PubMed] |
| 25. | Kao YH, Goto S, Jawan B, Nakano T, Hsu LW, Lin YC, Pan MC, Lai CY, Sun CK, Cheng YF. Heat preconditioning ameliorates hepatocyte viability after cold preservation and rewarming, and modulates its immunoactivity. Transpl Immunol. 2008;18:220-231. [PubMed] [DOI] |
| 26. | Keckler MS. Dodging the CTL response: viral evasion of Fas and granzyme induced apoptosis. Front Biosci. 2007;12:725-732. [PubMed] [DOI] |
| 27. | Wesche-Soldato DE, Chung CS, Gregory SH, Salazar-Mather TP, Ayala CA, Ayala A. CD8+ T cells promote inflammation and apoptosis in the liver after sepsis: role of Fas-FasL. Am J Pathol. 2007;171:87-96. [PubMed] [DOI] |
| 29. | Kuo HM, Tsai HC, Lin YL, Yang JS, Huang AC, Yang MD, Hsu SC, Chung MC, Gibson Wood W, Chung JG. Mitochondrial-dependent caspase activation pathway is involved in baicalein-induced apoptosis in human hepatoma J5 cells. Int J Oncol. 2009;35:717-724. [PubMed] |
| 30. | Chen J, Delannoy M, Odwin S, He P, Trush MA, Yager JD. Enhanced mitochondrial gene transcript, ATP, bcl-2 protein levels, and altered glutathione distribution in ethinyl estradiol-treated cultured female rat hepatocytes. Toxicol Sci. 2003;75:271-278. [PubMed] [DOI] |
| 31. | Guha M, Kumar S, Choubey V, Maity P, Bandyopadhyay U. Apoptosis in liver during malaria: role of oxidative stress and implication of mitochondrial pathway. FASEB J. 2006;20:1224-1226. [PubMed] [DOI] |
| 32. | Ping P, Murphy E. Role of p38 mitogen-activated protein kinases in preconditioning: a detrimental factor or a protective kinase? Circ Res. 2000;86:921-922. [PubMed] |
| 33. | Fu T, Blei AT, Takamura N, Lin T, Guo D, Li H, O'Gorman MR, Soriano HE. Hypothermia inhibits Fas-mediated apoptosis of primary mouse hepatocytes in culture. Cell Transplant. 2004;13:667-676. [PubMed] [DOI] |
| 34. | Matsushita T, Yagi T, Hardin JA, Cragun JD, Crow FW, Bergen HR 3rd, Gores GJ, Nyberg SL. Apoptotic cell death and function of cryopreserved porcine hepatocytes in a bioartificial liver. Cell Transplant. 2003;12:109-121. [PubMed] |