修回日期: 2009-12-06
接受日期: 2009-12-21
在线出版日期: 2010-02-08
目的: 研究靶向Bmi-1 siRNA对胃癌BGC823细胞衰老和转移的作用.
方法: 设计Bmi-1的siRNA靶序列, 分别合成两条互补的寡核苷酸链, 退火后重组入pRNAT-U6.2载体, 转化扩增后进行序列测定. 用脂质体包裹转染人胃癌BGC823细胞, 采用RT-PCR和Western blot分别检测Bmi-1基因mRNA和蛋白表达的变化. SA-β-Gal染色检测和细胞体外侵袭实验检测分析对细胞衰老和侵袭、转移的影响.
结果: 靶向Bmi-1基因的siRNA的双链寡核苷酸片段克隆入pRNAT-U6.2载体, 经测序分析, 插入片段正确; RT-PCR和Western blot检测显示, Bmi-1基因的表达水平明显降低, 其中以1 104-1 122 nt(GGAGGAGGTGAATGAT AAA)为靶序列的siRNA沉默作用最佳, Bmi-1 mRNA和蛋白表达几乎完全抑制. 转染siRNA组的衰老细胞百分率显著升高、穿透Matrigel的细胞数显著下降, 与未转染和转染空载体组比较差异有显著性(P<0.01).
结论: 抑制胃癌BGC823细胞Bmi-1基因表达, 可以增加细胞的衰老和降低细胞侵袭、转移的能力.
引文著录: 高凤兰, 刘春灵, 李维山, 赵国强. 沉默Bmi-1基因表达对胃癌细胞BGC823衰老和转移的作用. 世界华人消化杂志 2010; 18(4): 335-339
Revised: December 6, 2009
Accepted: December 21, 2009
Published online: February 8, 2010
AIM: To investigate the effects of B-cell-specific Moloney murine leukaemia virus insertion site 1 (Bmi-1) gene knock-down on cell senescence and migration in human gastric caner cell line BGC823.
METHODS: Two pairs of complementary small hairpin RNA (shRNA) oligonucleotides targeting the Bmi-1 gene were devised, synthesized, annealed and cloned into the pRNAT-U6.2 vector. After DNA sequencing to verify the correct insertion of the shRNA sequences, the recombinant plasmids were transfected into BGC823 cells. The expression of Bmi-1 mRNA and protein was examined by reverse transcription-polymerase chain reaction (RT-PCR) and Western blot, respectively. The effects of Bmi-1 knockdown on cell senescence and migration were determined by β-Gal activity assay and Boyden chamber assay, respectively.
RESULTS: The double-stranded shRNA oligonucleotides targeting the Bmi-1 gene were successfully cloned into the pRNAT-U6.2 vector. DNA sequencing results verified the correct insertion of the shRNA sequences. RT-PCR and Western blot analyses indicated that the expression levels of Bmi-1 mRNA and protein were significantly downregulated in cells transfected with the recombinant plasmids. Particularly, Bmi-1 protein expression was almost completely abolished in cells transfected with the recombinant vector harboring shRNA targeting the sequence GGAGGAGGTGAATGATAAA (nt 1 104-1 122). Compared with untransfected cells and cells transfected with the empty vector, the average percentage of senescent cells increased and the number of cells passing through the Matrigel decreased in cells transfected with the recombinant vectors.
CONCLUSION: ShRNA-mediated silencing of the Bmi-1 gene can effectively promote cell senescence and reduce migration in human gastric caner cell line BGC823.
- Citation: Gao FL, Liu CL, Li WS, Zhao GQ. ShRNA-mediated silencing of the Bmi-1 gene promotes senescence and inhibits migration in human gastric caner cell line BGC823. Shijie Huaren Xiaohua Zazhi 2010; 18(4): 335-339
- URL: https://www.wjgnet.com/1009-3079/full/v18/i4/335.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i4.335
原癌基因Bmi-1(B-cell specific moloney leukemia virus insertion site-1, Bmi-1)是多梳基因家族(polycomb group, PcG)家族的一员, 属于转录抑制因子, 在许多肿瘤中存在Bmi-1基因的高表达[1-3], Bmi-1高表达提示预后不良[4,5]. 研究表明Bmi-1是通过作用于INK4a/ARF基因位点而影响细胞增殖及衰老的, 且Bmi-1基因的表达水平还与肿瘤的侵袭、转移密切相关[6,7]. 黄丽芳等[8]利用RNA干扰技术抑制Bmi-1在慢性髓性白血病K562细胞中的过表达, 从而抑制K562细胞的增殖. 因此, 本实验拟利用RNA干扰技术, 沉默胃癌BGC823细胞Bmi-1基因的表达, 观察对胃癌BGC823细胞生长和转移的影响.
siRNA载体pRNAT-U6.2购自GeneScript公司; BglⅡ和HindⅢ、T4 DNA连接酶购自Promega公司; Bmi-1抗体(sc-10745)美国Santa Cruz公司; 人胃癌细胞系BGC823购自上海中科院细胞库; RPMI 1640、胎牛血清购自Gibco公司; 脂质体LipofectamineTM2000, G418, TRIzol试剂、RT-PCR试剂盒购自Invitrogen公司.
1.2.1 针对Bmi-1的siRNA靶序列的筛选: 利用Promega siRNA靶序列分析设计系统, 扫描人Bmi-1基因序列(NM_005180), 依据siRNA靶序列设计原则, 经BLAST同源性分析, 最终选择2个确定19个碱基的siRNA靶序列1104-1122 nt(GGAGGAGGTGAATGATAAA)和1356-1374 nt(GAGAGATGGACTGACAAAT)为靶序列. 分别合成2对发卡样DNA寡核苷酸单链(1104F、1104R和1356F、1356R), 两端分别加上BamHⅠ和XhoⅠ内切酶残基, 上海生工公司合成. 1104F 5'-GATCCGGAGGAGGTGAATGATAAA TTCAAGAGATTTATCATTCACCTCCTCC TTTTTTC-3'; 1104R 5'-TCGAGAAAAAAGGAGGAGGTGAATGATAAATCTCTTGAATTTATCATTCACCTCCTCCG-3'; 1356F 5'-GATCCGAGAGATGGACTGACAAATTTCAAGAGAATTTGTCAGTCCATCTCTCTTTTTTC-3'; 1356R 5'-TCGAGAAAAAAGAGAGATGGACTGACAAATTCTCTTGAAATTTGTCAGTCCATCTCTC G-3'.
1.2.2 siRNA载体质量组: 常规方法退火2对发卡样DNA寡核苷酸单链(1104F、1104R和1356F、1356R), 成为双链DNA(si1104和si1356). 然后重组连接, 2×连接反应缓冲液5 μL, 黏末端线性pRNAT-U6.2载体1 μL, T4连接酶1 μL, 退火产物(si1104和si1356)3 μL, 4 ℃过夜, 常规操作方法转化感受态细胞DH5α.
1.2.3 重组子的筛选鉴定: 随机挑取转化菌用通用引物PRNA-U6.2 FORWARD、PRNA-U6.2 REVERSE PCR扩增法鉴定重组子. 取少量菌重悬于50 μL去离子水中100 ℃煮沸裂解细菌为模板, PCR扩增体系为5 μL 10×Buffer, 2 μL 4×dNTP, PRNA-U6.2 FORWARD和PRNA-U6.2 REVERSE各0.5 μL, 0.5 μL Taq DNA聚合酶, 5 μL模板DNA, 去离子H2O补足50 μL. 94 ℃预变性3 min; 94 ℃ 45 s, 55 ℃ 45 s, 72 ℃ 45 s, 35个反应循环. 2%琼脂糖凝胶电泳分析扩增结果. 对阳性重组子的插入序列进行DNA序列分析, 得到pRNAT-U6.2-si1104和pRNAT-U6.2-si1356.
1.2.4 脂质体介导siRNA转染BGC823细胞: 转染方法参照LipofectamineTM2000说明书进行. 转染选择质粒的终浓度为2 mg/L, 分别转染pRNAT-U6.2-si1104和pRNAT-U6.2-si1356为实验1组和实验2组, 同时转染空pRNAT-U6.2质粒作为空载体对照组, 以未转染的BGC823细胞为空白对照组. 转染6 h换用含有800 mg/L G418完全培养基, 筛选培养后进行相关检测.
1.2.5 RT-PCR检测: 按照RT-PCR试剂盒说明书进行操作; Bmi-1引物Forward 5'-GGAGACCAGCAAGTATTGTCC-3'; Reverse 5'-GACCATTCCTTCTCCAGGTAT-3', 扩增片段为517 bp; 同时扩增β-actin作为内参照.
1.2.6 免疫印迹: 收集各组细胞, 超声破碎细胞, 测定蛋白的含量, 取适量样品, 进行SDS聚丙烯酰胺凝胶电泳; 电转到PVDF膜上用含50 g/L脱脂奶粉4 ℃封闭6 h; 加入1:200兔抗人(Bmi-1)多克隆抗体, 4 ℃下孵育过夜; 再用1:2 000山羊抗兔IgG二抗, 孵育1 h. 化学发光法分别检测PVDF膜上Bmi-1蛋白的表达量.
1.2.7 细胞衰老染色: 将各组转染后的细胞接种6孔板, 24 h细胞贴壁后, 使用美国Cell Biolabs公司细胞衰老β-半乳糖苷酶染色试剂盒, 按照说明书步骤进行染色, 后随机选取5个视野进行拍照(×100), 计数每个视野下衰老细胞百分率.
1.2.8 细胞体外侵袭实验: 采用Boyden Chmber Assay方法, 含有Matrigel(美国BD公司)的无血清1640培养基加到上层小室的滤膜上, 37 ℃放置2 h使Matrigel形成凝胶备用. 下室用无血清培养基培养的NIH3T3细胞的上清液200 μL作为趋化因子. 400 μL 1×109/L细胞加入上室. 37 ℃ 50 mL/L CO2条件下培养24 h. HE染色, 显微镜下(×100)随机计数6个视野滤膜背面的细胞数. 每组设5个平行实验.
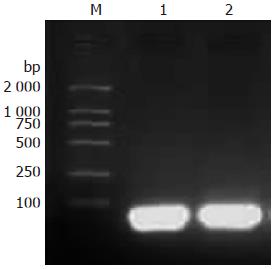
1104F、1104R和1356F、1356R发卡样寡核苷酸DNA单链退火后, 电泳可见明亮条带, 位于100 bp下, 接近100 bp处, 与设计完全一致, 见图1.
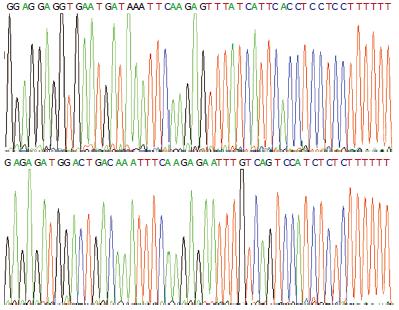
2个发卡样单链DNA退火产物(si1104和si1356)与pRNAT-U6.2双黏质粒连接后, 转化DH5α, 在Amp+LB平板上培养, 都长出10多个转化菌落. 随机各挑选2个克隆, 对插入片段进行DNA序列测定, 均得到与设计一致的阳性重组子(pRNAT-U6.2-si1104和pRNAT-U6.2-si1356)(图2).
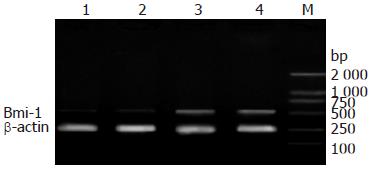
转染pRNAT-U6.2-si1104和pRNAT-U6.2-si1356的实验1、2组胃癌BGC823细胞中Bmi-1 mRNA表达都受到抑制, 其中实验1组的抑制效果优于实验2组; 而两个对照组(空载体组和空白对照组)的细胞中都存在较高水平的Bmi-1 mRNA表达(图3).
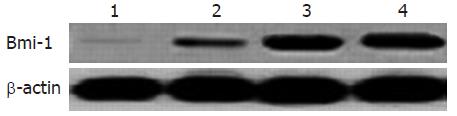
未转染的胃癌BGC823细胞和转染空载体pRNAT-U6.2的细胞中Bmi-1蛋白呈现高表达; 而转染靶向Bmi-1(pRNAT-U6.2-si1104和pRNAT-U6.2-si1356)的实验组胃癌细胞中, Bmi-1蛋白被显著抑制, 其中转染pRNAT-U6.2-si1104的细胞中Bmi-1蛋白几乎完全抑制(图4).
细胞衰老染色实验和细胞体外侵袭实验数据见表1. 转染pRNAT-U6.2-si1104和pRNAT-U6.2-si1356的实验1、2组的平均细胞衰老率, 与2个对照组相比显著增加, 差异有显著性(P<0.01); 实验1、2组穿透Matrigel的平均细胞数, 与2个对照组相比显著减少, 差异有显著性(P<0.01). 说明抑制胃癌BGC823细胞Bmi-1基因表达, 可以增加细胞的衰老和降低细胞侵袭和转移的能力.
| 分组 | 转染质粒 | 衰老染色实验视野内平均细胞衰老率(%) | 体外侵袭实验视野内平均细胞数(个) |
| 实验1组 | pRNAT-U6.2-si1104 | 28.3±3.9b | 22.4±4.2b |
| 实验2组 | pRNAT-U6.2-si1356 | 25.9±4.3b | 33.6±5.5b |
| 空载体对照组 | pRNAT-U6.2 | 15.6±2.7 | 74.7±9.3 |
| 空白对照组 | - | 17.2±3.1 | 68.9±10.1 |
胃癌是消化系常多见的恶性肿瘤, 占全球癌症死亡原因的第2位[9]. 胃癌的浸润及转移是影响预后的重要因素. 其浸润与转移受多因素与多基因调控. 目前, 发现与胃癌发病有关的癌基因主要有c-Myc、Ras、hst、c-erbB-2等[10]. Bmi-1 基因属于PcG成员, 首次被提出是在转基因鼠的淋巴瘤细胞传代中, 可与c-Myc协同作用引起细胞转化和肿瘤形成[1]. 人类Bmi-1基因定位于10p11.23, 由10个外显子组成, cDNA全长3 568 bp, 位于640-1 620 bp的开放阅读框编码一个含326个氨基酸, 相对分子质量45 kDa的核蛋白质. 序列同源性对比显示, 人和小鼠的Bmi-1在DNA水平和氨基酸水平上同源性分别为86%和98%[7]. Bmi-1蛋白有氨基端环指结构和中心区H-T-H结构域, 这对细胞复制寿命的延长和对抑制p16 INK4a是必须的. Jacobs等[11]通过小鼠和体外实验证实INK4a/ARF位点是Bmi-1基因的下游调控位点, 直接受Bmi-1的负调控而影响细胞增殖和衰老. 在不同启动子的作用下, INK4a编码p16 INK4a与p19ARF两种蛋白. 在细胞周期中, 由于cyclinD/CDK4/6复合物的作用, pRB是高度磷酸化的, 使他不能结合并抑制E2F转录因子, 允许E2F靶基因转录, 使细胞由G1期进入S期, 促进细胞生长和增殖. 当Bmi-1高表达时, p16 INK4a表达下调, 促进cyclinD与CDK4/6形成复合物, 通过p16 INK4a/cyclinD/Rb通路, 促进细胞的生长和增殖; Bmi-1高表达还抑制p19ARF, 通过p19ARF/MDM2/P53通路, 阻止细胞周期停滞和细胞凋亡[7]. 肿瘤细胞中Bmi-1基因表达失调间接对pRb和P53的异常调控可能是pRb和P53肿瘤抑制途径频阻的重要原因. 国外有研究[12]表明, Bmi-1基因是一种转录抑制因子, 一旦被激活可高表达于肿瘤细胞中, 其核蛋白产物在INK4a-ARF位点, 即多梳应答元件形成复合物介导相邻基因沉默, 在转录水平来调控细胞的衰老和增殖, 引起一系列的细胞生物学改变. 此外, Bmi-1基因可间接激活人端粒酶逆转录酶(human telomerase reverse transcriptase, hTERT)的活性而永生化人乳腺上皮细胞[13], 这可能是Bmi-1基因参与肿瘤形成的另一途径.
有研究提示胃癌组织中Bmi-1存在高表达现象, 并且Bmi-1的表达水平与肿瘤的大小和淋巴结转移有高度的相关性[4,7]. 黄开红等[14]用RT-PCR方法测定42例胃癌手术切除标本, 结果发现Bmi-1 mRNA表达与胃肿瘤大小、淋巴结转移及浸润深度密切相关(P<0.05), 并且, Bmi-1 mRNA 阳性表达者生存率明显低于阴性者, Bmi-1的过表达与肿瘤发展及预后密切相关. 因此, 本课题利用RNA干扰技术, 设计了2个针对Bmi-1的siRNA靶序列1 104-1 122 nt和1 356-1 374 nt, 构建出2个重组siRNA载体pRNAT-U6.2-si1104和pRNAT-U6.2-si1356, 转染入胃癌BGC823细胞. RT-PCR和Western blot检测结果显示, 以1 104-1 122 nt(GGAGGAGGTGAATGATAAA)靶序列构建的siRNA载体pRNAT-U6.2-si1104转染的细胞, Bmi-1基因在mRNA和蛋白水平的表达被非常有效的抑制; 细胞衰老染色实验结果显示, 该组细胞的平均细胞衰老率最高28.3%±3.9%; 同时体外侵袭实验结果显示, 该组细胞穿透Matrigel的平均细胞数最少22.4±4.2. 说明抑制胃癌BGC823细胞Bmi-1基因表达, 可以增加胃癌BGC823细胞的衰老和降低细胞侵袭和转移能力. 本实验结果与文献报道相似, 胃癌的发生与发展受多因素影响、多基因调控, 多步骤逐渐演进的过程, Bmi-1在胃癌的发生发展、浸润侵袭转移过程中起着重要的作用, 通过进一步的深入研究和探索, Bmi-1有望成为胃癌基因治疗的靶点.
胃癌的浸润及转移是影响预后的重要因素, 其浸润与转移受多因素与多基因调控. 目前, 发现与胃癌发病有关的癌基因主要有c-Myc、Ras、hst、c-erbB-2等. Bmi-1 基因可与c-Myc 协同对恶性细胞逃逸于凋亡有重要作用, 引起细胞转化和肿瘤形成.
唐世刚, 教授, 大连大学附属中山医院内科
国内外文献报道Bmi-1基因在多种肿瘤中均有表达, 且与肿瘤的侵袭、转移密切相关. RNA干扰因其可在胞质中导致同源的mRNA特异性降解从而特异性抑制基因表达已成为人们研究的热点.
黄丽芳等利用RNA干扰技术抑制Bmi-1在慢性髓性白血病K562细胞中的过表达, 从而抑制K562细胞的增殖, 本文利用RNA干扰技术, 沉默胃癌BGC823细胞Bmi-1基因的表达, 观察分析对胃癌细胞衰老和侵袭、转移的影响, 为胃癌治疗寻求新的靶点.
本研究成功构建了Bmi-1真核表达质粒, 并转染了人胃癌BGC823细胞, 利用RNA干扰技术, 沉默胃癌BGC823细胞Bmi-1基因的表达, 观察对胃癌BGC823细胞生长和转移的影响, 结果发现抑制胃癌BGC823细胞Bmi-1基因表达, 可以增加细胞的衰老和降低细胞侵袭、转移的能力.
本研究利用RNA干扰技术, 沉默胃癌BGC823细胞Bmi-1基因的表达, 观察分析对胃癌细胞衰老和侵袭、转移的影响, 为胃癌治疗寻求新的靶点.
本文以siRNA干扰技术, 沉寂Bmi-1基因, 从而发现其基因和蛋白表达水平降低, 可以导致胃癌细胞的衰老加速和转移能力下降, 对胃癌的基因治疗和靶点选择提供了实验依据, 实验结果有一定的说服力.
编辑: 李军亮 电编:何基才
| 1. | van Kemenade FJ, Raaphorst FM, Blokzijl T, Fieret E, Hamer KM, Satijn DP, Otte AP, Meijer CJ. Coexpression of BMI-1 and EZH2 polycomb-group proteins is associated with cycling cells and degree of malignancy in B-cell non-Hodgkin lymphoma. Blood. 2001;97:3896-3901. [PubMed] [DOI] |
| 2. | Vonlanthen S, Heighway J, Altermatt HJ, Gugger M, Kappeler A, Borner MM, van Lohuizen M, Betticher DC. The bmi-1 oncoprotein is differentially expressed in non-small cell lung cancer and correlates with INK4A-ARF locus expression. Br J Cancer. 2001;84:1372-1376. [PubMed] [DOI] |
| 3. | Kim JH, Yoon SY, Kim CN, Joo JH, Moon SK, Choe IS, Choe YK, Kim JW. The Bmi-1 oncoprotein is overexpressed in human colorectal cancer and correlates with the reduced p16INK4a/p14ARF proteins. Cancer Lett. 2004;203:217-224. [PubMed] [DOI] |
| 5. | Wang H, Pan K, Zhang HK, Weng DS, Zhou J, Li JJ, Huang W, Song HF, Chen MS, Xia JC. Increased polycomb-group oncogene Bmi-1 expression correlates with poor prognosis in hepatocellular carcinoma. J Cancer Res Clin Oncol. 2008;134:535-541. [PubMed] [DOI] |
| 6. | Glinsky GV. Stem cell origin of death-from-cancer phenotypes of human prostate and breast cancers. Stem Cell Rev. 2007;3:79-93. [PubMed] [DOI] |
| 7. | Park IK, Morrison SJ, Clarke MF. Bmi1, stem cells, and senescence regulation. J Clin Invest. 2004;113:175-179. [PubMed] |
| 9. | Shah MA, Schwartz GK. Treatment of metastatic esophagus and gastric cancer. Semin Oncol. 2004;31:574-587. [PubMed] [DOI] |
| 10. | Ketchum LD, Cohen IK, Masters FW. Hypertrophic scars and keloids. A collective review. Plast Reconstr Surg. 1974;53:140-154. [PubMed] [DOI] |
| 11. | Jacobs JJ, Kieboom K, Marino S, DePinho RA, van Lohuizen M. The oncogene and Polycomb-group gene bmi-1 regulates cell proliferation and senescence through the ink4a locus. Nature. 1999;397:164-168. [PubMed] [DOI] |
| 12. | Haupt Y, Alexander WS, Barri G, Klinken SP, Adams JM. Novel zinc finger gene implicated as myc collaborator by retrovirally accelerated lymphomagenesis in E mu-myc transgenic mice. Cell. 1991;65:753-763. [PubMed] [DOI] |
| 13. | Dimri GP, Martinez JL, Jacobs JJ, Keblusek P, Itahana K, Van Lohuizen M, Campisi J, Wazer DE, Band V. The Bmi-1 oncogene induces telomerase activity and immortalizes human mammary epithelial cells. Cancer Res. 2002;62:4736-4745. [PubMed] |