修回日期: 2010-10-22
接受日期: 2010-11-02
在线出版日期: 2010-12-28
目的: 研究奥曲肽(Octrotide, OCT)对结肠癌SW480细胞中APC/β-catenin/TCF通路各热点分子在mRNA水平和蛋白水平表达量的影响, 初步探讨OCT调控SW480细胞APC/β-catenin/TCF通路的分子靶点.
方法: (1)mRNA检测: 体外培养人结肠癌SW480细胞, 分为对照组和OCT组(10-10 mol/L), 分别提取两组细胞的总RNA, 以RT-PCR法检测APC2、AXIN、CK1α、Cyclin D1、FZD7的mRNA, 筛选出两组细胞5个基因mRNA的表达差异; (2)蛋白检测: 体外培养人结肠癌SW480细胞, 分为对照组和OCT 1、2、3组(10-14、10-12、10-10 mol/L), 分别提取4组细胞的总蛋白, 以Western blot法检测APC2、CK1α、Cyclin D1的蛋白质, 鉴定4组细胞中3个基因在蛋白水平的表达差异.
结果: (1)mRNA检测: OCT组(10-10 mol/L)中APC2、CK1α的mRNA表达上调(均P<0.05), Cyclin D1的mRNA表达下调(P<0.05), AXIN和FZD7的mRNA改变无统计学意义(P>0.05); (2)蛋白检测: OCT 1、2、3组中APC2、CK1α蛋白表达上调(P<0.05), Cyclin D1蛋白表达下调(P<0.05), 且呈浓度依赖性.
结论: OCT通过强化APC2、CK1α"负反馈"调节作用, 下调靶基因Cyclin D1, 负性调控结肠癌SW480中APC/β-catenin/TCF通路.
引文著录: 王松, 包铮, 龙建武, 肖忠盛, 李峰, 梁庆模. APC/β-catenin/TCF通路在奥曲肽调控结肠癌SW480中的分子机制. 世界华人消化杂志 2010; 18(36): 3857-3862
Revised: October 22, 2010
Accepted: November 2, 2010
Published online: December 28, 2010
AIM: To investigate whether the APC/β-catenin/TCF signaling pathway is involved in the regulatory effects of octreotide (OCT) on SW480 colon cancer cells.
METHODS: (1) mRNA testing: SW480 cells were cultured in vitro and divided into control group and OCT group (treated with 10-10 mol/L OCT). Total RNA was prepared from the two groups of cells and used to detect the mRNA expression of APC2, AXIN, CK1α, cyclin D1 and FZD7 by RT-PCR. (2) Protein testing: SW480 cells were cultured in vitro and divided into control group and OCT group (treated with /L OCT at a concentration of 10-14, 10-12 or 10-10 mol/L). Total protein was prepared from the two groups of cells and used to detect the protein expression of APC2, CK1α and CyclinD1 by Western blot.
RESULTS: (1) mRNA testing: Treatment with OCT increased the mRNA levels of APC2 and CK1α (both P < 0.05), decreased that of cyclin D1 (P < 0.05), but had no significant impact on those of FZD7 and axin (both P > 0.05) in SW480 cells; (2) Protein testing: Treatment with different concentrations of OCT increased the protein levels of APC2 and CK1α and decreased that of cyclin D1 in SW480 cells in a dose-dependent manner (all P < 0.05).
CONCLUSION: OCT can negatively regulate APC/β-catenin/TCF signaling by up-regulating APC2 and CK1α expression and down-regulating cyclin D1 expression.
- Citation: Wang S, Bao Z, Long JW, Xiao ZS, Li F, Liang QM. Involvement of the APC/β-catenin/TCF signaling pathway in the regulatory effects of octreotide on SW480 colon cancer cells. Shijie Huaren Xiaohua Zazhi 2010; 18(36): 3857-3862
- URL: https://www.wjgnet.com/1009-3079/full/v18/i36/3857.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i36.3857
结肠癌的发病率为恶性肿瘤的第4位, 而且近年来有逐渐增加的趋势. 结肠癌发生、发展机制较为复杂, 目前的分子模型提示其多阶段的发展过程中, 涉及到许多癌基因、抑癌基因和信号通路的改变. 其中约80%-90%的结肠癌中存在APC突变, 而非APC突变结肠癌中50%为β-catenin突变, 两者均为APC/β-catenin/TCF通路关键分子, 因此APC/β-catenin/TCF通路是控制结肠癌发生、发展的主要通路, 亦是结肠癌治疗的主要靶点之一. 近年来, 大量的研究发现奥曲肽对多种实体肿瘤的生长具有良好的抑制作用, 而其不良反应小, 患者耐受性好, 具有广阔的应用前景. 我们的前期工作也已证实奥曲肽可抑制结肠癌SW480增殖, 下调β-catenin蛋白[1], 并通过基因芯片初步了解到奥曲肽使结肠癌SW480细胞APC/β-catenin/TCF通路30个基因发生差异性改变, 其中13个基因显著上调, 主要涉及APC2、AXIN家族、CK1家族, 17个基因显著下调[2], 但是奥曲肽调控APC/β-catenin/TCF通路的机制尚未阐明. 因此本文参考基因芯片结果对热点基因进行研究, 以期证实奥曲肽调控结肠癌SW480中APC/β-catenin/TCF通路的分子机制, 为奥曲肽治疗结肠癌提供理论基础.
人结肠腺癌细胞株SW480, 系人结肠低分化黏液腺癌, 购于中南大学湘雅医学院. 醋酸奥曲肽注射液(批号: S0065, 北京诺华制药有限公司); RPMI 1640培养基(美国Gibco公司); 新生牛血清(杭州四季青公司); 胰蛋白酶(美国Amresco公司); DAB显色试剂为福州迈新公司; RT-PCR试剂盒、溴化乙锭(EB)、Taq酶等(美国Promega公司); 1, 4二硫苏糖醇、逆转录试剂盒(美国Amersham Biosciences公司); Tripure RNA 提取试剂盒、甲叉丙烯酰胺(美国Roche公司); APC2、AXIN、CK1α、FZD7和Cyclin D1引物由上海生工生物技术公司合成. CK1α(F158)兔抗人多克隆抗体、APC2(N32)兔抗人多克隆抗体和Cyclin D1(L283)兔抗人多克隆抗体(美国Abzoom公司); β-actin单克隆抗体、辣根酶标记羊抗兔IgG、辣根酶标记羊抗兔IgG(北京中杉金桥公司).
1.2.1 细胞培养: SW480细胞培养于含10%小牛血清, 1×105 U/L青霉素及1×105 U/L链霉素RPMI 1640完全培养基中, 在37 ℃, 50 mL/L CO2及饱和湿度条件下培养, 细胞呈单层生长, 铺满培养瓶约2-3 d传代1次. 取对数生长期细胞用于实验.
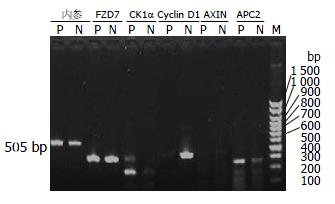
1.2.2 RT-PCR法检测基因mRNA表达: 依照前期实验结果[1,2], 取奥曲肽抑制SW480最佳抑制浓度为实验组, 即OCT组(10-10mol/L); 对照组为SW480加入培养基、生理盐水. 以上均培养24 h. 分别提取2组细胞的总RNA, 逆转录合成cDNA, PCR扩增APC2、CSNK1A1L、Cyclin D1、AXIN、FZD7(表1), RT-PCR产物鉴定及半定量分析, 最后凝胶图像分析APC2、CSNK1A1L、Cyclin D1、AXIN、FZD7表达强度.
| 热点基因 | 序列(5'-3') | 扩增片段长度(bp) |
| APC2 | A: GGA TGG AGA AGG CGA AAG TGA G | 352 |
| S: TTG CCA AAG GGT AGG GAA ATG | ||
| AXIN1 | A: CAG TCA AAC TCG TCG CTC AC | 444 |
| S: CTC CCA CCT CTT CAT CCA A | ||
| Cyclin D1 | A: CCT CCC ACG AAA CGC TAC T | 404 |
| S: CGA TGC CAA CCT CCT CAA | ||
| CK1α | A: TCC TCC ACT ACC TCC ACC | 255 |
| S: AGG CTA CAC CTT TGA CTA TGC | ||
| FZD7 | A: CCT TTA GCG AAG TCA GAA CCT | 363 |
| S: GCC AAG GAG ACG TGG AGT A | ||
| β-actin | A: GTGGG GCGCC CCAGG CACCA | 505 |
| S: CTTCC TTAAT GTCAC GCACG ATTTC |
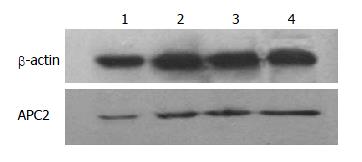
1.2.3 Western blot法检测基因蛋白表达: 取奥曲肽1、2、3组(10-14、10-12、10-10 mol/L)为实验组; 对照组为SW480加入培养基、生理盐水. 以上均培养24 h. 分别提取4组细胞的总蛋白, 制备SDS-PAGE凝胶, 将蛋白质样品上样至SDS-PAGE凝胶加样孔内, 每条泳道上样40 μg进行SDS-PAGE凝胶电泳, 转移至PVDF膜上, 5%脱脂奶粉封闭室温下2 h. 4 ℃孵育一抗(1:200 β-actin, 1:500 APC2, 1:500 CK1α, 1:500 Cyclin D1)过夜, TBST洗膜后孵育二抗(1:4 000)孵育1 h, TBST再次洗膜, 发光剂显色, X片曝光、显影、定影、水洗, 进行图像分析.
统计学处理 各组实验数据均用mean±SD表示, 采用SPSS13.0统计分析软件包处理. 实验结果采用One-way ANOVA方式行方差分析, 两两比较采用Student' t检验, 进行统计学分析, P<0.05认为差别有显著性意义. 实验重复3遍以上.
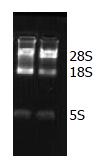
经电泳后RNA中28S、18S和5S 3条带清晰可见(图1), 说明细胞总RNA提取的质量可靠, 可以用于RT-PCR实验. RT-PCR法检测奥曲肽组(10-10 mol/L)和对照组细胞中APC2、CK1α、Cyclin D1、AXIN和FZD7各mRNA的表达(图2). 结果显示: 与对照组相比较, OCT组中SW480细胞APC2、CK1α mRNA表达增加, 且Cyclin D1 mRNA表达减少(P<0.05, 图3); 但是AXIN和FZD7 mRNA改变无统计学意义(P>0.05).
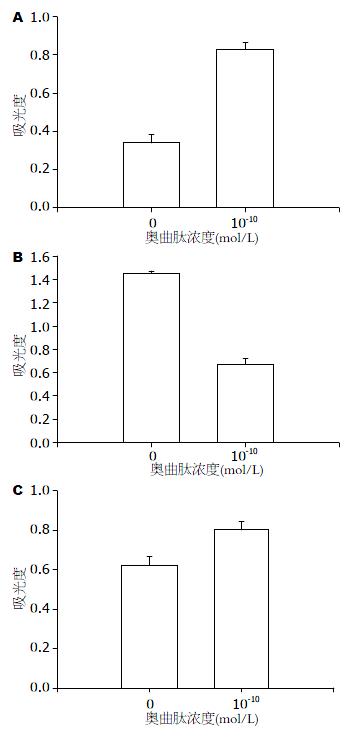
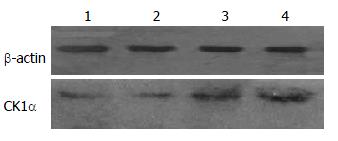
2.2.1 奥曲肽对SW480细胞中APC2蛋白表达的影响: 不同浓度OCT(0、10-14、10-12、10-10 mol/L)孵育SW480细胞24 h后, 提取总细胞蛋白, 用Western blot法检测各组细胞APC2蛋白(图4). 结果显示: 随着奥曲肽浓度的增大, 细胞中APC2蛋白逐渐增加, 呈剂量依赖性, 差异有统计学意义(P<0.05).
2.2.2 奥曲肽对SW480细胞中CK1α蛋白表达的影响: 不同浓度奥曲肽(0、10-14、10-12、10-10 mol/L组)孵育SW480细胞24 h后, 提取总细胞蛋白, 用Western blot法检测各组细胞CK1α蛋白(图5). 结果显示: 随着奥曲肽浓度的增大, 细胞中CK1α蛋白逐渐增加, 呈剂量依赖性, 差异有统计学意义(P<0.05).
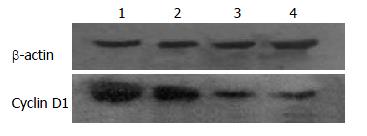
2.2.3 奥曲肽对SW480细胞中Cyclin D1蛋白表达的影响: 不同浓度奥曲肽(0、10-14、10-12、10-10 mol/L)孵育SW480细胞24 h后, 提取总细胞蛋白, 用Western blot法检测各组细胞Cyclin D1蛋白(图6). 结果显示: 随着奥曲肽浓度的增大, 细胞中Cyclin D1蛋白逐渐下降, 呈剂量依赖性, 差异有统计学意义(P<0.05).
奥曲肽(SMS 201-995, Octreotide)是一种人工合成的八肽生长抑素类似物, 与天然生长抑素比较, 其具有半衰期长(约90 min)、生物活性强、体内代谢稳定、受体选择性较强及分子小易吸收等特点, 已广泛应用于消化系疾病和多种内分泌肿瘤的临床治疗. 近期基础研究显示奥曲肽能有效控制消化系肿瘤, 如奥曲肽可以通过上调Fas/FasL表达而抑制肝癌细胞增殖[3], 通过上调Fas/FasL表达且下调突变型p53表达诱导SGC-7901胃癌细胞凋亡[4]. 同时, 我们的前期工作亦提示奥曲肽可以通过调控APC/β-catenin/TCF通路中30个基因抑制结肠癌SW480细胞增殖, 其中APC2、CK1α和AXIN显著上调(10-10 mol/L奥曲肽组/对照组>2倍), 他们主要参与"β-Catenin破坏复合体"的形成; 而Cyclin D1、FZD7显著下调(10-10 mol/L奥曲肽组/对照组<0.5), 其中Cyclin D1为下游靶基因[2]. 但是上述调控机制尚不清楚, 为此本课题就基因芯片中的热点基因进行了研究.
APC/β-catenin/TCF通路在结肠癌中控制着细胞的命运, 是结肠癌发生的重要早期事件, 控制着结肠癌细胞的增殖、侵袭和转移, 并起到癌细胞微环境调节器的作用[5]. 该通路多个组成成员APC、β-catenin、c-Myc、Cyclin D1等的突变, 在结肠癌的发生发展过程中起着决定性的作用[6].
APC突变为80%-90%的结肠癌的主要诱癌因素(如本实验对象SW480). APC突变聚集区(mutation cluster region, MCR)正好为β-catenin的结合区域, 导致细胞质内β-catenin异常积聚, β-catenin转导入细胞核内与TCF/LEF蛋白结合形成三聚体, 竞争性抑制TCF/LEF与APC/β-catenin/TCF通路下游靶基因结合, 开启靶基因的异常高表达而至癌.
APC2又称为APCL, 为APC的同源物, 位于染色体19p13.3, 由2 303个氨基酸组成. APC2缺失了保守的羧基端、缺乏3个15-aa重复基序、5个20-aa重复基序和两个SAMP重复基序, 但是仍与APC有76%的同源性, 基本保持了APC的主要功能: (1)Yang等[7]研究显示, 磷酸化位点同时包括了Ser-45位点(CK1作用)和Ser-33/Ser-37/Thr-41位点(GSK3-β作用), 而C-端截短APC蛋白并未影响GSK3-β和CK1对β-catenin的磷酸化功能; 研究还显示, SAMP重复基序与磷酸化β-catenin的降解有关, 与全长APC比较, APC2中的SAMP重复基序的减少使得β-catenin磷酸化降解下降, phosph-β-catenin增加; (2)Fagman等[8]研究认为C-端截短APC蛋白除包含了未被截去NES1APC 63-83及NES2APC的外, 其犰狳类结构区域可能还含有一个NLSX功能区, 他独立于NLS1APC及NLS2APC以外; (3)Neufeld等[9]和Henderson等[10]亦认为APC2和APC一样, 均具有细胞核穿梭功能, 调控β-catenin由细胞核转移至细胞质内. 以上研究表明APC2具有APC相似的功能, 可抑制APC突变激活的异常APC/β-catenin/TCF通路.
本实验采用RT-PCR和Western blot均证实了奥曲肽可以上调APC2 mRNA和蛋白, 并且呈浓度依赖性. 奥曲肽通过上调SW480细胞中APC2, 使得APC2与β-catenin、Axin等相结合, 重装"破坏复合体", 有利于GSK-3β、CK1α磷酸化β-catenin; 促进β-catenin从细胞核内向细胞质、细胞膜转位. 以上提示奥曲肽上调的APC2弥补了SW480细胞中突变APC的功能缺失, 从而抑制异常激活的APC/β-catenin/TCF通路.
CK1也是APC/β-catenin/TCF通路的重要组成部分, 他是一组广泛分布于各类真核生物的蛋白激酶超家族. 该家族中包括了"负性调控子"CK1α以及"正性调控子"CK1γ、CK1ε等. CK1α下降和CK1γ、CK1ε上升, 两种调控子的比例失调可抑制"破坏复合体"的形成, 异常激活APC/β-catenin/TCF通路.
CK1α与β-catenin、APC、Axin、GSK-3β共同形成破坏复合体, 该复合体中的CK1α可使β-catenin的丝氨酸(Ser)45残基磷酸化, 后者有助于GSK-3β对β-catenin的Ser33/37、苏氨酸(Thr)41残基磷酸化, 磷酸化后的β-catenin被泛素蛋白酶体泛素化和降解, 从而下调异常的APC/β-catenin/TCF通路[11]. 此外, 有研究认为CK1α可以通过TCF家族之一NF-AT4蛋白, 掩盖其NLS区域, 减少其转移至细胞核内, 减少基因的异常表达, 从而下调异常的APC/β-catenin/TCF通路[12].
CK1γ、CK1ε作用正好相反. (1)数项研究表明CK1ε通过磷酸化散乱蛋白干扰GSK-3β与AXIN结合, 增强TCF3与β-catenin的亲和力, 及减少异源三聚体参与了"破坏复合体"的形成, 解离"破坏复合体", 从而上调APC/β-catenin/TCF通路[13-15]; (2) CK1γ通过磷酸化促转录受体LRP5/6, 使得AXIN结合不稳定, 从而上调APC/β-catenin/TCF通路[16]; (3)CK1γ、ε通过磷酸化E-cadherin, 使E-cadherin丧失定位于细胞间稳定细胞黏附的作用, 且磷酸化后的E-cadherin与β-catenin作用减弱, 从而上调APC/β-catenin/TCF通路[17].
我们的前期工作显示, CK1家族中CK1α(10-10 mol/L奥曲肽组/对照组 = 6.41)的上调大于CK1γ(10-10 mol/L奥曲肽组/对照组 = 5)及CK1ε(10-10 mol/L奥曲肽组/对照组 = 0)[2]. 本实验RT-PCR和Western blot均证实, 奥曲肽可以上调CK1α的mRNA和蛋白, 呈浓度依赖性. 以上均提示奥曲肽可以选择性增加此"负性调控子]CK1α, 平衡两种调控子的比例, 重装"破坏复合体", 促进β-catenin的磷酸化, 从而抑制异常激活的APC/β-catenin/TCF通路.
Cyclin D1基因是一种细胞周期调控因子, 在结肠癌组织中通常是过表达, 而该基因直接发生突变的情况很少, 但他可被异常的APC/β-catenin/TCF信号通路直接激活. 我们的实验结果显示, 奥曲肽不但可上调APC2、CK1α的mRNA和蛋白, 还可以下调Cyclin D1的mRNA和蛋白, 且呈浓度依赖性.
目前, 研究显示多种化合物抗结肠癌的作用与APC/β-catenin/TCF通路有关, 如非甾体类抗炎药物可促进β-catenin蛋白的降解和核转出, 如阿司匹林[18]、舒林酸[19]; 酪氨酸激酶抑制剂可调控β-catenin的酪氨酸残基磷酸化, 促使β-catenin与E-cadherin结合增加, 如格列卫[20]、绿茶酚[21]等; 姜黄素[22]、槲皮素[23]等天然化合成分可减少细胞核内的β-catenin和TCF-4蛋白及其相互结合等.
本研究认为奥曲肽调控结肠癌SW480中APC/β-catenin/TCF通路的分子机制为: 奥曲肽通过上调APC2、CK1α, 重装"破坏复合体", 利于β-catenin蛋白分解, 减少β-catenin与TCF/LEF蛋白的结合, 从而抑制下游靶基因Cyclin D1, 强化"负反馈机制", 最终抑制APC/β-catenin/TCF通路. 这可能是奥曲肽抑制结肠癌细胞增殖的关键机制, 将为奥曲肽治疗结肠癌的策略提供理论依据.
APC/β-catenin/TCF通路异常是结肠癌发生的重要早期事件, 以其关键成分为靶标的药物将成为防治结肠癌的重要手段. 目前已有NASID、选择性COX-2抑制剂通过抑制该通路治疗结肠癌的临床干预试验, 但缺少奥曲肽抑制APC/β-catenin/TCF通路治疗结肠癌的相关研究.
李永翔, 主任医师, 安徽医科大学第一附属医院普外科
本课题组的前期工作提示奥曲肽可以通过调控APC/β-catenin/TCF通路中30个基因抑制结肠癌SW480细胞增殖, 其中APC2、CK1α和AXIN显著上调, 而Cyclin D1、FZD7显著下调.
化合物拮抗结肠癌机制研究大多集中在APC/β-catenin/TCF通路的β-catenin分子上, 而本课题以前期基因芯片热点基因的改变为研究对象, 对APC/β-catenin/TCF通路多个分子进行联合研究, 有利于充分阐明奥曲肽抑制结肠癌细胞增殖的关键机制.
奥曲肽具有半衰期长、生物活性强、体内代谢稳定、受体选择性较强及分子小易吸收等优势,已广泛应用于消化系疾病和多种内分泌肿瘤的临床治疗, 对其抑制结肠癌细胞APC/β-catenin/TCF通路的机制研究, 将为奥曲肽治疗结肠癌的策略提供理论依据.
本文可读性较好, 具有一定的科学性和创新性.
编辑: 曹丽鸥 电编:何基才
| 2. | Chen JS, Liang QM, Li HS, Yang J, Wang S, Long JW. Octreotide inhibits growth of colonic cancer SW480 cells by modulating the Wnt/P-catenin pathway. Pharmazie. 2009;64:126-131. [PubMed] |
| 3. | Ma Q, Meng LQ, Liu JC, Hu JP, Ge J, Wan YL, Jiang S. [Octreotide induces apoptosis of human hepatoma cells by the mechanism of facilitating the Fas/FasL gene expression therein]. Zhonghua Yixue Zazhi. 2008;88:716-718. [PubMed] |
| 5. | Huang D, Du X. Crosstalk between tumor cells and microenvironment via Wnt pathway in colorectal cancer dissemination. World J Gastroenterol. 2008;14:1823-1827. [PubMed] [DOI] |
| 6. | Bodmer WF. Cancer genetics: colorectal cancer as a model. J Hum Genet. 2006;51:391-396. [PubMed] [DOI] |
| 7. | Yang J, Zhang W, Evans PM, Chen X, He X, Liu C. Adenomatous polyposis coli (APC) differentially regulates beta-catenin phosphorylation and ubiquitination in colon cancer cells. J Biol Chem. 2006;281:17751-17757. [PubMed] [DOI] |
| 8. | Fagman H, Larsson F, Arvidsson Y, Meuller J, Nordling M, Martinsson T, Helmbrecht K, Brabant G, Nilsson M. Nuclear accumulation of full-length and truncated adenomatous polyposis coli protein in tumor cells depends on proliferation. Oncogene. 2003;22:6013-6022. [PubMed] [DOI] |
| 9. | Neufeld KL, Nix DA, Bogerd H, Kang Y, Beckerle MC, Cullen BR, White RL. Adenomatous polyposis coli protein contains two nuclear export signals and shuttles between the nucleus and cytoplasm. Proc Natl Acad Sci U S A. 2000;97:12085-12090. [PubMed] [DOI] |
| 10. | Henderson BR. Nuclear-cytoplasmic shuttling of APC regulates beta-catenin subcellular localization and turnover. Nat Cell Biol. 2000;2:653-660. [PubMed] [DOI] |
| 11. | Liu C, Li Y, Semenov M, Han C, Baeg GH, Tan Y, Zhang Z, Lin X, He X. Control of beta-catenin phosphorylation/degradation by a dual-kinase mechanism. Cell. 2002;108:837-847. [PubMed] |
| 12. | Zhu J, Shibasaki F, Price R, Guillemot JC, Yano T, Dötsch V, Wagner G, Ferrara P, McKeon F. Intramolecular masking of nuclear import signal on NF-AT4 by casein kinase I and MEKK1. Cell. 1998;93:851-861. [PubMed] |
| 13. | Hino S, Michiue T, Asashima M, Kikuchi A. Casein kinase I epsilon enhances the binding of Dvl-1 to Frat-1 and is essential for Wnt-3a-induced accumulation of beta-catenin. J Biol Chem. 2003;278:14066-14073. [PubMed] [DOI] |
| 14. | Lee E, Salic A, Kirschner MW. Physiological regulation of [beta]-catenin stability by Tcf3 and CK1epsilon. J Cell Biol. 2001;154:983-993. [PubMed] [DOI] |
| 15. | Gao ZH, Seeling JM, Hill V, Yochum A, Virshup DM. Casein kinase I phosphorylates and destabilizes the beta-catenin degradation complex. Proc Natl Acad Sci U S A. 2002;99:1182-1187. [PubMed] [DOI] |
| 16. | Davidson G, Wu W, Shen J, Bilic J, Fenger U, Stannek P, Glinka A, Niehrs C. Casein kinase 1 gamma couples Wnt receptor activation to cytoplasmic signal transduction. Nature. 2005;438:867-872. [PubMed] [DOI] |
| 17. | Dupre-Crochet S, Figueroa A, Hogan C, Ferber EC, Bialucha CU, Adams J, Richardson EC, Fujita Y. Casein kinase 1 is a novel negative regulator of E-cadherin-based cell-cell contacts. Mol Cell Biol. 2007;27:3804-3816. [PubMed] [DOI] |
| 18. | Dihlmann S, Klein S, Doeberitz Mv MK. Reduction of beta-catenin/T-cell transcription factor signaling by aspirin and indomethacin is caused by an increased stabilization of phosphorylated beta-catenin. Mol Cancer Ther. 2003;2:509-516. [PubMed] |
| 19. | Boon EM, Keller JJ, Wormhoudt TA, Giardiello FM, Offerhaus GJ, van der Neut R, Pals ST. Sulindac targets nuclear beta-catenin accumulation and Wnt signalling in adenomas of patients with familial adenomatous polyposis and in human colorectal cancer cell lines. Br J Cancer. 2004;90:224-229. [PubMed] [DOI] |
| 20. | Zhou L, An N, Haydon RC, Zhou Q, Cheng H, Peng Y, Jiang W, Luu HH, Vanichakarn P, Szatkowski JP. Tyrosine kinase inhibitor STI-571/Gleevec down-regulates the beta-catenin signaling activity. Cancer Lett. 2003;193:161-170. [PubMed] [DOI] |
| 21. | Ju J, Hong J, Zhou JN, Pan Z, Bose M, Liao J, Yang GY, Liu YY, Hou Z, Lin Y. Inhibition of intestinal tumorigenesis in Apcmin/+ mice by (-)-epigallocatechin-3-gallate, the major catechin in green tea. Cancer Res. 2005;65:10623-10631. [PubMed] [DOI] |
| 22. | Park CH, Hahm ER, Park S, Kim HK, Yang CH. The inhibitory mechanism of curcumin and its derivative against beta-catenin/Tcf signaling. FEBS Lett. 2005;579:2965-2971. [PubMed] [DOI] |
| 23. | Park CH, Chang JY, Hahm ER, Park S, Kim HK, Yang CH. Quercetin, a potent inhibitor against beta-catenin/Tcf signaling in SW480 colon cancer cells. Biochem Biophys Res Commun. 2005;328:227-234. [PubMed] [DOI] |